2. 蚌埠医学院病理生理学教研室,安徽 蚌埠 233030
2. Department of Pathophysiology, Bengbu Medical College, Bengbu 233030, China
神经功能可塑性是近年来研究的热点问题之一,它可涉及脑内多个层面形态和功能特性改变[1-3]。众所周知,存在一种感觉障碍的人,其他感觉的敏感性会异常增加,从而维持机体感觉功能的动态平衡,例如失明者通过增强其触觉、嗅觉、味觉、本体觉等获得周围环境信息以进行空间识别,而聋人则对输入的视觉信息更加敏感[4-8],这就是跨感觉模式可塑性,它是大脑学习和记忆的基础,其病变可导致某些脑功能性疾病[9]。目前跨感觉模式可塑性已在多个脑区得到证实,相关研究表明跨感觉模式可塑性产生的机理与感觉皮层区代偿性扩大、某些细胞因子高表达及神经环路重建等有关[6, 10-12]。但是,神经细胞参与不同类型跨感觉模式可塑性的内在机制仍不清楚。
目前有关跨感觉模式可塑性的研究大多数集中在听觉和视觉,但是否所有感觉类型都存在跨感觉模式可塑性,可塑性能否在嗅觉与触觉间产生?为此本课题组建立了嗅觉剥夺小鼠模型,并检查了胡须触觉功能和大脑桶状皮层主要抑制性神经元——GABA能神经元电生理功能。前期研究发现,嗅觉剥夺诱导触觉功能上调和大脑桶状皮层GABA能神经元突起密度增加、抑制性功能增强,提示GABA能神经网络可能参与了跨感觉模式可塑性的神经调控,GABA能神经元在神经网络动态平衡起重要作用[13]。而谷氨酸能神经元作为中枢主要兴奋性神经元,其功能变化是否参与了跨感觉模式可塑性的神经调控机制。此外,神经元轴突起始段和郎飞氏节等处的Ankyrin-G蛋白上存在电压门控性钠通道(Nav)的特异性结合位点,与Nav的生理功能密切相关,其表达变化将会影响神经元动作电位的发放[14-15]。跨感觉模式可塑性是否会影响桶状皮层谷氨酸能神经元轴突始端Ankyrin-G蛋白的表达量,有待我们进一步研究。
本实验通过应用氯仿剥夺嗅觉诱导触觉功能上调的动物模型,利用膜片钳技术、免疫荧光染色及激光扫描共聚焦技术对转基因小鼠桶状皮层谷氨酸能神经元电生理功能及轴突始端Ankyrin-G蛋白免疫荧光强度进行检测,在细胞水平探讨躯体感觉皮层神经网络信号处理机制及对经验活动依赖的大脑可塑性的影响。跨感觉模式可塑性潜在机制的阐明将为临床治疗感觉损伤和替代提供有利线索。
1 材料及方法 1.1 实验动物、主要试剂及仪器健康雄性12 d龄C57 Thy1-YFP小鼠40只,由蚌埠医学院实验动物中心提供,体质量8±0.5 g。Tris-GTP、EGTA、Mg2+-ATP、HEPES、Triton X-100(sigma),AnkyrinG、Alexa647(thermo),山羊血清(北京索莱宝公司)。摄像监视系统(VS-303D,Burleigh),IR-DIC光学显微镜(Nikon E600FN),MultiClamp-700B放大器(Axon)、微电极管拉制仪(P-97,SUUTTER)、振荡切片机(VIBRATOME)、激光共聚焦显微镜(FV1000,OLYMPUS)。
1.2 动物分组与模型制备实验分为2组:对照组(Control)和嗅觉剥夺组(Olfactory deprivation)。选用出生后12 d的C57 Thy1-YFP小鼠,予氯仿40 μL滴入小鼠一侧鼻腔,破坏一侧嗅觉复制嗅觉剥夺小鼠模型,嗅觉剥夺侧脑区为嗅觉剥夺组,对侧即为对照组。嗅觉剥夺1周后进行行为学触须视频拍摄,如小鼠触须功能增强则表明模型建立成功,主要表现在触须震动的频率、幅度或给予同一刺激强度触须伸、屈的时间长短,若嗅觉剥夺后小鼠嗅觉剥夺对侧的触须震动频率、幅度或伸、屈的时间明显增加说明模型建立成功[13]。
1.3 溶液配置[16-22]人工脑脊液(ACSF)Ⅰ(切脑液)组成(mmol/L):124 NaCl,26 NaHCO3,10 dextrose,5 Hepes,4 MgSO4,3 KCl,1.3 NaH2PO4,和0.5 CaCl2,pH 7.35~7.45(1 mol/L NaOH调节pH)。人工脑脊液Ⅱ(脑片灌流液)组成(mmol/L):124 NaCl,26 NaHCO3,10 dextrose,5 Hepes,3 KCl,2.4 CaCl2,1.3 NaH2PO4和1.3 MgSO4,pH 7.35~ 7.45(1 mol/LNaOH调节pH)。标准电极液组成(mmol/L):150 K-gluconate,5 NaCl,5 Hepes,5 phosphocreatine,4 Mg-ATP,0.5 Tris-GTP和0.4 EGTA,pH 7.35~7.45(2 mol/L KOH调节pH)。0.01 mol/L PBS组成(g):8 NaCl,0.2 KCl,0.24 KH2PO4,1.44 Na2HPO4。
1.4 实验方法 1.4.1 行为学测试嗅觉剥夺1周后进行小鼠行为学触须视频拍摄,然后将视频资料用会声会影编辑器进行编辑,观察和统计分析小鼠嗅觉剥夺侧和对侧触须的摆动频率及触须屈曲的时间。整个行为学实验在安静的环境中进行,室温18~25 ℃,无噪声和强光刺激。
1.4.2 脑片制备[13, 16-22]选择模型建立成功小鼠,异氟烷吸入麻醉后取出大脑,放入充分氧合冰水混合的ACSF Ⅰ中,用振荡切片机将大脑沿冠状切面切成400 mm脑片,放入充分氧合的ACSFⅡ,在25 ℃条件下孵育1~2 h。
1.4.3 大脑桶状皮层谷氨酸能神经元的选择将孵育好的1片脑片转运到充分氧合ACSFⅡ浸没的小槽内,灌流温度为31 ℃,速度为2 mL/min,用于全细胞记录[13, 16-22]。在IR-DIC光学显微镜(Nikon E600FN)下选择大脑桶状皮层谷氨酸能神经元,其在荧光显微镜波长575 nm光激发下可发出黄色荧光,以此与其他神经元相鉴别。本实验结合桶状皮层解剖结构,定位选择大脑桶状皮层的荧光标记神经元。
1.4.4 全细胞记录和指标测定[13, 16-22]利用MultiClamp- 700B放大器电流钳模式记录桶状皮层谷氨酸能神经元动作电位,采集的电信号输入pClamp 10.3(Axon Instrument Inc., Foster CA, USA)分析软件。放大器高频滤波为3 kHz,去极化电流脉冲诱发动作电位,根据不同的发放模式,按照实验要求设置实验的电流强度和持续时间。
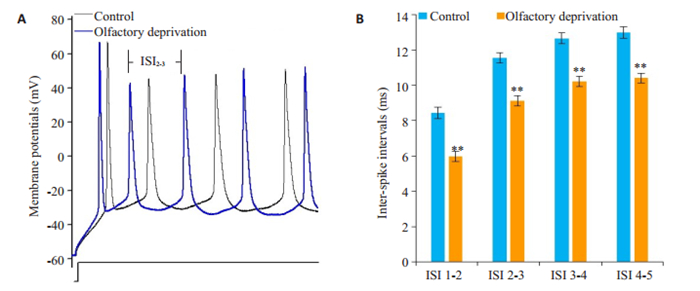
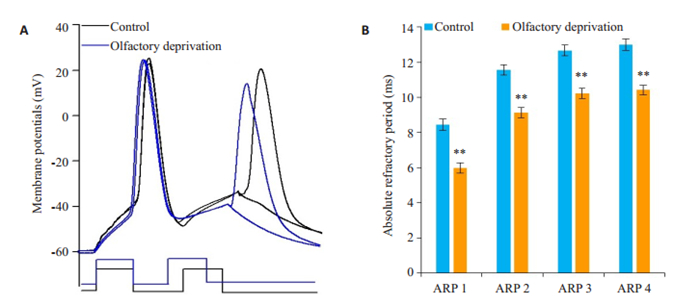
神经元内在特性包括动作电位间距(ISI)和绝对不应期(ARP)。ISI表示动作电位的发放能力,指在阈刺激下产生的序列动作电位中相邻两个动作电位峰顶点间的距离(图 2A);ARP是向神经元输入2个去极化电流脉冲诱发动作电位,通过调整刺激脉冲的间距,使后1个动作电位的发放概率为50%时2个动作电位之间的时程(图 3A)。
|
图 2 嗅觉剥夺小鼠谷氨酸能神经元动作电位ISI变化 Fig.2 Changes of ISI of sequential spikes in the glutamatergic neurons in the barrel cortex on the control and olfactory deprivation side. Olfactory deprivation increases the spike capacity of barrel cortex glutamatergic neurons in brain slices. Depolarization pulses were injected to evoke sequential spikes. A: Waveforms illustrate sequential spikes induced by identical protocol in a glutamatergic neuron from right-side barrel cortex (control, black line) and from leftside (olfactory deprivation, blue line). B: Quantitative data in inter-spike intervals at glutamatergic neurons from right-side barrel cortex (control, black symbols) and from left-side (olfactory deprivation, blue symbols), **P < 0.01 vs control |
|
图 3 嗅觉剥夺小鼠谷氨酸能神经元动作电位ARP变化 Fig.3 Changes of absolute refractory periods (ARP) of sequential spikes in the glutamatergic neurons in the barrel cortex on the control and olfactory deprivation side. Olfactory deprivation prolongs ARP of the barrel glutamatergic neurons in the brain slices. A: Measurement of ARP of spike-1 by changing inter-pulse intervals of depolarization currents (3 ms) in a glutamatergic neuron in the right-side barrels (control, black line) and a cell on the left side (olfactory deprivation, blue line); B: ARP of the spikes of glutamatergic cells from the right-side barrel cortex (control, black symbols) and from the left side (olfactory deprivation, blue symbols). **P < 0.01 vs control |
以20%乌拉坦0.1 mL/10 g麻醉模型小鼠,用含1%蔗糖和1%多聚甲醛的0.01 mol/L PBS溶液进行心脏灌流,待四肢僵硬后取脑,置于1%多聚甲醛后固定2 h,30%蔗糖脱水48 h,取脑做16 μmol/L的冠状面冰冻切片;然后以0.01 mol/L PBS漂洗3次,每次5 min;封闭:5%山羊血清和0.3% Triton X-100,20~25 ℃孵育2 h;加一抗Ankyrin-G(1:200稀释),避光,摇床,4 ℃孵育过夜;用0.01 mol/L PBS漂洗3次,每次5 min;加二抗Alexa647(1:1000稀释),避光,摇床,20~25 ℃孵育2 h;再用0.01 MPBS漂洗3次,每次5 min;最后以50%甘油封片,激光扫描共聚焦显微镜下观察,扫片,测定Ankyrin-G蛋白荧光强度的变化。
1.5 统计学分析采用SPSS 19.0统计软件。实验结果以均数±标准差表示,组间比较采用t检验,单因素方差分析,以P < 0.05为差异有统计学意义。
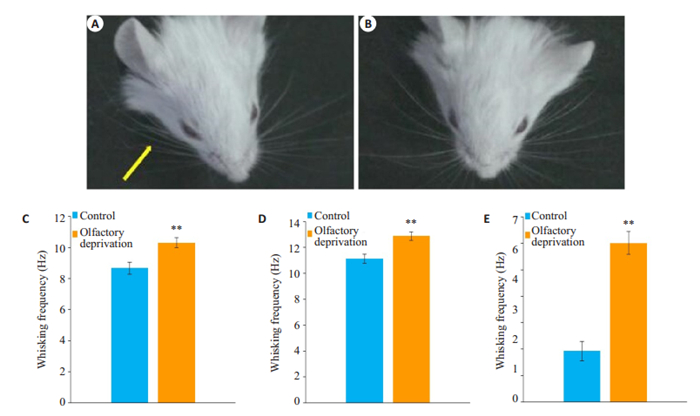
2 结果 2.1 行为学测试结果嗅觉剥夺1周后使用ZL250数码照相机对小鼠触须摆动进行视频拍摄,统计结果发现,嗅觉剥夺后小鼠自发活动时嗅觉剥夺对侧触须摆动频率增加,同时给予同样大小一定刺激后,小鼠嗅觉剥夺对侧触须摆动频率增加、屈曲时间延长(P < 0.01,图 1)。实验结果表明嗅觉剥夺触觉功能上调小鼠模型建立成功。
|
图 1 嗅觉剥夺对小鼠触须功能的影响 Fig.1 Olfactory deprivation in left nasal cavity up-regulates whisker tactile sensation in mice. A, B: Retraction (yellow arrow) of whiskers two seconds after air-puffing of the whiskers toward the right side (A) and left side (B). C: Frequency of whiskers on the right side (contralateral to the olfactory deprivation side, gray) and left side (white) in spontaneous state (n= 25, **P < 0.01 vs control); D: Frequency of whiskers on the right side (gray) and left side (white) after air-puffing (n=23, **P < 0.01 vs control); E: Retraction duration of free-air whisking on the right side (gray) and left side (white, n=23, **P < 0.01 vs control) |
为了阐明嗅觉功能丧失诱导触觉功能上调的跨感觉模式可塑性的细胞机制,我们研究了桶状皮层中谷氨酸能神经元电生理功能的变化。
2.2 嗅觉剥夺对桶状皮层谷氨酸能神经元电生理功能的影响 2.2.1 嗅觉剥夺对桶状皮层谷氨酸能神经元动作电位ISI的影响测量小鼠大脑桶状皮层谷氨酸能神经元相同序号动作电位ISI值,嗅觉剥夺组较对照组降低(P < 0.01,图 2),可见嗅觉剥夺使谷氨酸能神经元的兴奋性增加。
2.2.2 嗅觉剥夺对桶状皮层谷氨酸能神经元动作电位ARP的影响测量小鼠大脑桶状皮层谷氨酸能神经元相同编号动作电位ARP值,嗅觉剥夺组较对照组明显缩短,两种状态下比较有统计学意义(P < 0.01,图 3)。
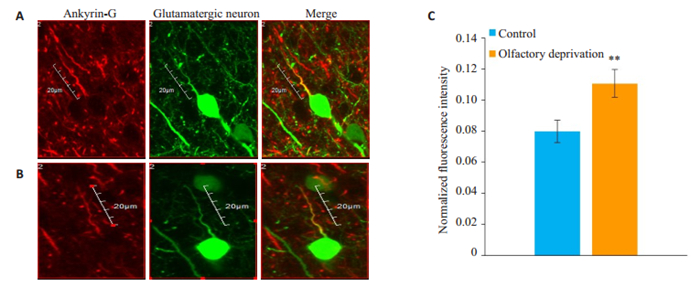
2.3 嗅觉剥夺对桶状皮层谷氨酸能神经元轴突始端Ankyrin-G蛋白表达量的影响由于Ankyrin-G蛋白与Nav的生理功能密切相关,其在轴突始端的表达量可以影响神经元动作电位的发放[14-15]。通过对嗅觉剥夺小鼠桶状皮层谷氨酸能神经元轴突始端Ankyrin-G蛋白表达量的检测,我们发现嗅觉剥夺后小鼠桶状皮层谷氨酸能神经元轴突始端Ankyrin-G蛋白的表达量明显高于对照组(P < 0.01,图 4)。
|
图 4 嗅觉剥夺小鼠谷氨酸能神经元轴突始端Ankyrin-G蛋白荧光强度的变化 Fig.4 Changes of ankyrin-G protein fluorescence intensity in the axon of glutamatergic neurons in olfactory deprived mice. Antibody staining for ankyrin-G (red) and glutamatergic neurons (green) was performed in rat barrel cortex, where the proximal AIS had strong staining for ankyrin-G on the left side (olfactory deprived side, A) and weak staining on the right side (B), and comparison of ankyrin-G protein fluorescence intensity between the two sides is shown in C. **P < 0.01 vs control. Images are projections of confocal z stacks. Scale bars represent 16 mm |
众所周知,盲人通过增强自身触觉和听觉功能以增强空间定位和识别能力,聋人则对视觉输入更加敏感[4-7]。目前的研究表明,跨感觉模式可塑性的产生机理与调控代偿脑区的大脑皮层区域面积扩大、神经发育可塑性相关的某些基因高表达,以及神经环路重建等有关[6, 10-12, 22-25]。但是,是否所有感觉类型都存在跨感觉模式可塑性?不同类型神经细胞参与大脑感觉功能重塑的内在细胞机制仍不清楚。为了阐明这些问题,本实验采用氯仿剥夺小鼠一侧嗅觉诱导嗅觉剥夺触觉功能上调的小鼠模型,通过对小鼠行为学测试(自发状态及触发状态下触须功能的变化)筛选出嗅觉剥夺触觉功能上调小鼠,针对性选择初级体感皮层——桶状皮层的谷氨酸能神经元作为研究对象,探讨桶状皮层谷氨酸能神经元在跨感觉模式可塑性中的变化及其可能的细胞特异性机制,为阐明谷氨酸能神经元在神经网络可塑性中的作用提供理论依据。
啮齿类动物主要是通过触须有节律的摆动来探索和感知环境变化,小鼠触须有节律的运动,即代表了小鼠的触觉功能。触须功能测定通常包括自发活动和刺激下引起触须摆动的频率和屈曲时间。为了检测嗅觉剥夺后小鼠触须功能的变化,我们测量了小鼠自发活动时触须的摆动频率,即主动触觉;同时,测量了一定流速的空气吹向触须后引起触须屈曲的持续时间,这代表了躯体感觉皮层对刺激的反应[13]。实验中我们发现,小鼠一侧嗅觉剥夺后与同侧触觉之间存在跨感觉模式可塑性,表现为:(1)小鼠嗅觉剥夺后在自发状态下嗅觉剥夺对侧触须摆动频率增加;(2)给予特定刺激后,嗅觉剥夺对侧触须摆动频率增加;(3)给予特定刺激后,嗅觉剥夺对侧触须由屈曲状态恢复到起始状态时间延长。嗅觉剥夺后小鼠触须摆动频率增加以及其由屈曲状态恢复到起始状态的时间延长,表明小鼠嗅觉剥夺后触须的敏感性增加,功能增强,即嗅觉剥夺提高触觉敏锐度,嗅觉剥夺触觉功能上调的跨感觉模式可塑性模型建立成功,表明跨感觉模式可塑性可能存在于所有的感觉类型中。
那么伴随外在行为学表现的内在神经机制是什么呢?前期研究发现,嗅觉剥夺小鼠触觉功能上调与桶状皮质中GABA能神经元的功能变化有关,嗅觉剥夺触觉功能上调小鼠桶状皮层中GABA能神经元突起密度增加、抑制性功能增强,提示GABA能神经网络可能参与了跨感觉模式可塑性的神经调控[13]。谷氨酸能神经元作为中枢主要的兴奋性神经元,其功能变化在跨感觉模式可塑性中的作用有待我们进一步探索。
啮齿类动物的桶状皮层主要负责胡须的感知,利用大脑脑片研究嗅觉剥夺后桶状皮层谷氨酸能神经元可塑性变化的机制中,我们发现嗅觉剥夺使桶状皮层谷氨酸能神经元的发放能力提高,兴奋性增加。这些变化与群集发放动作电位的锋间距(ISI)和绝对不应期(ARP)有关[16-23]。动作电位发放能力用ISI表示。ISI表示可兴奋细胞在一次有效刺激下产生的序列动作电位中相邻两动作电位峰顶点间的距离。相同刺激强度和时间下桶状皮层谷氨酸能神经元产生的相同编号动作电位ISI值,嗅觉剥夺组均低于对照组,表明相同刺激条件下,嗅觉剥夺使谷氨酸能神经元动作电位发放个数增加,即发放频率增加,动作电位发放能力增强,神经元兴奋性增高。
动作电位发放的变化与细胞内在特性即动作电位的ARP有关[16-23, 26]。实验中我们检验嗅觉剥夺是否诱导桶状皮层谷氨酸能神经元动作电位发放的ARP水平的改变来影响其兴奋性。结果显示,桶状皮层谷氨酸能神经元相同编号动作电位的ARP值,嗅觉剥夺组均较对照组缩短。ARP缩短意味着神经元单位时间内发放动作电位的个数增加,即动作电位的发放频率增加,这就使动作电位发放能力增强。
神经细胞的ARP由电压门控性钠通道动力学控制[16-23, 26]。在神经细胞等可兴奋细胞中,静息电位和动作电位的产生依赖于电压门控性离子通道的开放和关闭。近年来的大量研究表明,Ankyrin-G蛋白与离子通道蛋白等细胞膜蛋白的表达、定位和生理功能密切相关,电压门控性钠通道(Nav)可以诱导Ankyrin-G蛋白聚集,并参与同种细胞间的接触和识别[27]。Ankyrin-G蛋白在可兴奋细胞电活动、发育、转移中发挥着非常重要的作用。Ankyrin-G蛋白是锚蛋白的亚型之一,结合锚定在神经元轴突的起始段和郎飞氏节等处,呈现局部高密度分布结构,其上存在Nav特异性结合位点,从而控制着神经元动作电位的产生[15-16]。对嗅觉剥夺触觉功能上调小鼠桶状皮层谷氨酸能神经元轴突始端Ankyrin-G蛋白免疫荧光强度的测定结果发现,嗅觉剥夺后使谷氨酸能神经元轴突始端Ankyrin-G蛋白表达量明显增加,从而影响神经元整体兴奋性,使嗅觉剥夺后小鼠桶状皮层谷氨酸能神经元的兴奋性明显增加。
综上所述,小鼠一侧嗅觉剥夺后会引起对侧触须的触觉功能上调,这种触觉功能的变化与桶状皮层谷氨酸能神经元兴奋性增加有关,我们的实验结果对于理解跨感觉模式可塑性的细胞机制具有重要意义,跨感觉模式可塑性机制的澄清为帮助恢复和替代感觉开发治疗方法提供了线索。
| [1] |
Kujala T, Alho K, Näätänen R. Cross-modal reorganization of human cortical functions[J]. Trends Neurosci, 2000, 23(3): 115-20. DOI:10.1016/S0166-2236(99)01504-0 |
| [2] |
Mezzera C, López-Bendito G. Cross-modal plasticity in sensory deprived animal models: From the thalamocortical development point of view[J]. Chem Neuroanat, 2016, 75(9): 32-40. |
| [3] |
Huang SY, Hu JF, Gong HQ, et al. Postsynaptic Calcium pathway contributes to synaptic plasticity between retinal cones and luminositytype horizontal cells[J]. Acta Physiol Sin, 2006, 58(5): 407-14. |
| [4] |
Kupers R, Ptito M. Compensatory plasticity and cross-modal reorganization following early visual deprivation[J]. Neurosci Biobehav Rev, 2014, 4(41): 36-52. |
| [5] |
Ding H, Qin W, Liang M, et al. Cross-modal activation of auditory regions during visuo-spatial working memory in early deafness[J]. Brain, 2015, 9(138): 2750-65. |
| [6] |
Huber E, Chang K, Alvarez I, et al. Early blindness shapes cortical representations of auditory frequency within auditory cortex[J]. Neurosci, 2019, 39(26): 5143-52. DOI:10.1523/JNEUROSCI.2896-18.2019 |
| [7] |
Ptito M, Moesgaard SM, Gjedde A, et al. Cross-modal plasticity revealed by electrotactile stimulation of the tongue in congenitally blind[J]. Brain, 2005, 128(3): 606-14. DOI:10.1093/brain/awh380 |
| [8] |
Greenhill SD, Juczewski K, de Haan AM, et al. Amneurodevelopment. adult cortical plasticity depends on an early postnatal critical period[J]. Science, 2015, 349(6246): 424-7. DOI:10.1126/science.aaa8481 |
| [9] |
Que M, Jiang X, Yi C, et al. Language and sensory neural plasticity in the superior temporal cortex of the deaf[J]. Neural Plast, 2018, 5(2): 1-12. |
| [10] |
Wang JH. Searching basic units in memory traces: associative memory cells[J]. F1000Res, 2019(8): 457-89. |
| [11] |
Henschke J, Oelschlegel AM, Angenstein F, et al. Early sensory experience influences the development of multisensory thalamocortical and intracortical connections of primary sensory cortices[J]. Brain Struct Funct, 2018, 223(3): 1165-90. |
| [12] |
Wieloch T, Nikolich K. Mechanisms of neural plasticity following brain injury[J]. Curr Opin Neurobiol, 2006, 16(3): 258-64. DOI:10.1016/j.conb.2006.05.011 |
| [13] |
Ni H, Huang L, Chen N, et al. Upregulation of barrel GABAergic neurons is associated with cross-modal plasticity in olfactory deficit[J]. PLoS One, 2010, 5(10): 13736-54. DOI:10.1371/journal.pone.0013736 |
| [14] |
ZhouD, Lambert S, Malen PL, et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing[J]. Cell Biol, 1998, 143(5): 1295-304. DOI:10.1083/jcb.143.5.1295 |
| [15] |
Yang R, Walder-Christensen KK, Lalani S, et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly[J]. Proc Natl Acad Sci USA, 2019, 116(39): 19717-26. DOI:10.1073/pnas.1909989116 |
| [16] |
Zhu Z, Wang G, Ma K, et al. GABAergic neurons in nucleus accumbens are correlated to resilience and vulnerability to chronic stress for major depression[J]. Oncotarget, 2017, 8(8): 35933-45. |
| [17] |
Storozhuk M, Kondratskaya E, Nikolaenko L, et al. A modulatory role of ASICs on GABAergic synapses in rat hippocampal cell cultures[J]. Mol Brain, 2016, 9(1): 90-106. DOI:10.1186/s13041-016-0269-4 |
| [18] |
Liu YH, Gao ZL, Chen CF, et al. Piriform cortical glutamatergic and GABAergic neurons Express coordinated plasticity for whiskerinduced odor recall[J]. Oncotarget, 2017, 8(56): 95719-40. |
| [19] |
Lu W, Feng J, Wen B, et al. Activity-induced spontaneous spikes in GABAergic neurons suppress seizure discharges: an implication of computational modeling[J]. Oncotarget, 2017, 8(8): 32384-97. |
| [20] |
Huang L, Zhao SD, Lu W, et al. Acidosis-Induced dysfunction of cortical GABAergic neurons through Astrocyte-Related excitotoxicity[J]. PLoS One, 2015, 10(10): 24-42. |
| [21] |
Huang L, Wang C, Ge RJ, et al. Ischemia deteriorates spike encoding at cortical GABAergic neurons and cerebellar Purkinje cells by increasing the intracellular Ca2+[J]. Brain Res Bull, 2017, 131(131): 55-61. |
| [22] |
Li H, Chun W, Zhao SD, et al. PKC and CaMK-Ⅱ inhibitions synergistically rescue ischemia-induced GABAergic neuron dysfunction[J]. Oncotarget, 2017, 4(4): 1-14. |
| [23] |
Yu J, Qian H, Wang JH. Upregulation of transmitter release probability improves a conversion of synaptic analogue signals into neuronal digital spikes[J]. Mol Brain, 2012, 5(1): 26-38. DOI:10.1186/1756-6606-5-26 |
| [24] |
Zhang F, Liu B, Lei Z, et al. mGluR1, 5 activation improves network asynchrony and GABAergic synapse attenuation in the amygdala: implication for anxiety-like behavior in DBA/2 mice[J]. Mol Brain, 2012, 5(1): 20-33. DOI:10.1186/1756-6606-5-20 |
| [25] |
Zhang C, Lee T, Fu Y, et al. Properties of cross-modal occipital responses in early blindness: An ALE meta-analysis[J]. Neuroimage Clin, 2019, 18(24): 102041-53. |
| [26] |
Walker MD. Fluid and electrolyte imbalances:interpretation and assessment[J]. J Infus Nurs, 2016, 39(6): 382-6. DOI:10.1097/NAN.0000000000000193 |
| [27] |
Mcewen DP, Chen C, Meadows LS, et al. The voltage-gated Na + Channel beta 3 subunit does not mediate trans homophilic cell adhesion or associate with the cell adhesion molecule contactin[J]. Neurosci Lett, 2009, 462(3): 272-5. DOI:10.1016/j.neulet.2009.07.020 |
 2020, Vol. 40
2020, Vol. 40

