2. 重庆医科大学附属第二医院肝胆外科,重庆 400010;
3. 开州区人民医院肝胆心胸外科,重庆 405400
2. Department of Hepatobiliary Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China;
3. Department of Hepatobiliary Cardiothoracic Surgery, Kaizhou District People's Hospital, Chongqing 405400
巨噬细胞是体内免疫防御和抗原呈递的重要组成部分,可以在不同刺激下极化成不同的亚型。M1巨噬细胞具有促炎和抗肿瘤活性,而M2巨噬细胞具有免疫抑制和肿瘤促进特性[1]。巨噬细胞通过最大限度地吸收和储存铁、减少铁的排泄、减少对病原体可用的铁离子来限制病原体的生长和增殖[2-4]。Fe3O4纳米颗粒能够在巨噬细胞溶酶体内降解为铁离子,促进肿瘤相关巨噬细胞向M1型的极化,并显著增加巨噬细胞活性氧(ROS)的产生[5-7]。
聚乳酸羟基乳酸(PLGA)是乳酸和乙醇酸聚合而成的聚合物。目前许多研究集中在PLGA作为靶向纳米递送系统,用于将化疗癌症药物递送至靶组织。它具有减少全身毒性、增加血液循环时间和增加肿瘤部位的累积等优势[8-12]。通过将配体耦合到纳米微粒的表面,当纳米微粒循环至靶向细胞,配体即于受体结合,引起特定细胞内外运载物质浓度升高[13-15]。治疗性纳米颗粒可以通过吞噬性免疫细胞(主要是循环中的单核细胞和巨噬细胞)快速从内循环中去除[16]。研究表明,大多数纳米颗粒集中在肝脏和脾脏,并且纳米颗粒可以通过血液循环沉积在肿瘤组织中[17-19]。因此,我们设想能否将PLGA耦联抗体的方法通过靶向给药,作用于肿瘤相关巨噬细胞(TAM)的表型调节?而TAM在肿瘤免疫中有十分重要的作用,通过调节TAM的表型以期达到抗肿瘤的效应;这一相关相关设想还需要更深入的研究。
我们之前的研究发现提高巨噬细胞内铁含量能够促进巨噬细胞M1型极化,然后我们通过提高小鼠血液的含铁量,发现TAM较多表现为M1型,起到抗肿瘤生长的效应[20]。这种利用铁离子促进肿瘤内巨噬细胞M1型极化,以抑制肿瘤生长的方法简单易行、成本低廉,同时利用铁螯合剂能够迅速控制铁过载对机体的副作用,是一种具有潜力的抗肿瘤治疗方法。但机体铁过载对正常组织及细胞有较大损害,因此,在本研究中,我们旨在寻找一种既能促进TAM的M1极化,又能减少组织损伤的方法。
1 材料和方法 1.1 材料酸化PLGA共聚物(50:50,相对分子质量12 000,Sigma)。纳米氧化铁(10 nm,油酸包覆,氯仿分散20 mg/mL)(西安瑞溪生物)。柠檬酸铁(Sigma)、2-吗啉乙烷磺酸(MES)、1-乙基-3(- 3-二甲氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride, EDC)、N-羟基丁二酰亚胺(NHS)(Sigma)。胎牛血清(FBS)(Invitrogen)。DMEM细胞培养基(HyClone)。抗CD206、F4/80、CD86和GAPDH单克隆抗体(Abcam)。IL-1、IL-10、TGF-β和TNF-α单克隆抗体(GENETEX)。铁离子检测试剂盒(Sigma Alddrich)。细胞膜红色荧光探针(DIL)(碧云天)。TRITC(橘红色)、FITC(绿色)、APC(红色)荧光标记的二抗(Abcam)。
1.2 细胞培养RAW 264.7细胞由本实验室冻存,并在含10%胎牛血清、1%(V/V)青霉素-链霉素的DMEM中培养。置于含5% CO2 37 ℃恒温恒湿培养箱中。将巨噬细胞接种于6孔板中,用2 mL培养基培养3 h,然后加入2 mL IL-4培养12 h,获得CD206高表达巨噬细胞。用500 μL CD206-Fe3O4-PLGA纳米颗粒或Fe3O4-PLGA纳米颗粒悬浮液培养巨噬细胞30 min。然后,用PBS洗涤巨噬细胞3次,然后用TRITC(1:1000)标记的兔抗小鼠次级抗体孵育1 h,PBS洗涤3次。荧光显微镜观察纳米颗粒的靶向能力。
1.3 纳米微粒的制备以W/O/W复乳化溶剂扩散法制备载Fe3O4的PLGA纳米微粒。将PLGA(200 mg)、Fe3O4(400 mL,20 mg/mL)和9.4 mg Dil(碧云天公司)溶于2 mL二氯甲烷作为油相,然后加入8 mL 4% PVA溶液作为水相。用超声振荡仪(上海延勇超声仪器有限公司)以70%的振幅震荡60 s形成乳状,然后加入15 mL 0.2% PVA水溶液,并使用搅拌蒸发仪中搅拌90 min除去有机溶剂。然后离心(15 000×g,10 min,4 ℃)得到纳米颗粒,用双蒸水洗涤3次。
1.4 偶联CD206单克隆抗体使用碳二亚胺法制备CD206单克隆抗体结合的纳米颗粒,方法如Moura[20]所述。制备的纳米颗粒用10 mL MES缓冲液(pH 6.0)重新悬浮。在纳米颗粒悬浮液中加入1 mL EDC(0.1 mol/L),轻轻搅拌15 min,然后加入1 mL NHS(0.7 mol/L),继续搅拌45 min,离心(15 000×g,10 min,4 ℃)除去偶联反应中残留的试剂。然后将纳米颗粒用MES(pH 8.0)洗涤3次,最后再分散在2 mL双蒸馏水中。将100 mL CD206抗体溶液加入活化的纳米颗粒悬浮液中进行抗体结合,在室温下孵育2 h。最后,离心(15 000×g,10 min,4 ℃)除去过量的未结合的抗CD206抗体,用PBS洗涤3次。
1.5 纳米微粒表面特征检测使用高分辨率QuantaTM 400电子扫描显微镜(日立公司)检测纳米微粒的表面特征。使用SPI模块溅射镀膜系统,将样品安装在金属板上,在15 mA电流下通过喷溅60 s,镀上金薄膜。在5 kV的加速电压下采集图像。
1.6 纳米颗粒直径及Zeta电位检测使用马尔文激光粒径测量仪检测纳米颗粒直径,使用马尔文表面电位检测仪检测纳米微粒zeta电位。
1.7 组织免疫荧光使用组织免疫荧光检测CD86在皮下肿瘤组织(n= 10)的表达水平,方法如前所述[18]。用4',6-二脒基-2-苯基吲哚(DAPI)对细胞核进行染色。在高倍放大(×200)下,使用荧光显微镜(徕卡公司)采集图像。
1.8 细胞内活性氧水平检测500 L PLGA(10 mg)、Fe3O4- PLGA(10 mg)或CD206-Fe3O4-PLGA(10 mg)悬液加入巨噬细胞培养液基共培养4 h。加入10 mL 2,7-二氯荧光素二乙酸酯(DCFH-DA)(碧云天)在室温下避光孵育30 min,然后用PBS清洗3次,最后于荧光显微镜下测量巨噬细胞中的ROS水平。使用荧光显微镜(徕卡)观察细胞,并采集图像。
1.9 Fe3O4装载效率检测及组织内铁含量测定用铁检测试剂盒(Sigma Aldrich)分析Fe3O4浓度,按说明书进行操作。将标准铁溶液(100 nmol/L,试剂D)稀释100倍,将0、2、4、6、8、10 L的1 mmol/L标准铁溶液添加到96孔板中,以制备0、2、4、6、8、10 nmol/孔标准孔。在每个孔中加入铁测定缓冲液(试剂A),使体积达到100 L。在每个标准孔中加入5 L的还原剂(试剂C)。将10 mg CD206-Fe3O4-PLGA或Fe3O4-PLGA纳米颗粒冻干粉末完全溶于500 L二甲亚砜(DMSO)中。然后将50 L样品与50 L铁测定缓冲液和5 L铁还原剂混合,置于室温下避光孵育30 min。将100 L的铁探针(试剂B)加入标准孔及待测测试样品中,室温下避光孵育60 min。最后测量593 nm处的吸光度A593 nm。通过标准曲线转换计算得到待测样品铁含量。使用以下公式得到Fe3O4的装载率:Fe3O4装载率(%)=(样品中Fe3O4的质量)(/添加Fe3O4的总质量)×100%。
取下的皮下肿瘤,肝脏,脾脏和肺组织,准确提取1.5 g组织,用PBS洗净3次,完全去除血液。将组织剪碎后加入5 mL RIPA组织裂解液,研磨20 min。离心(15 000×g,10 min,4 ℃)吸取上清液。其余步骤与氧化铁纳米颗粒装载率的测量相同。
1.10 巨噬细胞极化的检测巨噬细胞培养基中加入2 L IL-4培养12 h,以获取高表达CD206的巨噬细胞(M2型),之后用PBS清洗3遍。随后在培养基中分别加入500 L CD206-Fe3O4- PLGA(10 mg)、Fe3O4-PLGA(10 mg)、PLGA(10 mg)和柠檬酸铁铵溶液(1.2 mg/mL)培养4 h,随后提取细胞内的蛋白质或RNA以备用。总蛋白质经BCA法测定浓度,测定后取200 L蛋白样品与50 L上样缓冲液混匀,100 ℃×10 min变性蛋白。按30 mg/孔上样进行电泳、转膜。所得条带经5% BSA封闭60 min;分别加入GAPDH抗体(1:5000)及IL-10、IL-1β、TNF-α、TGF-β抗体(比例均为1:1000),4 ℃过夜孵育;PBST清洗3遍×5 min;分别加入对应的二抗(1:1000)37 ℃孵育1 h;PBST清洗3遍× 5 min;ECL化学发光显影。使用TRIzol试剂(Invitrogen)提取RAW细胞内的总RNA,按产品说明书步骤进行;所得RNA通过分光光度计检测浓度;使用Takara逆转录试剂盒(日本)和T100 PCR仪(Bio-Rad)进行逆转录,按产品说明书步骤进行;逆转录后所得cDNA使用SYBR®-Green(TaKaRa)和荧光定量PCR检测系统(Bio-Rad)进行qRT-PCR检测,按说明书步骤进行。qRT- PCR检测核酸表达,以GAPDH为内参。相关引物信息见表 1。
| 表 1 qRT-PCR引物 Tab.1 Primers for qRT-PCR |
15只雌性BALB/C-57小鼠被随机分为3组,皮下接种200 L肿瘤细胞悬液(1×106/L)1周,肿瘤直径约为0.5 cm。100 L PLGA悬浮液、CD206-Fe3O4-PLGA悬浮液或柠檬酸铁铵溶液通过尾静脉注射,连续给药14 d后,处死小鼠,完整取下皮下肿瘤、肝脏、脾脏和肺,用于组织免疫荧光及组织内铁含量测定。
BALB/C-57小鼠购自重庆医科大学实验动物中心。本研究中使用的动物模型建立方案经重庆医科大学第二附属医院动物使用和伦理委员会评估和批准。
1.12 统计学分析采用SPSS 17.0统计软件分析数据,数据以均数±标准差表示,进行正态性、方差齐性检验,两样本均数比较采用独立样本t检验,以P < 0.05为差异有统计学意义。采用GraphPad Prism 5软件制图。
2 结果 2.1 纳米微粒的特性通过光学及电子扫描显微镜观察纳米微粒大小较均匀,呈球形,分散性好,表面光滑(图 1A、B)。荧光显微镜显示TRITC标记的CD206成功与PLGA纳米微粒偶联,所有的PLGA纳米微粒都使用细胞膜红色荧光探针DIL标记(图 1C)。CD206-Fe3O4-PLGA、Fe3O4-PLGA及PLGA微粒的Fe3O4装载效率、CD206抗体偶联效率、平均粒径及Zeta电位均在表 2中列出。
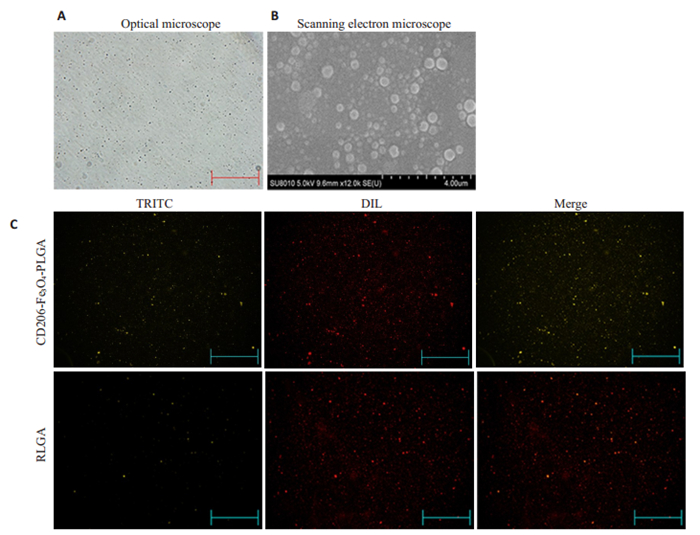
|
图 1 纳米微粒的特性 Fig.1 Characterization of CD206-Fe3O4-PLGA nanoparticles. A: Observation of the nanoparticles under optical microscope (Original magnification: ×100); B: Scanning electron microscopy of the nanoparticles (×50 000). C: Fluorescence microscopy of the nanoparticles. Red: DIL. Yellow: TRITC (×100) |
| 表 2 纳米微粒的特性 Tab.2 Characteristics of the nanoparticles |
我们之前的研究表明,小鼠机体高水平铁可能通过促进肿瘤相关巨噬细胞(TAM)的M1极化而抑制肿瘤生长。在随后的实验中发现,尾静脉注射柠檬酸铁可显著增加小鼠肝脏、脾脏和肺中的铁含量(图 2A),这可能导致潜在的器官损伤。由于TAMs几乎都是M2表型,因此,我们选择CD206偶联的Fe3O4-PLGA纳米微粒将Fe3O4转运至CD206阳性的巨噬细胞,从而靶向提高巨噬细胞铁浓度、减少正常组织内的铁蓄积,我们通过在M2巨噬细胞培养基中加入CD206偶联和未偶联CD206的纳米微粒,共培养4 h后,检测巨噬细胞内的铁含量。实验结果显示CD206偶联的纳米微粒与为偶联CD206的纳米微粒相比,它能够更加明显的提高经IL-4预处理的巨噬细胞内的铁含量(图 2B)。通过与不同的纳米微粒共培养,免疫荧光实验证实CD206阳性表达的巨噬细胞(M2)与CD206-Fe3O4-PLGA具有较强的结合能力,而CD206阴性巨噬细胞(M0/M1)则无较强的结合能力(图 2C、D)。
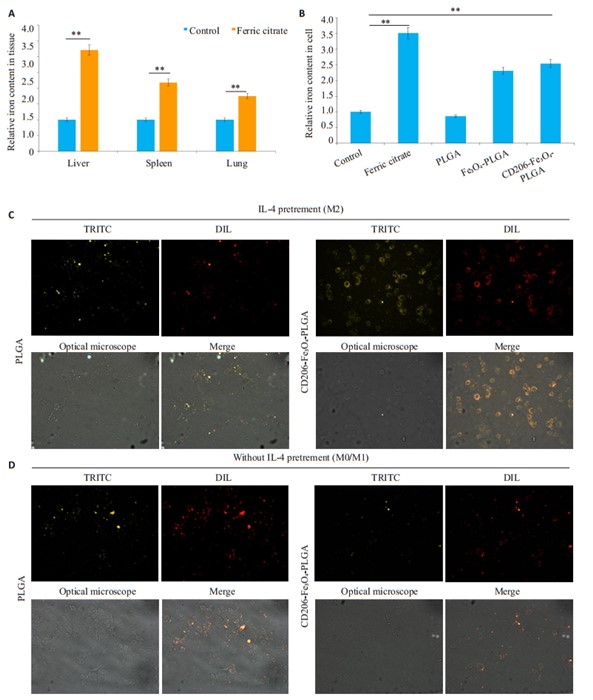
|
图 2 选择性地提高M2巨噬细胞内的铁含量 Fig.2 CD206-Fe3O4-PLGA nanoparticles selectively increases iron content in mouse M2 macrophages. A: Compared with the control mice, the mice injected with ammonium ferric citrate had greater iron contents in the liver, spleen, lung and subcutaneous tumors (**P < 0.05 vs control); B: All RAW cells were pretreated with IL-4. Compared with that in the control group, iron content in the macrophages cultured with CD206-Fe3O4-PLGA increased significantly 2 h after the addition of the nanoparticles (**P < 0.05 vs control); the iron content did not differ significantly between CD206-Fe3O4-PLGA group and ferric citrate group (P > 0.05 vs control). C, D: Immunofluorescence showed that CD206-Fe3O4-PLGA had a stronger binding ability to M2 macrophages than that PLGA. Both CD206-Fe3O4-PLGA and PLGA showed a low binding ability to M1/M0 macrophages (×400) |
我们采用Western blotting、q-RT PCR验证纳米颗粒是否具有促进巨噬细胞极化的作用。结果显示,CD206-Fe3O4-PLGA和Fe3O4-PLGA纳米微粒均能促进M1巨噬细胞极化标记物的表达(TNF-α,IL-1β,iNOS)(P < 0.05),同时抑制了M2巨噬细胞的标记物的表达。PLGA纳米微粒不具有促进巨噬细胞极化的功能(图 3A、B)。通过活性氧探针检测巨噬细胞内活性氧产生水平,结果显示CD206-Fe3O4-PLGA和Fe3O4-PLGA纳米微粒的预处理,细胞内铁含量升高的巨噬细胞内伴有ROS生成水平升高(图 3C)。
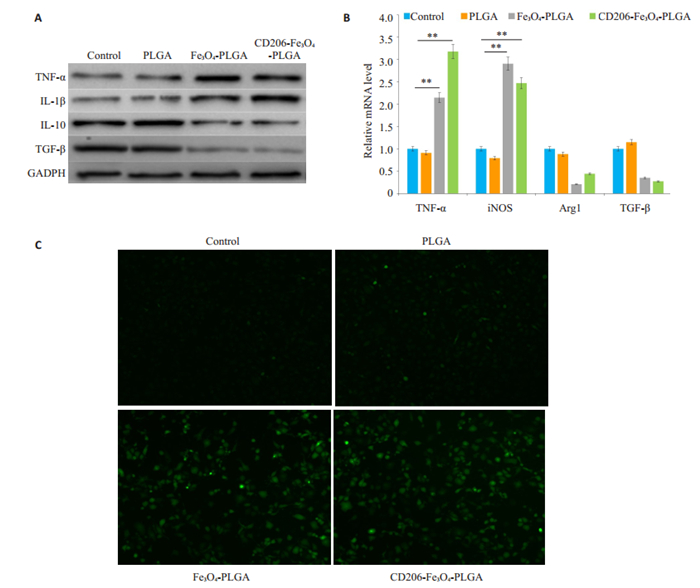
|
图 3 纳米微球促进巨噬细胞极化和细胞活性氧产生 Fig.3 Nanoparticles promote macrophage polarization and the production of reactive oxygen species (ROS). A, B: Western blotting and qRT-PCR showing that CD206-Fe3O4-PLGA and Fe3O4-PLGA promote the expression of TNF-α, IL-1β and iNOS (**P < 0.05 vs control); C: Reactive oxygen probe assay showing that PLGA microspheres did not significantly increase intracellular ROS. CD206-Fe3O4-PLGA and Fe3O4-PLGA nanoparticles significantly increased ROS production in the macrophages (×100) |
通过尾静脉注射CD206-Fe3O4-PLGA、Fe3O4- PLGA、PLGA纳米微粒或柠檬酸铁铵溶液对荷瘤小鼠进行体内靶向性研究。CD206-Fe3O4-PLGA纳米微粒组皮下肿瘤直径较PLGA组和对照组小(图 4A、B)。用免疫荧光法观察纳米颗粒在肿瘤组织中的沉积情况,实验结果显示CD206-Fe3O4-PLGA纳米微粒组皮下组织纳米颗粒聚集较PLGA组多(图 4D)。组织荧光实验结果显示CD206-Fe3O4-PLGA组巨噬细胞表达较高水平的CD86,而PLGA组CD86表达水平较低(图 4E)。通过检测肝、脾、肺及皮下瘤组织内的铁含量,发现CD206- Fe3O4- PLGA组肿瘤组织含铁量明显高于Fe3O4-PLGA、PLGA及柠檬酸铁铵溶液组(P < 0.05,图 4C)。
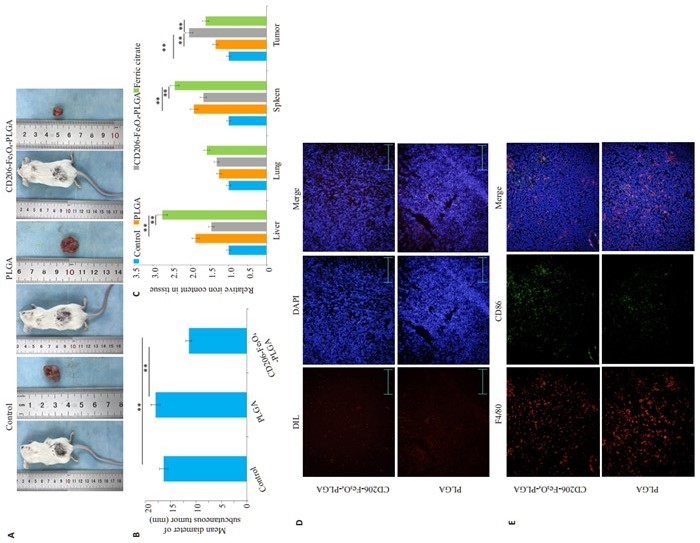
|
图 4 纳米微粒促进小鼠皮下瘤内巨噬细胞M1型极化 Fig.4 Nanoparticles promote M1 polarization of macrophages in mice bearing subcutaneous tumors. A, B: The diameter of subcutaneous tumors is smaller in mice treated with CD206-Fe3O4-PLGA than in the control group; C: Compared with iron citrate, CD206-Fe3O4-PLGA nanoparticles result in a higher iron content in the subcutaneous tissue and lower iron contents in the liver and spleen (**P < 0.05 vs control); D: Tissue immunofluorescence assay showing more obvious aggregation of nanoparticles in the subcutaneous tissue of mice treated with CD206-Fe3O4-PLGA (× 100); E: Tissue immunofluorescence assay showing a higher expression of CD86 in CD206-Fe3O4-PLGA treatment group, indicating more obvious M1 polarization of tumor-associated macrophages |
M1巨噬细胞快速摄取周围环境中的铁是一中重要的抑菌机制,也是慢性炎症相关性贫血的机制之一。另外,目前的一些研究数据显示,巨噬细胞内铁蓄积能够直接激活巨噬细胞,促进巨噬细胞向M1型极化,提示巨噬细胞铁蓄积在慢性炎症和自身免疫性疾病发病机制中的作用。相反的,M2型巨噬细胞更容易释放出细胞内的铁,以提高周围环境中可利用铁离子含量,促进临近细胞生长,所以,M2巨噬细胞在肿瘤生长及组织重塑中具有重要作用[21]。
较多研究显示,纳米氧化铁能够促进巨噬细胞M1型极化,同时M1型巨噬细胞通过芬顿反应诱导肿瘤细胞凋亡[22-23]。简单的提高机体含铁量可能会导致正常组织的铁沉积,如肝、脾和肺等。而铁沉积可导致许多潜在的组织损伤,如肝硬化、肺硬化和血管内皮损伤等[24-25]。另一方面,肿瘤细胞生长也需要较多的铁,因此,全身性的提高血液含铁量,是否会加速肿瘤细胞的生长、降低总体生存率,也需要进一步研究。
由于肿瘤内的巨噬细胞在肿瘤微环境中,多表现为M2型巨噬细胞,它具有促进肿瘤发展的作用,因此,我们尝试构建表面耦合有CD206单克隆抗体的PLGA纳米微球来靶向输送纳米铁,PLGA微球经血液循环到达肿瘤后,CD206单克隆抗体与M2型巨噬细胞表面的CD206蛋白结合,PLGA被巨噬细胞吞噬或直接水解释放出纳米铁粒子,纳米铁粒子在溶酶体中降解为铁离子,靶向地提高了巨噬细胞内含铁量。
在实验中,我们通过IL-4处理获得高表达CD206的M2型巨噬细胞,免疫荧光证实M2巨噬细胞能够很好的结合偶联CD206抗体的纳米微粒,通过该特性,我们将Fe3O4搭载于偶联CD206抗体的纳米微粒中,实验证实载有Fe3O4的CD206-PLGA纳米微粒与柠檬酸铁铵溶液处理都能够促进巨噬细胞M1型极化。在随后动物模型研究中,我们通过静脉途径将不同PLGA纳米微粒注射到荷瘤小鼠体内,通过免疫荧光检测了肿瘤组织内的PLGA沉积情况,实验结果显示CD206偶联的纳米微粒能够较多的沉积肿瘤组织内,说明偶联了CD206的纳米微球具有较好的靶向性。随后我们观察了肿瘤组织内的CD86和F4/80表达情况,结果显示CD206-Fe3O4-PLGA纳米微粒处理提高了CD86的表达,说明肿瘤内的巨噬细胞较多极化为M1型。最后,我们检测了肝脾肺及皮下瘤组织内的含铁量,发现柠檬酸铁溶液注射的小鼠,肝脏、脾脏内的含铁量明显高于CD206-PLGA纳米微粒组,而皮下瘤组织内的含铁量却低于CD206-Fe3O4-PLGA纳米微粒组,说明CD206- Fe3O4-PLGA纳米微粒能够较好的靶向性的提高肿瘤内巨噬细胞的含铁量,减少正常组织内的铁沉积。
本实验通过构建载有纳米氧化铁的偶联CD206抗体的PLGA纳米微球,达到靶向提高M2型巨噬细胞内铁含量的效果,促进M2巨噬细胞向M1型巨噬细胞极化,从而抑制了肿瘤的生长,却又能减少正常组织器官铁沉积。
将铁剂作为巨噬细胞极化状态的调节剂,方法简单也较为安全,体内铁含量也容易检测,同时在机体铁过载的时候,口服铁螯合剂能迅速、直接降低铁含量。我们的研究提供了一种可能的肿瘤免疫治疗辅助方法,但这种方法需要更多的实验及数据来验证。
| [1] |
Juhas U, Ryba-Stanisławowska M, Szargiej P, et al. Different pathways of macrophage activation and polarization[J]. Postepy Hig Med Dosw, 2015(69): 496-502. |
| [2] |
Costa LF, Mol JP, Silva AP, et al. Iron acquisition pathways and colonization of the inflamed intestine by salmonella enterica serovar typhimurium[J]. Int J Med Microbiol, 2016, 306(8): 604-10. DOI:10.1016/j.ijmm.2016.10.004 |
| [3] |
Nairz M, Dichtl S, Schroll A, et al. Iron and innate antimicrobial immunity-depriving the pathogen, defending the host[J]. J Trace Elem Med Bio, 2018(48): 118-33. |
| [4] |
Jung M, Mertens C, Brüne B. Macrophage Iron homeostasis and polarization in the context of cancer[J]. Immunobiology, 2015, 220(2): 295-304. |
| [5] |
Zanganeh S, Hutter G, Spitler R, et al. Iron oxide nanoparticles inhibit tumour growth by inducing pro-inflammatory macrophage polarization in tumour tissues[J]. Nat Nanotechnol, 2016, 11(11): 986-94. DOI:10.1038/nnano.2016.168 |
| [6] |
Thorek DLJ, Chen AK, Czupryna J, et al. Superparamagnetic iron oxide nanoparticle probes for molecular imaging[J]. Ana Biomed Eng, 2006, 34(1): 23-38. DOI:10.1007/s10439-005-9002-7 |
| [7] |
Liu Z, Jiang W, Nam J, et al. Immunomodulating nanomedicine for cancer therapy[J]. Nano Lett, 2018, 18(11): 6655-9. DOI:10.1021/acs.nanolett.8b02340 |
| [8] |
Minhee K, Dong-Min K, Keun-Sik K, et al. Applications of cancer cell-specific aptamers in targeted delivery of anticancer therapeutic agents[J]. Molecules, 2018, 23(4): 830. |
| [9] |
Sima R, Natascha ID, Mostafa KM, et al. PLGA-Based nanoparticles in cancer treatment[J]. Front Pharmacol, 2018(9): 1260. |
| [10] |
Francois F, Line H, Stefanie JH, et al. Investigating the cellular specificity in tumors of a surface-converting nanoparticle by multimodal imaging[J]. Bioconjug Chem, 2017, 28(5): 1413-21. DOI:10.1021/acs.bioconjchem.7b00086 |
| [11] |
Xu X, Ho W, Zhang X, et al. Cancer nanomedicine: from targeted delivery to combination therapy[J]. Trends Mol Med, 2015, 21(4): 223-32. DOI:10.1016/j.molmed.2015.01.001 |
| [12] |
Wang G, Griffin JI, Inturi S, et al. In vitro and In vivo differences in murine third complement component (C3) opsonization and macrophage/leukocyte responses to antibody-functionalized Iron oxide nanoworms[J]. Front Immunol, 2017, 8(2): 151. |
| [13] |
Badkas A, Frank E, Zhou ZL, et al. Modulation of in vitro phagocytic uptake and immunogenicity potential of modified Herceptin®- conjugated PLGA-PEG nanoparticles for drug delivery[J]. Colloids Surf B Biointerfaces, 2017, 12(162): 271-8. |
| [14] |
Lu S, Zhao F, Zhang Q, et al. Therapeutic peptide amphiphile as a drug carrier with ATP-Triggered release for synergistic effect, improved therapeutic index, and penetration of 3D cancer cell spheroids[J]. Int J Mol Sci, 2018, 19(9): 2773. DOI:10.3390/ijms19092773 |
| [15] |
Wickens JM, Alsaab HO, Kesharwani P, et al. Recent advances in hyaluronic acid-decorated nanocarriers for targeted cancer therapy[J]. Drug Discov Today, 2016, 22(4): 665-80. |
| [16] |
Jokerst JV, Lobovkina T, Zare RN, et al. Nanoparticle PEGylation for imaging and therapy[J]. Nanomedicine (Lond), 2011, 6(4): 715-28. DOI:10.2217/nnm.11.19 |
| [17] |
Kwon IK, Lee SC, Han B, et al. Analysis on the current status of targeted drug delivery to tumors[J]. Controlled Release, 2012, 164(2): 108-14. |
| [18] |
Kamaly N, Yameen B, Wu J, et al. Degradable controlled-release polymers and polymeric nanoparticles: mechanisms of controlling drug release[J]. Chem Rev, 2016, 116(4): 2602-63. DOI:10.1021/acs.chemrev.5b00346 |
| [19] |
Yingchoncharoen P, Kalinowski DS, Richardson DR. Lipid-Based drug delivery systems in cancer therapy: what is available and what is yet to come[J]. Pharmacol Rev, 2016, 68(3): 701-87. DOI:10.1124/pr.115.012070 |
| [20] |
周赟, 易竹君, 阙克婷, 等. 铁离子通过ROS-乙酰化P53促进巨噬细胞M1型极化[J]. 第三军医大学学报, 2018, 40(1): 45-52. |
| [21] |
Moura CC, Segundo M, Neves J, et al. Co-association of methotrexate and SPIONs into anti-CD64 antibody-conjugated PLGA nanoparticles for theranostic application[J]. Int J Nanomedicine, 2014, 9(1): 4911-22. |
| [22] |
Ganz T, Nemethiron E. Homeostasis in host defence and inflammation[J]. Nat Rev Immunol, 2015, 15(8): 500-10. DOI:10.1038/nri3863 |
| [23] |
Ahamed M, Akhtar MJ, Khan MAM, et al. Cobalt iron oxide nanoparticles induce cytotoxicity and regulate the apoptotic genes through ROS in human liver cells (HepG2)[J]. Colloid surface B, 2016, 148: 665-73. DOI:10.1016/j.colsurfb.2016.09.047 |
| [24] |
Radu BM, Din PI, Hermenean A, et al. Exposure to Iron oxide nanoparticles coated with Phospholipid-Based polymeric micelles induces biochemical and histopathological pulmonary changes in mice[J]. Int J Mol Sci, 2015, 16(12): 29417-35. DOI:10.3390/ijms161226173 |
| [25] |
Mollet IG, Patel D, Govani FS, et al. Low dose Iron treatments induce a DNA damage response in human endothelial cells within minutes[J]. PLoS One, 2016, 11(2): e0147990. DOI:10.1371/journal.pone.0147990 |
 2020, Vol. 40
2020, Vol. 40

