肠出血性大肠杆菌血清型O157 : H7(EHEC)是一种高度传染性的食源性病原体,引起严重的胃肠道疾病[1]。EHEC感染主要表现为出血性结肠炎,更为严重的是危及生命的溶血性尿毒综合征,对人类健康造成潜在的严重威胁[2-4]。据报道,EHEC感染的易感性因人而异,婴儿、儿童和老年人易感,特别是年龄小于5岁的患者发生严重症状的风险很高[5]。有研究报道了首例18岁男性感染EHEC引起肠套叠的病例[6]。目前对EHEC感染缺乏有效的治疗方案,抗生素治疗并没有改善EHEC引起的肠炎病程,甚至会增加并发溶血性尿毒综合征的危险[7-8]。因此,目前亟需转变策略,发展以预防为主的防控手段,以减少EHEC感染带来的疾病负担和经济负担。
研究认为益生菌可通过维持肠道微生态平衡、提高肠道免疫力等途径增强肠道屏障功能,在保持机体健康、预防及治疗肠道相关疾病中应用广泛[9-14]。目前使用较广泛的益生菌主要包括各种乳杆菌、双歧杆菌和肠球菌等。有研究用双歧杆菌乳杆菌三联活菌片成功预防了大肠杆菌K1株感染[15];有研究用嗜酸乳杆菌成功抑制了EHEC肠道定植[16]。但是益生菌的安全性存疑:在临床应用过程中发现,对于一些早产儿、极度虚弱或免疫缺陷的病人使用益生菌可能引起患者全身性感染、脓毒症、乳酸中毒、胃肠道不良反应等症状[17-19]。
鼠李糖乳杆菌GG株(LGG)活菌本身及其代谢物都是目前研究得最为深入的益生菌。我们的前期研究表明LGG培养上清液(LCS)可促进新生大鼠肠道屏障功能的发育和完善,并增强其对大肠杆菌K1株感染的抵抗力[20]。利用高效液相色谱-串联质谱分析(LC-MS/ MS)技术,我们鉴定出LCS中潜在的生物活性蛋白(命名为HM0539),并发现其对肠屏障功能有益[21]。但是HM0539是否对EHEC的感染具有预防及治疗作用还未可知。本研究主要通过体内、外实验考察HM0539防治EHEC感染的效果,并探讨在此过程中HM0539对EHEC感染肠道上皮屏障功能的影响及其潜在机制。
1 材料和方法 1.1 材料 1.1.1 实验动物SPF级3周龄雌性BALB/c小鼠,由南方医科大学实验动物中心提供。
1.1.2 菌株和细胞EHEC标准株EDL933(链霉素抗性)、HT-29细胞,本实验室保存。
1.1.3 主要试剂和仪器胰蛋白胨、酵母提取物、PAS试剂盒(北京Solarbio),1640细胞培养基(美国Gibco),FBS(PA),蛋白提取试剂盒(南京凯基生物科技有限公司),MUC2抗体(武汉Proteintech Group),ZO-1抗体、Occludin抗体(武汉Servicebio),辣根过氧化物酶标记的二抗(北京鼎国生物科技有限公司)。荧光显微镜(日本Nikon),SDS-PAGE凝胶电泳仪、电转仪(美国Bio-Rad)。
1.2 方法 1.2.1 EHEC菌液的制备EHEC培养于LB液体培养基[16]。收集对数生长期细菌,PBS洗3次,重悬于无菌PBS中,分光光度计调整好菌液浓度,置于4 ℃备用。
1.2.2 HM0539的表达、纯化和脱盐HM0539的表达和纯化参考文献[21]所述。HM0539经超滤浓缩除盐后,加入终浓度为20%的甘油,BCA法测量蛋白浓度,-80 ℃保存备用。
1.2.3 负载HM0539玉米醇溶蛋白-果胶颗粒的制备采用玉米醇溶蛋白-果胶负载技术制备HM0539-果胶颗粒,该剂型能保护蛋白免受胃酸消化,缓慢释放于肠道发挥保护功效。果胶颗粒的制备方法参考文献[21]所述。
1.2.4 HM0539不同浓度实验分组将细胞培养于24孔板中,置于37 ℃,5%二氧化碳恒温箱中培养10 d;实验分3组,向各处理组中分别加入10 ng/mL和100 ng/mL终浓度的HM0539,对照组中加入等体积的PBS于培养箱中孵育4 h,每组设3个副孔,然后向每孔中加入1× 107 CFU EHEC处理4 h进行黏附侵袭实验。
1.2.5 HM0539不同处理方式实验分组细胞培养及分组同上,向预处理组中预先加入100 ng/mL终浓度的HM0539于培养箱中孵育4 h,同时处理组中同时加入100 ng/mL终浓度的HM0539和1×107 CFU EHEC,对照组中同时加入等体积的PBS和1×107 CFU EHEC,每组设3个副孔,处理4 h进行黏附侵袭实验。
1.2.6 黏附实验上述处理完后,弃去培养基,PBS洗3次,加入150 μL 0.5%TritonX-100裂解8 min;裂解完后迅速加入850 μL PBS终止裂解,用枪头反复吹打每孔使悬液混匀;吸取悬液进行倍比稀释,取50 μL液体涂布于含链霉素的LB平板,放入37 ℃培养箱中培养10 h进行菌落计数;EHEC相对黏附率=(处理组各组菌落数/对照组中菌落数的均数)×100%。
1.2.7 侵袭实验上述处理完后,弃去培养基,PBS洗3次,加入含100 μg/mL氨苄青霉素的全培处理1 h,杀死细胞外细菌;弃去培养基,PBS洗3次,加入150 μL 0.5% TritonX-100裂解8 min;裂解完后迅速加入850 μL PBS终止裂解,用枪头反复吹打每孔使悬液混匀;吸取悬液进行倍比稀释,取50 μL液体涂布于含链霉素的LB平板,放入37 ℃培养箱中培养10 h进行菌落计数;EHEC相对侵袭率=(处理组各组菌落数/对照组中菌落数的均数)×100%。
1.2.8 细胞免疫荧光实验检测MUC2、ZO-1和Occludin蛋白的表达细胞培养、分组及处理同上;细胞处理完后,弃去培养基,PBS浸洗3次;加入-20 ℃冰冻甲醇,室温固定30 min;PBS浸洗3次,封闭液处理30~45 min;弃去封闭液,加入稀释好的相应一抗4 ℃孵育过夜;回收一抗,PBST浸洗3次,5 min/次;加入稀释好的二抗,避光孵育2 h;弃去二抗,PBST避光浸洗3次,10 min/次;加入40%甘油,荧光显微镜下观察结果。
1.2.9 Western blot检测MUC2、ZO-1和Occludin蛋白的表达细胞培养、分组及处理同上;弃去培养液,预冷PBS洗3次,提取总蛋白,BCA法测蛋白浓度,进行SDS-PAGE电泳,将电泳产物转印到PVDF膜,3% BSA室温封闭1 h,加入相应的一抗,4 ℃孵育过夜。洗膜后用对应辣根过氧化物酶标记的二抗,室温孵育1 h,再次洗膜后用化学发光法显色,观察各组蛋白表达量。
1.2.10 动物实验将小鼠随机分成4组(攻毒前,NC组和EHEC组每天灌胃空白果胶,连续7 d;HM0539组和HM0539+EHEC组每天灌胃HM0539果胶,连续7 d),10只/组。攻毒前提前3 d用链霉素水喂食小鼠并禁食12 h,EHEC组和HM0539 + EHEC组用100 μL × 1011 CFU/mL EHEC菌液灌胃小鼠,同时腹腔注射丝裂霉素(2.5 mg/kg),间隔12 h后用同样的菌量再次灌胃小鼠。NC组和HM0539组用100 μL无菌PBS模拟攻毒。
1.2.11 空肠组织H & E染色,PAS染色,MUC2、ZO-1的免疫组化攻毒后观察小鼠的生长状态,记录小鼠的体质量及存活情况,观察7 d后,取小鼠空肠组织制H & E、PAS及免疫组化切片。
1.3 统计学分析所有实验至少重复3次,使用软件SPSS 20.0进行统计分析,数据以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 HM0539可以抑制EHEC对HT-29细胞的黏附侵袭HM0539可以降低EHEC对HT-29细胞的黏附率和侵袭率,且具有浓度依赖性(P < 0.01,图 1AB)。将浓度为100 ng/mL HM0539与1×107 CFU EHEC共同处理细胞,结果显示,虽然HM0539共同处理组有降低EHEC对HT-29细胞黏附侵袭率的趋势,但差异无统计学意义(P < 0.05,图 1C、D)。HM0539能够抑制EHEC对HT-29细胞的黏附侵袭,同时用HM0539预处理的效果明显优于HM0539与EHEC同时处理。接下来的实验都采用HM0539预处理。
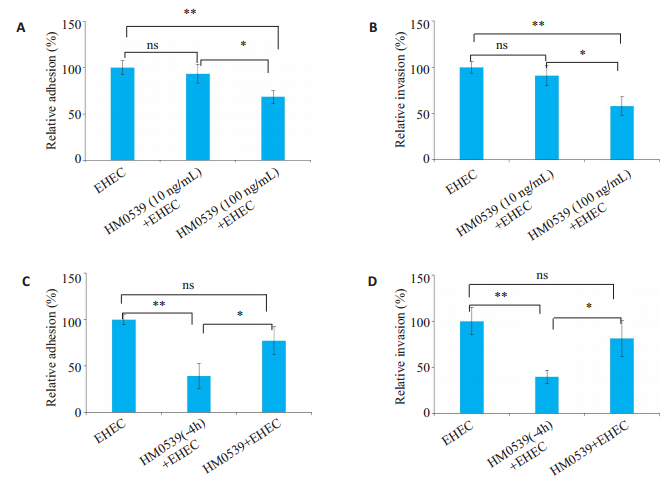
|
图 1 HM0539对EHEC黏附、侵袭HT-29细胞的影响 Fig.1 Effect of HM0539 on adhesion and invasion of EHEC to HT-29 cells. A: HM0539 significantly inhibits the adhesion of EHEC to HT-29 cells in a dose-dependent manner; B: HM0539 significantly inhibits the invasion of EHEC in HT-29 cells in a dose-dependent manner; C: The inhibitory effect of HM0539 on EHEC adhesion to HT-29 cells is stronger in HM0539 pretreatment group than in the co-treatment group; D: The inhibitory effect of HM0539 on EHEC invasion in HT-29 cells is stronger in HM0539 pretreatment group than in the co-treatment group. *P < 0.05; **P < 0.01. |
EHEC能够明显降解细胞分泌的MUC2蛋白,加入HM0539进行处理后,可以抑制EHEC对MUC2蛋白的破坏(P < 0.05,图 2A、B);免疫荧光实验也显示EHEC单独处理组中绿色荧光明显更少,且分布很不均匀,HM0539与EHEC组中,绿色荧光明显增多(图 2C)。
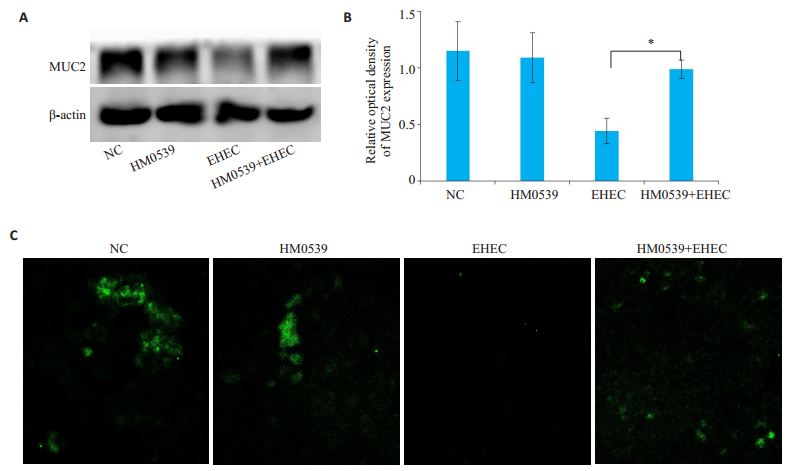
|
图 2 不同处理条件下细胞MUC2蛋白的表达变化 Fig.2 Expression of MUC2 in HT-29 cells with different treatment. A: Western blot analysis of MUC2; B: Image J semi-quantitative analysis of MUC2; C: Immunofluorescence analysis of MUC2. *P < 0.05 vs the control. |
EHEC能够明显降低细胞间紧密连接蛋白ZO-1和Occludin蛋白的表达量,加入HM0539处理后,ZO-1和occludin蛋白的表达量明显高于EHEC组(P < 0.05,图 3ABCD);免疫荧光实验显示,EHEC单独处理组中绿色网格明显更少且不完整,HM0539+EHEC组中,绿色网格明显增多且基本完整(图 3E、F)。
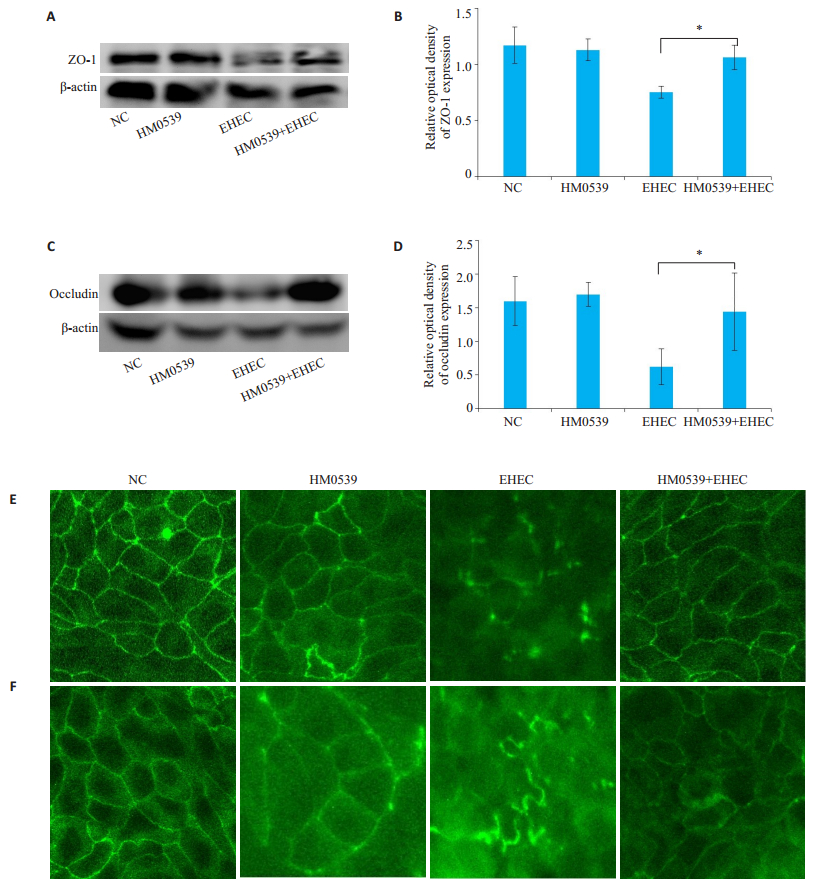
|
图 3 不同处理条件下细胞间紧密连接蛋白ZO-1和occludin的表达变化 Fig.3 Expression of tight junction proteins ZO-1 and occludin in HT-29 cells. A: Western blot analysis of ZO-1; B: Image J semi-quantitative analysis of ZO-1; C: Western blot analysis of occludin; D: Image J semi-quantitative analysis of Occludin; E: Immunofluorescence analysis of ZO-1; F: Immunofluorescence analysis of Occludin. *P < 0.05 vs the control. |
结果显示,HM0539降低了攻毒小鼠的死亡率和抑制了体质量下降(图 4A、B)。研究检测HM0539对攻毒小鼠小肠的影响,发现HM0539抑制了EHEC诱导的空肠绒毛萎缩和隐窝脓肿(图 4C、D)。
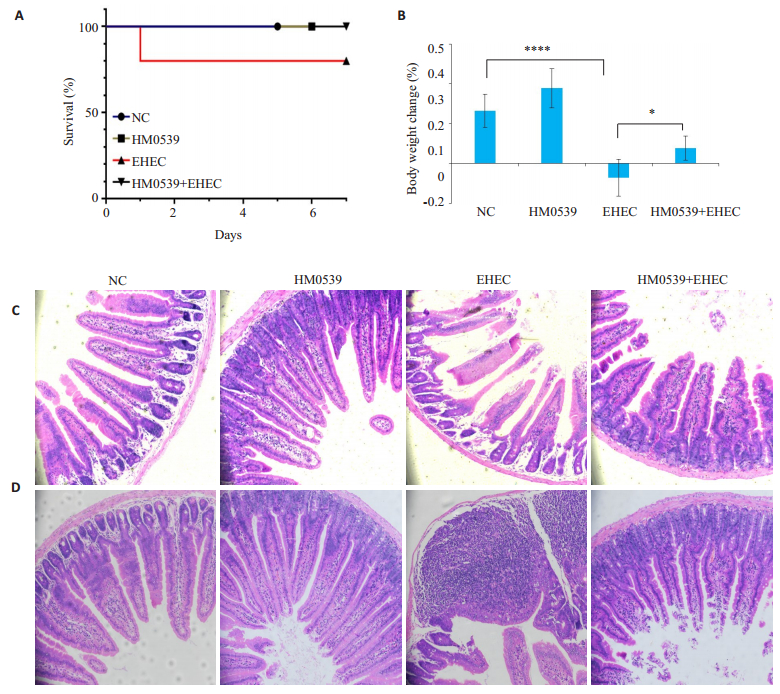
|
图 4 在EHEC诱发的小鼠小肠结肠炎的病理过程中,HM0539减轻了临床症状和肠道炎症 Fig.4 HM0539 alleviates symptoms and intestinal inflammation in mice with EHEC -induced colitis. A, B: Percentage survival (A) and body weight changes (B) of the mice (n=10) on day 7 after EHEC infection (*P < 0.05; ****P < 0.0001). Representative images of the jejunum with HE staining (×200) are used to compare villus changes (C) and crypt abscesses (D) in the jejunum of the mice. |
本研究使用PAS染色研究HM0539对空肠中杯状细胞的影响,结果显示,EHEC能够明显减少肠中杯状细胞的数量(P < 0.01),加入HM0539进行处理后,可以显着抑制EHEC诱导的空肠杯状细胞的减少(P < 0.05,图 5A、D)。
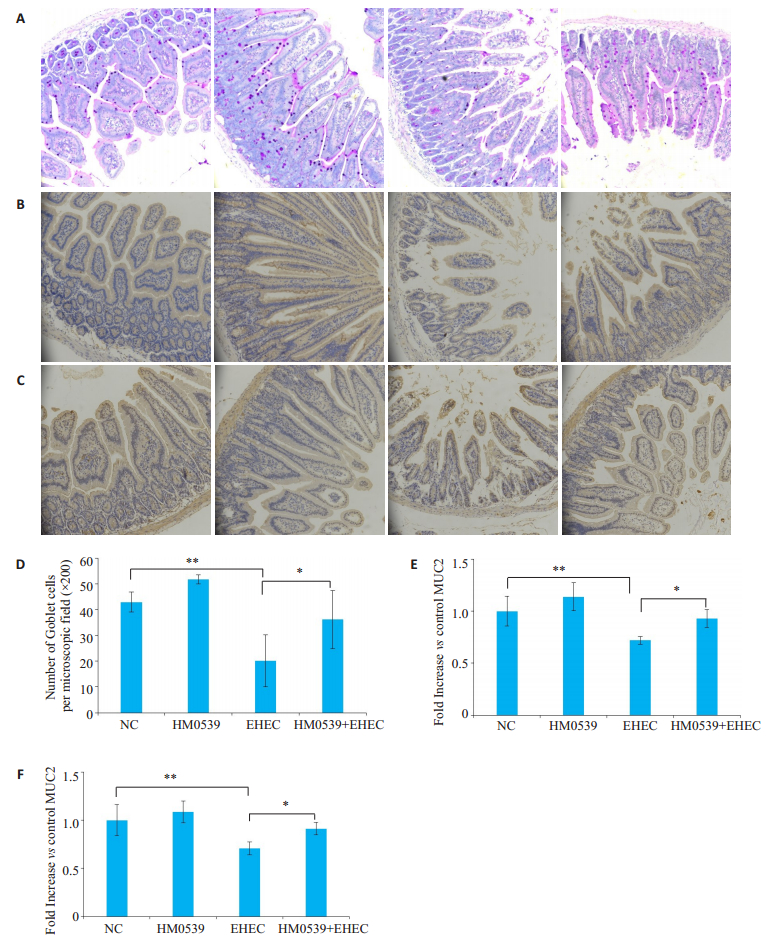
|
图 5 HM0539对EHEC感染小鼠的预防效果 Fig.5 Preventive effect of HM0539 in mice infected with EHEC. A: Representative images of the jejunum stained with PAS; B: Representative images of MUC2 expression in the jejunum with immunohistochemical staining; C: Representative images of ZO-1 expression in the jejunum with immunohistochemical staining; D: Number of goblet cells per microscopic field (×200) in the jejunum of the mice; E: Image J semi-quantitative analysis of MUC2; F: Image J semi-quantitative analysis of ZO-1. *P < 0.05; **P < 0.01. |
通过免疫组化检测小鼠肠中MUC2的蛋白表达,结果显示,HM0539+EHEC组空肠MUC2染色阳性区域面积明显大于EHEC组(图 5B、E);Image J半定量分析结果显示,HM0539+EHEC组空肠组织中MUC2表达量显著高于EHEC组(P < 0.05)。
2.7 HM0539抑制EHEC感染小鼠肠道中ZO-1表达的下调通过免疫组化检测小鼠肠中ZO-1的蛋白表达,结果显示,HM0539+EHEC组空肠ZO-1染色阳性区域面积明显大于EHEC组;Image J半定量分析结果显示,HM0539+EHEC组空肠组织中ZO-1表达量显著高于EHEC组(P < 0.05,图 5C、F)。
3 讨论益生元最近因其对宿主健康的潜在有益作用而受到医学关注。体外研究表明,HM0539可以保护肠上皮免受LPS或TNF-α诱导的损伤,体内研究表明,HM0539不仅可以预防DSS引起的结肠炎,而且可以预防LPS/GalN引起的肠屏障功能障碍,细菌易位和肝损伤[21]。
本研究首先通过体外用HM0539处理HT-29细胞,发现其可以呈浓度依赖性地抑制EHEC对HT-29细胞的黏附和侵袭,且HM0539预处理的效果明显优于HM0539与EHEC同时处理,即提前孵育HM0539效果好于HM0539与EHEC共同孵育的效果。现有研究表明EHEC能够破坏肠道表面的MUC2,从而引起肠道疾病[22-23]。加入HM0539处理后,其能够明显抑制EHEC对HT-29细胞中MUC2的破坏。本研究通过检测紧密连接蛋白ZO-1及Occludin的表达,发现EHEC能够明显破坏细胞间的紧密连接,加入HM0539处理后,发现HM0539能够明显抑制EHEC对细胞间紧密连接蛋白的破坏。
为了进一步验证HM0539对EHEC的预防作用,本研究进行了小鼠动物实验。小鼠在感染EHEC后表现出一系列的临床症状,如食欲低下、精神萎靡、体质量明显下降,HM0539改善了小鼠的病症,对体质量下降有一定的缓解作用,但是与未感染的小鼠体质量相比,仍有一定的差距。本研究H & E染色结果显示,HM0539减轻了EHEC诱导的空肠绒毛萎缩和隐窝脓肿。肠杯状细胞和粘蛋白的主要功能是覆盖肠上皮表面的粘液层的形成,并且在保护肠上皮屏障的完整性方面起着重要作用[24];现有研究表明,MUC2对抑制大肠杆菌入侵机体具有非常重要的作用[25-27]。本研究发现,HM0539可显着抑制EHEC诱导的小鼠肠道杯状细胞和MUC2的破坏。粘液可阻止细菌渗透,使其不能牢固地附着在空肠的上皮细胞上[28],经口感染的EHEC可破坏空肠杯状细胞分泌的粘液,HM0539显然改变了上述情况。紧密连接蛋白在抑制致病菌易位等方面扮演重要角色,其中紧密连接蛋白ZO-1表达水平是反映细胞间紧密连接完整性的敏感指标。有研究表明,EHEC下调了小鼠肠内紧密连接蛋白的表达并增加了肠的通透性[29]。本研究发现EHEC降低了小鼠空肠中ZO-1蛋白的表达量,而HM0539抑制了EHEC对小鼠空肠中ZO-1的破坏。
目前EHEC的治疗策略主要是支持疗法[30]。现有研究认为抗菌肽和噬菌体可以治疗EHEC感染[31-34]。抗菌肽类似于抗生素具有抗菌活性,可能会诱导细菌细胞壁溶解释放预先形成的毒素,从而增加与肠壁相互作用的毒素数量[35-36];噬菌体可能会诱导Stx基因的表达[35]。然而,这些方法都是直接作用于EHEC,不但可以引起细菌抗性,同时还会破坏肠道菌群结构,很可能对机体产生潜在的负面影响。本研究首次用HM0539预防EHEC,发现HM0539可以促进MUC2和紧密连接蛋白的表达,说明HM0539很可能是通过增强肠道屏障功能,而不是直接作用于EHEC,间接地起到预防的作用。研究表明Mucin除了可保护肠道上皮细胞免受致病菌的侵扰外,还能为肠道共生菌提供黏附位点和营养来源[37],我们推测HM0539不仅可以预防病原菌,还可以调节肠道菌群稳态。因此,HM0539对机体不会产生潜在的负面影响,安全性更具有优势,具有更广的益生功能,为预防EHEC感染提供了新的方向。
综上所述,HM0539可作为防治EHEC感染的候选后生元制剂,开发HM0539作为防治EHEC的后生元制剂在公共卫生领域的推广及临床的应用具有重要的意义。
| [1] |
Pennington H. Escherichia coli O157[J]. Lancet, 2010, 376(9750): 1428-35. DOI:10.1016/S0140-6736(10)60963-4 |
| [2] |
Mead PS, Griffin PM. Escherichia coli O157:H7[J]. Lancet, 1998, 352(9135): 1207-12. DOI:10.1016/S0140-6736(98)01267-7 |
| [3] |
Friesema I, Sigmundsdottir G, van Zwaluw K, et al. An international outbreak of Shiga toxin-producing escherichia coli O157 infection due to lettuce, September-October 2007[J]. Euro Surveill, 2008, 13(50): 1103-14. |
| [4] |
Cooper KK, Mandrell RE, Louie JW, et al. Comparative genomics of enterohemorrhagic Escherichia coli O145:H28 demonstrates a common evolutionary lineage with Escherichia coli O157:H7[J]. BMC Genomics, 2014, 15(2): 17-28. |
| [5] |
Terajima J, Izumiya H, Wada A, et al. Shiga toxin-producing Escherichia coli O157:H7 in Japan[J]. Emerg Infect Dis, 1999, 5(2): 301-2. DOI:10.3201/eid0502.990222 |
| [6] |
Cha PI, Gurland B, Forrester JD. First reported case of intussusception caused by escherichia coli O157:H7 in an adult: literature review and case report[J]. Surg Infect (Larchmt), 2019, 20(1): 95-9. DOI:10.1089/sur.2018.137 |
| [7] |
Wong CS, Mooney JC, Brandt JR, et al. Risk factors for the hemolytic uremic syndrome in children infected with Escherichia coli O157:H7: a multivariable analysis[J]. Clin Infect Dis, 2012, 55(1): 33-41. |
| [8] |
Proulx F, Turgeon JP, Delage G, et al. Randomized, controlled trial of antibiotic therapy for Escherichia coli O157:H7 enteritis[J]. J Pediatr, 1992, 121(2): 299-303. DOI:10.1016/S0022-3476(05)81209-0 |
| [9] |
Wang B, Huang Q, Zhang W, et al. Lactobacillus plantarum prevents bacterial translocation in rats following ischemia and reperfusion injury[J]. Dig Dis Sci, 2011, 56(11): 3187-94. DOI:10.1007/s10620-011-1747-2 |
| [10] |
Lin PW, Myers LE, Ray L, et al. Lactobacillus rhamnosus blocks inflammatory signaling in vivo via reactive Oxygen species generation[J]. Free Radic Biol Med, 2009, 47(8): 1205-11. DOI:10.1016/j.freeradbiomed.2009.07.033 |
| [11] |
Wang Y, Liu Y, Sidhu A, et al. Lactobacillus rhamnosus GG culture supernatant ameliorates acute alcohol-induced intestinal permeability and liver injury[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(1): G32-41. DOI:10.1152/ajpgi.00024.2012 |
| [12] |
Wang Y, Kirpich I, Liu Y, et al. Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury[J]. Am J Pathol, 2011, 179(6): 2866-75. DOI:10.1016/j.ajpath.2011.08.039 |
| [13] |
Patel RM, Myers LS, Kurundkar AR, et al. Probiotic bacteria induce maturation of intestinal claudin 3 expression and barrier function[J]. Am J Pathol, 2012, 180(2): 626-35. DOI:10.1016/j.ajpath.2011.10.025 |
| [14] |
Lin PW, Nasr TR, Berardinelli AJ, et al. The probiotic lactobacillus GG may augment intestinal host defense by regulating apoptosis and promoting cytoprotective responses in the developing murine gut[J]. Pediatr Res, 2008, 64(5): 511-6. DOI:10.1203/PDR.0b013e3181827c0f |
| [15] |
Zeng Q, He X, Puthiyakunnon S, et al. Probiotic mixture golden bifido prevents neonatal escherichia coli K1 translocation via enhancing intestinal defense[J]. Front Microbiol, 2017, 8(21): 1798-802. |
| [16] |
杜艳丽, 韩宗利, 王湘雨, 等. 大肠杆菌O157:H7体内多聚磷酸盐的DAPI荧光定量检测[J]. 南方医科大学学报, 2019, 39(3): 344-50. |
| [17] |
Venugopalan V, Shriner KA, Wong-Beringer A. Regulatory oversight and safety of probiotic use[J]. Emerg Infect Dis, 2010, 16(11): 1661-5. DOI:10.3201/eid1611.100574 |
| [18] |
Seale JV, Millar M. Probiotics: a new frontier for infection control[J]. J Hosp Infect, 2013, 84(1): 1-4. DOI:10.1016/j.jhin.2013.01.005 |
| [19] |
Rao SC, Rehman A, Yu S, et al. Brain fogginess, gas and bloating: a link between SIBO, probiotics and metabolic acidosis[J]. Clin Transl Gastroenterol, 2018, 9(6): 162-73. DOI:10.1038/s41424-018-0030-7 |
| [20] |
He XL, Zeng Q, Puthiyakunnon S, et al. Lactobacillus rhamnosus GG supernatant enhance neonatal resistance to systemic Escherichia coli K1 infection by accelerating development of intestinal defense[J]. Sci Rep, 2017, 52(7): 43305-16. |
| [21] |
Gao J, Li YB, Wan Y, et al. A novel postbiotic from lactobacillus rhamnosus GG with a beneficial effect on intestinal barrier function[J]. Front Microbiol, 2019, 10(5): 477-89. |
| [22] |
曾庆, 何肖龙, 肖汉森, 等. 鼠李糖乳杆菌培养上清液通过抑制NF-κB通路预防大肠杆菌性脑膜炎[J]. 南方医科大学学报, 2017, 37(1): 24-9. |
| [23] |
Lebeer S, Bron PA, Marco ML, et al. Identification of probiotic effector molecules: present state and future perspectives[J]. Curr Opin Biotechnol, 2018, 49(3): 217-23. |
| [24] |
Wang J, Lu J, Xie X, et al. Blend of organic acids and medium chain fatty acids prevents the inflammatory response and intestinal barrier dysfunction in mice challenged with enterohemorrhagic Escherichia coli O157:H7[J]. Int Immunopharmacol, 2018, 58(2): 64-71. |
| [25] |
Yi H, Hu W, Chen S, et al. Cathelicidin-WA improves intestinal epithelial barrier function and enhances host defense against enterohemorrhagic escherichia coli O157:H7 infection[J]. J Immunol, 2017, 198(4): 1696-705. DOI:10.4049/jimmunol.1601221 |
| [26] |
Johansson M, Han GC. Keeping bacteria at a distance[J]. Science, 2011, 334(2): 182-5. |
| [27] |
惠长野, 刘晓露, 郭妍, 等. 新生儿脑膜炎大肠埃希菌ompT敲除株毒力分析[J]. 中华微生物学和免疫学杂志, 2013, 33(8): 574-7. DOI:10.3760/cma.j.issn.0254-5101.2013.08.003 |
| [28] |
邱嘉文, 何肖龙, 张宝, 等. Muc2基因沉默可降低益生菌抑制大肠杆菌黏附和侵袭的能力[J]. 南方医科大学学报, 2016, 36(6): 819-23. |
| [29] |
Yu JY, He XL, Puthiyakunnon S, et al. Mucin2 is required for probiotic agents-mediated blocking effects on meningitic E. coli- induced pathogenicities[J]. J Microbiol Biotechnol, 2015, 25(10): 1751-60. DOI:10.4014/jmb.1502.02010 |
| [30] |
Atuma CS, Holm L. The adherent gastrointestinal mucusgel layer: thickness and physical state in vivo[J]. Am J Physiol Gastrointest, 2011, 280(8): 922-9. |
| [31] |
Roxas JL, Hecht G. Enterohemorrhagic E.coli alters murine intestinal epithelial tight junction protein expression and barrier function in a Shiga toxin independent manner[J]. Lab Invest, 2010, 90(10): 1152-68. |
| [32] |
Saeedi P, Yazdanparast M, Behzadi E, et al. A review on strategies for decreasing E. coli O157:H7 risk in animals[[J]. Microb Pathog, 2017, 103(2): 186-95. |
| [33] |
Sabouri S, Sepehrizadeh Z, Amirpour RS, et al. A minireview on the in vitro and in vivo experiments with anti-Escherichia coli O157:H7 phages as potential biocontrol and phage therapy agents[J]. Int J Food Microbiol, 2017, 243(1): 52-7. |
| [34] |
Ramirez K, Cazarez-Montoya C, Lopez HS, et al. Bacteriophage cocktail for biocontrol of Escherichia coli O157:H7: stability and potential allergenicity study[J]. PLoS One, 2018, 13(5): e0195023-34. DOI:10.1371/journal.pone.0195023 |
| [35] |
Haiwen Z, Rui H, Bingxi Z, et al. Cathelicidin- derived PR39 protects enterohemorrhagic Escherichia coli O157:H7 challenged mice by improving epithelial function and balancing the microbiota in the intestine[J]. Sci Rep, 2019, 9(1): 9456-67. DOI:10.1038/s41598-019-45913-6 |
| [36] |
Cruz J, Rondon-Villarreal P, Torres RG, et al. Design of bactericidal peptides against escherichia coli O157:H7, pseudomonas aeruginosa and methicillin-resistant staphylococcus aureus[J]. Med Chem, 2018, 14(7): 741-52. DOI:10.2174/1573406414666180508120024 |
| [37] |
Kakoullis L, Papachristodoulou E, Chra P, et al. Shiga toxin-induced haemolytic uraemic syndrome and the role of antibiotics: a global overview[J]. J Infect, 2019, 79(2): 75-94. DOI:10.1016/j.jinf.2019.05.018 |
| [38] |
Tarr GAM, Oltean HN, Phipps AI, et al. Strength of the association between antibiotic use and hemolytic uremic syndrome following Escherichia coli O157:H7 infection varies with case definition[J]. Int J Med Microbiol, 2018, 308(7): 921-6. DOI:10.1016/j.ijmm.2018.06.009 |
| [39] |
Pelaseyed T, Bergström JH, Gustafsson JK, et al. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system[J]. Immunol Rev, 2014, 260(1): 8-20. DOI:10.1111/imr.12182 |
 2020, Vol. 40
2020, Vol. 40

