2. 广东省职业病防治医院,广东 广州 510399;
3. 赤水芝绿金 钗石斛生态园开发有限公司,贵州 赤水 564700
2. Guangdong Provincial Hospital for Occupational Disease Prevention and Treatment, Guangzhou 510399, China;
3. Chishui Zhilü Jinchai Shihu Ecological Park Development Co. Ltd., Chishui 564700, China
红花为菊科植物红花(Carthamus tinctorius L.)的干燥花,当花冠由黄变红时择晴天早晨露水未干时采摘,晾干或晒干。其性温、味辛,具有活血化瘀之功效。临床主要用于月经不调、静脉曲张等疾病的治疗[1-2]。近来市场上发现有掺假现象,利用胭脂红等色素掺到红花中改变色泽,增加重量等[2-4]。其中胭脂红是一种合成偶氮染料,具有成本低和着色效果好的优点,因此被广泛应用于食品,药品等领域[5-7]。但现有研究表明,大量或长期摄入能够产生芳香胺的胭脂红可能对人类健康造成损害,例如近年来报导中指出的胭脂红可致DNA和RNA的突变[8]。如今,已有多种分析方法对胭脂红在食品和其他领域的滥用进行检测分析,如拉曼光谱法[9],电化学传感器[10],CPE-分光光度法[11]等,但这些检测方法成本昂贵,样品预处理繁琐,需要配备专业技术人员和专业设备等缺点使得应用难以普及,甚至还有在过程中造成分析成分受损等[12]。其中红花等中药材中的胭脂红检测手段主要为HPLC法和薄层色谱法,其检测限较高,灵敏度较低[4]。因此本研究研发了一种简便、灵敏、特异性强的富集和检测红花样品中胭脂红的方法。
1 材料和方法 1.1 试剂耗材胭脂红,4-乙烯基吡啶(4-VP),乙二醇二甲基丙烯酸酯(EGDMA),偶氮二异丁腈(AIBN),偶氮二异丁腈(AIBN),甲醇(色谱纯),均购买于上海阿拉丁生化科技有限公司;甲苯,乙酸铵,氨水溶液,甲酸,甲醇(分析纯),均购买于广州化学试剂厂;红花样品购于常州仁寿天医药连锁有限公司;玻璃毛细管(10 cm,500 μm,i.d)购买于上海申立玻璃仪器有限公司。
1.2 仪器设备HPLC色谱仪(1260 Infinity II LC系统),微量注射泵(LSP10-1B型),透射电子显微镜(i H-800),动态光散射仪(Zetasizer Nano ZS90),X射线衍射仪D/max-2200/,扫描电子显微镜(S- 3700N),红外光谱仪(Nicolet MagNa-IR 550),恒温水浴锅(LKTC-B1-T)
1.3 金属有机框架(UiO-66-NH2)的合成根据文献[13]中的合成方法,对合成条件进行了调整优化。优化后的方法如下:将0.3 mmoL的2-氨基对苯二甲酸溶解在4 mL DMF和20 μL三乙胺混合溶液中,再将0.3 mmoL ZrCl4溶于另外4 mL DMF中,最后将两者溶液混合。加0.9 mL乙酸至上述混合溶液中,在85 ℃烘箱中诱导反应24 h。粗反应产物用DMF洗涤3次后在二氯甲烷中浸泡5 d。最后,将产物在60 ℃下真空干燥。
1.4 UiO-66-NH2分子印迹毛细管整体柱的制备UiO-66-NH2分子印迹(UiO-66-NH2@MIPs)毛细管整体柱的制备过程如下:将0.007 g UiO-66-NH2载体、0.040 g模板分子胭脂红和0.040 mL功能单体4-VP分散在3 mL的甲醇、甲苯和正十二醇混合溶液中。将上述溶液超声处理15 min后,加入0.4 mL交联剂EGDMA和0.015 g引发剂AIBN,超声至完全分散后将混合溶液用高纯度N2吹溶液15 min以除去混合溶液中的氧气。然后将混合溶液虹吸到玻璃毛细管柱(10 cm×500 μm,i.d)中并用热熔胶密封闭末端。将密封的玻璃毛细管柱放入60 ℃水浴反应4 h。聚合完成后用微量注射泵进行洗脱,甲醇-氨水(9:1,V/V)作为洗脱剂,洗净至检测不到胭脂红。
为了比较和验证印迹效应,另合成UiO-66-NH2非印迹(UiO-66-NH2@NIPs)毛细管整体柱、不掺杂载体的分子印迹(MIPs)毛细管整体柱和不掺杂载体的非印迹(NIPs)毛细管整体柱。这些柱子的合成步骤参照UiO-66-NH2分子印迹毛细管整体柱的合成,不同点是UiO-66-NH2@NIPs毛细管整体柱合成中不添加模板分子胭脂红,MIPs毛细管整体柱合成过程中不添加载体UiO-66-NH2,NIPs毛细管整体柱合成中不添加UiO-66-NH2和胭脂红。
1.5 HPLC条件HPLC-UV分析以C18柱(4.6 mm×250 mm,5 μm)作为分离柱进行色谱分析。HPLC条件:流动相为甲醇-0.02 mol/L乙酸铵溶液(25:75,V/V),进样体积为20 μL,流速为1.0 mL/min,检测波长和参比波长分别设定为250 nm和620 nm。
1.6 制备标准溶液和样品溶液首先,制备50 μg/mL的胭脂红母液,制备过程:称取10 mg胭脂红标准品,蒸馏水定容至200 mL。用一定量蒸馏水稀释储备溶液,现配一系列浓度梯度的标准溶液(0.1、0.3、0.5、0.7、1.0、3.0、5.0、7.0、10.0 μg/mL)。
为研究该方法的可行性,进行了加标回收率测定。称取2.0 g红花在5.0 mL蒸馏水中超声提取30 min后12 000 r/min转速离心10 min,上述过程重复2次以实现高提取率。两次提取液合并后0.45 μm微孔滤膜过滤,蒸馏水稀释至10.0 mL。在5.0 mL红花提取溶液中添加胭脂红标准溶液,配制浓度为0.1、1.0和10.0 μg/mL的加标样品溶液进行加标回收率测定。
1.7 整体柱的动态吸附实验为评价UiO-66-NH2@MIPs整体柱的选择性和比较不同整体柱(UiO-66-NH2@MIPs,UiO-66-NH2@NIPs,MIPs,NIPs)的吸附性能,分别选择长度均为8.0 cm的上述4种不同整体柱进行漏点曲线的测定。其中,整体柱的平均质量(n=3)分别为:UiO-66-NH2-MIPs柱10.86 mg,UiO-66-NH2-NIPs柱12.61 mg,MIPs柱8.43 mg,NIPs柱10.58 mg。动态吸附过程如下:将10 μg/mL的胭脂红标准溶液通过自动微量注射泵以8 μL/min的流速缓慢注入至上述整体柱中,然后以每40 μL漏出液为一个节点,接15个点,将溶剂挥干后用蒸馏水稀释至2 mL,通过HPLC-UV检测,最后以上样体积为横坐标,样品含量(胭脂红的泄漏量)为纵坐标绘制了UiO-66-NH2@MIPs,UiO-66-NH2@NIPs,MIPs和NIPs四类整体柱的漏点曲线。
1.8 方法学验证和红花实际样品分析在最优条件下,根据特异性,线性,范围,检测限(LOD),准确度和精密度等指标评价所研究的UiO-66- NH2@MIPs-HPLC法。为了评估UiO-66-NH2@MIPsHPLC法的稳定性,重复实验6次。最后,通过该方法去分析加标样品的目标物含量。
红花样品分析实验过程如下:首先,用100 μL蒸馏水和100 μL甲醇活化整体柱,将制备的0.1 µg/mL加标样品溶液通过活化后的分子印迹毛细管整体柱。上样完成后用40 μL甲苯以相同的流速洗涤1次。然后用50 μL甲醇-氨水以10 μL/min的流速洗脱样品。最后,收集洗脱液,氮吹仪吹干,将残余物用0.4 mL的蒸馏水溶解,用于下一步的定量分析。
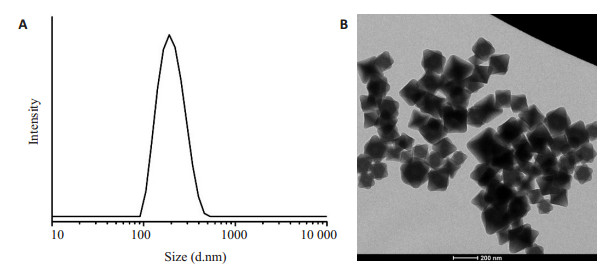
2 结果 2.1 UiO-66-NH2的动态光散射(DLS)和透射电镜(TEM)分析图 1A和图 1B分别展示了UiO-66-NH2的粒径大小和形态,从图 1A的DLS可知UiO-66-NH2的平均粒径约为200 nm,图 1B的TEM显示UiO-66-NH2的粒径约为200 nm,这与DLS数据相一致,而且形态规则,分散性好。
|
图 1 UiO-66-NH2的动态光散射和透射电镜图 Fig.1 Images of DLS and TEM. A: UiO-66-NH2, average particle size was approximately 200 nm; B: UiO-66-NH2, average particle size was approximately 200 nm. |
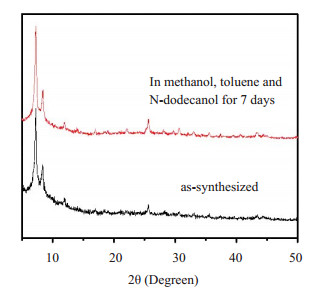
为证明UiO-66-NH2在混合致孔剂中的结构稳定性,进行了PXRD实验。图 2是未处理的UiO-66-NH2粉末PXRD图和浸泡在混合致孔剂中7 d后的UiO-66-NH2粉末PXRD图。通过图 2可以看出UiO-66-NH2在浸泡混合致孔剂7 d后与未处理的UiO-66-NH2的峰几乎一致。显示已知的混合致孔剂对UiO-66-NH2的结构变化没有显著影响。
|
图 2 UiO-66-NH2的粉末X射线衍射图 Fig.2 PXRD patterns for UiO-66-NH2: the original and those immersed in methanol, toluene and N-dodecanal for 7 days. |
UiO-66-NH2@MIPs毛细管整体柱的制备步骤中的主要因素包括两个方面:适合的用于分散模板和功能单体的致孔剂(能够减少聚合过程中印迹分子与功能单体之间的干扰[14]);模板分子,功能单体和交联剂(T:M: C)的摩尔比。所以,在制备整体柱前探究了致孔剂的种类、UiO-66-NH2添加量和T:M:C的比例等合成条件。
在我们的研究中,研究了乙腈-甲苯,甲醇-正十二醇,乙腈-甲苯-正十二醇,甲醇-乙腈-正十二醇和甲醇-甲苯-正十二醇,以选择最合适的致孔剂。当甲醇-甲苯-正十二醇作为致孔剂时可以达到适当的流速,对毛细管整体柱的柱压影响小,可以增加整体柱的使用寿命。根据结果,需要将致孔剂中甲苯的比例控制在30%~35%,以保持整体柱中的孔径和空隙结构合适。
为了得到合适的UiO-66-NH2添加量和T:M:C的摩尔比例,我们研究了一系列比例(表 1和表 2),以回收率作为评估指标,实验过程与3.6中的步骤相同,其中回收率计算是上样后吸附在UiO-66-NH2@MIPs毛细管整体柱中的胭脂红的含量与总上样量的比值。表 1说明当UiO-66-NH2的添加量为5 mg时,整体柱的回收率为94.2%,表明此MOF添加量下,整体柱的吸附性能最佳。表 2显示当T:M:C为1:6:30时,回收率为95.64%,此时整体柱表现出最佳的特异性和吸附亲和力。
| 表 1 不同UiO-66-NH2添加量下分子印迹整体柱的峰面积和回收率 Tab.1 Peak areas and the recovery with different amounts of UiO-66-NH2 in the columns |
| 表 2 不同摩尔比例下分子印迹整体柱的回收率 Tab.2 Different molar ratios of T:M:C of UiO-66-NH2@MIPs and the recovery of the columns |
图 3A和B是UiO-66-NH2@MIPs整体柱的扫描电子显微镜(SEM)图。图 3A和B分别是用于分析样品前和重复使用数百次后的UiO-66-NH2@MIPs整体柱之间表面形态分布的差异。图 3C和E分别是图 3A放大5K,20K倍后的横截面图,图 3D和F分别是图 5B放大5K,20K倍后的横截面图。通过图 3可以观察到UiO-66-NH2@MIPs毛细管整体柱在结构中具有许多孔穴,表面疏松,这与分子印迹作用印迹洗脱后的空腔有关。而且经过比较,可以看出经过数百次重复使用后,整体柱的表面结构和空穴结构相对来说没有较大的改变,表明UiO-66-NH2@MIP整体柱框架结构具有良好的稳定性,并且可以重复使用。

|
图 3 整体柱的横截面扫描电镜图 Fig.3 SEM images of the UiO-66-NH2@MIPs column. A: Before elution; B: After hundreds of elution; C: The magnification is 5k-fold that of A; D: The magnification is 20k-fold that of A; E: The magnification is 5k-fold that of B; F: The magnification is 20k-fold that of B. |
|
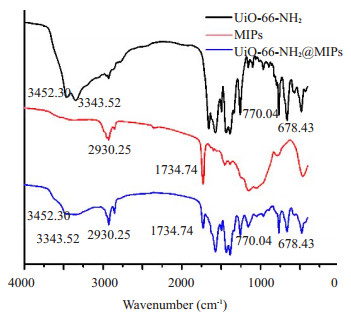
图 4 UiO-66-NH2, MIPs and UiO-66-NH2@MIPs的红外光谱图 Fig.4 IR spectra of UiO-66-NH2, MIPs and UiO-66-NH2@MIPs. |
|
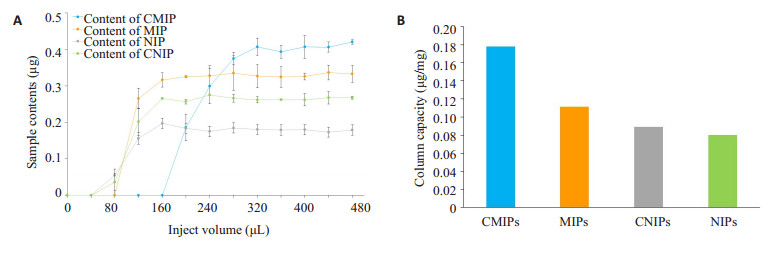
图 5 A为漏点曲线图,B为不同整体柱的柱容量对比图 Fig.5 A: Breakthrough curves of Ponceau 4R on UiO-66-NH2@MIPs, MIPs, UiO-66-NH2@NIPs and NIPs columns. Loading concentration: 10.0 μg/mL; sample flow rate: 8 μL/min; B: Column capacities of UiO-66-NH2@MIPs, MIPs, UiO-66-NH2@NIPs and NIPs monolithic columns. |
UiO-66-NH2,UiO-66-NH2@MIPs和MIPs的红外光谱揭示了化学基团峰和主要的化学结构(如图 4所示)。UiO-66-NH2的红外光谱在3452.30 cm-1和3343.52 cm-1处呈现出稍微凸起的特征峰,可分别归因于as(NH2)和s(NH2)。MIPs的红外光谱在2930.25 cm- 1处有强烈的峰,这可归因于甲基(C-H伸缩振动),1730 cm-1处的峰带表示C=O振动模式。UiO-66-NH2与MIP的红外光谱相比较,UiO-66-NH2@MIPs呈现出UiO-66-NH2和MIPs所共有的特征峰,它表明UiO-66-NH2已成功与MIPs结合,进一步证实成功制备了UiO-66-NH2@MIPs聚合物。
2.4 UiO-66-NH2@MIPs毛细管整体柱的性能为了对比不同毛细管整体柱之间的富集能力,测定了漏点曲线和计算了柱容量。可以看出胭脂红一开始在整体柱内完全吸附,然后整体柱的吸附容量会缓慢达到饱和,过量的胭脂红溶液继续通过色谱柱,漏出液的目标物含量不再变化,此时柱子吸附完全饱和,所制得曲线符合S模型(图 5A)。UiO-66-NH2@MIPs,MIPs,UiO-66-NH2@NIPs和NIPs整体柱的柱容量分别计算得到为0.178、0.111、0.089、0.080 μg/mg。对比结果表明,UiO-66-NH2@MIPs整体柱展现出最优的动态吸附,其对胭脂红的动态吸附效果也明显优于其他组,UIO-66-NH2与MIPs的结合可以提高柱容量(图 5B)。
2.5 洗脱液和洗脱体积的优化优化洗脱液的目的是确保吸附的胭脂红完全得到解吸,并达到使用最少量洗脱液可以最优洗脱目标分析物效果。所以,最佳洗脱液的选择在洗脱能力,灵敏度和精密度等方面都起着至关重要的作用。在优化过程中,分别使用50 μL或100 μL的甲醇、甲醇-氨水溶液(9:1,v/v)和甲醇-氨水溶液(8:2,v/v)的洗脱液。结果如表 3所示,使用100 μL甲醇-氨水溶液(9:1,v/v)进行洗脱时,胭脂红的回收率达91.7%,相比其它洗脱液该比例洗脱效果是最好的。
| 表 3 洗脱剂种类及比例选择 Tab.3 Comparisons of different eluents |
在优化条件下进行方法验证,线性,检测限(LOD),再现性和回收率都如表 4所示。该方法回归方程为y= 39.017x-1.592(R2=0.9999),在0.1~10.0 μg/mL保持良好线性。通过检测不同浓度(0.1,1,10 μg/mL)的加标红花样品溶液,检验了该方法的加标回收率和精密度,结果表明该方法的回收率在82.60%~105.56%,日内相对标准偏差(RSD)值介于2.4%~3.4%,日间RSD值介于2.5%~3.3%。因此,表明该方法在低浓度和高浓度下都具有良好的精确度,LOD(S/N=3)为2.7×10-4 μg/mL,将UiO-66-NH2@MIPs整体柱-HPLC法与传统液相检测方法比较(检测限为0.4 μg/mL)[9],这种方法更为灵敏。
| 表 4 样品加标回收率检测 Tab.4 Recoveries of Ponceau 4R spiked in samples |
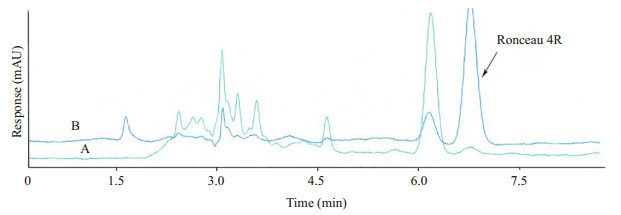
本实验用于检测实际样品中的胭脂红和评价UiO-66-NH2@MIPs-HPLC的富集和除杂效果。对比研究了0.1 μg/mL加标红花溶液通过自制整体柱富集后和直接HPLC检测的峰面积差异,结果如图 6所示。图 6A是0.1 μg/mL加标红花溶液样品直接用于液相检测的HPLC色谱图,可以看出其样品基质背景非常复杂,目标峰的响应值很低。图 6B是相同溶液通过UiO-66-NH2@MIPs柱富集后的色谱图,图中胭脂红的峰响应值明显增高,而其他无关化合物的峰值降低甚至消失,计算可得该方法对比直接通过HPLC法检测,富集倍数高达73倍。
|
图 6 样品溶液中胭脂红的富集和除杂HPLC图 Fig.6 Liquid chromatograms for sample enrichment and impurity removal. A: 0.1 μg/mL Ponceau 4R sample before being loaded onto the column; B: 0.1 μg/mL Ponceau 4R sample after being loaded onto the UiO-66-NH2@MIPs column. |
近年来,由于红花的用途广泛,货源紧张,市面上红花价格也不断上涨,所以出现胭脂红对红花进行染色以次充好的现象,而红花伪品的大小颜色与正品相似,很难分辨。伪品不仅影响红花的质量和疗效,还会给用药带来极大的安全隐患[2-4]。国家食品药品监督管理局禁止使用胭脂红给红花染色,并建议采用薄层色谱法及HPLC色谱法检测红花样品中的胭脂红[15]。但是,上述两种方法的检测限较高和灵敏度比较低,尤其在中药成分复杂的情况下,检测条件的优化非常的繁琐和耗时。近红外光谱作为近年来在中药鉴定方面迅速应用的光谱分析技术,虽然可以定量,但是需要具有非常强的专业分析能力和掌握专业数据软件处理能力的技术人员,因此应用范围相对狭小,而且成本较高[4]。所以现亟需开发一种能够克服这些缺点的方法去检测红花伪品中的胭脂红。在本次研究中,我们将分子印迹技术联合HPLC,成功研发一种灵敏度高、专一性强、价格低廉、操作简单的新方法,能够高效富集和灵敏检测红花样品中的胭脂红。
在本研究中,载体材料的选择和分子印迹整体柱的制备都是非常关键的。
首先什么是分子印迹?分子印迹聚合物(MIPs)是一种具有三维空穴结构的材料,其独特之处就在于尺寸、形状和化学功能都与模板分子(即目标分子)相匹配,合适的洗脱剂洗掉模板分子后,目标分子的空腔便保留在整体柱中[16-17],形成具有特异性的目标孔穴,从而展现强专一性和特异性,因此分子印迹已被应用于食品、药品、农药残留物检测[18-19]。本研究制备的分子印迹整体柱是分子印迹技术中常用的一种样品富集方法,常用于选择性提取和分析色素、食品和药品等[20-21]。本研究通过对整体柱合成的影响因素,如功能单体的类型和添加量,T:M:C的摩尔比,致孔剂的类型和比例的研究,确定当功能单体为4-VP,T:M:C为1:6:30,致孔剂为甲醇-甲苯-正十二醇(0.5:1.0:1.5)时,制备的整体柱具有高回收率和框架结构稳定性。
随着对大比表面积的载体材料的不断研究,大量研究表明分子印迹中加入新型载体可以增加整体柱的比表面积和结合位点,从而获得优异的特异性、选择性和吸附性,常用的载体如Fe3O4纳米粒子[22],二氧化硅和银纳米粒子[23],CdTe量子点[24],聚苯乙烯胶体粒子[25],多壁碳纳米管[26],石墨烯[27]等。然而,这些载体材料具有刚性差和空间结构无序等缺点。所以,我们把具有比表面积大,刚性强,化学惰性,低毒性,易功能化,热稳定性,空间结构整齐和高孔隙率等优点的金属有机框架(MOFs)选择作为本次研究的载体材料。MOFs由金属离子与有机物连接的簇组成配位体,近年来已被应用于许多领域[28],如催化反应[29],分子印迹技术[30-31],电化学传感[32],吸附和分离[33]等。UiO-66作为MOFs里面最经典,结构最稳定的种类之一,我们对其功能化基团改进,合成带-NH2的UiO-66-NH2,在本研究前还未发现将其应用于分子印迹方面的相关研究。通过DLS和TEM结果可知,本次研究合成的UiO-66-NH2具有合适的粒径,规则的形态和良好的分散性,能够应用于作为分子印迹的载体材料。通过红外色谱图和漏点曲线与柱容量图能清晰反映UiO-66-NH2在本研究中被成功应用于分子印迹。
另外,除了探究材料和整体柱合成的最佳条件,我们还进行不同整体柱之间的对比,探索分子印迹和负载UiO-66-NH2的分子印迹与非分子印迹之间的吸附性能差异。结果表明,负载UiO-66-NH2的分子印迹整体柱柱容量是最高的,其次是分子印迹整体柱,柱容量最低的为非分子印迹整体柱。进一步证实载体材料的加入,一方面能够增加比表面积和孔隙率提高负载量,另一方面载体材料的刚性结构使得整个分子印迹整体柱结构稳定性增加,扫描电镜整体图可以直接验证其可以被重复利用。
在本次研究中,我们成功地制备了UiO-66-NH2@MIPs整体柱,并将其应用于实际红花样品中的胭脂红检测。通过液相图发现,同样浓度的样品溶液经过HPLC色谱直接检测和通过本研究自制的UiO-66-NH2@MIPs-HPLC法进行检测,本研究方法具有显著的检测和富集效果(其检测限可达2.7×10-4 μg/mL,方法的富集倍数为73倍)。说明即使被测物质在液相检测限无法检测出情况下,通过本方法富集后仍然可被灵敏检出。通过对线性,检测限(LOD),再现性和回收率等研究,结果都表明该方法是一种可靠且有潜力的方法。
因此,基于对该研究的结果分析,本研究自制的UiO-66-NH2@MIPs毛细管整体柱联合HPLC可以作为红花样品中胭脂红的吸附、富集、除杂和检测方法。此外可扩展在食品和医药物领域中, 例如应用于尿液、血液等内含的某特定目标物质的富集和微量检测。
| [1] |
国家药典委员会.中华人民共和国药典第一部[S].北京: 中国医药科技出版社, 2015: 151.
|
| [2] |
郭钦安, 李守俊. 红花伪品及其染色物的检测探讨[J]. 中国民族民间医药, 2019, 28(13): 57-60. |
| [3] |
肖凌, 侯俊杰, 徐箐, 等. 红花中一种新掺伪染料的确认及6种染色成分检测方法研究[J]. 药物分析杂志, 2014, 34(7): 1231-6. |
| [4] |
刘攀颜, 陈碧清, 袁珊珊, 等. 近红外光谱法测定染色红花中常见染料的含量[J]. 中国中药杂志, 2019, 44(08): 1537-44. |
| [5] |
Tanaka T. Reproductive and neurobehavioural toxicity study of Ponceau 4R administered to mice in the diet[J]. Food Chem Toxicol, 2006, 44(10): 1651-8. DOI:10.1016/j.fct.2006.05.001 |
| [6] |
Wang ML, Gao YQ, Sun Q, et al. Ultrasensitive and simultaneous determination of the isomers of Amaranth and Ponceau 4R in foods based on new carbon nanotube/polypyrrole composites[J]. Food Chem, 2015, 172: 873-9. DOI:10.1016/j.foodchem.2014.09.157 |
| [7] |
Yilmaz UT, Ergun F, Yilmaz H. Determination of the food dye carmine in milk and candy products by differential pulse polarography[J]. J Food Drug Anal, 2014, 22(3): 329-35. DOI:10.1016/j.jfda.2013.12.002 |
| [8] |
Zhao XY, Ding JH, Bai WL, et al. PEDOT: PSS/AuNPs/CA modified screen-printed carbon based disposable electrochemical sensor for sensitive and selective determination of carmine[J]. J Electroanal Chem, 2018, 824: 14-21. DOI:10.1016/j.jelechem.2018.07.030 |
| [9] |
Wu YX, Liang P, Dong QM, et al. Design of a silver nanoparticle for sensitive surface enhanced Raman spectroscopy detection of carmine dye[J]. Food Chem, 2017, 237: 974-80. DOI:10.1016/j.foodchem.2017.06.057 |
| [10] |
Ma X, Xie Y, Yu YH, et al. Three-dimensional β-cyclodextrin functionalized graphene aerogels: An enhanced electrochemical sensing platform for quantification of Ponceau 4R[J]. J Electroanal Chem, 2018, 823: 437-44. DOI:10.1016/j.jelechem.2018.06.043 |
| [11] |
Heydari R, Hosseini M, Zarabi S. A simple method for determination of carmine in food samples based on cloud point extraction and spectrophotometric detection[J]. Spectrochim Acta A, 2015, 150: 786-91. DOI:10.1016/j.saa.2015.06.032 |
| [12] |
Qader B, Baron M, Hussain I, et al. Electrochemical determination of disulfoton using a molecularly imprinted poly-phenol polymer[J]. Electrochim Acta, 2019, 295: 333-9. DOI:10.1016/j.electacta.2018.10.127 |
| [13] |
Lee YJ, Chang YJ, Lee DJ, et al. Effective adsorption of phosphoric acid by UiO-66 and UiO-66-NH2 from extremely acidic mixed waste acids: Proof of concept[J]. J Taiwan Inst Chem E, 2019, 96: 483-6. DOI:10.1016/j.jtice.2018.12.018 |
| [14] |
Zhai HY, Su ZH, Chen ZG, et al. Molecularly imprinted coated graphene oxide solid-phase extraction monolithic capillary column for selective extraction and sensitive determination of phloxine B in coffee bean[J]. Anal Chim Acta, 2015, 865: 16-21. DOI:10.1016/j.aca.2015.01.028 |
| [15] |
国家食品药品监督管理局.药品检验补充检验方法和检验项目批准件[EB/OL][2020-02-11]. http://www.nifdc.org.cn/CL0829.
|
| [16] |
Feng JY, Hu YX, Grant E, et al. Determination of thiabendazole in orange juice using an MISPE-SERS chemosensor[J]. Food Chem, 2018, 239: 816-22. DOI:10.1016/j.foodchem.2017.07.014 |
| [17] |
Rutkowska M, Płotka-Wasylka J, Morrison C, et al. Application of molecularly imprinted polymers in analytical chiral separations and analysis[J]. Trac-trend Anal Chem, 2018, 102: 91-102. DOI:10.1016/j.trac.2018.01.011 |
| [18] |
Ashley J, Shahbazi MA, Kant K, et al. Molecularly imprinted polymers for sample preparation and biosensing in food analysis: Progress and perspectives[J]. Biosens Bioelectron, 2017, 91: 606-15. DOI:10.1016/j.bios.2017.01.018 |
| [19] |
Luliński P. Molecularly imprinted polymers based drug delivery devices: a way to application in modern pharmacotherapy. A review[J]. Mater Sci Eng C Mater Biol Appl, 2017, 76: 1344-53. DOI:10.1016/j.msec.2017.02.138 |
| [20] |
Ji WH, Zhang MM, Wang T, et al. Molecularly imprinted solid-phase extraction method based on SH-Au modified silica gel for the detection of six Sudan dyes in chili powder samples[J]. Talanta, 2017, 165: 18-26. DOI:10.1016/j.talanta.2016.12.021 |
| [21] |
Li HY, Li NJ, Jiang J, et al. Molecularly imprinted magnetic microparticles for the simultaneous detection and extraction of Rhodamine B[J]. Sensor Actuat B-Chem, 2017, 246: 286-92. DOI:10.1016/j.snb.2017.02.055 |
| [22] |
Tang YW, Liu H, Gao JW, et al. Upconversion particle@ Fe3O4 @molecularly imprinted polymer with controllable shell thickness as high-performance fluorescent probe for sensing quinolones[J]. Talanta, 2018, 181: 95-103. DOI:10.1016/j.talanta.2018.01.006 |
| [23] |
Hu R, Tang R, Xu JY, et al. Chemical nanosensors based on molecularly-imprinted polymers doped with silver nanoparticles for the rapid detection of caffeine in wastewater[J]. Anal Chim Acta, 2018, 1034: 176-83. DOI:10.1016/j.aca.2018.06.012 |
| [24] |
Ensafi AA, Nasr-Esfahani P, Rezaei B. Simultaneous detection of folic acid and methotrexate by an optical sensor based on molecularly imprinted polymers on dual-color CdTe quantum dots[J]. Anal Chim Acta, 2017, 996: 64-73. DOI:10.1016/j.aca.2017.10.011 |
| [25] |
Hou J, Li MZ, Song YL. Recent advances in colloidal photonic crystal sensors: Materials, structures and analysis methods[J]. Nano Today, 2018, 22: 132-44. DOI:10.1016/j.nantod.2018.08.008 |
| [26] |
Yin ZZ, Cheng SW, Xu LB, et al. Highly sensitive and selective sensor for sunset yellow based on molecularly imprinted polydopamine-coated multi-walled carbon nanotubes[J]. Biosens Bioelectron, 2018, 100: 565-70. DOI:10.1016/j.bios.2017.10.010 |
| [27] |
Zeng QL, Ruan YJ, Sun SL, et al. Development of graphene oxide functionalized cotton fiber based solid phase extraction combined with liquid chromatography-fluorescence detection for determination of trace auxins in plant samples[J]. Chromatographia, 2018, 81(6): 861-9. DOI:10.1007/s10337-018-3518-0 |
| [28] |
Wang XY, Deng CH. Preparation of magnetic graphene @polydopamine @Zr-MOF material for the extraction and analysis of bisphenols in water samples[J]. Talanta, 2015, 144: 1329-35. DOI:10.1016/j.talanta.2015.08.014 |
| [29] |
Bhadra BN, Vinu A, Serre C, et al. MOF-derived carbonaceous materials enriched with nitrogen: Preparation and applications in adsorption and catalysis[J]. Mater Today, 2019, 25: 88-111. DOI:10.1016/j.mattod.2018.10.016 |
| [30] |
Bagheri N, Khataee A, Habibi B, et al. Mimetic Ag nanoparticle/Zn-based MOF nanocomposite (AgNPs@ZnMOF) capped with molecularly imprinted polymer for the selective detection of patulin[J]. Talanta, 2018, 179: 710-8. DOI:10.1016/j.talanta.2017.12.009 |
| [31] |
Rocío-Bautista P, Pacheco-Fernández I, Pasán J, et al. Are metal-organic frameworks able to provide a new generation of solid-phase microextraction coatings? -A review[J]. Anal Chim Acta, 2016, 939: 26-41. DOI:10.1016/j.aca.2016.07.047 |
| [32] |
Shrivastav V, Sundriyal S, Goel P, et al. Metal-organic frameworks (MOFs) and their composites as electrodes for lithium battery applications: Novel means for alternative energy storage[J]. Coordin Chem Rev, 2019, 393: 48-78. DOI:10.1016/j.ccr.2019.05.006 |
| [33] |
Petit C. Present and future of MOF research in the field of adsorption and molecular separation[J]. Curr Opin Chem, 2018, 20: 132-42. DOI:10.1016/j.coche.2018.04.004 |
 2020, Vol. 40
2020, Vol. 40

