系统性红斑狼疮(SLE)是一种常见的以免疫性炎症为突出表现的结缔组织疾病。近年来多研究表示SLE患者为维生素D缺乏高发人群[1],体内维生素D的低水平状态可能会加重SLE患者的免疫异常[2-3]。而单核趋化蛋白-1(MCP-1)被认为可能是反映SLE活动性的重要指标[4-5],目前已有学者就MCP-1与SLE维生素D缺乏的相关性进行探讨,发现维生素D以剂量依赖性方式抑制SLE患者外周血单个核细胞(PBMC)表达MCP-1,但持续增加维生素D的干预剂量并不能完全抑制MCP-l表达[6]。由于维生素D需与维生素D受体(VDR)结合后发挥相应的生物效应,通过我们前期试验已证实VDR在SLE的免疫系统稳态中可能也发挥重要作用[7],目前关于SLE患者PBMC的VDR的表达与MCP-1表达之间的相关性研究暂未见报道,我们将通过检测SLE患者的PBMC的VDR、MCP-1以及血清中MCP-1的表达,分析VDR与SLE疾病活动度的关系,探讨VDR与趋化因子MCP-1两者之间的关系,为临床治疗SLE提供新的方向。
1 资料和方法 1.1 研究对象选取2014~2015年我院肾脏风湿科住院SLE患者60例,其中女性53例,男性7例,年龄39.8±12.4岁。同时选取年龄、性别匹配的健康人28例标记为对照组,女性25例,男性3例,年龄39.4±7.9岁,均无免疫性疾病及其他疾病史。研究对象均签署了知情同意书,并获得了中南大学医学伦理中心批准。
1.2 诊断标准纳入标准:所有患者均符合1997年美国风湿协会(ACR)制定的SLE分类诊断标准[8]。排除标准包括:(1)有明确的其他免疫性疾病;(2)合并有急性或慢性感染疾病;(3)孕妇及哺乳期妇女;(4)乙肝表面抗原阳性患者;(5)糖尿病等慢性代谢性疾病;(6)有明确的恶性肿瘤病史。
1.3 实验分组入组的SLE患者根据SLE疾病活动指数评分(SLEDAI)[9]分为SLE活动组:SLEDAI>4分,36例;SLE非活动组:SLEDAI≤4分,24例[10];正常对照组:健康人28例。
1.4 PBMC的分离收集抗凝的外周静脉血5 mL于EDTA抗凝管,按1:1比例用PBS缓冲液稀释血液,加入5 mL淋巴细胞分离液,使二者界面清晰,然后4 ℃,2000 r/min,离心20 min,再用移液器将血浆层与分离液间的白色雾状层吸出,将其移入另一离心管中,加入10 mL的PBS混匀,在4 ℃及1500 r/min条件下离心10 min,弃上清,再重复洗涤1次。提取的外周血单个核细胞1部分用于RNA的提取,1部分用于蛋白的提取。
1.5 Real-time PCR及结果分析根据TRIzol法提取PBMC的总RNA,RNA浓度(µg/µL)=A260 nm×稀释倍数×40/1000:(1)反转录:按照Fermentas cDNA反转录试剂盒说明书进行反转录合成cDNA备用;(2)Real-time PCR:按照说明书所述的步骤配置10 μL Real-time PCR反应体系,分别为:上游引物(10 μmol/L)0.5 μL;下游引物(10 μmol/L)0.5 μL、PCR H2O 3 μL、2X SYBGREEN PCR Master Mix 5 μL;反转录产物1 μL;Real-time PCR反应参数:预变性95 ℃ 2 min,变性95 ℃ 10 s,退火58 ℃ 20 s,延伸72 ℃ 30 s,共40个循环,然后72 ℃延伸5 min[11];引物序列:在NCBI上搜索目的基因的序列,运用primer5软件设计引物(表 1)。选择β-actin作为内参,并采用计算2-△△CT值[12]方法进行表达量相对定量分析。
| 表 1 各引物序列及长度 Tab.1 Sequence and length of each primer |
SLE患者活动组、非活动组、健康对照组各组随机选15例提取PBMC总蛋白后用BCA法测定细胞蛋白浓度,取20 μg蛋白采用聚丙烯酰胺凝胶电泳分离,电泳结束后用转膜缓冲液浸泡,按照滤纸-凝胶-PVDF膜-滤纸的顺序依次叠好,用含5%脱脂奶粉的TBST溶液室温封闭1 h;将膜与一抗(1:1000稀释)密封后置摇床4 ℃过夜孵育,次日用TBST溶液洗3次膜后,15 min/次;将膜置入二抗(1:4000稀释)摇动孵育1 h,再次用TBST溶液洗膜3次,15 min/次。使用ECL化学发光试剂处理并暗室内显影后,通过quantity one专业灰度分析软件对图片条带面积和灰度值进行分析,计算VDR蛋白灰度值与内参灰度值之比,即为VDR蛋白的相对表达水平。
1.7 ELISA方法检测MCP-1血清浓度外周血MCP-1浓度的检测严格按照MCP-1检测试剂盒说明书进行。
1.8 统计学方法使用SPSS17.0统计软件进行数据资料统计分析,计量资料数据以均数±标准差表示,两组间计量资料比较采用t检验,3组间比较时采用单因素方差分析,各因素间进行相关分析采用Person相关分析,以α=0.05为检验水准,P < 0.05时差异有统计学意义。
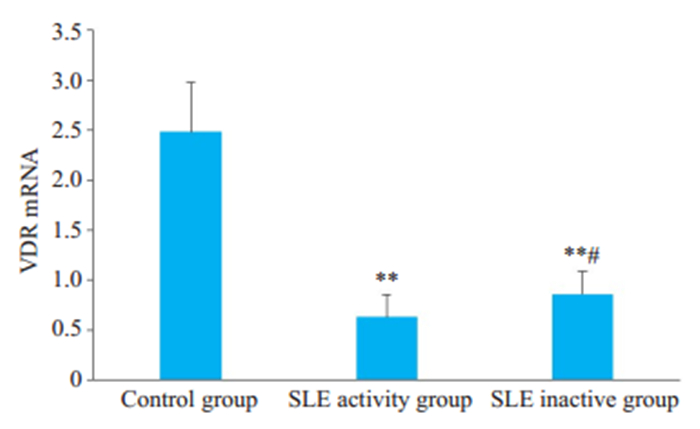
2 结果 2.1 SLE患者PBMC的VDR表达 2.1.1 SLE患者VDRmRNA的相对表达量正常对照组、SLE活动组、SLE非活动组PBMC的VDRmRNA相对表达量(图 1)。SLE活动组与SLE非活动组VDRmRNA相对表达量显著低于正常对照组(P < 0.01),与SLE非活动组相比,SLE活动组PBMC VDR mRNA的相对表达量降低,差异具有统计学意义(P < 0.05)。
|
图 1 正常对照组、SLE活动组及非活动组VDRmRNA的表达水平比较 Fig.1 VDR mRNA expression levels in control group, active SLE group and inactive SLE group (Mean ± SD). **P < 0.01 vs control group. #P < 0.05 vs SLE activity group. |
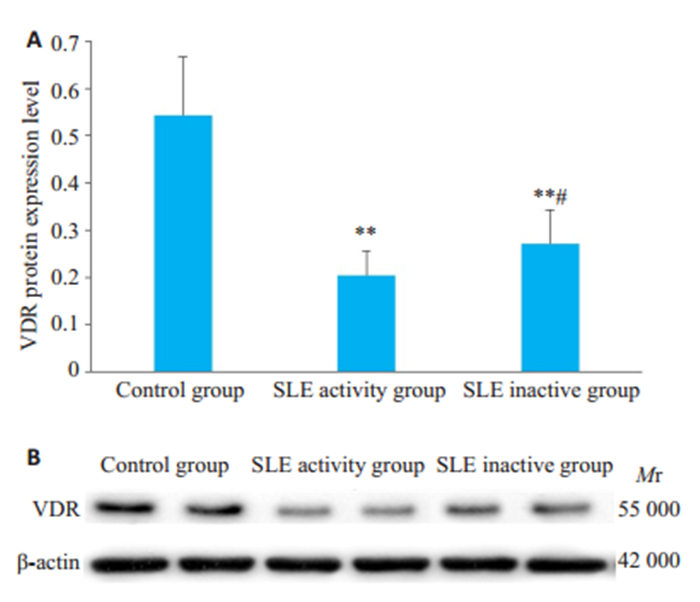
正常对照组、SLE活动组、SLE非活动组VDR蛋白表达(图 2)。SLE活动组、SLE非活动组VDR蛋白表达水平较正常对照组明显降低,差异具有显著统计学意义(P < 0.01),SLE活动组VDR蛋白低于SLE非活动组,差异有统计学意义(P < 0.05)。
|
图 2 正常对照组、SLE活动组及非活动组VDR蛋白的表达水平 Fig.2 VDR protein expression levels in control group, SLE active group and inactive group. A Comparison of VDR protein expression levels in control group, SLE active group and inactive group(Mean ± SD); B: western blot analysis of VDR protein expression in each group. **P < 0.01 vs control group. #P < 0.05 vs SLE activity group. |
正常对照组、SLE活动组、SLE非活动组的PBMC的MCP-1 mRNA相对表达量及血清MCP-1水平(表 2)。SLE活动组与SLE非活动组MCP-1 mRNA相对表达量及血清水平均显著高于正常对照组(P < 0.01),与SLE非活动组相比,SLE活动组PBMC的MCP-1 mRNA的相对表达量及血清MCP-1水平增加,差异具有统计学意义(P < 0.05)。
| 表 2 SLE非活动组、活动组及正常对照组MCP-1的表达比较 Tab.2 Comparison of expression of MCP-1 in SLE inactive group, SLE active group and control group (Mean±SD) |
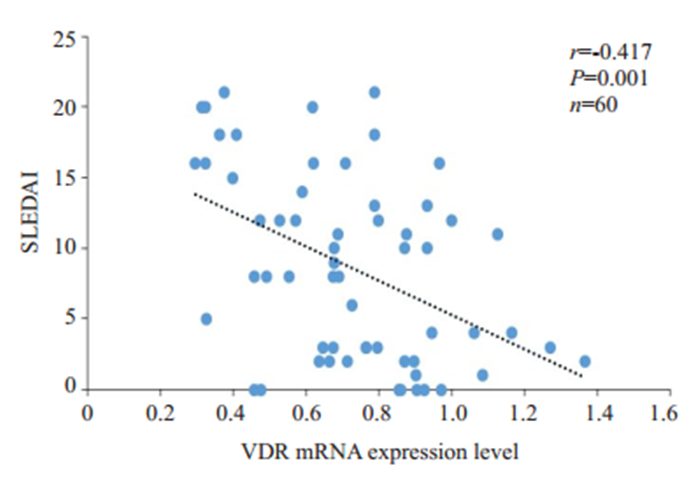
将VDR mRNA与SLEDAI进行相关分析,结果显示:VDR mRNA与SLEDAI成负相关(r=- 0.417,P= 0.001,图 3)。
|
图 3 VDR mRNA表达水平与SLEDAI的相关性分析 Fig.3 Correlation analysis between VDR mRNA expression level and SLEDAI (n=60). |
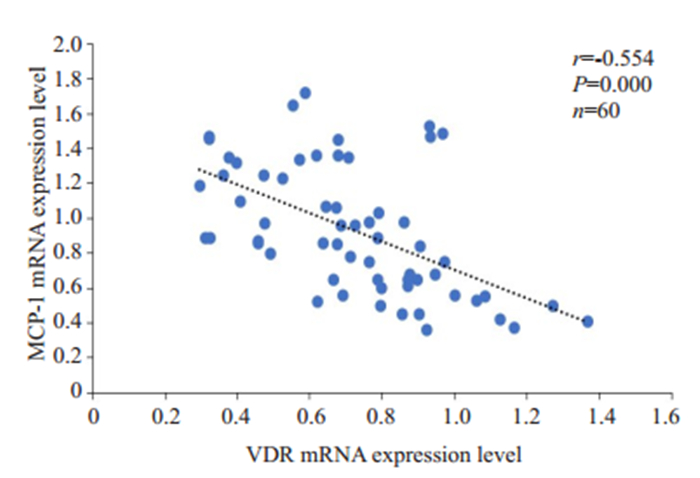
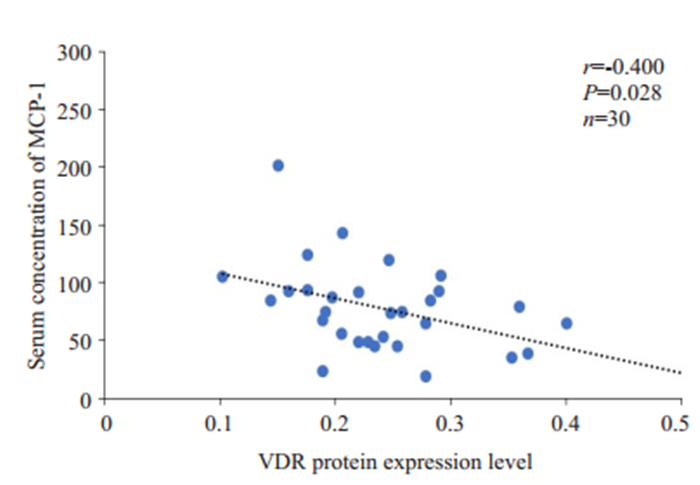
将VDR mRNA与MCP-1进行相关分析,结果显示:VDR mRNA与MCP-1 mRNA成负相关(r=-0.554,P=0.000,图 4)。VDR蛋白与血清MCP-1水平呈负相关(r=-0.400,P=0.028,图 5)。
|
图 4 VDR mRNA表达水平与MCP-1 mRNA表达水平的相关性分析 Fig.4 Correlation analysis between VDR mRNA expression level and MCP-1 mRNA expression (n=60). |
|
图 5 VDR蛋白表达水平与MCP-1血清浓度的相关性分析 Fig.5 Correlation analysis between VDR protein expression level and MCP-1 serum concentration (n=30). |
免疫功能的紊乱在SLE的发病进展中是一个非常重要的步骤。维生素D已被多研究证实参与SLE免疫炎症反应[13-15],并通过所有免疫细胞中表达的VDR产生基因效应来发挥重要作用。VDR位于细胞核内,为亲核蛋白,本质上是一个依赖配体的转录因子,它的表达可能受遗传、microRNA、表观遗传及体内活性维生素D水平等多重因素的调控[16-18]。既往研究多涉及VDR基因多态性与SLE的关系[19-20],近年有学者提出1,25(OH)2D3和VDR均可调节不同T细胞亚群中的细胞因子分泌来降低炎症因子的表达[2],并发现可以通过介导PKCδ/ ERK(蛋白激酶Cδ/细胞外信号调节激酶)途径激活CD4+ T细胞及抑制CD4+ T细胞过度活化,从而缓解SLE自身免疫反应[21]。我们的前期试验也证实单核细胞和T淋巴细胞系中,SLE患者的VDR表达被TNF-α抑制后下调,可能影响着病情的进展[7],故认为VDR的表达变化可能参与SLE的免疫炎症反应并发挥重要作用。
在本研究中,SLE患者PBMC的VDR mRNA及蛋白水平表达均明显下降,且以SLE活动期的VDR表达下降为著,这与国内相关报道并不一致[22],但可能与研究的对象不同有关,郑一君等[22]学者所选取的均为我国未服用过激素治疗的初发患者,而我们并未将病情初发作为研究的SLE患者纳入标准。另通过相关分析发现VDR与SLEDAI呈负相关(r=-0.417,P=0.001),处于SLE活动状态的患者VDR表达低下,表明VDR的表达可以作为反映SLE疾病活动程度的指标,提示VDR的表达下调可能增加SLE的风险。而有关VDR mRNA的表达下调的机制,有研究指出VDR mRNA在人原代B细胞中以低水平组成型表达,并且在1,25(OH)2D3存在下以时间依赖性方式增强[23],所以当体内维生素D缺乏时,可能导致维生素D介导VDR上调作用受到抑制。另也有学者提出在中国人群中VDR基因多态性发现与SLE发病易感性有关,且B等位基因、F等位基因可能在VDR基因转录中发挥负调节作用,通过下调VDR mRNA的表达影响病情变化[24-25]。
MCP-1又称为单核细胞趋化和活化因子,是控制单核细胞和巨噬细胞迁移过程的关键蛋白,主要与Th2细胞介导的免疫反应有关。Hao W等学者证实MCP-1在SLE中可以通过结合CRR2激活相关信号通路,促进细胞因子释放引起炎症反应导致组织器官损伤[26]。大部分研究表明血清MCP-1水平与活动性狼疮性肾炎相关,并认为与健康人相比,SLE患者PBMC的MCP-1 mRNA及血清中MCP-1表达呈上调趋势[27-28],提出MCP-1参与SLE病程进展及可能是提示SLE病情活动性的一项指标,我们实验结果与此相一致。我国学者进一步提出25(- OH)D3对SLE患者PBMCS的MCP-1表达存在剂量依赖性抑制,但大剂量维生素D仍未能完全抑制MCP-1的表达[6]。Wang等[29]学者则提出1α,25(- OH)2D3至少部分是通过VDR对MCP-1产生的抑制作用的观点,另在糖尿病肾脏病模型中也发现VDR活化剂的使用可以降低肾脏mRNA中MCP-1的表达,认为MCP-1基因的启动子的上有核转录调节因子核因子-kappaB(NF-κB)的结合位点,而VDR对经典NF-κB的转录靶MCP-1的表达可能存在负调节作用[30],本研究对结果进行相关性分析时也显示VDR的表达与MCP-1呈负相关,以上均佐证了VDR对MCP-1存在影响的推断。因此本研究可能进一步补充解释了SLE患者的MCP-1表达未能完全被维生素D抑制的事实,但目前尚未有研究明确VDR激活剂对SLE炎症反应有无改善作用,还需要更大规模的临床研究来证实VDR与MCP-1的关系及更深入的细胞实验和动物模型研究来探讨VDR对SLE炎症反应的影响,从而提供未来靶向治疗的新途径。
综上所述,本研究结果显示SLE患者PBMC的VDR的低表达与疾病的活动程度呈负相关,我们研究进一步发现VDR表达与趋化因子MCP-1呈负相关,提示SLE的发病机制中VDR对MCP-1的表达可能存在影响关系。
| [1] |
Wang XR, Xiao JP, Zhang JJ, et al. Decreased serum/plasma vitamin D levels in SLE patients: a meta-analysis[J]. Curr Pharm Des, 2018, 24(37): 4466-73. |
| [2] |
Ding Y, Liao W, He XJ, et al. Effects of 1, 25(OH)2 D3 and vitamin D receptor on peripheral CD4(+)/CD8(+) double-positive T lymphocytes in a mouse model of systemic lupus erythematosus[J]. J Cell Mol Med, 2017, 21(5): 975-85. DOI:10.1111/jcmm.13037 |
| [3] |
Karimzadeh H, Shirzadi M, Karimifar M. The effect of Vitamin D supplementation in disease activity of systemic lupus erythematosus patients with Vitamin D deficiency: A randomized clinical trial[J]. J Res Med Sci, 2017, 22: 4. DOI:10.4103/1735-1995.199089 |
| [4] |
Zivkovic V, Cvetkovic T, Mitic B, et al. Monocyte chemoattractant protein-1 as a marker of systemic lupus erythematosus:an observational study[J]. Rheumatol Int, 2018, 38(6): 1003-8. DOI:10.1007/s00296-017-3888-x |
| [5] |
庹艳红, 卢金金, 马特安. 系统性红斑狼疮患者尿液相关细胞因子的检测及临床意义探讨[J]. 医学研究杂志, 2014, 43(5): 152-5. |
| [6] |
罗雄燕, 魏琴, 刘青松, 等. 活性维生素D对系统性红斑狼疮患者表达单核细胞趋化蛋白的影响[J]. 中华风湿病学杂志, 2018, 22(1): 20-3. DOI:10.3760/cma.j.issn.1007-7480.2018.01.005 |
| [7] |
Sun J, Liu C, Zhang S, et al. Vitamin D receptor expression in peripheral blood mononuclear cells is inversely associated with disease activity and inflammation in lupus patients[J]. Clin Rheumatol, 2019, 38(9): 2509-18. DOI:10.1007/s10067-019-04594-2 |
| [8] |
Pease JE, Williams TJ. Chemokines and their receptors in allergic disease[J]. JAllergy Clin Immunol, 2006, 118(2): 305-18. DOI:10.1016/j.jaci.2006.06.010 |
| [9] |
Romagnani P, Crescioli C. CXCL10: a candidate biomarker in transplantation[J]. Clin ChimActa, 2012, 413(17/18): 1364-73. |
| [10] |
Abdel GM, Ezzeldin N, El-Boshy ME. The role of serum IL-17 and IL-6 as biomarkers of disease activity and predictors of remission in patients with lupus nephritis[J]. Cytokine, 2015, 76(2): 280-7. DOI:10.1016/j.cyto.2015.05.007 |
| [11] |
Yi B, Huang J, Zhang W, et al. Vitamin D receptor down-regulation is associated with severity of albuminuria in type 2 diabetes patients[J]. J Clin Endocrinol Metab, 2016, 101(11): 4395-404. DOI:10.1210/jc.2016-1516 |
| [12] |
Livak K, Schmittgen T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2000, 25(4): 402-8. |
| [13] |
Dall'ara F, Cutolo M, Andreoli L, et al. Vitamin D and systemic lupus erythematous: a review of immunological and clinical aspects[J]. Clin Exp Rheumatol, 2018, 36(1): 153-62. |
| [14] |
Mak A. The impact of vitamin D on the immunopathophysiology, disease activity, and extra-musculoskeletal manifestations of systemic lupus erythematosus[J]. Int J Mol Sci, 2018, 19(8): 2355. DOI:10.3390/ijms19082355 |
| [15] |
Shahin D, El-Farahaty RM, Houssen ME, et al. Serum 25-OH vitamin D level in treatment-naive systemic lupus erythematosus patients: Relation to disease activity, IL-23 and IL-17[J]. Lupus, 2017, 26(9): 917-26. DOI:10.1177/0961203316682095 |
| [16] |
Chen C, Liu Q, Zhu LM, et al. Vitamin D receptor gene polymorphisms on the risk of tuberculosis, a meta-analysis of 29 casecontrol studies[J]. PLoS One, 2013, 8(12): e83843. DOI:10.1371/journal.pone.0083843 |
| [17] |
Zhang H, Wang JW, Yi B, et al. BsmI polymorphisms in vitamin D receptor gene are associated with diabetic nephropathy in type 2 diabetes in the Han Chinese population[J]. Gene, 2012, 495(2): 183-8. DOI:10.1016/j.gene.2011.12.049 |
| [18] |
Chen Y, Du J, Zhang Z, et al. MicroRNA-346 mediates tumor necrosis factor alpha-induced downregulation of gut epithelial vitamin D receptor in inflammatory bowel diseases[J]. Inflamm Bowel Dis, 2014, 20(11): 1910-8. DOI:10.1097/MIB.0000000000000158 |
| [19] |
Ghaly MS, Badra DI, Dessouki O, et al. Vitamin D receptor fok1& bsm 1 gene polymorphisms in systemic lupus erythematosus and osteoarthritis: autoimmune inflammatory versus degenerative model[J]. Egypt J Immunol, 2017, 24(2): 151-64. |
| [20] |
Bae SC, Lee YH. Vitamin D receptor FokI, TaqI, and ApaI polymorphisms and susceptibility to systemic lupus erythematosus: an updated meta-analysis[J]. Clin Rheumatol, 2018, 37(6): 1529-37. DOI:10.1007/s10067-018-4036-z |
| [21] |
He XJ, Ding Y, Xiang W, et al. Roles of 1, 25(OH)2D3 and vitamin D receptor in the pathogenesis of rheumatoid arthritis and systemic lupus erythematosus by regulating the activation of CD4+T cells and the PKCdelta/ERK signaling pathway[J]. Cell Physiol Biochem, 2016, 40(3/4): 743-56. |
| [22] |
郑一君, 胡大伟, 陈盛, 等. 系统性红斑狼疮初发患者外周血中维生素D及其受体mRNA的水平和意义[J]. 中华风湿病学杂志, 2009, 13(9): 595-8. DOI:10.3760/cma.j.issn.1007-7480.2009.09.004 |
| [23] |
Chen S, Sims GP, Chen XX, et al. Modulatory effects of 1, 25- dihydroxyvitamin D3 on human B cell differentiation[J]. J Immunol, 2007, 179(3): 1634-47. DOI:10.4049/jimmunol.179.3.1634 |
| [24] |
罗雄燕, 武丽君, 杨明辉, 等. 维生素D受体Fok Ⅰ基因多态性对SLE患者维生素D受体表达的影响[J]. 细胞与分子免疫学杂志, 2011, 27(8): 901-5. |
| [25] |
罗雄燕, 武丽君, 陈龙, 等. 维生素D受体Bsm I基因多态性及VDR mRNA表达与系统性红斑狼疮的相关性[J]. 中华临床免疫和变态反应杂志, 2011, 5(01): 17-23. DOI:10.3969/j.issn.1673-8705.2011.01.004 |
| [26] |
Hao W, Rovin BH, Friedman A. Mathematical model of renal interstitial fibrosis[J]. Proc Natl Acad Sci USA, 2014, 111(39): 14193-8. DOI:10.1073/pnas.1413970111 |
| [27] |
Yoshio T, Okamoto H, Kurasawa K, et al. IL-6, IL-8, IP-10, MCP-1 and G-CSF are significantly increased in cerebrospinal fluid but not in sera of patients with central neuropsychiatric lupus erythematosus[J]. Lupus, 2016, 25(9): 997-1003. DOI:10.1177/0961203316629556 |
| [28] |
Zhou H, Li B, Li J, et al. Dysregulated T cell activation and aberrant cytokine expression profile in systemic lupus erythematosus[J]. Mediators Inflamm, 2019, 8450947: 11. |
| [29] |
Wang YC, Hsieh CC, Kuo HF, et al. Effect of vitamin D3 on monocyte chemoattractant protein 1 production in monocytes and macrophages[J]. Acta Cardiologica Sinica, 2014, 30(2): 144-50. |
| [30] |
Sanchez-Nino MD, Bozic M, Cordoba-Lanus E, et al. Beyond proteinuria: VDR activation reduces renal inflammation in experimental diabetic nephropathy[J]. J Physiol Renal Physiol, 2012, 302(6): F647-57. DOI:10.1152/ajprenal.00090.2011 |
 2020, Vol. 40
2020, Vol. 40

