2. 蚌埠医学院生理学教研室,安徽 蚌埠 233030;
3. 蚌埠医学院安徽医科大学2016级临床医学系,安徽 合肥 230000
2. Department of Physiology, Bengbu Medical College, Bengbu 233030, China;
3. Department of Clinical Medicine, South Campus, Anhui Medical University, Hefei 230000, China
糖尿病心肌病(DCM)是一类以心肌肥大及心肌胶原纤维沉积从而引起心肌组织慢性炎症反应为特点的心肌特异性疾病[1-2]。其发生发展与心肌氧化损伤、肾素血管紧张素醛固酮系统(RAAS)过表达、心脏慢性炎性损伤、心肌纤维化及心肌凋亡[3-7]等有密切关系,最终导致心脏功能障碍及死亡率增加,其中慢性炎症反应与糖尿病心肌病关系密切。核苷酸结合寡聚化结构域样受体1(NLRP1)是NLR(Nod-like receptors)蛋白超家族的成员,其在机体内的功能主要涉及细胞程序性死亡、慢性炎症和免疫应答反应等多方面,是机体内慢性炎症的主要参与者[8-11]。研究显示,当机体受内外源性损伤因素作用时,损伤因子可与NLRP1耦合并招募凋亡相关斑点样蛋白(ASC)和半胱天冬酶前体1(Pro-caspase 1),诱发半胱天冬酶前体激活导致炎症因子释放进而引起机体的慢性炎症[12]。现阶段已有研究证明NLRP1与1型糖尿病、糖尿病视网膜病变、动脉粥样硬化及缺血再灌注损伤等多种疾病关系密切[13-17]。但NLRP1炎症体在DCM病变心肌组织中的表达情况及机制尚不清楚,本研究拟探究高脂高糖饮食及糖尿病大鼠心肌组织中NLRP1炎症体的表达情况及其可能机制,为糖尿病心肌损伤寻求潜在病因。
1 材料和方法 1.1 动物来源取雄性Sprague-Dawley大鼠,体质量180~240 g,由蚌埠医学院实验动物中心提供并在22 ± 2 ℃和(50~70)%湿度下进行12 h光照/黑暗循环,大鼠可自由获取水分和食物。实验程序按照蚌埠医学院委员会制定的实验室动物使用和护理指南进行。
1.2 复制糖尿病大鼠实验模型随机将30只健康雄性SD大鼠分成正常对照(CON)、高糖高脂饮食(HC)和糖尿病(DM)3组。CON组大鼠正常饮食,其余大鼠给予高糖高脂饮食,4周后糖尿病实验组于腹腔注射STZ(30mg/kg)复制2型糖尿病大鼠模型,CON组及HC组予以等剂量生理盐水腹腔注射。注射3 d后监测各组大鼠血糖,若糖尿病组中连续1周随机血糖均高于16.7 mmol/L认定造模成功,剔除不合格大鼠,并持续检测大鼠血糖至造模后第8周[18]。于第8周称取体质量并完善其它相关检查后留取标本。
1.3 大鼠血浆TG、TC、FBG、FINS水平测定及IRI、ISI计算各组大鼠禁食12 h后抽取腹主动脉血2 mL,3000 r/min离心5 min取血浆,通过生化分析仪检测血清总胆固醇(TC)、血清总甘油三酯(TG)及空腹血糖(FBG)情况,并通过Elisa试剂盒快速检测各组大鼠血清空腹胰岛素含量(FINS)。运用统计学软件得出胰岛素抵抗指数(IRI)和胰岛素敏感性指数(ISI),其中IRI=FBG(mmol/L)FINS(mU/L)/22.5;ISI=1/[FBG(mmol/L)FINS(mIU/L)[19]。
1.4 心脏彩超评估心脏功能造模成功后第8周,使用心脏超声判断大鼠室壁运动情况测定左心室内舒张末期直径(LVID)、左心室收缩末期内径(LVSD)、室间隔直径(IVSd)、左室射血分数(LVEF)、短轴缩短率(FS)及早期至舒张晚期血流速度(E/A)评估心脏功能及射血情况。
1.5 RT-qPCR检测NLRP1、ASC及caspase 1的表达使用Trizol从心肌组织中分离总RNA,逆转录合成cDNA,引物序列为:NLRP1正向引物为5'-GCCCTGGAGACAAAGAATCC-3',反向引物为5'-AGTGGGCATCGTCATGTGT-3';ASC正向引物为5'-ACCCCATAGACCTCACTGAT-3',反向引物为5'-ACAGCTCCA GACTCTTCCAT-3';caspase 1正向引物为5'-ATGCCGTGGAGAGAAACAAG-3',反向引物为5'- CCAGGACACATTATCTGGTG-3';β-actin正向引物为5'-TTCCTTCCTGGGTATGGAAT-3',反向引物为5'-GAGGAGCAATGATCTTGATC-3'。反应条件为:预变性:95 ℃,10 min;变性:95 ℃,15 s;退火:60 ℃,30 s;延伸:72 ℃,30 s;终止延伸:72 ℃,5 min;循环40次。运用荧光定量PCR仪分析计算扩增循环数Ct值,以2-△△Ct法计算相对表达量[14]。
1.6 免疫印迹法(Western blot)检测NLRP1、ASC及caspase 1蛋白表达取大鼠左室心肌组织约100 mg,-80 ℃保存,实验开始时取100 mg心肌组织裂解获取组织匀浆,4 ℃离心(12 000 r/min)离心10 min,取上清,蛋白定量后,经15% SDS PAGE分离后电转膜至聚偏二氟乙烯(PVDF)膜,常温下于Tris缓冲液封闭1 h,依次加入NLRP1、ASC及caspase 1一抗,4 ℃过夜。次日充分洗涤后加入HRP的二抗IgG孵育,ECL试剂盒进行曝光成像。凝胶成像系统进行条带的灰度值测量,计算NLRP1、ASC、caspase 1及NLRP1/β-action、ASC/β-action及caspase 1/β-action蛋白表达的相对量[20]。
1.7 IL-18、IL-1β的酶免疫测定将心脏组织在0.1 mol/L乙酸中在100 ℃下煮沸20 min,然后在冰浴中均化。将匀浆在4℃下以13000 r/min离心30 min以收集上清液。根据制造商的说明,用酶免疫吸附法测量心肌样品中IL-18、IL-1β水平。
1.8 统计学分析所有数据应用SPSS19.0统计分析软件进行处理,计量资料以均数±标准差表示,组间比较采用One-way ANOVA,P<0.05为差异有统计学意义。
2 实验结果 2.1 血清学指标实验开始时各分组间大鼠血清TG、TC、FBG水平无明显差异(P>0.05),人工干预8周后与CON组相比,HC组大鼠出现质量增加及血浆TG、TC含量增高(P<0.01),但FINS、IRI及ISI未见明显变化(P>0.05)。而在DM组中观察到TC、TG及FBG升高的同时伴有糖尿病大鼠FINS和ISI降低(P<0.01),数据表明高脂高糖饮食可引起大鼠的体质量及血脂水平升高,但未引起血糖变化及胰岛素抵抗,而在糖尿病组大鼠中除血糖代谢障碍同时亦出现血脂异常及胰岛素抵抗现象(表 1)。
| 表 1 各组TG、TC、FBG、FINS、IRI、ISI及BW变化情况 Tab.1 changes of TG, TC, FBG, FINS, IRI, ISI and BW in different groups (Mean±SD, n=3) |
与CON组比较,HC组中心脏结构及功能未见明显变化(P>0.05),而DM组中大鼠出现左室室壁运动不协调,LVID、LVSD增加和LVEF、FS及E/A比值下降(P<0.01),IVSd未出现明显变化(P>0.05,图 1,表 2)。
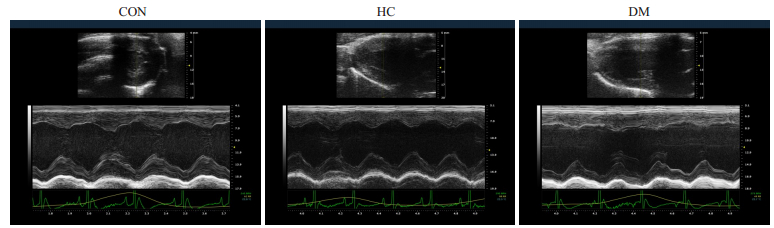
|
图 1 不同组大鼠的心脏彩超检查 Fig.1 Echocardiography to assess different groups cardiac function. CON: Normal control group; HC: Highcalorie group; DM: Diabetes group. |
| 表 2 大鼠心脏功能测定 Tab.2 Cardiac function test of the rats (Mean±SD, n=3) |
第8周末,与CON组相比,HC及DM组NLRP1、ASC及Caspase-1 mRNA含量均增高(P<0.01),而与HC组相比,DM组NLRP1/ASC/caspase 1的mRNA表达无明显差异(P>0.05);该数据说明当机体在高脂高糖饮食干预下及糖类代谢出现异常时均可观察到心肌组织中信号通路NLRP1/ASC/caspase 1表达的增加(P<0.01),但两种干预方式在mRNA的表达上无显著差异(图 2)。
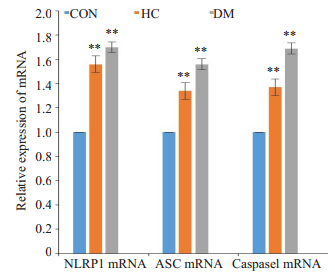
|
图 2 NLRP1/ASC/caspase 1通路的mRNA表达 Fig.2 The expression of NLRP1/ASC/caspase 1 mRNA levels. CON: Normal control group; HC: Highcalorie group; DM: Diabetes group. **P < 0.01 vs CON; ##P < 0.01 vs HC. |
与CON组相比,HC组NLRP1蛋白表达明显增加(P<0.01),但ASC及caspase 1的蛋白含量升高不明显(P>0.05),而DM组中NLRP1及caspase 1蛋白的表达均增加(P<0.01),但ASC升高不明显(P>0.05);与HC组相比,DM组NLRP1及caspase 1蛋白的表达亦升高,以caspase 1升高最显著(P<0.01)。在糖尿病大鼠中除NLRP1表达增加外还伴有caspase 1含量的增加(P<0.01),但ASC变化不显著(P>0.05,图 3)。
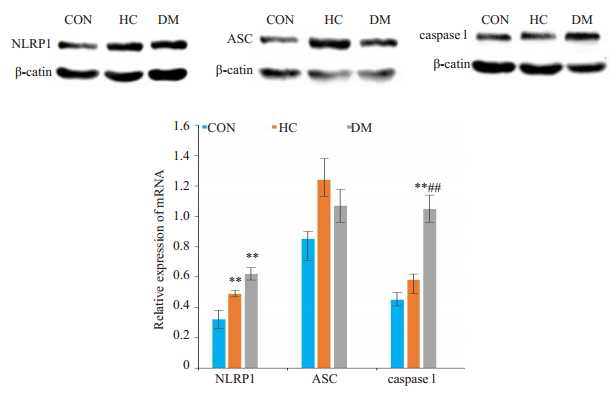
|
图 3 Western blot检测NLRP1/ASC/caspase 1通路蛋白表达 Fig.3 Western blot analysis of protein expressions in NLRP1/ASC/caspase 1 pathway. CON: Normal control group; HC: Highcalorie group; DM: Diabetes group. **P < 0.01 vs CON; ##P < 0.01 vs HC. |
与CON组相比,HC组IL-18、IL-1β未见明显变化,而在糖尿病组中炎症产物IL-18、IL-1β较CON和HC组均显著增高(P<0.01,图 4)。
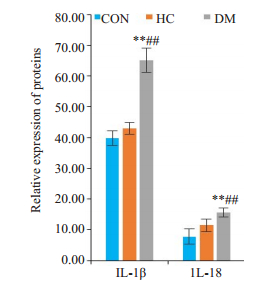
|
图 4 ELISA检测IL-18、IL-1β的表达情况 Fig.4 ELISA detection of serum IL-18 and IL-1β levels in the rats. CON: Normal control group; HC: Highcalorie group; DM: Diabetes group, **P < 0.01 vs CON. ##P < 0.01 vs HC. |
DCM作为独立的糖尿病并发症,主要指在无其他心脏危险因素(如冠状动脉疾病、高血压和显著的瓣膜病等)存在的情况下出现的心脏结构和功能异常,主要表现为心室肥厚和间质纤维化[21-22]。体内长期的高糖环境可引起内皮功能障碍、脂肪酸代谢紊乱、线粒体损伤及全身性炎症从而引起心脏结构及功能障碍[23-25]。既往研究显示,NLRP1炎症体可通过级联反应诱导心室扩张和心肌肥大,而NLRP1基因缺失后可延缓心肌肥厚从而改善心室重构[26]。本研究发现:给予高脂高糖饮食后大鼠出现严重的脂质代谢紊乱,但大鼠血糖代谢、心脏结构及功能未见明显影响;而在糖尿病大鼠中,除出现严重的糖和脂质代谢异常及胰岛素抵抗外还出现心脏结构及功能障碍,主要表现为左心室收缩舒张功能异常及E/A比值降低。该数据提示机体的长期高糖水平在引起脂质代谢障碍同时可引起心脏心肌结构和功能异常。
NLRP1炎症体由NLRP1、ASC和Pro-caspase 1这3个主要部分组成,其可被内外源性损伤因素激活促使Pro-caspase 1活化,在引起炎症物质(如IL-1β、IL-18)激活的同时也可引起细胞的特殊形式死亡即细胞焦亡[27]。在动脉粥样硬化患者中,Bleda等[28]发现,机体内的甘油三脂和胆固醇可刺激内皮细胞炎症体活化及NLRP1的产生。NLRP1被激活后可通过TGF-β1/Smad信号通路促进心肌成纤维细胞分化从而介导心脏结构和功能异常[29],而当NLRP1表达抑制后心肌细胞的纤维化及心肌肥厚症状可减轻[30]。本课题组发现,在HC组中高甘油三脂和胆固醇仅引起NLRP1、ASC及caspase 1mRNA的产生增加及NLRP1蛋白表达,但增加的mRNA及NLRP1蛋白尚不足以引起caspase 1蛋白的表达及炎性物质产生增加。而糖尿病组中我们观察到NLRP1及caspase 1 mRNA和其蛋白含量的增加以及炎性物质IL-18和IL-1β的活化。该研究提示NLRP1/ ASC/Caspase-1通路活性的增强以及其介导的炎性产物产生可能是由糖代谢的异常产生而受非甘油三酯和胆固醇升高的影响。
糖尿病心肌病是糖尿病的严重并发症,也是诱发器质性心肌损害的重要因素,其中长期慢性炎症反应是糖尿病心肌损害的重要影响因素。IL-1β和IL-18作为体内常见的促炎因子,其在体内蓄积可引起心肌收缩力减弱、心室肥厚、线粒体自噬增加及心肌纤维化[31]。在长期高血糖诱导下可促进体内炎性物质释放从而引起心肌组织持续性损伤进而导致心脏的功能障碍[32]。NLRP1炎症体作为炎症产物的重要调控受体,其对于炎性物质的产生和活性发挥扮演着重要角色,Li等[15]在糖尿病视网膜大鼠模型中发现,NLRP3/NLRP1基因敲除能降低细胞内caspase 1和IL-1β水平从而减轻炎症反应。在我们的研究中发现,在糖尿病大鼠心脏组织可以观察到NLRP1及caspase 1蛋白的过度表达及其介导的炎症产物IL-1β和IL-18的增加并引起心脏组织的炎症损伤,但在高脂高糖组中尚未观察到caspase 1的活化及炎症物质的过度表达。该研究进一步证实了NLRP1/ASC/caspase 1通路在炎症损伤调控中的作用及caspase 1在促炎因子的产生中扮演的重要角色。
综上所述,在糖尿病大鼠中我们观察到心脏结构及功能的改变和IL-18和IL-1β等炎性物质的过度表达,而这些状况的产生可能与NLRP1/ASC/caspase 1通路的表达有重要关系。而抑制NLRP1炎症体的活化能否对抗心肌炎性损伤,仍待今后实验进一步研究证实。
| [1] |
Xie YY, Sun MM, Lou XF, et al. Overexpression of PEP-19 suppresses angiotensin Ⅱ-induced cardiomyocyte hypertrophy[J]. J Pharmacol Sci, 2014, 125(3): 274-82. DOI:10.1254/jphs.13208FP |
| [2] |
Tan Y, Li X, Prabhu SD, et al. Angiotensin Ⅱ plays a critical role in alcohol-induced cardiac nitrative damage, cell death, remodeling, and cardiomyopathy in a protein kinase C/nicotinamide adenine dinucleotide phosphate oxidase-dependent manner[J]. J Am Coll Cardiol, 2012, 59(16): 1477-86. DOI:10.1016/j.jacc.2011.12.034 |
| [3] |
Parim B, Sathibabu UVV, Saravanan G. Diabetic cardiomyopathy: molecular mechanisms, detrimental effects of conventional treatment, and beneficial effects of natural therapy[J]. Heart Fail Rev, 2019, 24(2): 279-99. DOI:10.1007/s10741-018-9749-1 |
| [4] |
Hotamisligil GS. Inflammation and metabolic disorders[J]. Nature, 2006, 444(7121): 860-7. DOI:10.1038/nature05485 |
| [5] |
Dong B, Yu QT, Dai HY, et al. Angiotensin-converting enzyme- 2 overexpression improves left ventricular remodeling and function in a rat model of diabetic cardiomyopathy[J]. J Am Coll Cardiol, 2012, 59(8): 739-47. DOI:10.1016/j.jacc.2011.09.071 |
| [6] |
Thomas CM, Yong QC, Rosa RM, et al. Cardiac-specific suppression of NF-κB signaling prevents diabetic cardiomyopathy via inhibition of the renin-angiotensin system[J]. Am J Physiol Heart Circ Physiol, 2014, 307(7): H1036-45. DOI:10.1152/ajpheart.00340.2014 |
| [7] |
Wen HL, Liang ZS, Zhang R, et al. Anti-inflammatory effects of triptolide improve left ventricular function in a rat model of diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12(1): 50. DOI:10.1186/1475-2840-12-50 |
| [8] |
Kim YK, Shin JS, Nahm MH. NOD-Like receptors in infection, immunity, and diseases[J]. Yonsei Med J, 2016, 57(1): 5-14. DOI:10.3349/ymj.2016.57.1.5 |
| [9] |
Van Opdenbosch N, Van Gorp H, Verdonckt M, et al. Caspase-1 engagement and TLR-Induced c-FLIP expression suppress ASC/ caspase-8-Dependent apoptosis by inflammasome sensors NLRP1b and NLRC4[J]. Cell Rep, 2017, 21(12): 3427-44. DOI:10.1016/j.celrep.2017.11.088 |
| [10] |
Yu CH, Moecking J, Geyer M, et al. Mechanisms of NLRP1- Mediated autoinflammatory disease in humans and mice[J]. J Mol Biol, 2017, 430(2): 142-52. |
| [11] |
Feria MG, Andrea TN, Hernandez JC, et al. HIV replication is associated to inflammasomes activation, IL-1β, IL-18 and caspase-1 expression in GALT and peripheral blood[J]. PLoS One, 2018, 13(4): e0192845. DOI:10.1371/journal.pone.0192845 |
| [12] |
Mitchell PS, Sandstrom A, Vance RE. The NLRP1 inflammasome: new mechanistic insights and unresolved mysteries[J]. Curr Opin Immunol, 2019, 60: 37-45. DOI:10.1016/j.coi.2019.04.015 |
| [13] |
Liu H, Xu R, Kong Q, et al. Downregulated NLRP3 and NLRP1 inflammasomes signaling pathways in the development and progression of type 1 diabetes mellitus[J]. Biomedicine & Pharmacotherapy, 2017, 94: 619-26. |
| [14] |
Lénárt N, Brough D, Dénes Á. Inflammasomes link vascular disease with neuroinflammation and brain disorders[J]. J Cereb Blood Flow Meta, 2016, 36(10): 1668-85. DOI:10.1177/0271678X16662043 |
| [15] |
Li Y, Liu C, Wan XS, et al. NLRP1 deficiency attenuates diabetic retinopathy (Dr) in mice through suppressing inflammation response[J]. Biochem Biophys Res Commun, 2018, 501(2): 351-7. DOI:10.1016/j.bbrc.2018.03.148 |
| [16] |
Cao L, Chen Y, Zhang Z, et al. Endoplasmic reticulum stress-induced NLRP1 inflammasome activation contributes to myocardial ischemia/reperfusion injury[J]. Shock, 2018, 51(4): 511-8. |
| [17] |
Bo G, Yu W, Yuan- Jian Y, et al. Sinomenine exerts anticonvulsant profile and neuroprotective activity in pentylenetetrazole kindled rats: involvement of inhibition of NLRP1 inflammasome[J]. J Neuroinflammation, 2018, 15(1): 152. DOI:10.1186/s12974-018-1199-0 |
| [18] |
王洪巨, 康品方, 叶红伟, 等. 乙醛脱氢酶2在糖尿病大鼠心肌缺血/再灌注损伤中的抗凋亡作用[J]. 南方医科大学学报, 2012, 32(3): 69-72. |
| [19] |
Hongwei Y, Ruiping C, Yingyan F, et al. Effect of irbesartan on AGEs-RAGE and MMPs systems in rat type 2 diabetes myocardialfibrosis model[J]. Exp Biol Med (Maywood), 2019, 244(7): 612-20. DOI:10.1177/1535370219840981 |
| [20] |
Zhang B, Zhang Y, Wu W, et al. Chronic glucocorticoid exposure activates BK-NLRP1 signal involving in hippocampal neuron damage[J]. J Neuroinflammation, 2017, 14(1): 139. DOI:10.1186/s12974-017-0911-9 |
| [21] |
Bracey NA, Beck PL, Muruve DA, et al. The Nlrp3 inflammasome promotes myocardial dysfunction in structural cardiomyopathy through IL-1β[J]. Exp Physiol, 2012, 98(2): 462-72. |
| [22] |
Mezzaroma E, Toldo S, Farkas D, et al. The inflammasome promotes adverse cardiac remodeling following acute myocardial infarction in the mouse[J]. Proc Natl Acad Sci, 2011, 108(49): 19725-30. DOI:10.1073/pnas.1108586108 |
| [23] |
Zamora M, Villena JA. Contribution of impaired insulin signaling to the pathogenesis of diabetic cardiomyopathy[J]. Int J Mol Sci, 2019, 20(11): E2833. DOI:10.3390/ijms20112833 |
| [24] |
Jia GH, Hill MA, Sowers JR. Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity[J]. Circ Res, 2018, 122(4): 624-38. DOI:10.1161/CIRCRESAHA.117.311586 |
| [25] |
Zeng ZL, Li GH, Wu SY, et al. Role of pyroptosis in cardiovascular disease[J]. Cell Prolif, 2019, 52(2): e12563. DOI:10.1111/cpr.12563 |
| [26] |
Jing Z, Fang-Fang L, Kai L, et al. Nuclear localization leucine-richrepeat protein 1 deficiency protects against cardiac hypertrophy by pressure overload[J]. Cellular Physiology and Biochemistry, 2018, 48(1): 75-86. DOI:10.1159/000491664 |
| [27] |
Merkle S, Frantz S, Schoen MP, et al. A role for caspase-1 in heart failure[J]. Naunyn Schmiedebergs Arch Pharmacol, 2007, 375(1): 61. |
| [28] |
Bleda S, De Haro J, Varela C, et al. Elevated levels of triglycerides and vldl-cholesterol provoke activation of nlrp1 inflammasome in endothelial cells[J]. Int J Cardiol, 2016, 220: 52-5. DOI:10.1016/j.ijcard.2016.06.193 |
| [29] |
Jing Z, Hao Z, Fang-Fang L, et al. NLRP1 promotes TGF-β1-induced myofibroblast differentiation in neonatal rat cardiac fibroblasts[J]. J Mol Histol, 2018, 49: 509-18. DOI:10.1007/s10735-018-9789-9 |
| [30] |
Zong J, Li FF, Liang K, et al. Nuclear localization Leucine- RichRepeat protein 1 deficiency protects against cardiac hypertrophy by pressure overload[J]. Cell Physiol Biochem, 2018, 48(1): 75-86. |
| [31] |
Peiró C, Lorenzo Ó, Carraro R, et al. IL-1β inhibition in cardiovascular complications associated to diabetes mellitus[J]. Front Pharmacol, 2017, 8: 363. DOI:10.3389/fphar.2017.00363 |
| [32] |
Li X, Du N, Zhang Q, et al. MicroRNA-30d regulates cardiomyocyte pyroptosis by directly targeting foxo3a in diabetic cardiomyopathy[J]. Cell Death Dis, 2014, 5(10): e1479. DOI:10.1038/cddis.2014.430 |
 2020, Vol. 40
2020, Vol. 40

