2. 广州市妇女儿童医疗中心优生围产研究所,广东 广州 510623
2. Prenatal Diagnosis Center, Guangzhou Women and Children's Medical Center, Guangzhou 510623, China
染色体多态性是染色体异染色质区域的变异,通常发生在1、9、16号染色体的长臂着丝点旁的异染色质区,D、G组染色体的短臂和Y染色体的远端异染色质区域。
传统理论认为此区域无遗传信息传递, 发生变异后一般不会引起临床表型异常。但近年研究发现染色体多态性的个体存在生殖功能异常[1],如精子发生异常[2]、不育[3-4]、重复性流产[5-6]等。并且不孕症患者染色体多态性发生率明显高于正常生育妇女[7-8]。
染色体多态性是否会影响体外受精-胚胎移植(IVF-ET)患者妊娠结局目前研究得到的结论不一。有研究认为染色体多态性不影响体外受精胚胎移植技术的妊娠结局[9],但我们前期研究发现:夫妇的染色体多态性与胚胎的多核相关[10],提示染色体多态性确实会对生殖过程产生影响。
为进一步探讨染色体多态性影响胚胎多核形成的机制,我们对染色体多态性进行分组,探讨不同亚组染色体多态性与胚胎多核形成的相关性。
1 资料和方法 1.1 研究对象和分组研究对象选自2011年1月1日~2016年12月31日在我中心行体外授精-胚胎移植(IVF/ICSI-ET)周期治疗的1145对不孕夫妇;纳入标准:第一周期促排卵治疗;AMH大于1.1 ng/mL,AFC大于5个;黄体期长方案促排卵治疗;排除标准为:;重复取卵周期;其他方案促排卵治疗。
染色体核型分析:染色体分析采用中期染色体G显带技术。取外周血抗凝,接种于1640培养基,37 ℃培养72 h,常规制片、G显带观察,必要时行C显带、R显带。每例计数30个中期核型, 分析3个核型。如疑嵌合体,计数100个中期分裂相。
染色体多态变异的定义:根据《2013年染色体命名国际体系》 [11],以下染色体变异属于多态性变化:1、9、16号染色体长臂上的着丝粒异染色质区增长(1qh+、9qh+、16qh+);短臂随体增长(ps+);D和G组染色体短臂随体柄增长或缩短(pstk+/-);1、9和Y染色体的臂间倒位(inv)。多态性判断的标准是变异区域长度至少为正常区域长度的2倍。当检测到正常多态核型时,需由另1检测技术人员进行复核,以尽量减少错误。
分组:无染色体多态性的设为正常对照组,夫妇双方有一方或双方有上述的染色体多态为多态组,根据不同的多态类型分为染色体臂间倒位亚组、D/G组染色体多态亚组和(1,9,16)qh+多态亚组。
1.2 控制超促排卵方案患者采用标准GnRH-a长方案进行超促排卵。启动剂量根据AMH、卵巢窦状滤泡计数、女性年龄和基础FSH。随后的剂量根据卵泡生长和血清雌二醇水平进行调整。当至少3个优势的卵泡达到平均直径≥18 mm时,用人绒毛膜促性腺激素(HCG)或重组HCG触发最终卵泡成熟。34~38 h后经阴道取卵。
1.3 胚胎培养及卵裂期胚胎多核评估取卵后4~6 h行常规IVF或ICSI。授精后16~18 h进行授精评估。2个原核的存在被认为是正常受精。根据ESHRE/ALPHA共识[12]提出的胚胎评价时间(授精后44±1 h),对卵裂期胚胎(2~6细胞)碎片率、多核、卵裂球对称性评价。任何1个卵裂球含有2个或以上细胞核的胚胎定义为多核胚胎,其中而所有卵裂球均含有小于或等于1个细胞核的胚胎为正常对照胚胎[10]。每个胚胎都由两名胚胎学家进行了复核。
1.4 胚胎移植临床妊娠率比较第1移植周期,如果新鲜周期未移植,则选取用第1冷冻-解冻移植周期(常规HRT方案准备内膜),胚胎移植后给予黄体支持。移植后14 d抽血查血β-HCG,移植后28 d B超检查有孕囊,记录为临床妊娠;记录流产率、宫外孕率、出生率。
1.5 统计学处理所有数据分析均采用SPSS 20.0进行。对于连续变量以均数±标准差表示,分类变量以被试人数(N)和百分比(%)表示。对单变量使用双样本t检验进行分析。采用卡方检验比较各组间的发生率和比例,P<0.05为差异有统计学意义。
2 结果 2.1 染色体多态性分布情况1145对夫妇,其中139对夫妇至少有1方为染色体多态,发生率为6.10 %,其中男性67人,女性72人。男性主要的染色体多态性变异为21pstk+(25.3 %)、1qh+(20.9 %)和Inv(9)(p12q13)(19.4 %),女性主要的染色体多态性变异为Inv(9)(p12q13)(27.8 %)、21pstk+(19.4 %)和1qh+(19.4 %)(表 1)。
| 表 1 染色体多态核型类型 Tab.1 Frequency of chromosomal polymorphisms in the infertile couples |
按多态性类型分类;染色体臂间倒位亚组(n=39,占28.1 %)、D组(13、14、15)和G组(21、22)染色体多态亚组,(n=61,占43.8 %)、(1,9,16)qh+多态亚组(n=39,占28.1 %)。
2.2 各组一般资料及临床数据比较染色体多态各亚组和对照组之间在女性平均年龄、BMI、基础FSH、平均不孕时间、不孕类型、不孕病因等方面无显著差异(表 2)。
| 表 2 染色体多态亚组和对照组一般情况比较 Tab.2 Comparison of baseline characteristics between couples with chromosomal polymorphisms and the control group |
各组均采用黄体期长方案进行促排卵治疗。促排卵天数、总促性腺激素用量、HCG日LH水平、HCG日雌激素水平和平均获卵数等方面无显著差异(表 3)。
| 表 3 染色体多态亚组与对照组IVF周期临床情况对比 Tab.3 Comparison of stimulation cycle characteristics between couples with chromosomal polymorphisms and the control group |
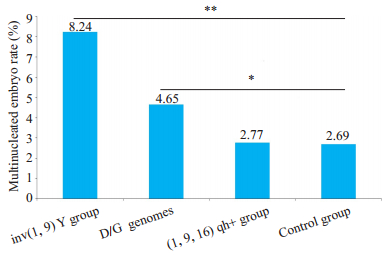
各组IVF受精率、第3天优质胚胎率、妊娠率和活产率均无统计学差异(表 4)。染色体臂间倒位、D/G组染色体多态和(1,9,16)qh+多态3个亚组胚胎多核发生率分别为8.23%、4.65%和2.77%,而正常对照组仅为2.69%。染色体臂间倒位、D/G组染色体多态和对照组比较多核率显著性升高(P<0.05),而(1,9,16)qh+多态组和对照组比较多核率则无显著差异(P>0.05,图 1)。
| 表 4 染色体多态亚组与对照组胚胎发育及临床结局情况对比 Tab.4 Comparison of quality of embryos and pregnancy outcome between couples with chromosomal polymorphisms and the control group |
|
图 1 染色体多态亚组与对照组胚胎多核率比较 Fig.1 Comparison of multinucleated embryo rate between different types of chromosomal polymorphism and control groups. **P < 0.01, *P < 0.05 vs control group. |
按照ESHRE推荐,多核的胚胎未进行移植。染色体多态各亚组和对照组之间比较移植胚胎数、临床妊娠率、活产率均无统计学差异(P>0.05)。
3 讨论染色体多态性主要表现为染色体臂间倒位、D组(13、14、15)和G组(21、22)染色体多态和(1,9,16)qh+多态等不同类型[13]。其本质是异染色质的变异,在正常人群中发生率为3.74% [14]。由于异染色质所含DNA主要是非编码的高度重复序列,不含结构基因,也没有转录活性,因此很长1段时间染色体多态性都被认为是正常变异,不会引起临床效应。但近期研究表明不孕不育人群中染色体多态发生率远高于正常人,Madon等[3]对842例原发不孕或多发性流产史的IVF患者的染色体多态性情况进行回顾性分析,结果显示染色体多态性变异在IVF患者中的检出率均较正常人群升高, 差异有统计学意义。
染色体多态性对生殖有何影响,Garcia-Guixe和Kort等人的研究发现染色体多态会导致胚胎非整倍率增加[15]和卵裂期胚胎染色体异常率升高[16]。Morales等[17]人也发现,染色体多态的不育男性与正常男性相比,精子非整倍体频率更高(37.7 % vs 16.3 %),证实了染色体多态与精子和胚胎的高非整倍体率存在相关性。
关于染色体多态性对体外受精结果的影响存在争议。国内研究中松迪[9]及高辉[18]等研究均认为染色体多态性不影响IVF/ICSI-ET助孕患者的临床结局。但Ni等研究发现丈夫为染色体多态的夫妇IVF的妊娠结局较差,表现为累积早期流产率增高和周期活产率降低[19]。Xu等[20]也报道在IVF周期中,男性染色体多态性主要导致受精率、胚胎卵裂率、优质胚胎率、临床妊娠率、持续妊娠率、分娩率降低以及单纯生化妊娠率升高;女性的染色体多态性主要导致胚胎卵裂率降低。在我们的前期研究中,发现染色体多态夫妇在体外受精治疗中的临床结局与松迪等报道结论相似,染色体多态组和对照组之间一般资料和临床结局之间均无统计学差异,但在胚胎发育方面,虽然两组之间受精率和优质胚胎率方面没有差异,但多态组的胚胎多核率会增加,染色体多态性与多核胚胎形成独立相关[10],提示染色体多态性会对胚胎发育过程产生影响。
正常的人类胚胎每个卵裂球只有1个细胞核,在1个卵裂球中含有1个以上细胞核的胚胎被定义为多核胚胎(MNB),发生率在15~40 %之间[21-22]。胚胎卵裂球中存在多核现象会导致胚胎发育不良并会对体外受精(IVF)的结局产生不良影响[23]。既往研究多从临床方案及药物剂量方面对胚胎多核形成进行探讨,认为多核形成的因素主要是由于超促排卵处理过程中快速诱导排卵,使血中E2水平上升和获卵数增加,导致胚胎的多核率上升所致[21, 24]。而我们则发现染色体多态性与多核胚胎形成独立相关[10],从遗传学上阐述了胚胎多核发生的原因。在此基础上,本研究进一步分析了染色体多态的不同亚组与胚胎多核率的关系,发现1、9和Y染色体的臂间倒位组和D/G组染色体短臂随体柄增长亚组多核率较对照组明显增高,而(1,9,16)qh+多态亚组多核率和对照组无显著差异。
1、9和Y染色体的臂间倒位主要是指染色体的长臂和短臂各发生一次断裂,断片倒转180度后重接,这种结构变化没有遗传物质丢失,因此具有臂间倒位的个体一般不具有表型效应。但在配子生成的时候,由于倒位的染色体在进行减数分裂时会形成特有的倒位环,当环内发生交换后可以形成平衡和不平衡性的配子,这种携带部分重复及部分缺失的不平衡重组染色体的配子在与正常配子受精后,造成遗传物质的不平衡,最终导致胚胎染色体异常[25]。除了1、9和Y染色体,其他的臂间倒位都属于染色体异常,而1、9和Y染色体的臂间倒位属于染色体多态性。可能是由于其倒位区间的染色质不含结构基因的原因。然而,近期的研究发现9号染色体倒位患者特发性生殖功能障碍的比例较正常对照组高[26],并与男性无精症相关[27]。提示9号染色体倒位可能具有一定的临床意义。.
D/G组染色体多态是指这两组染色体末端的随体或短臂延长,肖晓素等[28]认为由于D、G组染色体短臂增长部分的rRNA高度重复,使染色体不分离,形成了染色体异常的配子或合子。段程颖等[29]认为D/G组染色体多态给细胞分裂带来的直接影响是在同源染色体配对时多态性部分造成染色体配对的困难,进而导致胚胎发生染色体非整倍性变异或减数分裂中异常配子产生。因此,这两种染色体多态均会增加配子染色体异常和干扰减数分裂造成胚胎非整倍体增加,从而导致胚胎多核率上升,这和我们之前的研究中发现胚胎多核率上升是胚胎非整倍体率上升的外在表现的结论相符[10]。
(1,9,16)qh+多态发生在染色体长臂的异染色质区--次缢痕区,主要由高度重复的DNA序列组成,容易发生自发和诱发断裂,表现为高度重复的DNA序列增加或减少[30]。Sahin等[31]认为次缢痕区的增减将产生不平衡的配子无法受精而死亡,或形成非整倍体胚胎而造成男性不育、流产死胎等。和前两种多态不同,由于(1,9,16)qh+多态产生的不平衡配子会导致不能受精无法形成胚胎,所以这部分不平衡配子在体外受精过程在会被淘汰,这可能是其非整倍体胚胎发生率较其他两组多态低而导致胚胎多核率较低的原因。
我们发现各染色体多态亚组和对照组间IVF周期的临床结局没有差异,这和其他几个研究的结论相似[9, 32]。我们之前的研究认为染色体多态导致胚胎多核率增加的原因,可能是因为染色体多态增加了配子非整倍体率,从而导致胚胎非整倍体率的增高,胚胎多核率上升是胚胎非整倍体率上升的外在表现[10]。而临床结局没有差异的原因可能是在IVF过程中,多核的非整倍体胚胎会在培养过程被发现[14, 33],在移植时我们往往选择无多核的胚胎进行移植。Hong等[32]做了相关研究,他们比较了染色体多态变异组和对照组第1次胚胎移植周期,发现两组都没有用多核胚胎进行移植,所以也没有发现两组之间临床结局有显著差异,而在Ni等[19]的研究发现,在1个完整的IVF治疗周期中,当优质胚胎移植完后,使用多核胚胎进行移植,会导致更高的累计流产率和低出生率。
本研究存在一定的局限性。首先,我们只在胚胎培养的第1天(授精后第2天)评估了多核现象,而没有使用胚胎时差系统进行观察。这种可能会导致遗漏一些多核胚胎。其次,我们虽然发现胚胎多核风险与特定类型的染色体多态亚组之间有关联,但未能通过更进一步的实验手段比如二代测序技术(NGS)等进一步证实其关联性,这可能需要更大的样本量才能确定特定类型的染色体多态性对胚胎多核的潜在影响。第三,目前尚不清楚染色体多态变异各亚组患者在进行重复促排卵过程中是否会反复出现胚胎多核现象。进一步分析染色体多态变异夫妇的重复IVF周期将有助于进一步了解染色体多态变异亚组对多核形成的影响。
综上所述,在接受体外受精的夫妇中,虽然染色体多态各亚组对IVF/ICSI-ET周期临床结局没有负面影响,但1、9和Y染色体的臂间倒位和D/G组染色体多态会导致胚胎发育过程中胚胎多核率升高,而(1,9,16)qh+多态组则不会增加胚胎多核率。
| [1] |
唐冬生, 田允波, 李晓杰, 等. 染色体多态性与生殖异常的关系研究[J]. 中国优生与遗传杂志, 2002, 10(6): 51-2. DOI:10.3969/j.issn.1006-9534.2002.06.025 |
| [2] |
Guo T, Qin Y, Gao X, et al. The role of male chromosomal polymorphism played in spermatogenesis and the outcome of IVF/ ICSI-ET treatment[J]. Int J Androl, 2012, 35(6): 802-9. DOI:10.1111/j.1365-2605.2012.01284.x |
| [3] |
Madon PF, Athalye AS, Parikh FR. Polymorphic variants on chromosomes probably play a significant role in infertility[J]. Reprod Biomed Online, 2005, 11(6): 726-32. DOI:10.1016/S1472-6483(10)61691-4 |
| [4] |
Minocherhomji S, Athalye AS, Madon PF, et al. A case-control study identifying chromosomal polymorphic variations as forms of epigenetic alterations associated with the infertility phenotype[J]. Fertil Steril, 2009, 92(1): 88-95. DOI:10.1016/j.fertnstert.2008.05.071 |
| [5] |
Caglayan AO, Ozyazgan I, Demiryilmaz F, et al. Are heterochromatin polymorphisms associated with recurrent miscarriage?[J]. J Obstet Gynaecol Res, 2010, 36(4): 774-6. DOI:10.1111/j.1447-0756.2010.01207.x |
| [6] |
Fuente-Cortés LB, Cerda-Flores RM, Dávila-Rodríguez M, et al. Chromosomal abnormalities and polymorphic variants in couples with repeated miscarriage in Mexico[J]. Reprod Biomed Online, 2009, 18(4): 543-8. DOI:10.1016/S1472-6483(10)60132-0 |
| [7] |
Ahmet Okay C, Isilay O, Fatma D, et al. Cytogenetic results of patients with infertility in middle Anatolia, Turkey: do heterochromatin polymorphisms affect fertility?[J]. J Reprod Infertil, 2010, 11(3): 179-81. |
| [8] |
Mierla D, Stoian V. Chromosomal polymorphisms involved in reproductive failure in the romanian population[J]. Balkan J Med Genet, 2012, 15(2): 23-8. DOI:10.2478/bjmg-2013-0003 |
| [9] |
松迪, 印惠荣, 张慧琴, 等. 染色体多态性不影响体外受精胚胎移植技术的生殖结局[J]. 第二军医大学学报, 2017, 38(7): 836-41. |
| [10] |
Sun L, Chen ZH, Yang L, et al. Chromosomal polymorphisms are independently associated with multinucleated embryo formation[J]. J Assist Reprod Genet, 2018, 35(1): 149-56. DOI:10.1007/s10815-017-1037-9 |
| [11] |
Shaffer LG, Mcgowan-Jordan J, Schmid M. ISCN 2013: an international system for human cytogenetic nomenclature[M]. basel: karger medical and scientific publishers, 2013.
|
| [12] |
Alpha scientists in reproductive medicine and ESHRE special interest group of embryology. the istanbul consensus workshop on embryo assessment: proceedings of an expert meeting[J]. Hum Reprod, 2011, 26(6): 1270-83. DOI:10.1093/humrep/der037 |
| [13] |
李蓉, 翁炳焕, 董旻岳. 常见染色体多态性及其临床意义的探讨[J]. 中国产前诊断杂志:电子版, 2016, 8(1): 42-7. |
| [14] |
Cheng R, Ma Y, Nie Y, et al. Chromosomal polymorphisms are associated with female infertility and adverse reproductive outcomes after infertility treatment: a 7-year retrospective study[J]. Reprod Biomed Online, 2017, 35(1): 72-80. DOI:10.1016/j.rbmo.2017.03.022 |
| [15] |
Garcia-Guixé E, Jimenez-Macedo A, Arjona C, et al. Chromosomal variants and increased risk of aneuploidy in preimplantational embryos[J]. Hum Reprod, 2011, 26: i54. |
| [16] |
Kort DH, Chia G, Treff NR, et al. Human embryos commonly form abnormal nuclei during development: a mechanism of DNA damage, embryonic aneuploidy, and developmental arrest[J]. Hum Reprod, 2016, 31(2): 312-23. |
| [17] |
Morales R, Lledó B, Ortiz JA, et al. Chromosomal polymorphic variants increase aneuploidies in male gametes and embryos[J]. Syst Biol Reprod Med, 2016, 62(5): 317-24. DOI:10.1080/19396368.2016.1212949 |
| [18] |
高辉. 染色体多态性对IVF/ICSI-ET妊娠结局的影响[J]. 中国优生与遗传杂志, 2016, 24(2): 104-5. |
| [19] |
Ni T, Li J, Chen H, et al. Male chromosomal polymorphisms reduce cumulative live birth rate for IVF couples[J]. J Assist Reprod Genet, 2017, 34(8): 1017-25. DOI:10.1007/s10815-017-0951-1 |
| [20] |
Xu X, Zhang R, Wang W, et al. The effect of chromosomal polymorphisms on the outcomes of fresh IVF/ICSI- ET cycles in a Chinese population[J]. J Assist Reprod Genet, 2016, 33(11): 1481-6. DOI:10.1007/s10815-016-0793-2 |
| [21] |
Jackson KV, Ginsburg ES, Hornstein MD, et al. Multinucleation in normally fertilized embryos is associated with an accelerated ovulation induction response and lower implantation and pregnancy rates in in vitro fertilization embryo transfer cycles[J]. Fertil Steril, 1998, 70(1): 60. DOI:10.1016/S0015-0282(98)00100-9 |
| [22] |
Yilmaz A, Zhang L, Zhang XY, et al. Chromosomal complement and clinical relevance of multinucleated embryos in PGD and PGS cycles[J]. Reprod Biomed Online, 2014, 28(3): 380-7. DOI:10.1016/j.rbmo.2013.11.003 |
| [23] |
Desai N, Ploskonka S, Goodman L, et al. Delayed blastulation, multinucleation, and expansion grade are independently associated with live-birth rates in frozen blastocyst transfer cycles[J]. Fertil Steril, 2016, 106(6): 1370-8. DOI:10.1016/j.fertnstert.2016.07.1095 |
| [24] |
De Cássia Savio Figueira R, Souza Setti A, Paes De Almeida Ferreira Braga D, et al. Blastomere multinucleation: Contributing factors and effects on embryo development and clinical outcome[J]. Hum Fertil (Camb), 2010, 13(3): 143-50. DOI:10.3109/14647273.2010.508505 |
| [25] |
Serra A, Brahe C, Millington-Ward A, et al. Pericentric inversion of chromosome 9:prevalence in 300 Dow n syndrome families and molecular studies of nondisjunction[J]. Am J Med Genet, 1990, 37(57): 162-8. |
| [26] |
Šípek A, Panczak A, Mihalová R, et al. Pericentric inversion of human chromosome 9 epidemiology study in czech males and females[J]. Folia Biol (Praha), 2015, 61(4): 140-6. |
| [27] |
Takeda T, Iwatsuki S, Hamakawa T, et al. Chromosomal anomalies and sperm retrieval outcomes of patients with non-obstructive azoospermia: a case series[J]. Andrology, 2017, 5(3): 473-6. DOI:10.1111/andr.12338 |
| [28] |
肖晓素, 王勇强, 杨媛慧, 等. 遗传咨询者染色体多态性与临床效应的研究[J]. 中国优生与遗传杂志, 2004, 12(4): 65-6. DOI:10.3969/j.issn.1006-9534.2004.04.033 |
| [29] |
段程颖, 王丽娟, 王挺, 等. 染色体多态性与临床生殖效应的研究[J]. 生殖与避孕, 2009, 29(10): 643-7. |
| [30] |
张建林, 张玉泉. 习惯性流产夫妇的细胞遗传学分析与临床研究[J]. 中国妇幼保健, 2014, 29(2): 259-60. |
| [31] |
Sahin FI, Yilmaz Z, Yuregir OO, et al. Chromosome heteromorphisms: an impact on infertility[J]. J Assist Reprod Genet, 2008, 25(5): 191-5. DOI:10.1007/s10815-008-9216-3 |
| [32] |
Hong Y, Zhou YW, Tao J, et al. Do polymorphic variants of chromosomes affect the outcome of in vitro fertilization and embryo transfer treatment?[J]. Hum Reprod, 2011, 26(4): 933-40. DOI:10.1093/humrep/deq333 |
| [33] |
Kligman I, Benadiva C, Alikani M, et al. The presence of multinucleated blastomeres in human embryos is correlated with chromosomal abnormalities[J]. Hum Reprod, 1996, 11(7): 1492-8. DOI:10.1093/oxfordjournals.humrep.a019424 |
 2020, Vol. 40
2020, Vol. 40

