2. 广西医科大学广西高校高发疾病预防与控制研究重点实验室,广西 南宁 530021;
3. 广西医科大学基础医学院,广西 南宁 530021;
4. 广西医科大学广西高校基础医学研究重点实验室,广西 南宁 530021
2. Guangxi Colleges and Universities Key Laboratory of Prevention and Control of Highly Prevalent Diseases, Guangxi Medical University, Nanning 530021, China;
3. School of Preclinical Medicine, Guangxi Medical University, Nanning 530021, China;
4. Guangxi Colleges and Universities Key Laboratory of Preclinical Medicine, Guangxi Medical University, Nanning 530021, China
白脂素是2016年在Cell首次报道的一种葡萄糖调控的蛋白质类激素,最初是在研究新生儿型早衰综合征发病机制中发现[1]。它是由原纤维蛋白1(FBN1)基因编码的原纤维蛋白1的C末端截断突变而来的裂解产物[1-2]。该激素可升高血糖水平,增加胰岛素抵抗,因此被认为是治疗肥胖和糖尿病潜在的分子靶标[1],一经发现即引起了极大的关注[3-4]。进一步的研究发现白脂素在多种代谢性相关疾病,如2型糖尿病、多囊卵巢综合征、成年肥胖、糖耐量异常等患者血清和血浆中白脂素水平均高于正常人[5-10]。利用腺病毒在小鼠肝脏细胞中高表达白脂素,其肝脏糖合成效率大幅增加[1];肥胖小鼠腹腔注射白脂素抗体后,可以显著降低食欲和体质量,同时血中胰岛素水平也下降[11]。提示白脂素在各类代谢性相关疾病中有着重要作用,可能会成为这些疾病的潜在治疗靶点。
目前开展的白脂素研究多为对临床标本的检测,关于细胞和动物实验较少,为了进一步探索白脂素作用的分子机制和对糖脂代谢的影响,需要获得大量纯化且具有功能的重组白脂素蛋白以用于开展细胞和动物实验研究。现有研究中白脂素表达纯化方法多为利用原核系统表达的可溶性蛋白[12],此方法获得的重组蛋白产量较低,无法满足后续实验研究的需要。而采用原核系统表达的包涵体经适当的溶解和复性后可获得大量的有功能的蛋白产物。为了获得大量有功能的重组白脂素蛋白,本研究探索了白脂素包涵体表达与纯化的方法,首次采用包涵体洗涤溶解,梯度尿素透析复性与亲和层析纯化相结合的方法纯化了白脂素重组蛋白;纯化后的蛋白质通过考马斯亮蓝染色和蛋白免疫印迹进行表达验证,并在小鼠体内注射进行功能验证。采用验证后的重组蛋白初步探索了白脂素对人MIHA肝细胞活性及糖原含量的影响。本研究建立一种经济有效的白脂素原核表达与纯化方法,为白脂素分子作用机制和临床应用的研究奠定基础。
1 材料和方法 1.1 材料 1.1.1 菌株、质粒与细胞、动物感受态菌株E. coli DH5α与E. coli BL21(DE3)购于天根生化科技(北京)有限公司,菌株DH5α用于保存质粒,BL21(DE3)用于表达蛋白质;His-asprosin pET-22b质粒合成于武汉金凯瑞公司。原核表达的宿主菌培养于LB培养基中。MIHA肝细胞由广西中医药大学冷静教授馈赠,在37 ℃,5%二氧化碳环境中,培养于含10%FBS,0.1%环丙沙星的1640培养基中。雌性C57BL/6小鼠购于广西医科大学实验动物中心(SCXK桂2014—0002),本实验获得广西医科大学实验动物中心动物实验伦理审查许可,涉及动物的实验操作符合中华人民共和国《实验动物管理条例》。
1.1.2 主要试剂与仪器His标签蛋白纯化试剂盒、溶菌酶、蛋白酶抑制剂(碧云天);去内毒素柱(赛默飞);透析袋(Viskase);生化培养箱(博讯);高速离心机(Eppendorf);超声裂解仪(天根生化科技);水平摇床(赛默飞);其他试剂为国产分析纯。
1.2 方法 1.2.1 白脂素表达载体的构建白脂素基因由FBN1的65号外显子和66号外显子共同编码而来。根据在美国国家生物技术信息中心(NCBI)查找的人FBN1 mRNA基因序列,参考文献[1-2, 11]后我们推算编码白脂素基因片段是NM_000138.4(8592-9011),该序列为FBN1 mRNA的CDS区。针对该序列做以下的优化:在N端连接His序列,同时在两端增加NcoⅠ和BlpⅠ酶切位点以及两个补位基因。将人工合成的优化后白脂素基因和pET-22b质粒用限制性内切酶Ncol和Blpl进行双酶切,再用T4DNA连接酶进行连接,即可得到包含人白脂素的pET-22b载体质粒,将其命名为pET-22b-asprosin。
1.2.2 转化感受态细胞采用热激法转化感受态细胞DH5α与BL21。从-70 ℃取出100 μL感受态细胞于冰水中解冻,加入10 ng pET-22b-asprosin质粒冰浴中静置30 min;42 ℃水浴90 s后冰浴3 min;加入900 μL不含抗生素的LB培养基,37 ℃,150 r/min摇床振荡培养45 min;取20 μL菌液在含有100 μg/mL氨苄青霉素的固体培养基上涂布,37 ℃倒置培养12~16 h后挑取单克隆菌落,加入15 mL含100 μg/mL氨苄青霉素的LB培养基中,37 ℃,150 r/min摇床振荡培养12~16 h后分装并保存于-80 ℃,并取1 mL送Life公司测序。
1.2.3 表达条件优化取20 μL测序无误的细菌接种在含100 μg/mL氨苄青霉素和1%葡萄糖的LB培养基中,37 ℃,150 r/min摇床振荡培养12~16 h;4 ℃、4500 g离心5 min后,用含1 mmol/L异丙基硫代半乳糖苷(IPTG)的LB培养基重悬至A600 nm约为0.6~0.8;37 ℃,110 r/min摇床振荡诱导4 h;在诱导0、1、2、4 h分别取20 μL菌液进行SDS-PAGE电泳,并用考马斯亮蓝染色。将诱导4 h后的菌液在4 ℃、4500 g条件下离心5 min,收集沉淀。
1.2.4 包涵体变性与复性、纯化取37 ℃诱导4 h的菌液4℃、5000 g离心6 min收集沉淀,按1 g菌体加入2~5 mL非变性裂解液,混匀后按1: 100比例加入溶菌酶,4 ℃放置30 min(每5 min振摇1次);-80 ℃冻融2次,然后在冰上超声裂解5 min,超声裂解后4 ℃、12 000 g离心20 min收集沉淀,沉淀即为包涵体。
包涵体使用2%脱氧胆酸钠洗涤30 min,超纯水洗涤2次,然后用包涵体溶解液(8 mol/L尿素、50 mmol/L Tris·HCl,1 mmol/L EDTA,调pH至8.0)溶解沉淀2 h;按照表 1进行透析复性,并按照复性前后包涵体重量判断复性效率。
| 表 1 包涵体梯度尿素复性条件 Tab.1 Gradient urea renaturation condition of the inclusion body |
收集透析后的液体用His标签蛋白纯化试剂盒按照说明书进行亲和层析纯化。简述如下:用非变性裂解液平衡镍柱5次后,4 ℃上样,并收集穿流液,然后用1mL洗涤液洗柱5次并收集洗涤液,最后用0.5 mL洗脱液洗脱目的蛋白6~10次并收集洗脱液。收集获得的洗脱液即为纯化的白脂素样品,对纯化后的样品进行SDS-PAGE电泳初步判断其纯度。
1.2.5 表达蛋白鉴定与去除内毒素对亲和层析后收集的目的蛋白进行SDS-PAGE电泳,用考马斯亮蓝染色后计算蛋白纯度;使用白脂素抗体对纯化的目的蛋白通过蛋白免疫印迹法进行鉴定;用PBS透析收集经过亲和层析的重组白脂素,再用去内毒素试剂盒去除内毒素,最后检测重组白脂素内毒素范围,过滤后分装保存。
1.2.6 重组白脂素对C57小鼠血糖的影响雌性8周龄C57BL/6小鼠8只,适应性喂养后随机分为2组,每组4只小鼠。实验组按30 μg/只腹腔注射重组白脂素,对照组注射等量生理盐水。过夜禁食后,从尾部取血,用血糖测量仪检测注射前血糖;再分别从尾部取血检测腹腔注射重组白脂素后30、60、120 min的血糖。
1.2.7 Alamar Blue法检测重组白脂素对MIHA细胞活性的影响从细胞培养瓶中收集对数生长期的MIHA细胞接种于96孔板中,每孔细胞数1×105个;设置4组,每组5个复孔,1组为对照组,其他3组分别加入终浓度1、10、100 nmol/L的重组白脂素。96孔板在37 ℃、5% CO2细胞培养箱中培养过夜使细胞完全贴壁;更换为无糖培养基后处理组分别加入重组白脂素至终浓度为1、10、100 nmol/L,对照组不加白脂素,继续培养24 h后加入Alamar Blue孵育0.5 h用酶标仪检测各孔荧光值,并计算平均值;与对照组比较判断白脂素作用24 h对MIHA细胞活性的影响。
1.2.8 纯化的白脂素对MIHA肝细胞糖原的作用根据细胞生长和增殖情况,将对数生长期的细胞按每孔7.5×105细胞密度接种到六孔板中,37 ℃、5% CO2细胞培养箱中培养过夜至完全贴壁。分别设置对照组和实验组,更换为无糖培养基后,实验组分别加入1、10、100 nmol/L白脂素,对照组不加白脂素,继续培养24 h后用糖原提取液收集细胞,蒽酮法检测细胞糖原含量。
1.2.9 统计分析实验数据采用软件GraphPad Prism 6和Excel进行整理分析;用SPSS 23.0软件进行统计分析,两组之间比较用t检验,多组之间比较用单因素方差分析,P<0.05表明差异有统计学意义。
2 结果 2.1 pET-22b-asprosin质粒测序、His-Asprosin表达、包涵体复性及纯化条件质粒测序结果表明插入序列大小及阅读框架均正确。所获得的基因经SnapGene软件分析与设计的pET-22b-asprosin序列完全一致。原核表达载体pET- 22b-asprosin转化表达宿主菌E. coli BL21(DE3),分别在16、25和37 ℃条件下,用0.1、0.5、1 mmol/L IPTG诱导4、12、24 h,收集菌体超声破碎后发现各组重组白脂素均呈包涵体表达,对各反应条件比较后,选用IPTG终浓度1 mmol/L,37 ℃诱导4 h作为后续诱导表达条件。复性前后包涵体重量分别为23.3 mg和1.3 mg,据此判断,复性效率大于90%。进行镍柱亲和层析纯化时,用含不同浓度的咪唑洗脱液洗脱目的蛋白,当咪唑浓度为150 mmol/L时,目的蛋白的洗脱效果最好,洗脱后可以获得较高纯度的目的蛋白。
2.2 重组蛋白的验证将去除内毒素后的蛋白质过滤除菌后分装,蛋白定量后进行SDS-PAGE电泳,用考马斯亮蓝染色,结果如图 1A,计算蛋白质纯度大于95%。采用白脂素抗体对纯化的蛋白进行免疫印迹分析,结果条带位置与考马斯亮蓝染色后的一致(图 1B),说明纯化后的蛋白质为白脂素蛋白。经过纯化和去内毒素等步骤最后获得的蛋白质纯度大于95%,内毒素含量小于1 EU/mg,蛋白浓度为0.34 mg/mL,纯化产量约0.5 mg/g细菌,纯化的蛋白可以用于后续的细胞和动物实验。
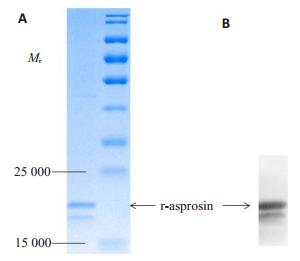
|
图 1 重组白脂素的鉴定 Fig.1 Identification of the recombinant asprosin. A: Identification of the relative molecular mass and purity of the recombinant asprosin by SDS-PAGE and Coomassie blue; B: Identification of the recombinant asprosin by Western blotting with anti-asprosin antibody. |
过夜禁食后,两组小鼠从尾部取血用血糖仪检测注射前血糖;实验组每只小鼠按30 μg腹腔注射重组白脂素,对照组注射等量生理盐水,分别检测注射后30、60、120 min血糖。结果显示与对照组相比,腹腔注射重组白脂素的小鼠血糖在注射后60 min升高达到峰值,在注射后120 min基本恢复到正常水平(图 2),且在注射后60 min和120 min,注射重组白脂素组小鼠血糖高于对照组,差异有统计学意义(P1=0.021,P2=0.03)。
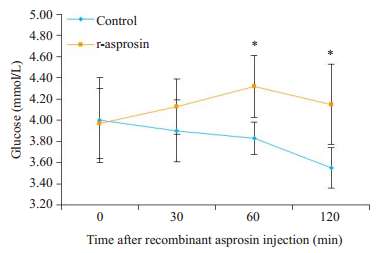
|
图 2 外源给予重组白脂素对C57小鼠血糖的影响 Fig.2 Effect of recombinant asprosin on blood glucose in C57 mice (n=4, *P < 0.05) vs control. |
用Alamar Blue法检测白脂素作用24 h后对MIHA细胞活性的影响,结果显示与对照组相比,1、10、100 nmol/L白脂素作用24 h对MIHA细胞活性均没有影响(图 3A)。
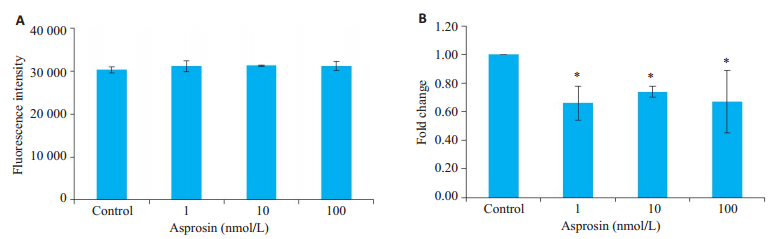
|
图 3 重组白脂素对MIHA细胞活性和糖原的影响 Fig.3 Effect of recombinant asprosin on viability and glycogen content in MIHA cells. A: Detection of MIHA cell viability by Alamar blue staining; B: Detection of glycogen content using anthrone sulfate. *P < 0.05 vs control. |
MIHA细胞更换为无糖培养基后,处理组分别加入1、10、100 nmol/L重组白脂素,对照组不加白脂素,在37 ℃、5% CO2环境下继续培养24 h后,用糖原提取液收集细胞,蒽酮法检测糖原含量。结果显示与对照组相比,加入白脂素刺激的组别糖原含量更低(图 3B),不同浓度白脂素组与对照组比较差异有统计学意义(P1=0.013,P2=0.036,P3=0.011),不同浓度白脂素组间差异无统计学意义(P>0.05)。
3 讨论研究发现,脂肪组织除了有储存脂肪的作用,其分泌的多种细胞因子和激素如脂联素、鸢尾素、瘦素等在人体的能量代谢、葡萄糖调控、食欲调节等生理过程中有重要的作用[13-15]。白脂素是白色脂肪组织分泌的蛋白质类激素之一,具有促进肝葡萄糖产生和刺激食欲的作用[1, 11, 16];可以通过免疫隔离的方式阻断白脂素对血糖和胰岛素的作用[1]。目前研究表明白脂素在2型糖尿病、多囊卵巢综合征、葡萄糖调节异常、肥胖、2型糖尿病合并非酒精性脂肪肝及冠心病患者血浆和血清中含量较正常人群高,而在肥胖儿童血浆中白脂素水平是降低的[5, 7-10, 17-18]。但关于白脂素发挥生理功能时具体作用机制尚不清楚,本实验通过建立白脂素原核表达系统,生产具有功能的重组白脂素蛋白,为白脂素作用机制研究及其临床应用提供依据。
本研究首次采用原核表达系统表达白脂素包涵体蛋白,并通过洗涤溶解和梯度尿素透析的方法使包涵体复性;同时利用SDS-PAGE、考马斯亮蓝染色、蛋白免疫印迹法验证了所表达的蛋白,且优化了表达和纯化的条件,获得纯度较高的重组蛋白。国内关于白脂素原核表达的研究表明,上清中可溶重组白脂素蛋白含量较低,本研究中采用的大肠杆菌原核表达系统表达包涵体的方法具有产量高、蛋白稳定、容易纯化的优点,在包涵体洗涤溶解和复性后可以得到大量的目的蛋白,能满足长期和大剂量实验研究[12, 20-22]。目前认为包涵体形成主要是由于外源蛋白在细胞内的高表达使得蛋白质合成速度过快,不能形成正确的折叠,以及缺少翻译后修饰、培养温度、pH等因素存在[20, 23-24]。通常需要经过洗涤溶解、复性的过程使无活性的重组蛋白正确折叠恢复活性[25-27]。本研究收获包涵体后,用脱氧胆酸钠溶液洗涤,经包涵体溶解液溶解,梯度尿素透析和非变性裂解液透析的方法使表达的包涵体成功复性,利用所表达的蛋白上的His标签结合到镍柱上而达到纯化的目的,最后获得纯度大于95%的目的蛋白。采用白脂素抗体对纯化的蛋白质进行蛋白免疫印迹后,条带位置与SDS-PAGE电泳、考马斯亮蓝染色后条带的位置相同,说明纯化得到的蛋白为白脂素。重组的白脂素蛋白纯度大于95%、内毒素含量低于1 EU/mg,可以用于进行下一步的体外细胞和在体动物实验[28],为进一步研究白脂素的生物学特性、功能等奠定基础。
为了验证重组白脂素的功能,过夜禁食的C57小鼠腹腔注射重组白脂素蛋白,在注射后60 min小鼠血糖升高至峰值,120 min恢复到正常水平,这与Romere等[1]的研究中重组白脂素对小鼠血糖影响趋势一致,说明本研究所表达与纯化的重组白脂素蛋白具有功能。利用有功能的重组白脂素刺激人MIHA肝细胞,初步探索白脂素的功能。首先采用Alamar Blue法[29-30]检测发现白脂素作用24 h对MIHA细胞活性没有影响;然后在无糖培养基情况下用重组白脂素处理MIHA肝细胞,与对照组比较发现加入白脂素组别的细胞糖原含量更低,说明在饥饿情况下重组白脂素具有降低糖原的作用。肝脏是体内物质代谢至关重要的脏器,在维持血糖稳定与代谢性疾病发生中有着举足轻重的地位。Li等[31]的研究表明白脂素在肝脏中可以通过激活嗅觉受体OLFR734耦连的G蛋白-cAMP-PKA信号通路上调糖异生相关基因从而诱导肝葡萄糖产生,但目前还没有关于白脂素调节糖原释放影响血糖具体作用机制的研究,白脂素与糖原合成分解及糖异生之间的关系还有待深入的研究。
本研究成功利用原核表达系统获得了重组白脂素蛋白,通过细胞和动物实验发现白脂素在饥饿状态下具有降低糖原、升高血糖的作用;国内研究表明白脂素具有抑制心功能损伤和抑制高糖环境下氧化应激介导的心肌细胞凋亡[12, 32],说明白脂素也与心血管疾病有重要关系。现有研究表明白脂素在多种代谢性相关疾病中有着重要的作用,通过对它功能和相关分子作用机制的进一步研究,白脂素有望成为治疗多种疾病的有效靶点。
| [1] |
Romere C, Duerrschmid C, Bournat J, et al. Asprosin, a FastingInduced glucogenic protein hormone[J]. Cell, 2016, 165(3): 566-79. DOI:10.1016/j.cell.2016.02.063 |
| [2] |
Jensen SA, Aspinall G, Handford PA. C-terminal propeptide is required for fibrillin-1 secretion and blocks premature assembly through linkage to domains cbEGF41- 43[J]. Proc Natl Acad Sci USA, 2014, 111(28): 10155-60. DOI:10.1073/pnas.1401697111 |
| [3] |
陈重九, 郑瑞茂. Asprosin——新发现的脂肪因子[J]. 生理科学进展, 2016, 47(5): 400. |
| [4] |
Greenhill C. Liver: asprosin-new hormone involved in hepatic glucose release[J]. Nat Rev Endocrinol, 2016, 12(6): 312. |
| [5] |
Ugur K, Aydin S. Saliva and blood asprosin hormone concentration associated with obesity[J]. Int J Endocrinol, 2019, 2521096. |
| [6] |
Li X, Liao M, Shen R, et al. Plasma asprosin levels are associated with glucose metabolism, lipid, and sex hormone profiles in females with metabolic-related diseases[J]. Mediators Inflamm, 2018, 7375294. |
| [7] |
Wang Y, Qu H, Xiong X, et al. Plasma asprosin concentrations are increased in individuals with glucose dysregulation and correlated with insulin resistance and First- Phase insulin secretion[J]. Mediators Inflamm, 2018, 9471583. |
| [8] |
Wang CY, Lin TA, Liu KH, et al. Serum asprosin levels and bariatric surgery outcomes in obese adults[J]. Int J Obes (Lond), 2019, 43(5): 1019-25. DOI:10.1038/s41366-018-0248-1 |
| [9] |
Zhang L, Chen C, Zhou N, et al. Circulating asprosin concentrations are increased in type 2 diabetes mellitus and independently associated with fasting glucose and triglyceride[J]. Clin Chim Acta, 2019, 489: 183-8. DOI:10.1016/j.cca.2017.10.034 |
| [10] |
Alan M, Gurlek B, Yilmaz A, et al. Asprosin: a novel peptide hormone related to insulin resistance in women with polycystic ovary syndrome[J]. Gynecol Endocrinol, 2019, 35(3): 220-3. DOI:10.1080/09513590.2018.1512967 |
| [11] |
Duerrschmid C, He Y, Wang C, et al. Asprosin is a centrally acting orexigenic hormone[J]. Nat Med, 2017, 23(12): 1444-53. DOI:10.1038/nm.4432 |
| [12] |
朱丽雯, 谭延振, 罗文平, 等. Asprosin的表达纯化及其对小鼠在体心脏功能的作用[J]. 中国实验动物学报, 2017, 25(4): 368-72, 379. DOI:10.3969/j.issn.1005-4847.2017.04.005 |
| [13] |
谷倩倩, 肖新华. Asprosin在代谢性疾病中的研究进展[J]. 中国现代医学杂志, 1-5. |
| [14] |
Kajimura S. Adipose tissue in 2016 advances in the understanding of adipose tissue biology[J]. Nat Rev Endocrinol, 2017, 13(2): 69-70. DOI:10.1038/nrendo.2016.211 |
| [15] |
Ouchi N, Parker JL, Lugus JJ, et al. Adipokines in inflammation and metabolic disease[J]. Nat Rev Immunol, 2011, 11(2): 85-97. DOI:10.1038/nri2921 |
| [16] |
Donma MM, Donma O. Asprosin: possible target in connection with ghrelin and cytokine network expression in the post-burn treatment[J]. Med Hypotheses, 2018, 118: 163-8. DOI:10.1016/j.mehy.2018.07.008 |
| [17] |
徐佰达, 叶挺, 王倩, 等. 血浆白脂素水平与冠心病的关系[J]. 心脏杂志, 2019, 31(4): 428-31. |
| [18] |
李昊翔, 徐梦娇, 袁婧, 等. 2型糖尿病合并非酒精性脂肪肝患者血清白脂素浓度变化及其影响因素[J]. 江苏大学学报:医学版, 2019, 29(1): 62-6. |
| [19] |
Long W, Xie X, Du C, et al. Decreased circulating levels of asprosin in obese children[J]. Horm Res Paediatr, 2019, 91(4): 271-7. DOI:10.1159/000500523 |
| [20] |
罗莉, 李坤, 王保成, 等. 包涵体变复性技术研究进展[J]. 中国医药生物技术, 2012, 7(4): 290-3. DOI:10.3969/cmba.j.issn.1673-713X.2012.04.008 |
| [21] |
Clark ED. Protein refolding for industrial processes[J]. Curr Opin Biotechnol, 2001, 12(2): 202-7. DOI:10.1016/S0958-1669(00)00200-7 |
| [22] |
Burgess RR. Refolding solubilized inclusion body proteins[J]. Meth. Enzymol, 2009, 463: 259-82. DOI:10.1016/S0076-6879(09)63017-2 |
| [23] |
Castellanos-Mendoza A, Castro-Acosta RM, Olvera A, et al. Influence of pH in the formation of inclusion bodies during production of recombinant sphingomyelinase-D in Escherichia coli[J]. Microb Cell Fact, 2014, 13: 137. DOI:10.1186/s12934-014-0137-9 |
| [24] |
Singh SM, Eshwari AN, Garg LC, et al. Isolation, solubilization, refolding, and chromatographic purification of human growth hormone from inclusion bodies of Escherichia coli cells: a case study[J]. Methods Mol Biol, 2005, 308: 163-76. |
| [25] |
Singh A, Upadhyay V, Panda AK. Solubilization and refolding of inclusion body proteins[J]. Methods Mol Biol, 2015, 1258: 283-91. |
| [26] |
Singh SM, Panda AK. Solubilization and refolding of bacterial inclusion body proteins[J]. J Biosci Bioeng, 2005, 99(4): 303-10. DOI:10.1263/jbb.99.303 |
| [27] |
Singh A, Upadhyay V, Upadhyay AK, et al. Protein recovery from inclusion bodies of Escherichia coli using mild solubilization process[J]. Microb Cell Fact, 2015, 14: 41. DOI:10.1186/s12934-015-0222-8 |
| [28] |
国家药典委员会. 中华人民共和国药典(第四部)[M]. 北京: 中国医药科技出版社, 2015.
|
| [29] |
杨阳, 刘宝瑞, 钱晓萍. Alamar Blue法用于体外培养细胞活性检测的方法研究[J]. 现代肿瘤医学, 2006, 14(1): 6-8. DOI:10.3969/j.issn.1672-4992.2006.01.003 |
| [30] |
李磊, 杨雨晗, 王双, 等. 细胞活性检测方法之比较[J]. 生物学杂志, 2011, 28(1): 87-90, 93. DOI:10.3969/j.issn.1008-9632.2011.01.087 |
| [31] |
Li E, Shan H, Chen L, et al. OLFR734 mediates glucose metabolism as a receptor of asprosin[J]. Cell Metab, 2019, 30(2): 319-328. DOI:10.1016/j.cmet.2019.05.022 |
| [32] |
冯健, 杜劲, 侯娟妮, 等. 白脂素对高糖导致的心肌细胞损伤保护作用的研究[J]. 中国糖尿病杂志, 2018, 26(9): 775-9. DOI:10.3969/j.issn.1006-6187.2018.09.013 |
 2020, Vol. 40
2020, Vol. 40

