2. 锦州医科大学第三医院妇科,辽宁 锦州 121000
2. Department of Gynecology, Third Affiliated Hospital, Jinzhou Medical University, Jinzhou 121000, China
microRNA(miRNA或miR)是21~23个核苷酸长的、高度保守的非编码小RNA分子,其主要功能是使基因沉默[1-2]。miRNA已经被提出其可作为诊断疾病和预后较好的生物学标志物,尤其是癌症[3-6]。miR-145在多种肿瘤中表达下调,并能够通过多种通路参与癌症的发生与发展[7-10],其在进化上高度保守,有研究表明miR-145在人子宫内膜癌(EC)组织中低表达,其在EC的发生与发展中起着重要作用[11]。双特异性磷酸酶6(DUSP6),也称为丝裂原活化蛋白激酶磷酸酶-3(MKP-3),是促分裂原活化蛋白激酶(MAPK)磷酸酶家族的成员,其特异性地灭活ERK家族的成员。研究表明,当DUSP6表达异常时就有可能导致EC的发生[12]。Zhang等[13]进一步证实过表达DUSP6促进人子宫内膜癌Ishikawa细胞生长和增殖,相反下调DUSP6抑制人子宫内膜癌Ishikawa细胞生长和增殖。然而,miR-145与DUSP6在EC中的关系国内外尚无此类研究。本研究旨在上调或下调miR-145-5p检测其对EC Ishikawa细胞增殖、侵袭和凋亡及其对细胞中DUSP6 mRNA和蛋白质的影响,为寻找防护和治疗EC提供新的潜在靶点。
1 材料和方法 1.1 材料和试剂人子宫内膜癌Ishikawa细胞系购买自南京凯基生物科技有限公司,miR-145-5p mimic、miR-145-5p mimic NC、miR-145-5p inhibitor、miR-145-5p inhibitor NC均来源于武汉金拓思生物科技有限公司,细胞培养液及胎牛血清购买自GIBCO,选取细胞对数生长期进行实验。转染试剂Lipo2000购买于Millipore。
1.2 实验方法 1.2.1 实验分组A组(未转染组)、B组(mimic NC组)、C组(mimic组)、D组(inhibitor NC组)、E组(inhibitor组)。采用Lipo 2000转染法进行转染,将处于对数生长期的Ishikawa细胞在转染前1 d重悬后接种到6孔板中,当6孔板中细胞覆盖率达到70%~80%时进行转染。Lipo2000试剂进行转染,A管:100 μL RPMI 1640不完全培养基加上Lipo2000试剂6 μL;B管:100 μL RPMI 1640不完全培养基加上mimic NC或mimic或inhibitor NC或inhibitor分别100 pmoL。将A管与B管混合后静置20 min。将6孔板中原完全培养基更换成RPMI 1640不完全培养基,把静置后的脂质体复合物缓缓加进6孔板中,八字混匀后置于37 ℃、5%CO2培养箱中培养,当转染后的细胞达到各检测时间后,回收细胞进行以下实验。
1.2.2 RNA提取和RT-PCR运用TRIzol提取转染48 h各组细胞的RNA, 紫外分光光度计NANO 2000测定各组样本中RNA的浓度,经逆转录后,运用ExicyclerTM 96荧光定量仪进行荧光定量分析。采用2-△ △ Ct法表示miR-145-5p较内参U6及靶基因(DUSP6)较内参U6的相对表达量。本实验每组样本每个检测指标进行4个复孔平行实验,实验数据的选取,是舍去误差较大的数值,取剩余数值的平均值作为最终实验保留数据以校正误差。
1.2.3 MTT法检测细胞增殖情况待各组细胞达到试验要求时,PBS清洗1次,将上清弃去,用0.25%胰酶对细胞进行消化,当细胞变圆后,用完全培养基终止其反应。将培养板内各处细胞吹打下来,将吹打下来的细胞混合液收集至15 mL试管,离心后将各组细胞收集起来,将收集后的细胞调整其计数并接种于96孔板中,每孔细胞量4×103,每组设置5个平行复孔;待各组细胞达检测时间后弃去培养基,更换为完全培养基,将96孔板中每孔加入20 μL MTT溶液,在细胞培养箱内继续培养4h,4 h后弃去上清,加入150 μLDMSO,摇床震荡15 min至紫色结晶完全溶解后在酶标仪上测定吸光值A570nm。
1.2.4 伤口愈合实验检测细胞迁移能力将各组细胞培养至融合状态,在实验前将培养基更换为无血清培养基并加入终浓度为1 μg/mL的丝裂霉素C处理1 h。将各组细胞用200 µL pipette tip划一条直线,形成无细胞生长范围(即划痕),用PBS清洗细胞表面3次,除去细胞碎片,显微镜下观察(100×)、拍照,运用Image pro plus软件测量各实验组迁移距离。
1.2.5 Transwell法检测细胞侵袭能力Matrigel胶4 ℃过夜解冻后,将其置于冰上放入超净工作台中,用无血清培养基将胶按1:3比例进行稀释,将Transwell小室置于24孔板中,将稀释好的Matrigel胶40 μL置于小室膜上,培养箱中培养2 h。收集各组培养48 h后的细胞,进行细胞计数。运用无血清培养基将细胞重悬,使细胞密度为1×105/mL,分别取各组200 μL细胞悬液加入小室内,底部加入含30% FBS的培养液800 μL。在37 ℃、5%CO2、饱和湿度的细胞培养箱中培养24 h。把小室内液体弃去,用棉签擦去小室底部内面细胞,用PBS将小室清洗2次。4%多聚甲醛室温下固定15 min,0.4%结晶紫染液染色5 min,蒸馏水冲洗。将侵袭至微孔膜下层的细胞运用倒置显微镜(200×)计数。随机选取每孔5个不重复的视野进行细胞计数,将此孔5个视野的均数作为该孔的侵袭细胞数。
1.2.6 流式细胞术检测细胞凋亡将已转染48 h的各组细胞收集,收集后90 g离心5 min后,弃去上清,PBS洗涤细胞2次,90 g离心5 min后收集细胞,加入500 μL Binding buffer轻轻重悬细胞,取100 μL细胞悬液加入5μL AnnexinV-FITC混匀后,加入10 μL Propidium Iodide混匀,在室温下避光孵育15 min,运用流式细胞仪检测细胞凋亡比例。
1.2.7 生物信息学方法预测miR-145-5p潜在靶基因运用生物学信息学在线软件miRTarBase、TargetScan、TargetMiner及miRDB预测miR-145-5p潜在靶基因,运用四个软件预测的靶基因绘制Venny图并取其交集靶基因。
1.2.8 Western blot检测DUSP6的表达水平将转染后48 h的各组细胞收集,运用细胞裂解液裂解细胞,4 ℃ 14 000 r/min离心10 min,取其上清蛋白液。应用BCA法进行蛋白质定量,经过电泳、转膜、封闭、孵一抗、孵二抗、ECL发光等步骤,将胶片进行扫描,用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的灰度值。灰度值=目的蛋白/β-actin。
1.3 统计学方法用统计软件SPSS 22.00进行统计学分析,本研究所有计量资料均采用均数±标准差表示,每组实验重复3~5次,对比方法主要为方差分析、LSD-t检验等,检验水准为α=0.05,P<0.05认为差异有统计学意义。
2 结果 2.1 转染后miR-145-5p及DUSP6 mRNA表达水平对比以A组为参照,C组成功构建了miR-145-5p过表达样本,E组成功的抑制了miR-145-5p表达,差异有统计学意义(P<0.05)。以A组为参照,RT-PCR检测在过表达miR-145-5p组中DUSP6表达降低,在miR-145-5p低表达组中DUSP6表达增高,差异有统计学意义(P<0.05,表 1)。
| 表 1 转染后各组miR-145-5P及DUSP6表达水平对比 Tab.1 Comparison of miR-145-5p and DUSP6 expression levels in each group after transfection (Mean±SD, n=3) |
转染后48、72、96 h,C组比B组细胞的增殖能力下降,E组比D组细胞的增殖能力增强,过表达miR-145-5p抑制细胞增殖,相反抑制miR-145-5p促进细胞增殖能力,差异有统计学意义(P<0.05,表 2)。
| 表 2 不同组别转染后不同时间点的细胞增殖水平对比 Tab.2 Comparison of cell proliferation at different time points after transfection among the groups (Mean±SD, n=3) |
伤口愈合实验24、48 h后,C组较A组及B组迁移能力下降,E组较A组及D组迁移能力增强,过表达miR-145-5p抑制细胞迁移,相反抑制miR-145-5p促进细胞迁移能力,差异有统计学意义(P<0.05,图 1)。
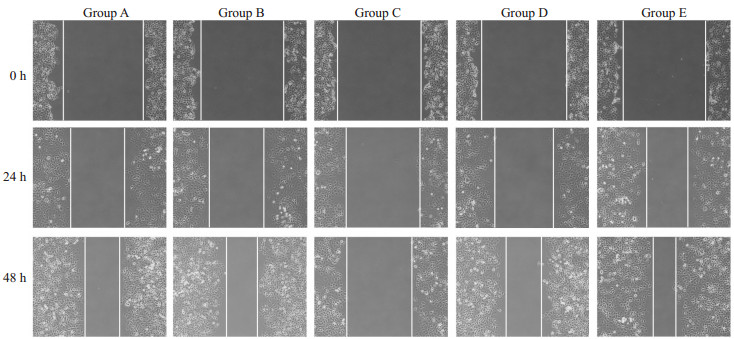
|
图 1 各组Ishikawa细胞迁移能力 Fig.1 Changes in migration ability of Ishikawa cells after transfection with miR-145- 5p mimic or inhibitor (Original magnification: ×100). Group A: Untransfected group; Group B: Mimic NC group; Group C: Mimic group; Group D: Inhibitor NC group; Group E: Inhibitor group. |
转染48 h后,C组比A组和B组细胞的侵袭能力下降(33.40±3.36 vs 85.80±8.89),E组比A组和D组细胞的侵袭能力增强(85.80±8.89 vs 85.80±8.89),过表达miR-145-5p抑制细胞侵袭,相反抑制miR-145-5p促进细胞侵袭能力,差异有统计学意义(P<0.05,图 2)。
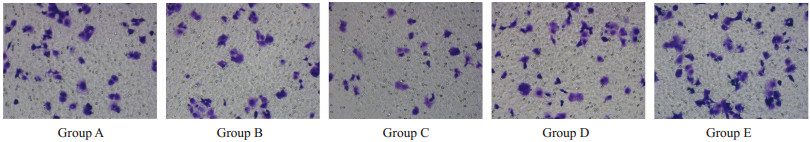
|
图 2 Transwell实验检测各组细胞侵袭能力 Fig.2 Transwell assay for assessing invasion ability of the cells after transfection with miR-145-5p mimic or inhibitor (×200). Group A: Untransfected group; Group B: Mimic NC group; Group C: Mimic group; Group D: Inhibitor NC group; Group E: Inhibitor group. |
转染48 h后,A组、B组、C组、D组、E组凋亡率分别为(0.66 ± 0.05)%、(0.60 ± 0.03)%、(17.74 ± 1.02)%、(0.72±0.04)%、(0.31±0.02)%,过表达miR-145-5p促进细胞凋亡,相反抑制miR-145-5p细胞凋亡下降,差异有统计学意义(P<0.05,图 3)。
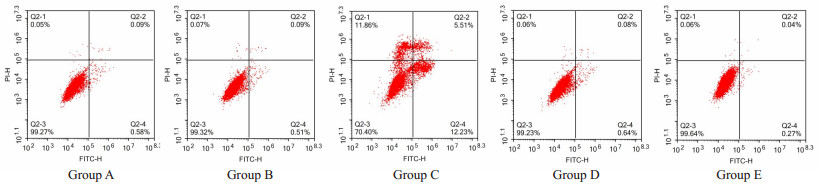
|
图 3 转染后各组凋亡水平对比 Fig.3 Changes in apoptosis of the cells after transfection with miR-145-5p mimic or inhibitor. Group A: Untransfected group; Group B : Mimic NC group; Group C: Mimic group; Group D: Inhibitor NC group; Group E: Inhibitor group. |
miR-145-5p在miRTar base、Target scan、Target miner及miRDB四个在线软件中分别存在15064、890、1305、495个潜在靶基因,经过绘制Venny图并取其交集共有100个潜在的靶基因,DUSP6为其中之一(图 4)。
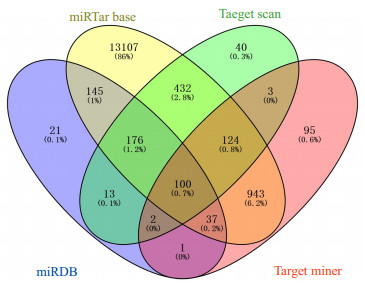
|
图 4 Venny图 Fig.4 Venny diagram. |
转染48 h后,DUSP6蛋白在A组、B组、C组、D组、E组中的相对表达水平分别为0.29±0.03、0.28±0.04、0.16±0.03、0.32±0.05、0.74±0.05,miR-145-5p与DUSP6表达呈负向相关关系,差异有统计学意义(P<0.05,图 5)。
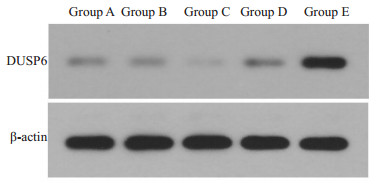
|
图 5 转染后各组细胞蛋白表达水平对比 Fig.5 Comparison of protein expression levels in each group after transfection. Group A: Untransfected group; Group B: Mimic NC group; Group C: Mimic group; Group D: Inhibitor NC group; Group E: Inhibitor group. |
迄今为止,EC患者通常接受的是手术治疗[14]。低分化、复发或转移性癌症的主要治疗方法为放疗和化疗, 然而,虽然放疗和化疗会破坏癌细胞,但正常细胞会发生附带损害,这种情况对临床医生构成了挑战。高通量基因组学的发展可能会提供更详细的疾病分子特征及其异质性,旨在促进靶向治疗和个性化治疗[15]。其中,基因治疗在临床癌症研究中越来越普遍,基因治疗可以有效改善患有各种遗传和获得性疾病患者的健康,以pDNA,mRNA和非编码RNA为主的核酸治疗正在迅速进入临床实践研究[16]。基因治疗有以下几个优点,包括对晚期癌症转移的高选择性和有效性,使其成为治疗晚期癌症患者具有前景性的治疗策略,并可能替代手术,放疗和化疗[17]。本研究选取世界癌症前沿治疗手段-基因靶向治疗中的mRNA进行研究。
本研究转染后检测显示,C组miR-145-5p的表达水平明显高于B组,E组miR-145-5p的表达式平明显较D组低,表明本研究成功地构建了miR-145-5p过表达和抑制表达的细胞模型。越来越多的研究表明miRNA在生理过程中起着重要作用,包括细胞分化,增殖,转移,侵袭,凋亡和血管生成[18-22]。研究证实,EC中有多种miRNA表达异常,此结果提示miRNA在EC的发生发展中发挥重要作用[23-25]。miRNA模拟物的导入能够模拟体内的内源性miRNA,构建miRNA过表达的模型;而miRNA inhibitor是可以与miRNA完全互补的反义寡核苷酸序列,转染后能够抑制miRNA的功能。
本研究显示过表达miR-145-5p抑制了Ishikawa细胞的增殖、迁移与侵袭能力,并促进了细胞凋亡;相反将miR-145-5p抑制后促进了Ishikawa细胞的增殖、迁移与侵袭能力,并抑制了细胞凋亡。成熟miRNA是通过与靶mRNA的3'UTR的互补结合来调节基因表达,此种调节作用将导致靶mRNA降解或蛋白质翻译抑制,从而细胞功能将发生变化[26]。miR-145可以与多种靶基因结合,从而调控靶基因的表达,进而对癌细胞的迁移、增殖、侵袭、凋亡等生物学行为进行调控:例如过表达miR-145-5p可以下调CD44蛋白表达,从而能够抑制胃癌细胞增殖与迁移,并促进凋亡[27];在食管鳞状细胞癌中PLCE1是miR-145的直接靶标,并且两者表达呈负相关,且其过表达能够抑制食管鳞状细胞癌的增殖与迁移,靶基因PLCE1过表达可以部分逆转miR-145的抑制作用[28];在宫颈癌中FSCN1是miR-145的靶标,miR-145过表达可以抑制HeLa细胞的增殖,沉默FSCN1与过表达miR-145同样可以出现与抑制宫颈癌细胞增殖相似的效应[29]。
在国内外研究中,本研究首次证明过表达miR-145-5p能够抑制DUSP6 mRNA及蛋白质的表达,相反抑制miR-145-5p的表达能够促进DUSP6 mRNA及蛋白质的表达,两者之间存在负向相关关系。EC的发生与发展是由于外部因素(环境因素)和内部因素(遗传变异)决定的,但其具体机制仍尚不清楚。DUSP6与细胞外信号调节激酶1/2(ERK1/2)特异性相互作用,对哺乳动物细胞MAPK途径中起负反馈调节作用,迄今为止,已有研究表明DUSP6在多种肿瘤中出现异常高表达,并能够促进肿瘤增殖与抑制凋亡[30]。有研究表明DUSP6可以通过调节ERK活性参与其对化疗药物的敏感性[31]。本研究也有一定的缺陷,首先虽然是体外成功地建立了miR-145-5p过表达模型,并证明了miR-145-5p能够抑制EC细胞增殖、侵袭与促进凋亡,但仍需通过体内及临床实验进一步证实,其次miR-145-5p靶向调控DUSP6的机制有待进一步探索。
综上所述,miR-145-5p过表达能够抑制子宫内膜癌增殖、迁移、侵袭并促进癌细胞凋亡,其具体机制可能是通过miR-145-5p负向调控DUSP6的表达而实现。在国内外研究中,该研究首次鉴证了在EC Ishikawa细胞中微小RNA-145-5p能够沉默DUSP6基因的表达,并抑制Ishikawa细胞增殖、迁移、侵袭和促进凋亡,两者存在潜在的靶向性关系,并为临床防治EC的发生与发展奠定了实验基础。
| [1] |
Bracken CP, Scott HS, Goodall GJ. A network-biology perspective of microRNA function and dysfunction in cancer[J]. Nat Rev Genet, 2016, 17(12): 719-32. DOI:10.1038/nrg.2016.134 |
| [2] |
Zhi Y, Pan J, Shen W, et al. Ginkgolide B inhibits human bladder cancer cell migration and invasion through MicroRNA-223-3p[J]. Cell Physiol Biochem, 2016, 39(5): 1787-94. DOI:10.1159/000447878 |
| [3] |
Wen M, Kwon Y, Wang Y, et al. Elevated expression of UBE2T exhibits oncogenic properties in human prostate cancer[J]. Oncotarget, 2015, 6(28): 25226-39. |
| [4] |
Yu H, Xiang P, Pan Q, et al. Ubiquitin-conjugating enzyme E2T is an Independent prognostic factor and promotes gastric cancer progression[J]. Tumour Biol, 2016, 37(9): 11723-32. DOI:10.1007/s13277-016-5020-3 |
| [5] |
Xiang W, Han L, Mo G, et al. MicroRNA-96 is a potential tumor repressor by inhibiting NPTX2 in renal cell carcinoma[J]. J Cell Biochem, 2020, 121(2): 1504-13. DOI:10.1002/jcb.29385 |
| [6] |
Pan M, Li M, You C, et al. Inhibition of breast Cancer growth via miR-7 suppressing ALDH1A3 activity concomitant with decreasing breast cancer stem cell subpopulation[J]. J Cell Physiol, 2020, 235(2): 1405-16. DOI:10.1002/jcp.29059 |
| [7] |
Du Y, Li J, Xu T, et al. MicroRNA-145 induces apoptosis of glioma cells by targeting BNIP3 and Notch signaling[J]. Oncotarget, 2017, 8(37): 61510-27. |
| [8] |
Shen SN, Li K, Liu Y, et al. Down-regulation of long noncoding RNA PVT1 inhibits esophageal carcinoma cell migration and invasion and promotes cell apoptosis via microRNA-145-mediated inhibition of FSCN1[J]. Mol Oncol, 2019, 13(12): 2554-73. DOI:10.1002/1878-0261.12555 |
| [9] |
Sathyanarayanan A, Chandrasekaran KS, Karunagaran D. microRNA-145 downregulates SIP1-expression but differentially regulates proliferation, migration, invasion and Wnt signaling in SW480 and SW620 cells[J]. J Cell Biochem, 2018, 119(2): 2022-35. DOI:10.1002/jcb.26365 |
| [10] |
Wang RK, Shao XM, Yang JP, et al. MicroRNA-145 inhibits proliferation and promotes apoptosis of HepG2 cells by targeting ROCK1 through the ROCK1/NF-kappa B signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2019, 23(7): 2777-85. |
| [11] |
Chang L, Yuan Z, Shi H, et al. miR-145 targets the SOX11 3'UTR to suppress endometrial cancer growth[J]. Am J Cancer Res, 2017, 7(11): 2305-17. |
| [12] |
Chiappinelli KB, Rimel BJ, Massad LS, et al. Infrequent methylation of the DUSP6 phosphatase in endometrial cancer[J]. Gynecol Oncol, 2010, 119(1): 146-50. |
| [13] |
Zhang H, Guo Q, Wang C, et al. Dual-specificity phosphatase 6 (Dusp6), a negative regulator of FGF2/ERK1/2 signaling, enhances 17β-estradiol-induced cell growth in endometrial adenocarcinoma cell[J]. Mol Cell Endocrinol, 2013, 376(1/2): 60-9. |
| [14] |
Shalowitz DI, Epstein AJ, Buckingham L, et al. Survival implications of time to surgical treatment of endometrial cancers[J]. Am J Obstet Gynecol, 2017, 216(3): 268.e1-268.e18. DOI:10.1016/j.ajog.2016.11.1050 |
| [15] |
Bendifallah S, Ballester M, Darai E. Endometrial cancer: Predictive models and clinical impact[J]. Bull Cancer, 2017, 104(12): 1022-31. |
| [16] |
Matsui M, Corey DR. Non-coding RNAs as drug targets[J]. Nat Rev Drug Discov, 2017, 16(3): 167-79. |
| [17] |
Wirth T, Parker N, Yla-Herttuala S. History of gene therapy[J]. Gene, 2013, 525(2): 162-9. DOI:10.1016/j.gene.2013.03.137 |
| [18] |
Liang Z, Chi YJ, Lin GQ, et al. MiRNA-26a promotes angiogenesis in a rat model of cerebral infarction via PI3K/AKT and MAPK/ERK pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(11): 3485-92. |
| [19] |
Sun G, Liu M, Han H. Overexpression of microRNA-190 inhibits migration, invasion, epithelial- mesenchymal transition, and angiogenesis through suppression of protein kinase B-extracellular signal-regulated kinase signaling pathway via binding to stanniocalicin 2 in breast cancer[J]. J Cell Physiol, 2019, 234(10): 17824-38. |
| [20] |
Zhu J, Zhu DQ, Zhang Y, et al. MicroRNA-363 inhibits angiogenesis, proliferation, invasion, and migration of renal cell carcinoma via inactivation of the Janus tyrosine kinases 2-signal transducers and activators of transcription 3 axis by suppressing growth hormone receptor gene[J]. J Cell Physiol, 2019, 234(3): 2581-92. DOI:10.1002/jcp.27020 |
| [21] |
Xie X, Dai J, Huang X, et al. MicroRNA-145 inhibits proliferation and induces apoptosis in human prostate carcinoma by upregulating long non-coding RNAGAS5[J]. Oncol Lett, 2019, 18(2): 1043-8. |
| [22] |
Gao F, Wu H, Wang R, et al. MicroRNA-485-5p suppresses the proliferation, migration and invasion of small cell lung cancer cells by targeting flotillin-2[J]. Bioengineered, 2019, 10(1): 1-12. |
| [23] |
Jayaraman M, Radhakrishnan R, Mathews CA, et al. Identification of novel diagnostic and prognostic miRNA signatures in endometrial cancer[J]. Genes Cancer, 2017, 8(5/6): 566-76. |
| [24] |
Van Sinderen M, Griffiths M, Menkhorst E, et al. Restoration of microRNA-29c in type I endometrioid cancer reduced endometrial cancer cell growth[J]. Oncol Lett, 2019, 18(3): 2684-93. |
| [25] |
Wang Q, Zhu W. MicroRNA-873 inhibits the proliferation and invasion of endometrial cancer cells by directly targeting hepatomaderived growth factor[J]. Exp Ther Med, 2019, 18(2): 1291-8. |
| [26] |
Zhang L, Yang MZ, Mayer T, et al. Use of MicroRNA biomarkers to distinguish enchondroma from low-grade chondrosarcoma[J]. Connect Tissue Res, 2017, 58(2): 155-61. DOI:10.1080/03008207.2016.1197212 |
| [27] |
Jian JF, Ze ng, Xiao XQ, et al. Micro RNA-145 exerts tumorsuppressive and chemoresistance lowering effects by targeting CD44 in gastric cancer[J]. World J Gastroenterol, 2017, 23(13): 2337-45. |
| [28] |
Tang C, He JY, Yu C, et al. MicroRNA-145 performs as a tumor suppressor in human esophageal squamous cell carcinoma by targeting phospholipase C epsilon 1[J]. J Cell Biochem, 2019, 120(6): 10678-87. DOI:10.1002/jcb.28358 |
| [29] |
Ma L, Li LL. miR-145 contributes to the progression of cervical carcinoma by directly regulating FSCN1[J]. Cell Transplant, 2019, 28(9/10): 1299-305. |
| [30] |
Ahmad MK, Abdollah NA, Shafie NH, et al. Dual-specificity phosphatase 6 (DUSP6): a review of its molecular characteristics and clinical relevance in cancer[J]. Cancer Biol Med, 2018, 15(1): 14-28. DOI:10.20892/j.issn.2095-3941.2017.0107 |
| [31] |
Chan DW, Liu VW, Tsao GS, et al. Loss of MKP3 mediated by oxidative stress enhances tumorigenicity and chemoresistance of ovarian cancer cells[J]. Carcinogenesis, 2008, 29(9): 1742-50. DOI:10.1093/carcin/bgn167 |
 2020, Vol. 40
2020, Vol. 40

