2. 上海交通大学医学院附属新华医院口腔科,上海 200092;
3. 口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心,四川 成都 610041;
4. 四川大学华西 口腔医学院,四川 成都 610041;
5. 四川省医学科学院·四川省人民医院口腔科,四川 成都 610072;
6. 电子科技 大学附属医学院,四川 成都 610054
2. Department of Stomatology, Xinhua Hospital Affiliated To Shanghai Jiaotong University, Shanghai 200092, China;
3. State Key Laboratory of Oral Diseases and National Clinical Research Center for Oral Diseases, Chengdu 610041, China;
4. West China School of Stomatology, Sichuan University, Chengdu 610041, China;
5. Department of Stomatology, Sichuan Academy of Medical Science and Sichuan Provincial People's Hospital, Chengdu 610072, China;
6. School of Medicine, University of Electronic Science and Technology, Chengdu 610054, China
牙周炎是糖尿病的并发症,糖尿病患者患重度牙周炎的风险比普通人群高8.53倍,血糖控制水平与牙龈炎症程度和牙周破坏程度相关[1-2]。目前国际共识认为两者之间的联系集中在炎症信号通路上,主要有炎症因子IL-1、TNF-α、IL-6,NF-κB配体,toll样受体(TLR 2/4),AGEs-RAGE的结合等[3]。高迁移率族蛋白B1(HMGB1)是一种重要的晚期炎症介质,也是晚期糖基化终产物受体(RAGE)的重要配体,近几年发现与牙周炎相关[4-5]。HMGB1-RAGE结合会激活转录因子NF-κB,引发促炎因子TNF-α等的进一步释放,体外实验发现牙周韧带细胞和破骨细胞都存在有HMGB1/RAGE信号轴[6],但其和糖尿病伴发牙周炎的关系研究还处于空白中。肝脏是重要的免疫器官,也是重要的糖代谢器官,在炎症和代谢紊乱中扮演了重要的调控作用[7-8]。因此,本研究同时讨论了HMGB1-RAGE在糖尿病牙周组织炎症中的存在性,以及和肝脏脂代谢之间的关系。
1 材料和方法 1.1 材料和仪器牙龈卟啉单胞菌W83(口腔疾病研究国家重点实验室),高脂饲料(斯莱克),链脲佐菌素(STZ, Sigma),GTVisionⅢ抗鼠/兔通用型免疫组化检测试剂盒(基因科技),兔单克隆抗体RAGE抗体和兔单克隆抗体HMGB1抗体(Abcam),兔多克隆抗体TNF-α抗体(Bioworld),BX53显微镜及照相系统(Olympus),罗氏活力®血糖仪。
1.2 实验方法 1.2.1 实验动物及分组4~6周龄清洁级雄性Sprague-Dawley(SD)大鼠100只,分为4组:(1)空白对照组(NC组);(2)糖尿病组(DM组);(3)牙周炎组(CP组);(4)糖尿病+牙周炎组(DM+CP组),每组25只,于四川大学华西医学实验动物中心清洁级环境饲养。
1.2.2 牙周炎大鼠模型建立以及上颌骨标本采集饲养第7周,禁食12 h,7%水合氯醛(0.5 mL/100 g)腹腔注射麻醉,4-0不可吸收丝线结扎右上颌第二磨牙牙颈部。术后口内滴注P.gingivalisW83(×109 CFU/mL)活菌悬液0.1 mL(每周3次),共结扎6周,诱导实验性牙周炎。第13周,处死取右侧上颌骨组织样本。
1.2.3 糖尿病大鼠模型建立以及血清标本采集高脂饮食喂养4周后,禁食12 h,腹腔1次性注射1% STZ(25 mg/kg),pH4.2~4.6,术后2 d采用4%低渗葡萄糖水,后改为普通食水喂养。每周检测随机血糖进行并记录体质量,随机血糖大于13.9mmol/L即认为达标。注射1周后血糖不达标的大鼠,再次腹腔注射1% STZ(25 mg/kg),1周后再不达标者弃用。第13周,右心室负压取血,静置30 min后离心,吸取上层血清,分装,-80℃保存备用。
1.2.4 牙周炎模型的组织学检测带牙龈及软组织的上颌骨样本去除丝线,于4 ℃的多聚甲醛固定48 h,10% EDTA常温脱钙,冲洗、脱水、透明、浸蜡后包埋,切片,脱蜡、脱水后苏木精-伊红(HE)染色,免疫组化染色,光学显微镜进行组织学观察。
1.2.5 外周血血清中IL-10、IL-17、TGF-β的检测取分装好的血清样本,冰盒保存送至四川省人民医院检验科,全自动生化仪光谱法检测血清脂代谢相关指标低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)和肝损伤血清生化指标谷丙转氨酶(ALT)。
1.2.6 图片采集处理BX53显微镜及照相系统(Olympus)统一曝光时间和亮度,随机选取400倍高倍镜下的5个视野进行拍摄。Image J1.51软件处理图片,统一图片背景,阈值,计算出每个视野面积中阳性表达面积所占的百分比(%Area),取平均值作为此标本的免疫组化染色阳性表达数值。
1.2.7 统计学处理方法应用SPSS 20.0软件对数据进行统计学分析,实验统计数据用均数±标准差表示,实验数据先做正态检验和方差齐性检验,两项检验合格,组间比较用单因素方差分析,进一步两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠牙周炎模型建立NC组、DM组未见明显牙周组织破坏,CP组及DM+CP组牙龈上皮炎性增生,有明显的炎细胞浸润,结合上皮根向增殖,牙槽骨破坏吸收(图 1)。
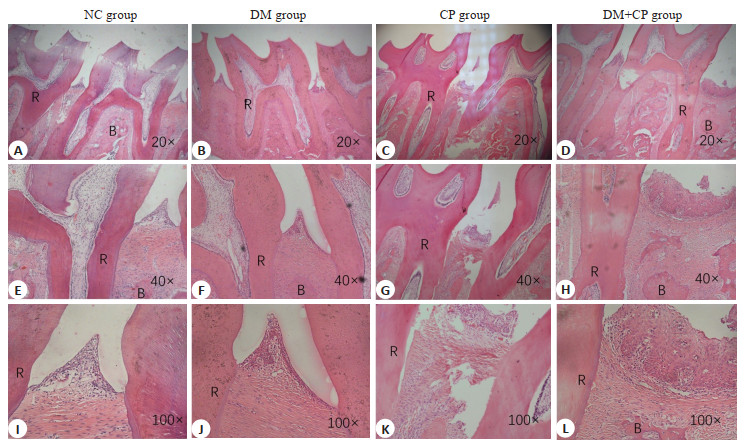
|
图 1 牙周组织切片HE染色 Fig.1 HE staining of the periodontal tissue in different groups. R: Root; B: Bone. |
DM组、DM+CP组术后第3周随机血糖全部超过阈值13.9 mmol/L,后续的4、5、6周随机血糖稳定维持在13.9 mmol/L以上(图 2A)。NC组大鼠体质量随时间增加,而DM组、DM+CP组大鼠体质量均逐渐降低(图 2B)。
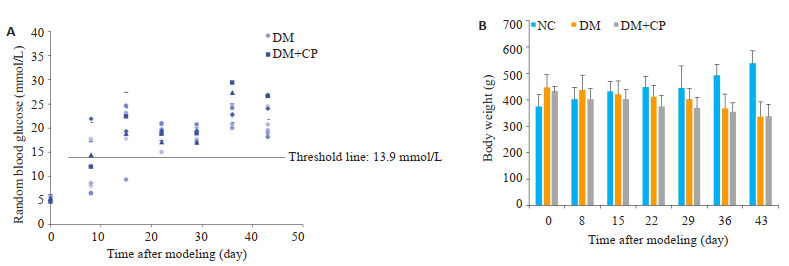
|
图 2 大鼠血糖和体质量变化 Fig.2 Blood glucose and body weight changes of the rats in control group (NC), diabetes group (DM), and diabetes and periodontitis group (DM+CP). A: Scatter plot of random blood glucose changes before and after modeling in diabetic rats (n=5); B: Histogram of body weight changes in each group. |
400倍光镜下4组大鼠牙周组织HMGB1、RAGE、TNF-α免疫组化染色显示:NC组HMGB1,RAGE,TNF-α 3个指标均着色很浅,少见阳性细胞;DM组未感染P. gingivalis,HMGB1仍有广泛的阳性表达,染色主要集中在胞核,HMGB1阳性细胞比较均匀地分布在牙周组织的各个部位,同样,RAGE也可见广泛的胞膜棕染,但TNF-α阳性表达不明显;CP组HMGB1在胞核、胞浆以及胞外都可见明显的棕染,RAGE未见明显胞膜棕染,TNF-α阳性表达明显;DM+CP组3个指标的阳性表达都高于其他组,HMGB1在胞核、胞浆以及胞外都可见明显的棕染,RAGE可见广泛的胞膜棕染,与DM组类似,TNF-α阳性表达最明显,牙龈染色最深,根方的牙周膜染色稍浅。
4组HMGB1、RAGE、TNF-α免疫组化染色阳性表达面积百分比(%Area)可见:DM组HMGB1、RAGE阳性表达面积百分比显著性高于NC组(P < 0.05),但TNF-α表达和NC组表达无差异(P>0.05);CP组HMGB1和TNF-α的阳性表达面积显著性高于NC组(P < 0.05),而RAGE的阳性表达面积与NC组没有显著性差异(P>0.05),且显著低于DM组及DM+CP组(P < 0.05)DM+CP组HMGB1、RAGE、TNF-α三个指标阳性表达面积百分比均显著高于NC组(P < 0.05),其中TNF-α阳性表达面积最高,对比NC组、DM组及CP组都有统计学差异(图 4,P < 0.05)。
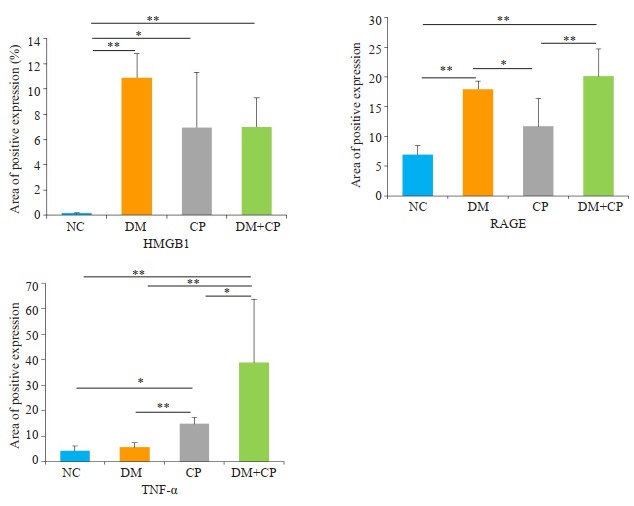
|
图 4 大鼠牙周组织中HMGB1,RAGE,TNF-α免疫组化染色平均阳性面积比率 Fig.4 Comparison of the areas with positive immunohistochemical staining of HMGB1, RAGE, and TNF-α in periodontal tissues. *P < 0.05, **P < 0.01. |
CP,DM+CP组中,分别出现多项脂代谢及肝损伤指标异常。DM组高密度脂蛋白胆固醇HDL-C、谷丙转氨酶ALT、甘油三酯TG和总胆固醇TC均显著高于空白对照组(P < 0.05)。CP组谷丙转氨酶ALT显著性高于对照组,而DM+CP组在高密度脂蛋白胆固醇HDL-C、谷丙转氨酶ALT和总胆固醇TC两项数据上显著高于空白对照组(图 5,P < 0.05)。
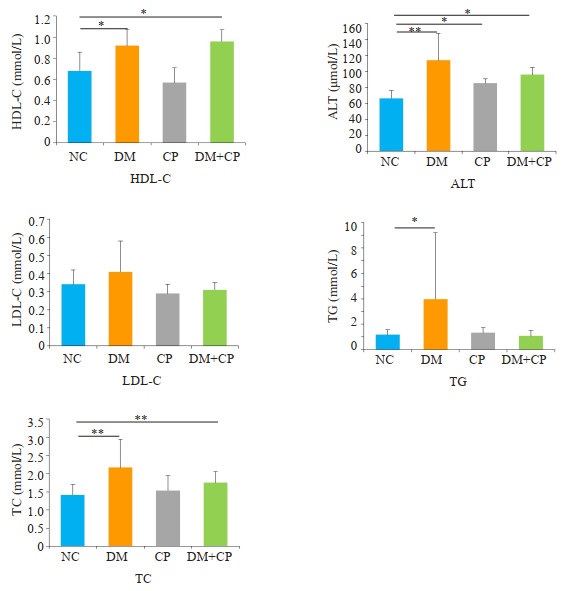
|
图 5 大鼠脂代谢相关血清生化指标HDL-C、LDL-C、TC、TG和肝损伤血清指标ALT浓度 Fig.5 Comparison of the biochemical indicators among the 4 groups. *P < 0.05, **P < 0.01. |
腹腔注射STZ是建立动物糖尿病模型的常规方法,注射剂量不一(27.5~75 mg/kg),注射方式也分一次性腹腔注射和小剂量连续多次腹腔注射[9-10]。文献中多用一次性腹腔注射STZ(45~65 mg/kg)[10],也有用高脂饮食诱导+一次性小剂量STZ腹腔注射(27.5~35 mg/kg)建模成功的例子[11]。结合文献,我们选用高脂饮食诱导4周+一次性小剂量STZ腹腔注射(25 mg/kg)建立大鼠糖尿病模型。
大鼠糖尿病建模成功的标准不一,主要有3类标准:空腹血糖≥11.1 mmol/L,血糖≥13.9 mmol/L(250 mg/dL),血糖≥16.7 mmol/L(300 mg/dL)[10]。根据临床糖尿病的诊断标准,有高血糖症状(多饮、多尿、多食,体质量减少)和随机血糖检测≥11.1 mmol/L即可诊断为糖尿病[12]。结合临床诊断标准和文献,本实验大鼠腹腔注射STZ术后1周,大部分大鼠随机血糖已经超过阈值13.9 mmol/L,第3周至实验结束,大鼠随机血糖全部高于13.9 mmol/L,并且出现多饮多尿症状,体重减轻,糖尿病建模成功。
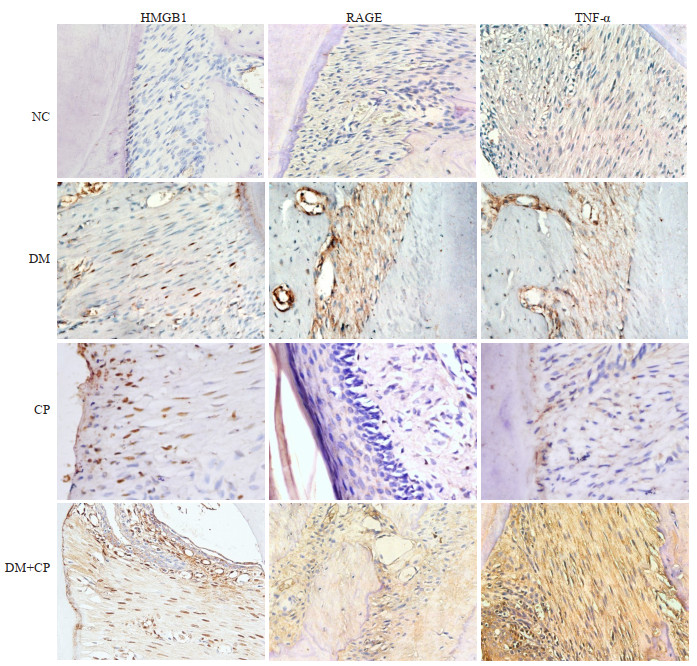
|
图 3 大鼠牙周组织中HMGB1、RAGE、TNF-α的表达 Fig.3 Expression of HMGB1, RAGE, and TNF-α in periodontal tissues in the 4 groups (Original magnification: ×400). |
高糖状态导致末端糖化产物AGEs在牙周组织中的累积,导致局部RAGE表达上调,激活下游NF-κB信号通路,引起局部TNF-α等细胞因子的表达升高,导致结缔组织破坏和骨吸收,加重牙周炎症进程[13-14]。本实验中所有糖尿病大鼠牙周组织均高表达RAGE,对照组大鼠及牙周炎大鼠牙周组织中则几乎不表达,且DM组、DM+CP组组间RAGE阳性表达面积没有明显差异,说明RAGE表达主要和糖尿病相关,本研究中没有发现牙周炎促进RAGE表达的证据,与临床研究结果一致。如Aemaimanan等[15]检测2型糖尿病伴发牙周炎患者牙龈组织中RAGE的分布显著高于慢性牙周炎患者。俞宁等[16]发现RAGE的基因多态性在2型糖尿病伴慢性牙周炎、单纯慢性牙周炎、健康对照人群中分布无差异,RAGE基因并非2型糖尿病以及慢性牙周炎的易感基因。本实验数据也提示牙周组织中RAGE表达水平的高低,主要与血糖相关,与牙周炎症没有显著联系。糖尿病状态下牙周组织RAGE表达上升,就可能激活下游的NF-κB炎症信号通路,提示RAGE可能参与糖尿病患者牙周炎症的发生发展过程[17]。
HMGB1是重要的晚期炎症介质,在维持炎症反应中起重要作用[18-19]。HMGB1和牙周炎相关,Nogueira等[5]在体外用LPS和IL-1刺激牙周韧带细胞,检测到HMGB1 mRNA和HMGB1表达量的显著性升高。大鼠牙周炎模型中,牙周组织中HMGB1的表达和牙周破坏程度正相关。Xie等[20]在临床实验中检测了慢性牙周炎、广泛性侵袭性牙周炎、种植体周围炎患者的龈沟液和牙龈组织,发现HMGB1高表达,说明HMGB1在牙周组织中的表达受牙周炎症影响。本研究发现DM组、DM+CP组和CP组牙周组织中HMGB1均高表达,说明单纯的牙周局部炎症,单纯的高血糖状态以及高血糖复合牙周炎的状态,均会导致牙周组织表达HMGB1。
在CP组中,我们发现HMGB1表达的显著性升高,TNF-α的表达也显著性升高,同时不伴有RAGE表达的显著性升高。推测在单纯牙周炎状态下,HMGB1的升高可能并没有激活RAGE的表达。回顾文献可以发现,在炎症刺激下,HMGB1释放到胞外,其主要受体为(1)HMGB1与RAGE的结合;(2)与TLR-2,TLR-4结合,激活下游信号通路,介导慢性炎症发生[21-22],推测CP组HMGB1升高,可能是通过激活TLR-2,TLR-4介导TNF-α表达,该结果尚需进一步证实。
本研究发现糖尿病伴发牙周炎的大鼠牙周组织中HMGB1、RAGE的表达最高,牙周破坏最重,TNF-α表达最高,提示HMGB1/RAGE信号轴是糖尿病伴发牙周炎的重要炎症通路中的一环。同时,糖尿病大鼠的牙周组织中也检测到了HMGB1、RAGE的高表达,但是HE染色在光镜下未观察到明显病理性变化,TNF-α表达也类似健康对照。推测其原因为糖尿病大鼠牙周组织中HMGB1-RAGE表达升高后,使炎症信号更容易被放大,导致糖尿病状态下对牙周炎易感,但没有局部菌斑刺激,并没有出现明显炎症反应。
流行病学调查显示,牙周炎和糖尿病,肝脏疾病都相关,肝脏是重要的糖代谢器官,也是重要的免疫器官,在炎症和代谢紊乱中扮演了重要的调控作用[25-26]。我们猜测在牙周炎状态下,肝脏可能参与到糖尿病与牙周炎的双向关系中。糖代谢紊乱常伴有血脂代谢的异常,脂代谢相关指标HDL-C、LDL-C、TC、TG,是机体代谢紊乱的指标,与糖尿病前期状态密切相关[21-22],结合肝损伤血清生化指标ALT,可以观察肝脏的功能变化。课题组前期实验和本次研究在牙周炎及P.gingivalis多次尾静脉注射的刺激下,暂时未发现大鼠肝脏炎症性病理改变[27],在该状态下,DM,CP及DM+CP各组均已出现HDL-C、LDL-C、TC、TG、ALT等多项肝脏代谢指标异常。其中能反映肝细胞损伤程度及坏死情况的ALT在3组中均出现显著性表达异常,说明在高血糖、牙周炎及高血糖复合牙周炎状态时,即使未见肝脏明显炎症性变化,肝脏功能仍出现一定程度损伤。目前有大量研究显示,ALT水平升高与糖代谢异常具有而一定相关性[28],也是全身炎症活化和氧化应激增加的独立标志物[29]。在本研究中,在DM及DM+CP组中均发现ALT表达升高,说明在高血糖状态肝脏出现功能损伤。在CP组中,ALT也有异常高表达,分析其原因,可能为牙周炎状态导致的全身慢性炎症状态引起,其具体机制仍需进一步研究。
本实验通过分析大鼠牙周组织中HMGB1,RAGE,TNF-α的表达,结合HE染色结果和血清HDL-C、LDL-C、TC、TG、ALT浓度,发现牙周局部炎症和糖尿病均可导致牙周组织HMGB1的高表达,进而介导炎症发生,而RAGE的表达仅与糖尿病相关。HMGB1和RAGE共同参与了糖尿病大鼠的牙周炎症进程,并可能是造成糖尿病对牙周炎易感的因素之一。在牙周炎和高血糖的状态下,肝脏功能也出现一定程度的损伤,其机制尚需进一步研究。
| [1] |
Ni J, Chen L, Zhong S, et al. Influence of periodontitis and scaling and root planing on insulin resistance and hepatic CD36 in obese rats[J]. J Periodontol, 2018, 89(4): 476-85. DOI:10.1002/JPER.17-0115 |
| [2] |
Abhijit, N, Gurav. Management of diabolical diabetes mellitus and periodontitis nexus:Are we doing enough?[J]. World J Diabetes, 2016, 7(4): 50-66. DOI:10.4239/wjd.v7.i4.50 |
| [3] |
Sanz M, Ceriello A, Buysschaert M, et al. Scientific evidence on the links between periodontal diseases and diabetes:consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International diabetes federation and the european federation of periodontology[J]. J Clin Periodontol, 2018, 45(2): 138-49. DOI:10.1016/j.diabres.2017.12.001 |
| [4] |
Borgnakke WS, Ylöstalo PV, Taylor GW, et al. Effect of periodontal disease on diabetes:systematic review of epidemiologic observational evidence[J]. J Clin Periodontol, 2013, 40: S135-52. DOI:10.1902/jop.2013.1340013 |
| [5] |
Nogueira AV, de Souza JA, de Molon RS, et al. HMGB1 localization during experimental periodontitis[J]. Mediators Inflamm, 2014, 816320. DOI:10.1155/2014/816320 |
| [6] |
Liu J, Li R, Liu T, et al. High mobility group box 1 protein level as a novel biomarker for the development of peri-implant disease[J]. Sci Rep, 2017, 7(1): 7027. DOI:10.1038/s41598-017-06937-y |
| [7] |
Alazawi W, Bernabe E, Tai D, et al. Periodontitis is associated with significant hepatic fibrosis in patients with non-alcoholic fatty liver disease[J]. PLoS One, 2017, 12(12): e0185902. DOI:10.1371/journal.pone.0185902 |
| [8] |
Han P, Sun D, Yang J. Interaction between periodontitis and liver diseases[J]. Biomed Rep, 2016, 5(3): 267-76. |
| [9] |
Sanz M, Ceriello A, Buysschaert M, et al. Scientific evidence on the links between periodontal diseases and diabetes:consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the international diabetes federation and the european federation of periodontology[J]. J Clin Periodontol, 2018, 45(2): 138-49. DOI:10.1016/j.diabres.2017.12.001 |
| [10] |
Almani SA, Memon IA, Shaikh TZ, et al. Berberine protects against metformin-associated lactic acidosis in induced diabetes mellitus[J]. Iran J Basic Med Sci, 2017, 20(5): 511-5. DOI:10.22038/ijbms.2017.8675 |
| [11] |
于德民, 吴锐, 尹潍, 等. 实验性链脲佐菌素糖尿病动物模型的研究[J]. 中国糖尿病杂志, 1995, 3(2): 105-9. |
| [12] |
Cefalu WT, Berg EG, Saraco M, et al. Classification and diagnosis of diabetes:standards of medical care in diabetes-2019[J]. Diabetes Care, 2019, 42(1): S13-28. DOI:10.2337/dc19-S002 |
| [13] |
Hiroshima Y, Sakamoto E, Yoshida K, et al. Advanced glycation end-products and porphyromonas gingivalis lipopolysaccharide increase calprotectin expression in human gingival epithelial cells[J]. J Cell Biochem, 2018, 119(2): 1591-603. DOI:10.1002/jcb.26319 |
| [14] |
Park YJ, Lee HK. The role of skin and orogenital microbiota in protective immunity and chronic immune-mediated inflammatory disease[J]. Front Immunol, 2017, 8(8): 1955. DOI:10.3389/fimmu.2017.01955 |
| [15] |
Aemaimanan P, Sattayasai N, Wara-Aswapati N, et al. Alanine aminopeptidase and dipeptidyl peptidase Ⅳ in saliva of chronic periodontitis patients[J]. J Periodontol, 2009, 80(11): 1809-14. |
| [16] |
俞宁, 孙尚敏, 刘博, 等. RAGE基因多态性与2型糖尿病伴慢性牙周炎遗传易感性的相关研究[J]. 口腔医学, 2018, 38(1): 33-8. DOI:10.7666/d.y1893003 |
| [17] |
Su SC, Hung YJ, Huang CL, et al. Cilostazol inhibits hyperglucoseinduced vascular smooth muscle cell dysfunction by modulating the RAGE/ERK/NF-κB signaling pathways[J]. J Biomed Sci, 2019, 26(1): 68. |
| [18] |
Yang H, Hreggvidsdottir HS, Palmblad K, et al. A critical cysteine is required for HMGB1 binding to Toll-like receptor 4 and activation of macrophage cytokine release[J]. Proc Natl Acad Sci USA, 2010, 107(26): 11942-7. DOI:10.1073/pnas.1003893107 |
| [19] |
Koh WU, Kim J, Lee J, et al. Remote ischemic preconditioning and diazoxide protect from hepatic ischemic reperfusion injury by inhibiting HMGB1-Induced TLR4/MyD88/NF-κB signaling[J]. Int J Mol Sci, 2019, 20(23): pii:E5899. |
| [20] |
Luo L, Xie P, Gong P, et al. Expression of HMGB1 and HMGN2 in gingival tissues, GCF and PICF of periodontitis patients and periimplantitis[J]. Arch Oral Biol, 2011, 56(10): 1106-11. DOI:10.1590/s1517-83822011000300047 |
| [21] |
Musumeci D, Roviello GN, Montesarchio D. An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1-related pathologies[J]. Pharmacol Ther, 2014, 141(3): 347-57. DOI:10.1016/j.pharmthera.2013.11.001 |
| [22] |
Liu Y, Zhuang GB, Zhou XZ. HMBG1 as a driver of inflammatory and immune processes in the pathogenesis of ocular diseases[J]. J Ophthalmol, 2018, 5195290. DOI:10.1155/2018/5195290 |
| [23] |
Fan YB, Xiong W, Li JJ, et al. Mechanism of TangGanJian on nonalcoholic fatty liver disease with type 2 diabetes mellitus[J]. Pharm Biol, 2018, 56(1): 567-72. DOI:10.1080/13880209.2018.1504972 |
| [24] |
Bellan M, Colletta C, Barbaglia MN, et al. Severity of nonalcoholic fatty liver disease in type 2 diabetes mellitus:relationship between nongenetic factors and PNPLA3/HSD17B13 polymorphisms[J]. Diabetes Metab J, 2019, 43(5): 700-10. |
| [25] |
Blasco-Baquev B, Garidou L, Pomié C, et al. Periodontitis induced by Porphyromonasgingivalis drives periodontal microbiota dysbiosis and insulin resistance via an impaired adaptive immune response[J]. Gut, 2017, 66(5): 872-8522. DOI:10.1136/gutjnl-2015-309897 |
| [26] |
Younossi ZM, Henry L. The impact of obesity and type 2 diabetes on chronic liver disease[J]. Am J Gastroenterol, 2019, 114(11): 1714-5. |
| [27] |
杜芹, 孟姝, 裴心佛. 高血糖状态下牙龈卟啉单胞菌对大鼠肝脏的影响[J]. 成都医学院学报, 2019, 14(01): 40-3. |
| [28] |
Dimzova M, Kondova-Topuzovska I, Bosilkovski M, et al. Noninvasive biomarkers in assessment of liver fibrosis in patients with HBeAg negative chronic hepatitis B[J]. Open Access Maced J Med Sci, 2018, 6(6): 1052-8. DOI:10.3889/oamjms.2018.122 |
| [29] |
Gao F, Pan JM, Hou XH, et al. Liver enzymes concentrations are closely related to pre-diabetes:findings of the Shanghai diabetes study Ⅱ (SHDS Ⅱ)[J]. Biomed Environ Sci, 2012, 25(1): 30-7. DOI:10.3967/0895-3988.2012.01.005 |
 2020, Vol. 40
2020, Vol. 40

