2. 南方医科大学中医药学院,广东 广州 510515
2. School of Traditional Medical University, Southern Medical University, Guangzhou 510515, China
肌醇1, 4, 5-三磷酸受体2型(Itpr2)是内质网上的钙离子通道受体,掌控内质网中钙离子的释放,主要在大脑中的星形胶质细胞中表达,对星形胶质细胞在脑中的正常功能的维持,如星形胶质细胞向胞外释放ATP等起着重要作用[1-3]。先前已有抑郁症相关的研究将Itpr2-/-小鼠作为实验对象,发现该小鼠会出现明显抑郁样行为,并且进一步揭示这是由于Itpr2缺失导致的胞内钙离子水平下降,从而使星形胶质细胞向胞外释放ATP减少导致的[4]。Tanaka等[5]报道Itpr2-/-小鼠与社会隔离造模小鼠的海马CA1区电位变化相同,且Itpr2-/-小鼠的右侧海马CA1区的局部电位幅度下降,这与抑郁行为之间存在关系。
海马作为边缘系统的重要成员之一,在抑郁症研究中被广泛关注[6-8]。已有研究利用结构磁共振扫描抑郁症患者大脑并进行分析,发现抑郁症患者存在海马体积的减小[9],Schoenfeld等[10]以大鼠为实验对象进行抑郁症造模,利用磁共振扫描发现造模大鼠海马体积减小,且海马切片染色显示腹侧海马神经再生能力下降。同时在抑郁症患者中,静息功能磁共振扫描表明海马与大脑其它部位的功能连接会发生改变,如前额叶、杏仁核等[11-12]。
三维动脉自旋标记(3D-ASL)成像是一种可检测组织血流灌注量的无创成像技术[13]。有研究报道在重度抑郁症患者中,3D-ASL扫描显示双侧额中回及右侧额上回的血流灌注减少[14],此外在抑郁症伴双相情感障碍的患者中,3D-ASL扫描显示小脑左侧齿状核的血流灌注减少,而在单相抑郁患者中,双侧小脑脚和左侧齿状核血流灌注量下降[15]。
目前在以Itpr2-/-小鼠为对象的抑郁症研究中,主要是从细胞分子层面探究机制,在神经影像方面还十分欠缺[16]。3D-ASL是目前可以无创性显示脑区组织活动水平的有效指标[17-18],本文将从神经影像方面入手,利用3D-ASL技术对Itpr2-/-小鼠的海马中间层面血流灌注量进行检测,揭示Itpr2-/-小鼠海马区血流灌注量及神经元活动水平的改变。
1 材料和方法 1.1 实验动物Itpr2-/- C57BL/6小鼠及野生型C57BL/6小鼠均由上海南方模式生物科技股份有限公司繁育。饲养于南方医科大学南方医院动物中心,实验动物合格证编号:SYXK(粤)2015-0056,所有动物实验过程均符合中国及南方医院关于实验动物健康及福利的制度。试验前动物适应饲养环境1周,遵循昼夜节律,环境安静,室温25 ℃,动物自由饮食饮水。
1.2 动物行为学测试 1.2.1 糖水偏爱测试将实验组Itpr2-/- C57BL/6小鼠(n=28)及对照组野生型C57BL/6小鼠(n=20)分笼饲养,每笼放置两个水瓶,1瓶装1%蔗糖溶液,另1瓶装纯水。每12 h换1次瓶子位置。之后,动物先禁水禁食12 h,再放置事先称过重量的两瓶水:1%蔗糖溶液和纯水,再使小鼠自由饮水1 h。结束后称取饮水瓶的重量计算消耗量,按公式计算小鼠糖水的偏好百分比:小鼠糖水偏好百分比(%)=糖水消耗量(g)/总液体消耗量(糖水消耗量(g)+纯水消耗量(g)×100%。
1.2.2 悬尾实验本实验参考Stem建立的实验模型,对所有实验组Itpr2-/- C57BL/6小鼠(n=28)及对照组野生型C57BL/6小鼠(n=20)进行测试。把1块医用胶布粘在老鼠尾巴末端,将胶布挂在夹子上,使小鼠倒悬在离地60 cm的地方。记录小鼠6 min内的行为表现,并计算开始后4 min小鼠静止不动的总时间。只有当小鼠放弃挣扎并保持静止时,才认为小鼠静止不动[19]。
1.2.3 强迫游泳实验该试验是按照Porsolt等[20]描述的方法进行的,实验对象为所有实验组Itpr2-/- C57BL/6小鼠(n=28)及对照组野生型C57BL/6小鼠(n=20)。把小鼠放入1个装水的圆柱形透明容器中(直径10 cm;高度:25 cm),水深15 cm,水温保持在25 ℃。记录小鼠在6min内的行为表现,并计算这段时间小鼠静止不动的总时间,以小鼠漂浮于水面、四肢停止挣扎为不动的判定标准,记录开始后4 min的不动时间。
1.2.4 旷场实验对所有实验组Itpr2-/- C57BL/6小鼠(n=28)及16只对照组野生型C57BL/6小鼠(其余4只野生型C57BL/6小鼠由于实验条件受限未参与实验)进行测试。旷场实验的盒子为正方形盒子,尺寸如下:高度,35 cm;长度,60 cm;宽度为60 cm,分为4个象限,每个象限分为36个等边象限。实验是在1间安静的实验室里,在60 W的灯光下进行的。每只小鼠置于方盒中央,录像记录5 min内小鼠的活动情况。计算小鼠中心区域停留时间和边缘区域停留时间。每只小鼠测试前用75%的乙醇擦拭。运动检测软件(EthoVision 7.0; Noldus, Wageningen,荷兰)被用来记录每只老鼠的运动轨迹和停留时间。
1.3 小动物磁共振扫描 1.3.1 磁共振图像获取从实验组Itpr2-/- C57BL/6小鼠中随机选取15只及对照组野生型C57BL/6小鼠中随机选取14只进行磁共振成像扫描。设备采用南方医科大学中心实验室7.0 T小动物磁共振扫描仪(PharmScan, Bruker)。扫描前将小鼠放入麻醉诱导盒,5%异氟烷及氧气0.8 L/min进行麻醉,小鼠眼睑对光反应迟钝、脚趾收缩反应丧失后移至无菌垫单进行气管插管,之后立即转移至扫描床并连接呼吸机。呼吸频率对脑部血流量存在影响,监控呼吸频率保持在60次/min左右以维持实验对象脑血流的稳定及ASL扫描时的准确性,给予3%异氟烷及氧气0.8 L/min维持麻醉,将37 ℃的加热垫放置于小鼠腹部进行保温。连接呼吸门控,并用医用胶布固定小鼠,待小鼠状态稳定后进行扫描。首先采集3D-T2WI结构像作为解剖参照:采用Turbo RARE序列,参数包括:重复时间(TR)=1800 ms,回波时间(TE)=45 ms,翻转角=90°,矩阵大小=256×256,体素大小=0.078 mm×0.078 mm×0.512 mm,32层,层厚/间隔=0.512/0 mm。3D-ASL扫描采用FAIR RARE序列,参照结构像将扫描层面置于海马所在层面,扫描参数包括:重复时间(TR)=10 224 ms,回波时间(TE)=79 ms,共采用16个翻转恢复时间(T1=35,100,200,300,400,500,600,700,800,900,1000,1200,1300,1400,1600),每个T1时间下分别采集选择性和非选择性翻转图像(共32幅图像)视野(FOV)=20 mm×20 mm,矩阵大小=128×128。
1.3.2 海马区域CBF值测量及分析利用ParaVision软件(Bruker Biospin,Ettlingen, Germany),对所获得的ASL原始图像进行处理,生成CBF图像,利用ITK-SNAP将生成的海马中间层面的CBF图像与该层面的T2结构像相配准,图像配准后,调节CBF图像透明度使CBF图像所在层面的结构像显现,并根据所匹配的结构像勾画出海马中间层面的海马区域,并计算此区域的平均CBF值,将本实验所得CBF值与既往文献比较,分析是否存在较大误差[21-22]。所有小鼠的海马脑区勾画由1名研究人员在不知小鼠分组情况下完成,最终对2组小鼠所勾画的海马区域的体素数进行统计比较,分析对2组小鼠所勾画的海马区域范围大小是否存在差异。
1.4 统计学方法使用SPSS 20.0统计软件包进行数据分析,采用两独立样本t检验比较两组之间数据差异,P<0.05为差异有统计学意义。
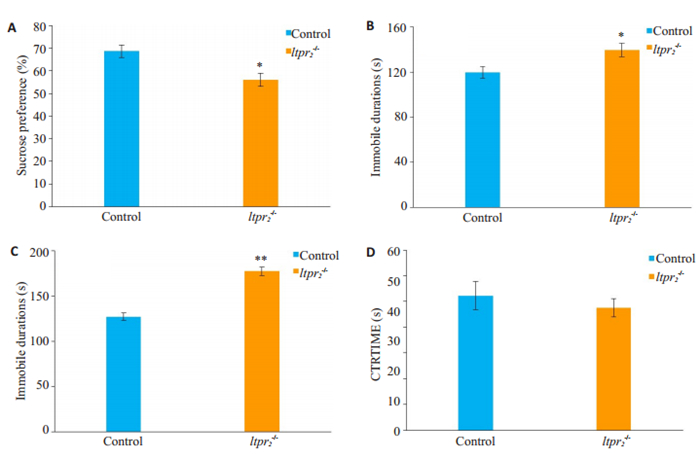
2 结果 2.1 Itpr2缺失小鼠具有抑郁倾向在糖水偏爱测试中,与对照组相比,Itpr2-/-小鼠的蔗糖偏好率减低(P<0.05,图 1A);在悬尾实验中,Itpr2-/-小鼠的不动总时间明显大于对照组(P<0.05,图 1B);在强迫游泳实验中,相较于对照组小鼠,Itpr2-/-小鼠的不动总时间明显延长(P<0.01,图 1C);而在旷场实验中,对照组和实验组小鼠的中心停留时间百分比差异没有统计学意义(P>0.05,图 1D)。
|
图 1 行为学测试结果(A)蔗糖偏爱实验(B)悬尾实验(C)强迫游泳实验(D)旷场实验 Fig.1 Behavioral tests of Itpr2-/- mice and the wild-type mice (control). A: Sucrose preference test; B: Immobile time in tail suspension test; C: Immobile time in forced swimming test; D: Time spent in the center in open field test. Data are expressed as Mean±SD. *P < 0.05, **P < 0.01 vs control group. |
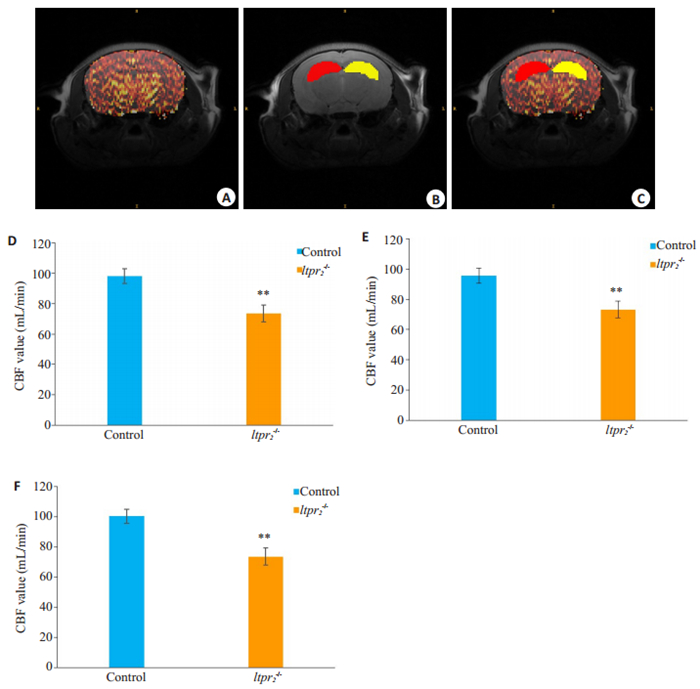
对两组小鼠的海马区CBF值进行统计分析发现,与正常对照组野生型小鼠相比,Itpr2-/-小鼠左、右侧海马的平均CBF值显著下降(其中实验组Itpr2-/-小鼠及正常对照组小鼠的左侧海马CBF分别为73.30 ± 5.61和95.77 ± 5.10,右侧海马CBF分别为73.53 ± 5.70和100.50±4.70,双侧海马最终计算所得分别为73.42±5.61和98.12±4.75),即实验组Itpr2-/-小鼠的左右侧海马血流灌注量降低,且有统计学意义(P<0.01,图 2)。
|
图 2 海马区域CBF值测量结果 Fig.2 Cerebral blood flow (CBF) in the hippocampus of the mice. A: CBF maps matching the structural images of the corresponding layers of the hippocampus; B, C: Hippocampal areas delineated according to the structural image and the CBF values were measured. The red area represents the left hippocampus and the yellow area represents the right hippocampus. D-F: Comparison of the CBF values in the bilateral, left and right hippocampus between the two groups, respectively, **P < 0.01 vs control. |
本研究以Itpr2-/-小鼠为实验对象,首先对实验组和对照组的小鼠进行了行为学测试,与对照组相比,Itpr2-/-小鼠的糖水偏爱百分比下降、强迫游泳实验以及悬尾试验中的不动时间增加,且变化具有统计学差异,说明Itpr2-/-小鼠不仅出现了快感缺失,还出现了行为方面的抑郁,这与之前的文献报道相符合[4],表明了Itpr2的缺失与抑郁症的发病相关。在旷场实验中,与野生型C57BL/6小鼠相比,Itpr2-/-小鼠的中心停留时间百分比略有下降,但不具有统计学意义,这跟之前的文献报道一致[4],考虑到旷场实验中的中心停留时间主要是对小鼠的焦虑情绪及探索行为进行测试,表明Itpr2-/-小鼠并未出现明显的焦虑情绪及探索意向的丧失。
Itpr2主要在脑中的星形胶质细胞中表达,涉及细胞中钙离子水平的变化,对星形胶质细胞的正常功能起着重要作用[23-25],星形胶质细胞的异常是抑郁症主要的发病机制之一[26-27]。正常生理条件下,当脑区中神经元活动水平上升时,会向胞外分泌神经因子。这些神经因子会作用于星形胶质细胞,促其胞内钙离子水平上升,从而分泌花生四烯酸的血管活性代谢物,促进血管扩张,导致血流灌注量增加[28]。Itpr2作为内质网钙库上的钙离子通道,它的缺失会导致星形胶质细胞内钙离子水平的下降[29],已有研究利用多普勒血流仪发现在同样的电流刺激下,Itpr2-/-小鼠的大脑皮层血流灌注量异常减低[30]。
目前关于Itpr2-/-小鼠的抑郁倾向发生机制的研究还未涉及血流灌注量的改变,本研究利用了3D-ASL技术对海马中间层面进行扫描,对海马区域的血流灌注量进行检测。与既往的研究中的激光多普勒技术相比,3D-ASL具有无创、准确及对实验对象干扰较小的优点[31-33]。结果显示与对照组相比,Itpr2-/-小鼠对应层面的海马区域的血流灌注量下降。脑区血流灌注量的多少会影响该区域神经元的活动水平[34],因此根据该结果可以推测Itpr2-/-小鼠海马的神经元活动水平下降,提示海马血流灌注量下降引起的神经元活动水平下降可能是Itpr2-/-小鼠发生抑郁倾向的机制之一,本研究与先前的研究相比,从海马血流灌注量的角度补充了Itpr2-/-小鼠抑郁倾向发生的潜在机制。
综上所述,探究Itpr2缺失相关的行为学变化以及通过3D-ASL技术探究Itpr2-/-小鼠海马脑组织血流灌注量的潜在改变,将有利于进一步研究Itpr2相关的抑郁行为发生机制。考虑到参与抑郁症发病的机制复杂,本研究目前仅关注在海马的中间层面上,还未对大脑中其它脑区进行探究,今后仍需深入研究以明确机制。
| [1] |
Shigetomi E, Patel S, Khakh BS. Probing the complexities of astrocyte calcium signaling[J]. Trends Cell Biol, 2016, 26(4): 300-12. DOI:10.1016/j.tcb.2016.01.003 |
| [2] |
Li H, Xie Y, Zhang N, et al. Disruption of IP(3)R2-mediated Ca(2) (+) signaling pathway in astrocytes ameliorates neuronal death and brain damage while reducing behavioral deficits after focal ischemic stroke[J]. Cell Calcium, 2015, 58(6): 565-76. DOI:10.1016/j.ceca.2015.09.004 |
| [3] |
Wang Q, Jie W, Liu J H, et al. An astroglial basis of major depressive disorder? An overview[J]. Glia, 2017, 65(8): 1227-50. DOI:10.1002/glia.23143 |
| [4] |
Cao X, Li LP, Wang Q, et al. Astrocyte-derived ATP modulates depressive-like behaviors[J]. Nat. Med, 2013, 19(6): 773-7. DOI:10.1038/nm.3162 |
| [5] |
Tanaka M, Wang X, Mikoshiba K, et al. Rearing-environmentdependent hippocampal local field potential differences in wild-type and inositol trisphosphate receptor type 2 knockout mice[J]. J Physiol, 2017, 595(20): 6557-68. DOI:10.1113/JP274573 |
| [6] |
Videbech P, Ravnkilde B. Hippocampal volume and depression: a meta-analysis of MRI studies[J]. Am J Psychiatry, 2004, 161(11): 1957-66. DOI:10.1176/appi.ajp.161.11.1957 |
| [7] |
Campbell S, Marriott M, Nahmias C, et al. Lower hippocampal volume in patients suffering from depression: a meta-analysis[J]. Am J Psychiatry, 2004, 161(4): 598-607. DOI:10.1176/appi.ajp.161.4.598 |
| [8] |
Sahay A, Hen R. Adult hippocampal neurogenesis in depression[J]. Nat Neurosci, 2007, 10(9): 1110-5. DOI:10.1038/nn1969 |
| [9] |
Chan SW, Harmer CJ, Norbury R, et al. Hippocampal volume in vulnerability and resilience to depression[J]. J Affect Disord, 2016, 189: 199-202. DOI:10.1016/j.jad.2015.09.021 |
| [10] |
Schoenfeld TJ, Mccausland HC, Morris HD, et al. Stress and loss of adult neurogenesis differentially reduce hippocampal volume[J]. Biol Psychiatry, 2017, 82(12): 914-23. DOI:10.1016/j.biopsych.2017.05.013 |
| [11] |
Maren S, Hobin JA. Hippocampal regulation of context-dependent neuronal activity in the lateral amygdala[J]. Learn Mem, 2007, 14(4): 318-24. DOI:10.1101/lm.477007 |
| [12] |
Liu K, Zhao X, Lu X, et al. Effect of selective serotonin reuptake inhibitor on prefrontal-striatal connectivity is dependent on the level of TNF-alpha in patients with major depressive disorder[J]. Psychol Med, 2018, 1-9. DOI:10.1017/S0033291718003586 |
| [13] |
Tan H, Maldjian JA, Pollock JM, et al. A fast, effective filtering method for improving clinical pulsed arterial spin labeling MRI[J]. J Magn Reson Imaging, 2009, 29(5): 1134-9. DOI:10.1002/jmri.21721 |
| [14] |
Fu C, Shi D, Gao Y, et al. Functional assessment of prefrontal lobes in patients with major depression disorder using a dual-mode technique of 3D-arterial spin labeling and (18)F-fluorodeoxyglucose positron emission tomography/computed tomography[J]. Exp Ther Med, 2017, 14(2): 1058-64. DOI:10.3892/etm.2017.4594 |
| [15] |
Zhao L, Wang Y, Jia Y, et al. Cerebellar microstructural abnormalities in bipolar depression and unipolar depression: A diffusion kurtosis and perfusion imaging study[J]. J Affect Disord, 2016, 195: 21-31. DOI:10.1016/j.jad.2016.01.042 |
| [16] |
Shi Y, Yuan Y, Xu Z, et al. Genetic variation in the calcium/ calmodulin-dependent protein kinase (CaMK) pathway is associated with antidepressant response in females[J]. J Affect Disord, 2012, 136(3): 558-66. DOI:10.1016/j.jad.2011.10.030 |
| [17] |
Hoge RD, Pike GB. Oxidative metabolism and the detection of neuronal activation via imaging[J]. J Chem Neuroanat, 2001, 22(1-2): 43-52. DOI:10.1016/S0891-0618(01)00114-4 |
| [18] |
Lauritzen M. Relationship of spikes, synaptic activity, and local changes of cerebral blood flow[J]. J Cereb Blood Flow Metab, 2001, 21(12): 1367-83. DOI:10.1097/00004647-200112000-00001 |
| [19] |
Steru L, Chermat R, Thierry B, et al. The tail suspension test: a new method for screening antidepressants in mice[J]. Psychopharmacology, 1985, 85(3): 367-70. DOI:10.1007/BF00428203 |
| [20] |
Porsolt R D, Le Pichon M, Jalfre M. Depression: a new animal model sensitive to antidepressant treatments[J]. Nature, 1977, 266(5604): 730-2. DOI:10.1038/266730a0 |
| [21] |
Huang C, Gu Y, Chen J, et al. A wearable fiberless optical sensor for continuous monitoring of cerebral blood flow in mice[J]. IEEE J Sel Top Quant, 2019, 25(1): 1-8. |
| [22] |
丁宁, 姜婧, 卢梦晗, 等. 通督启神"针法对SAMP8小鼠海马脑血流量的影响及其作用机制研究[J]. 中华中医药杂志, 2019, 34(11): 5116-22. |
| [23] |
Sofroniew MV, Vinters HV. Astrocytes: biology and pathology[J]. Acta Neuropathol, 2010, 119(1): 7-35. DOI:10.1007/s00401-009-0619-8 |
| [24] |
Sharp AH, Nucifora FJ, Blondel O, et al. Differential cellular expression of isoforms of inositol 1, 4, 5-triphosphate receptors in neurons and glia in brain[J]. J Comp Neurol, 1999, 406(2): 207-20. DOI:10.1002/(SICI)1096-9861(19990405)406:2<207::AID-CNE6>3.0.CO;2-7 |
| [25] |
Santello M, Toni N, Volterra A. Astrocyte function from information processing to cognition and cognitive impairment[J]. Nat Neurosci, 2019, 22(2): 154-66. DOI:10.1038/s41593-018-0325-8 |
| [26] |
Rajkowska G, Legutko B, Moulana M, et al. Astrocyte pathology in the ventral prefrontal white matter in depression[J]. J Psychiatr Res, 2018, 102: 150-8. DOI:10.1016/j.jpsychires.2018.04.005 |
| [27] |
Zhang H, Zhao Y, Wang Z. Chronic corticosterone exposure reduces hippocampal astrocyte structural plasticity and induces hippocampal atrophy in mice[J]. Neurosci Lett, 2015, 592: 76-81. DOI:10.1016/j.neulet.2015.03.006 |
| [28] |
Macvicar BA, Newman EA. Astrocyte regulation of blood flow in the brain[J]. Cold Spring Harb Perspect Biol, 2015, 7(5): a20388. |
| [29] |
Sherwood M W, Arizono M, Hisatsune C, et al. Astrocytic IP3 Rs: Contribution to Ca(2 +) signalling and hippocampal LTP[J]. Glia, 2017, 65(3): 502-13. DOI:10.1002/glia.23107 |
| [30] |
Takata N, Nagai T, Ozawa K, et al. Cerebral blood flow modulation by Basal forebrain or whisker stimulation can occur independently of large cytosolic Ca2+ signaling in astrocytes[J]. PLoS One, 2013, 8(6): e66525. DOI:10.1371/journal.pone.0066525 |
| [31] |
Pinkham A, Loughead J, Ruparel K, et al. Resting quantitative cerebral blood flow in schizophrenia measured by pulsed arterial spin labeling perfusion MRI[J]. Psychiatry Res, 2011, 194(1): 64-72. DOI:10.1016/j.pscychresns.2011.06.013 |
| [32] |
Atlan M, Forget BC, Boccara AC, et al. Cortical blood flow assessment with frequency-domain laser Doppler microscopy[J]. J Biomed Opt, 2007, 12(2): 24019. DOI:10.1117/1.2715184 |
| [33] |
Wardell K, Hemm-Ode S, Rejmstad P, et al. High-resolution laser doppler measurements of microcirculation in the deep brain structures: a method for potential vessel tracking[J]. Stereotact Funct Neurosurg, 2016, 94(1): 1-9. |
| [34] |
Noonan JE, Lamoureux EL, Sarossy M. Neuronal activity-dependent regulation of retinal blood flow[J]. Clin Exp Ophthalmol, 2015, 43(7): 673-82. DOI:10.1111/ceo.12530 |
 2020, Vol. 40
2020, Vol. 40

