胃癌是一种很常见的消化道恶性肿瘤,其在癌症中的发病率居全球第3位[1]。肿瘤异常能量代谢已成为抗肿瘤治疗中重要的靶点,通过抑制糖酵解可以有效地抑制肿瘤细胞生长或者提高肿瘤细胞对抗癌药物的敏感性[2]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号在有氧糖酵解中发挥了至关重要的作用[2-3]。Bao等[2]认为PI3K/Akt信号是通过调控葡萄糖转运体1(GLUT-1)的表达,增强肿瘤细胞葡萄糖的摄入,促进有氧糖酵解。我们前期实验表明重组甲硫氨酸酶(rMETase)造成的胃癌细胞内甲硫氨酸饥饿能下调胃癌细胞中PI3K/ Akt信号通路,抑制胃癌细胞的增殖[4]。然而,rMETase能否通过PI3K/AKT/GLUT-1抑制糖酵解促进凋亡抑制肿瘤生长尚不清楚。本实验通过研究rMETase对SGC- 7901细胞的PI3K/Akt通路、有氧糖酵解、增殖、凋亡的影响,探讨rMETase调控有氧糖酵解进而抗肿瘤的分子机制,为临床上应用rMETase治疗胃癌提供新的策略。
1 材料和方法 1.1 材料人胃癌细胞株SGC-7901(吉妮欧生物)。rMETase(Bivison),胰蛋白酶(Slarbio),1640培养基(Gibco)、胎牛血清(Gibco);LY294002(MCE)、740Y-P(MCE);CCK-8(Boster)、葡萄糖和乳酸含量检测试剂盒(建成)、CellTiter-LumiTM试剂盒(Beytime);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(Keygen)、细胞周期试剂盒(US EVERBRIGHT);RIPA裂解液(CWBI0)、蛋白酶抑制剂(CWBI0)、蛋白磷酸酶抑制剂(Applygen)、BCA蛋白浓度测定试剂盒(Applygen);PI3K、Akt、p-AKT、GLUT- 1、HK Ⅱ、LDHA、Caspase-3(Abcam),PFKM(CST),Bcl- 2、BAX、GAPDH抗体(Proteintech),IRDye800荧光标记二抗购自Boster,ECL发光试剂盒(Beytime),聚偏二氟乙烯(PVDF)膜(Millipore)。
1.2 细胞培养在37 ℃,5% CO2的培养条件下,使用含10%胎牛血清的1640完全培养基培养SGC-7901细胞株,48~72 h使用胰蛋白酶消化传代1次,定期检测排除支原体污染,选取对数生长期细胞进行试验。
1.3 CCK-8检测细胞活力将SGC-7901细胞按1×104/孔接种到96孔板中。设置空白对照组(Ac)、rMETase(1.25,2.5 mmol/L)组(As),每组设置5个复孔并设置调零孔(Ab)。处理72 h后每孔加入10 μL的CCK-8溶液继续培养2 h。使用酶标仪检测各孔450 nm波长的光密度A值,并计算细胞活力公式(1)。
| ${\rm{细胞活力}}\left( \% \right) = \left[ {\left( {{\rm{As - Ab }}} \right)/\left( {{\rm{Ac - Ab}}} \right)} \right] \times 100\% $ | (1) |
将SGC-7901细胞按1×106/孔接种到6孔板,细胞分组处理同1.3项。处理72 h后在倒置显微镜下进行细胞形态学观察并拍照(400×)。
1.5 平板细胞克隆形成实验检测细胞增殖能力将SGC-7901细胞按200个/孔接种于6孔板中,按1.3项分组处理。每隔96 h换液,培养2 w。PBS洗2遍,4%多聚甲醛固定15 min后,加GIMSA染色液染色20 min,流水缓慢洗去染色液,空气干燥。显微镜下计数克隆数量,按公式(2)计算克隆形成率。
| ${\rm{克隆形成率 = }}\left( {{\rm{克隆数/接种细胞数}}} \right) \times 100\% $ | (2) |
将SGC-7901细胞按5×105/孔接种到6孔板,细胞分组同1.3项。处理72 h后,吸净各组的培养液,用PBS漂洗2次,胰蛋白酶消化,1000 r/min离心5 min收集细胞,使用预冷PBS洗涤2次。加入1× Binding buffer 500 μL制成单细胞悬液,加入5 μL的Annexin V-FITC 5 min孵育后加入5 μL PI孵育15 min,流式细胞术检测四个象限细胞数,分析各组的凋亡率。
1.6.2 分析周期阻滞细胞处理、收集和洗涤方式如前。加1 mL的75%酒精重悬后,在-20 ℃封闭4 h,离心弃上清后洗涤1次。加入buffer 500 μL后重悬,加入PI 5 μL孵育20 min,使用流式细胞术检测各个细胞周期的细胞数,分析周期阻滞。
1.7 比色法检测细胞葡萄摄取和乳酸产生量,化学发光法检测ATP含量取对数生长期的SGC-7901细胞按2×106/皿接种到培养皿中。设置空白对照组、实验组(rMETase1.25、2.50 mmol/L)、阳性对照组(PI3K激活剂740Y-P 50 μg/ mL[5]、rMETase 2.50 mmol/L+740Y-P 50 μg/mL、PI3K抑制剂LY294002 10 μmol/L[6]、rMETase2.50 mmol/L+ LY294002 10 μmol/L)。细胞贴壁长至80%后,更换配置好的培养液处理72 h,将各组培养液和新鲜培养液离心取上清。分别按说明书操作将收集的上清处理后,终溶液按100 μL加入96孔板中,每组5个复孔,使用酶标仪检测各孔505 nm波长的葡萄糖光密度A值和550 nm波长的乳酸光密度A值,根据试剂盒说明书分别计算新鲜培养液(Af)和处理组培养液(Ae)葡萄糖和乳酸的浓度。将各组细胞经胰酶消化,离心收集并计数,按公式3计算每百万个细胞吸收的葡萄糖,按公式4计算每百万个细胞产生的乳酸量。分别取各组消化好的细胞稀释为1×106/mL,取100 μL置于黑色96孔板中,每组5个复孔,加入100 μL的CellTiter-LumiTM静置10 min[7],使用酶标仪检测各组化学荧光A值,检测各组细胞内ATP水平。
| ${\rm{葡萄糖吸收量 = }}\left( {{\rm{Af - Ae}}} \right)/{\rm{百万个细胞数}} $ | (3) |
| ${\rm{乳酸产生量 = }}\left( {{\rm{Ae - Af}}} \right)/{\rm{百万个细胞数}} $ | (4) |
细胞处理同1.7项。洗净各组细胞培养液,预冷PBS洗3遍,使用已经加入蛋白酶抑制剂和磷酸酶抑制剂RAPI裂解液4 ℃裂解20 min,收集各组裂解物,14 000 r/min离心10 min收集上清。使用BCA法测定各组样品蛋白质浓度,加入6×Protein Loading Buffer煮沸10 min,置于-20 ℃保存。配制10%的SDS-PAGE的分离胶和5%的浓缩胶,按照BCA测定结果上样。120 V恒压进行分离,恒流260 mA,130 min将蛋白转至PVDF膜上。使用含5%脱脂奶粉的TBST封闭液,室温封闭1 h。在4℃下在一抗中孵育过夜,现配TBST清洗后室温内孵育二抗1 h,现配TBST清洗后,使用Bio-Rad全自动凝胶成像分析仪进行曝光分析。
1.9 统计学分析使用Graphpad Prism7.0软件作图并统计分析。数据以均数±标准差表示,所有试验均重复3次。采用t检验评价试验组间差异,P < 0.05为差异有统计学意义。
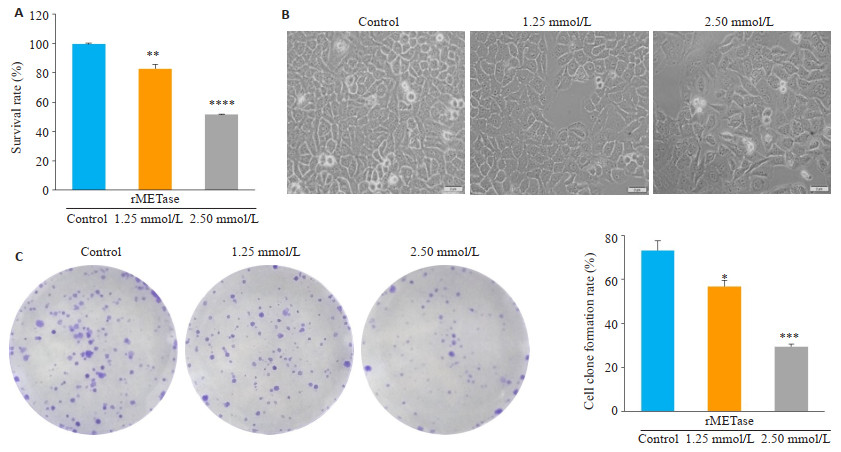
2 结果 2.1 rMETase抑制SGC-7901细胞增殖CCK-8法检测结果(图 1A)显示,rMETase处理72 h后1.25 mmol/L组的细胞活力为(82.79±3.04)%,2.5 mmol/L组为(51.47±0.25)%,细胞活力随着浓度的升高逐渐降低(P < 0.05)。在倒置显微镜下(图 1B),对照组细胞形态清晰,密度均匀,呈铺路石状;1.25 mmol/L组细胞密度稍减,形态略有变化;2.50 mmol/L组细胞形态变化成梭形,密度大幅度降低。平板细胞克隆形成实验表明(图 1C),随着rMETase的浓度上升,细胞克隆形成率下降,对照组为(73.17±4.24)%,1.25 mmol/L组为(56.77±2.87)%,2.5 mmol/L组为(29.53±1.18)%,明显抑制克隆形成(P < 0.05)。
|
图 1 rMETase抑制胃癌SGC-7901细胞增殖 Fig.1 rMETase inhibits the proliferation of gastric cancer SGC-7901 cells. A: CCK-8 assay of cell viability; B: Morphological observation of the cells under inverted microscope; C: Plate colony formation assay. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs control. |
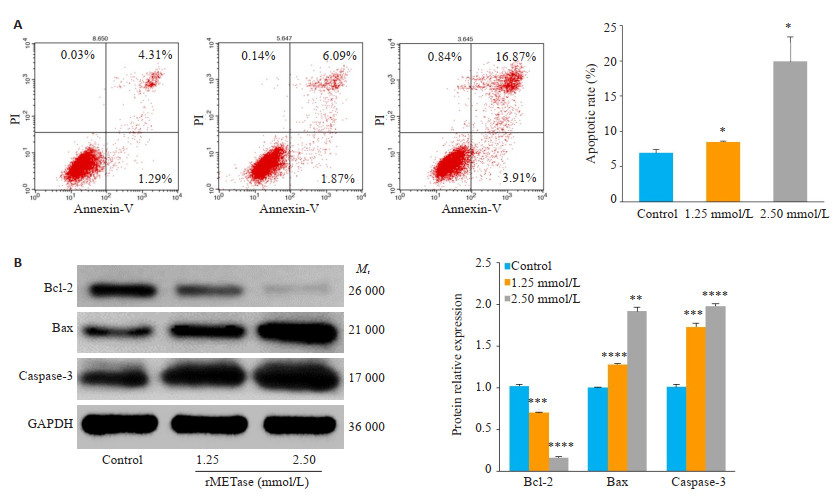
AnnexinV-FITC/PI双染流式细胞结果(图 2A)显示,空白对照组细胞凋亡率为(6.947±0.50)%,而1.25 mmol/L组细胞凋亡率增加到(8.53±0.05)%,2.50 mmol/L组细胞凋亡率为(19.90±3.45)%,差异均具有统计学意义(P < 0.05)。蛋白印迹结果(图 2B)表明,抗凋亡蛋白Bcl-2随浓度升高表达下调,促凋亡蛋白Bax、Casepase-3表达上升,差异均具有统计学意义(P < 0.01)。
|
图 2 rMETase促进胃癌细胞凋亡 Fig.2 rMETase promotes apoptosis of gastric cancer cells. A: Flow cytometric analysis of cell apoptosis; B: Western blotting of apoptosis-related proteins *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs control. |
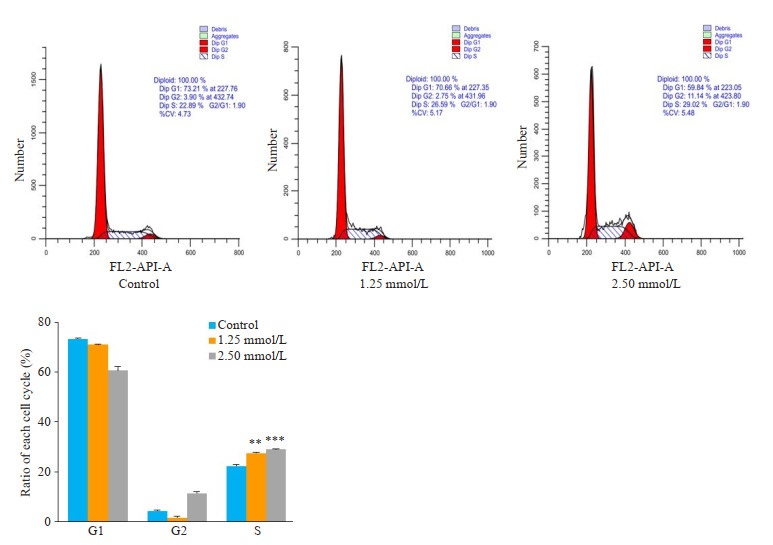
根据碘化丙锭染色流式细胞结果显示(图 3),对照组S期为(22.33 ± 0.50)%,1.25 mmol/L处理组为(27.48±0.46)%,2.50 mmol/L处理组为(28.96±0.16)%,(P < 0.01)。
|
图 3 rMETase诱导SGC-7901细胞S期阻滞 Fig.3 rMETase induces S phase arrest in SGC-7901 cells. **P < 0.01, ***P < 0.001 vs control. |
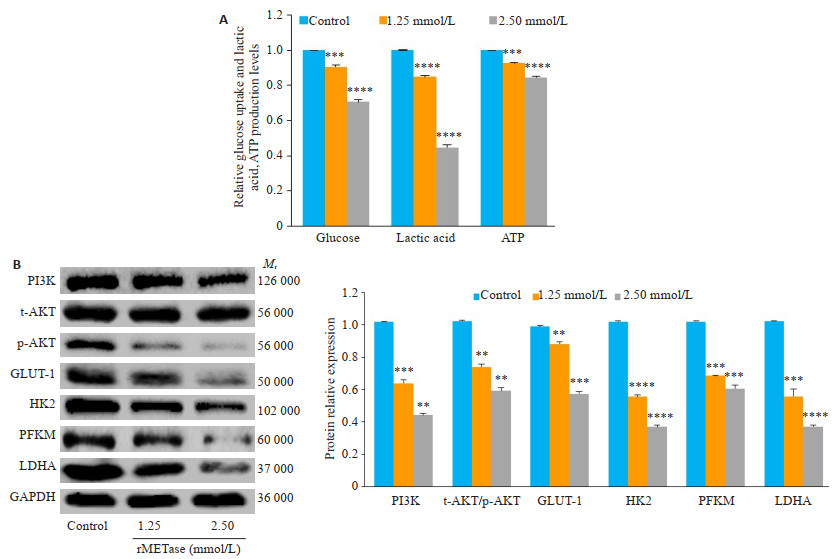
葡萄糖、乳酸和ATP(图 4A)检测结果表明,随着rMETase的浓度的增加细胞葡萄糖吸收降低,并伴随糖酵解产物乳酸和ATP的下降,差异均具有统计学意义(P < 0.001)。蛋白印迹显示(图 4B)随着rMETase浓度上升,有氧糖酵解的关键酶己糖激酶2(HK2)、磷酸果糖激酶(PFKM)、乳酸脱氢酶(LDHA)、PI3K和p-Akt/t-Akt的表达量下调(P < 0.01)。
|
图 4 rMETase可以抑制有氧糖酵解和PI3K/Akt通路 Fig.4 rMETase inhibits aerobic glycolysis and PI3K/Akt pathway. A: Detection of glucose, lactic acid, and ATP levels; B: Western blotting of the protein expressions. **P < 0.01, ***P < 0.001, ****P < 0.0001 vs control. |
蛋白印迹结果(图 4B)表明,GLUT-1随rMETase浓度上升而下调(P < 0.05)。使用PI3K激动剂740Y-P处理后,发现(图 5A)740Y-P可以促进细胞葡萄糖吸收,增加有氧糖酵解产物乳酸和ATP的生成,拮抗rMETase造成的葡萄糖、乳酸和ATP下降(P < 0.05)。蛋白印迹结果(图 5B)表明,740Y-P在上调PI3K/Akt通路的同时能够对抗rMETase造成的GLUT-1、糖酵解关键酶HK2,PFKM,LDHA蛋白表达和PI3K/Akt通路下调(P < 0.05)。此外,我们还使用PI3K抑制剂LY294002进行处理,发现(图 5C)其能与rMETase明显协同抑制葡萄糖的摄入和乳酸、ATP的生成(P < 0.05)。蛋白印迹(图 5D)表明,LY294002和rMETase起协同作用,下调PI3K、p-Akt/t-Akt、GLUT-1、HK2、PFKM、LDHA蛋白的表达(P < 0.05)。
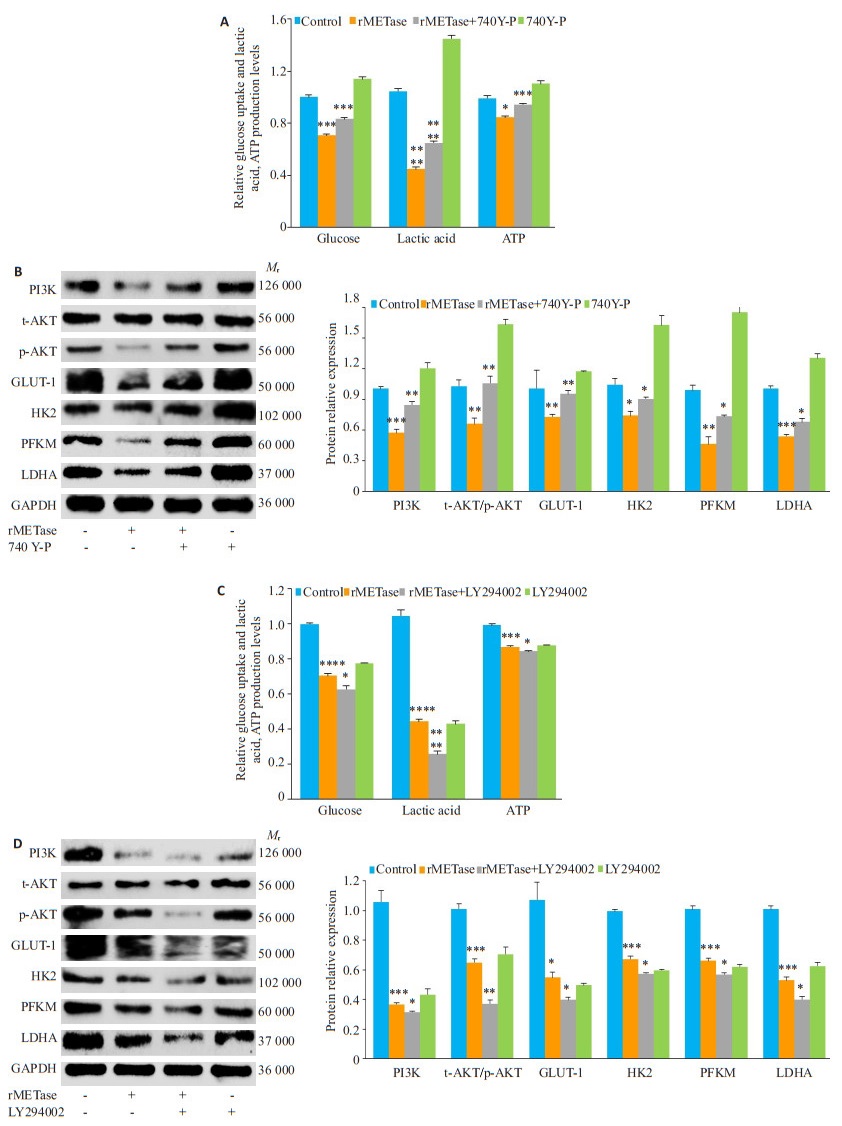
|
图 5 rMETase是通过调控PI3K/Akt/GLUT-1抑制有氧糖酵解 Fig.5 rMETase inhibits aerobic glycolysis by modulating PI3K/Akt/GLUT-1 pathway. A: Detection of glucose, lactic acid, and ATP levels after 740Y-P (50 μg/mL) treatment; B: Western blotting of protein expressions after 740Y-P treatment; C: Detection of glucose, lactic acid, and ATP levels after treatment with LY294002 (10 μmol/L); D: Western blotting of protein expressions after treatment with LY294002. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs control. |
研究者多数肿瘤细胞在甲硫氨酸剥夺的培养基中不能生长,正常细胞在甲硫氨酸剥夺的条件下可以正常生长[8]。这有可能是肿瘤细胞内蛋白质合成和转甲基化反应的增加,其对甲硫氨酸的需要量远远超过正常细胞,同时由于肿瘤细胞内甲硫氨酸合成酶的活性较低,无法像正常细胞一样利用同型半胱氨酸合成足够的内源性甲硫氨酸[9]。我们前期研究表明rMETase能催化甲硫氨酸和同型半胱氨酸的α、γ-裂解反应,生成α-丁酮酸、甲硫醇和氨,从而全身性的消耗甲硫氨酸,制肿瘤细胞的生长[4, 10]。在本研究中,经rMETase处理的SGC-7901细胞细胞活力下降,生长放缓,克隆形成率下降并诱导S周期阻滞。这些结果证实,rMETase可以抑制胃癌SGC-7901细胞增殖。
细胞凋亡是在多细胞生物体中发生的程序性细胞死亡的一种形式。在肿瘤细胞中,细胞凋亡过程失调导致其不受控制的增殖[11]。所以,促进肿瘤细胞的凋亡是一种主要的治疗策略。Hens等[12]发现限制甲硫氨酸摄入能够抑制细胞增殖促进凋亡。我们使用流式细胞术检测凋亡显示SGC-7901细胞凋亡率随浓度升高而升高;蛋白印迹表明抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax、Caspase-3表达上调,同样证实了rMETase能够促进胃癌细胞的凋亡。
凋亡的激活机制有营养缺乏、热、辐射、缺氧等。肿瘤细胞与正常细胞在能量产生方式也有着差异,针对这种差异可以促进肿瘤细胞凋亡[13-14]。在正常细胞中能量的主要产生方式是氧化磷酸化,糖酵解是被抑制的。而德国学者Warburg发现,在有氧条件下恶性肿瘤细胞的糖酵解是同样活跃的[15]。所以,肿瘤细胞可能会优先通过有氧糖酵解途径生成大量的乳酸进而获取更多其所需的能量[16]。有报道显示,通过抑制糖酵解能够促进肿瘤细胞的凋亡,抑制肿瘤细胞生长[13]。而有氧糖酵解的主要能量来源是葡萄糖,抑制葡萄糖摄取可能是癌症治疗的潜在策略[17]。细胞的葡萄糖代谢取决于膜转运蛋白的运输,即葡萄糖转运蛋白家族[18]。GLUT家族一共有14种,研究表明GLUT-1在细胞能量代谢中发挥重要作用[19]。并且Chen等[20]证实了GLUT-1在胃癌组织中高表达,并且与预后相关,是一种治疗胃癌的有效靶点。Zhang等[21]通过敲低GLUT-1的表达,发现敲低GLUT-1的表达能够逆转胃癌细胞中的高有氧糖酵解状态。本研究表明经rMETase处理的胃癌SGC-7901细胞,有氧糖酵解产物乳酸、ATP减少,关键酶HK2、PFKM、LDHA表达降低,并且GLUT-1的表达下调,说明rMETase能通过调控GLUT-1抑制有氧糖酵解这一代谢表型促进细胞凋亡。
研究发现,PI3K/Akt通路在肿瘤细胞的有氧糖酵解中发挥关键作用[22]。PI3K/Akt信号在细胞中是一种重要的转导通路,调控肿瘤细胞发生发展。在肿瘤细胞中PI3K/Akt信号传导途径常处于被激活状态,从而维持其活跃的增殖能力[23]。激活的PI3K/Akt可以促进肿瘤细胞的糖酵解,促进肿瘤细胞进展[24]。有文献证实,PI3K/Akt信号通路是通过上调GLUT-1的表达,增加葡萄糖的吸收,增强有氧糖酵解[2, 25-26]。我们前期的研究提示rMETase能够抑制胃癌细胞的PI3K/Akt信号通路[4]。为了验证rMETase是否通过PI3K/Akt/GLUT-1调节糖酵解,我们联合PI3K激动剂740Y-P和抑制剂LY294002处理胃癌SGC-7901细胞。经rMETase处理的胃癌细胞PI3K、p-Akt/t-Akt下调与之前研究结果一致。740Y-P在上调PI3K/Akt通路的同时对抗rMETase造成的GLUT-1下调、葡萄糖吸收下降、糖酵解产物乳酸和ATP下降以及糖酵解关键酶的下调,而LY294002能够和rMETase起协同作用。
综上,我们研究证实了rMETase能通过PI3K/Akt通路抑制GLUT-1的表达限制胃癌细胞葡萄糖摄取,抑制SGC-7901细胞糖酵解,抑制胃癌细胞生长。本文将肿瘤细胞的甲硫氨酸依赖性和特异性能量代谢有机的联系起来,阐明了rMETase抑制肿瘤细胞生长的分子机制,提示了rMETase抑制胃癌细胞能量代谢可能是一种有潜力的胃癌治疗手段。然而,rMETase的抗癌作用的确切机制需要进行更深入的研究。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Bao YY, Zhou SH, Lu ZJ, et al. Inhibiting GLUT-1 expression and PI3K/Akt signaling using apigenin improves the radiosensitivity of laryngeal carcinoma in vivo[J]. Oncol Rep, 2015, 34(4): 1805-14. DOI:10.3892/or.2015.4158 |
| [3] |
Parker VE, Knox RG, Zhang Q, et al. Phosphoinositide 3-kinaserelated overgrowth:cellular phenotype and future therapeutic options[J]. Lancet, 2015, 385(suppl1): S77. DOI:10.1016/S0140-6736(15)60392-0 |
| [4] |
Xin L, Cao WX, Fei XF, et al. Applying proteomic methodologies to analyze the effect of methionine restriction on proliferation of human gastric cancer SGC7901 cells[J]. Clin Chim Acta, 2007, 377(1-2): 206-12. DOI:10.1016/j.cca.2006.09.027 |
| [5] |
Han L, Hao Y, Wang J, et al. Knockdown of LINC02465 suppresses gastric cancer cell growth and metastasis via PI3K/AKT pathway[J]. Hum Gene Ther Cl Dev, 2019, 30(1): 19-28. DOI:10.1089/humc.2018.177 |
| [6] |
Cao B, Liu C, Yang G. Down-regulation of lncRNA ADAMTS9-AS2 contributes to gastric cancer development via activation of PI3K/Akt pathway[J]. Biomed Pharmacother, 2018, 107: 185-93. DOI:10.1016/j.biopha.2018.06.146 |
| [7] |
Wei X, Mao T, Li S, et al. DT-13 inhibited the proliferation of colorectal cancer via glycolytic metabolism and AMPK/mTOR signaling pathway[J]. Phytomedicine, 2019, 54(15): 120-31. DOI:10.1016/j.phymed.2018.09.003 |
| [8] |
Kano Y, Sakamoto S, Kasahara T, et al. Methionine dependency of cell growth in normal and malignant hematopoietic cells[J]. Cancer Res, 1982, 42(8): 3090-2. DOI:10.1016/0304-3835(82)90136-7 |
| [9] |
Graziosi L, Mencarelli A, Renga B, et al. Epigenetic modulation by methionine deficiency attenuates the potential for gastric cancer cell dissemination[J]. J Gastrointest Surg, 2013, 17(1): 39-49. |
| [10] |
Xin L, Liu C, Yang WF, et al. Recombinant methioninase inhibits self-renewal and proliferation of gastric cancer stem cells[J]. Int J Clin Exp Med, 2017, 10(4): 6091-9. |
| [11] |
Ahmed K, Tabuchi Y, Kondo T. Hyperthermia:an effective strategy toinduce apoptosisin cancer cells[J]. Apoptosis, 2015, 20(11): 1411-9. DOI:10.1007/s10495-015-1168-3 |
| [12] |
Hens JR, Sinha I, Perodin F, et al. Methionine-restricted diet inhibits growth of MCF10AT1-derived mammary tumors by increasing cell cycle inhibitors in athymic nude mice[J]. BMC cancer, 2016, 16: 349. DOI:10.1186/s12885-016-2367-1 |
| [13] |
Maximchik P, Abdrakhmanov A, Inozemtseva E, et al. 2-Deoxy-Dglucose has distinct and cell line-specific effects on the survival of different cancer cells upon antitumor drug treatment[J]. FEBS J, 2018, 285(24): 4590-601. DOI:10.1111/febs.14687 |
| [14] |
Shahruzaman SH, Fakurazi S, Maniam S. Targeting energy metabolism to eliminate cancer cells[J]. Cancer Manag Res, 2018, 10: 2325-35. DOI:10.2147/CMAR.S167424 |
| [15] |
Warburg Otto. über den Stoffwechsel der carcinomzelle[J]. Wien Klin Wochenschr, 1925, 4(12): 534-6. DOI:10.1007/BF01726151 |
| [16] |
Li XB, Gu JD, Zhou QH. Review of aerobic glycolysis and its key enzymes-new targets for lung cancer therapy[J]. Thorac Cancer, 2015, 6(1): 17-24. DOI:10.1111/1759-7714.12148 |
| [17] |
Rodriguez-Enriquez S, Marin-Hernandez A, Gallardo-Perez JC, et al. Targeting of cancer energy metabolism[J]. Mol Nutr Food Res, 2009, 53(1): 29-48. DOI:10.1002/mnfr.200700470 |
| [18] |
Mueckler M, Thorens B. The SLC2(GLUT) family of membrane transporters[J]. MolAspects Med, 2013, 34(2-3): 121-38. DOI:10.1016/j.mam.2012.07.001 |
| [19] |
Ancey PB, Contat C, Meylan E. Glucose transporters in cancer-from tumor cells to the tumor microenvironment[J]. FEBS J, 2018, 285(16): 2926-43. DOI:10.1111/febs.14577 |
| [20] |
Ha Schlößer, Drebber U, Urbanski A, et al. Glucose transporters 1, 3, 6, and 10 are expressed in gastric cancer and glucose transporter 3 is associated with UICC stage and survival[J]. Gastric Cancer, 2017, 20(1): 83-91. DOI:10.1007/s10120-015-0577-x |
| [21] |
Zhang TB, Zhao Y, Tong ZX, et al. Inhibition of glucose-transporter 1(GLUT-1) expression reversed warburg effect in gastric cancer cell MKN45[J]. Int J Clin Exp Med, 2015, 8(2): 2423-8. |
| [22] |
Cairns Rob A, Harris Isaac S, Mak Tak W. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11: 85. DOI:10.1038/nrc2981 |
| [23] |
Bunney Tom D, Katan Matilda. Phosphoinositide signalling in cancer:beyond PI3K and PTEN[J]. Nat Rev Cancer, 2010, 10: 342. DOI:10.1038/nrc2842 |
| [24] |
Zhao Y, Yang L, He J, et al. STYK1 promotes warburg effect through PI3K/AKT signaling and predicts a poor prognosis in nasopharyngeal carcinoma[J]. Tumour Biol, 2017, 39(7): 1010428317711644. DOI:10.1177/1010428317711644 |
| [25] |
Broecker-Preuss M, Becher-Boveleth N, Bockisch A, et al. regulation of glucose uptake in lymphoma cell lines by c-MYC-and PI3K-dependent signaling pathways and impact of glycolytic pathways on cell viability[J]. J Transl Med, 2017, 15(1): 158. DOI:10.1186/s12967-017-1258-9 |
| [26] |
Robey RB, Hay N. Is Akt the "Warburg kinase"?-Akt-energy metabolism interactions and oncogenesis[J]. Semin Cancer Biol, 2009, 19(1): 25-31. DOI:10.1016/j.semcancer.2008.11.010 |
 2020, Vol. 40
2020, Vol. 40

