2. 江门市妇幼保健院药学部,广东 江门 529000;
3. 江门市中心医院 病理科,广东 江门 529030;
4. 江门市中心医院 中心实验室,广东 江门 529030;
5. 广东省人乳头状瘤病毒(HPV)相关疾病分子诊断工程技术研究开发中心,广东 潮州 521021
2. Department of Pharmacy, Jiangmen Maternity and Child Health Care Hospital, Jiangmen 529000, China;
3. Department of Pathology, Jiangmen Central Hospital, Jiangmen 529030, China;
4. Central Laboratory, Jiangmen Central Hospital, Jiangmen 529030, China;
5. Research and Development Center for Molecular Diagnosis Engineering Technology of Human Papillomavirus (HPV) Related Diseases of Guangdong Province, Chaozhou 521021, China
子宫内膜癌高发于绝经后的50~60岁女性,易发生阴道不规则出血,故多数患者(约75%)能在疾病早期确诊,手术或放射治疗效果较好,5年早期患者总生存率在70%以上[1-2]。对于中晚期患者,化疗(新辅助化疗、辅助化疗和姑息化疗等)是关键的治疗方法,其中铂类+紫杉醇类是首选的化疗方案[3-4],但是化疗不敏感及诱导耐药的情况时有发生,晚期患者5年总生存率仅为25%[5-6]。对的生物标志物及克服其耐受的治疗方法,具有重要的临床现实意义,同样是国内外研究的重点[7-8]。本课题组前期利用全基因组拷贝数变异(CNV)分析的方法,筛选出白血病相关因子(LIF)可能与子宫内膜癌患者化疗抵抗相关[9],但迄今未见LIF参与子宫内膜癌化疗抵抗的机制报道,缺少LIF作为子宫内膜癌临床治疗的生物标志物及靶点的前期研究,因此,本研究通过体外模型,旨在探索LIF对子宫内膜癌细胞生物学行为的影响,以期为子宫内膜癌的诊治提供新的思路。
1 材料和方法 1.1 关键试剂和仪器MEM培养液、DMEM/F12培养液、Opti-MEN培养液、胎牛血清(FBS)为100 ×青霉素-链霉素(P/S)、Lipofectamine 3000、针对LIF的酶联免疫吸附检测试剂盒(ThermoFisher);胰岛素(Merck);嘌呤霉素(Puro)、顺铂和紫杉醇(阿拉丁);CCK-8试剂盒(同仁);Annexin V-FITC/PI检测试剂盒(凯基);JC-1检测试剂盒、双荧光素酶报告基因检测试剂盒、BCA蛋白定量试剂盒、RIPA裂解液,蛋白酶抑制剂混合物和蛋白磷酸酶抑制剂混合物(碧云天);针对Bcl-2、Bcl-xL、Bax、Bad、STAT3、p-STAT3(Y705)和α-tubulin的抗体(Cell Signal);非连接酶依赖型单片段快速克隆试剂盒、总RNA提取试剂(Trizol法)、HiScript cDNA一链合成试剂盒和ChamQ高灵敏性染料法定量PCR检测试剂盒(诺唯赞)。Synergy2多功能酶标仪(BioTek),MiniProtean电泳、Mini Trans-Blot转膜设备和CFX96荧光定量PCR系统(BIO-RAD),HD9 Touch多功能成像系统(UVITEC),Gallios流式细胞仪(Beckman Coulter)。
1.2 细胞及培养条件两子宫内膜癌细胞(HEC-1B和RL95-2)及用于病毒包装的293FT(普诺赛)均通过STR鉴定,经规范培养、传代扩增后,冻存于江门市中心医院中心实验室(临床生物资源库)的液氮罐中。HEC-1B的完全培养基为含10% FBS和1% P/S的MEM培养液,RL95-2的完全培养基为含10% FBS、5 mg/L胰岛素及1% P/S的DMEM/F12培养液;细胞换液、传代、冻存及复苏均按常规操作,所有细胞的培养环境均为,5% CO2,37.5 ℃恒温恒湿。
1.3 质粒及小干扰RNA转染人HLF基因,转录本编号NM_002309,购自山东维真公司,并利用快速克隆试剂盒构建进pLVX-IRESPuro慢病毒载体质粒;psPAX2(#12260)和pMD2.G(#12259)购自Addgene;pSTAT3-TA-luc、pGL6-TA-luc和pRL-SV40-N质粒购自上海碧云天公司;针对STAT3的小干扰RNA(Small interfering RNA, siRNA; #siB0837165849)及对照siRNA片段(#siN0000001)均由广州锐博公司设计和合成。质粒和siRNA的转染均使用Lipofectamine 3000脂质体转染系统,操作按试剂说明书操作。
1.4 过表达LIF子宫内膜癌细胞建立如课题组前期报道[10]所述,转染前夜,消化传代293FT细胞,接种于包被好明胶包被好的培养介质,5% CO2,37 ℃培养过夜,确认细胞状态良好;按15:8:12比例混合pLVX-IRES-Puro、pMD2.G和psPAX2,按说明书操作,利用Lipofectamine 3000转染混合物,5% CO2,37 ℃正常培养6 h;弃去培养液,轻柔地用预热好的PBS洗涤细胞表面3次,再小心加入完全培养基,正常培养;转染过夜后,开始收集培养液上清,0.2 μm微孔滤膜过滤后,可直接感染细胞或置-80 ℃短期保存。感染前夜,消化传代目标细胞,正常培养过夜,确认细胞状态良好;弃去原培养液,加入已过滤的含病毒培养液,正常培养,每6~10 h换含病毒的培养液1次,连续3 d;感染结束后,换完全培养液正常培养1 d,待细胞状态恢复并长至90%融合度,传代并冻存;传代过夜的细胞,加入0.1~10 mg/L含Puro筛选培养液,正常传代培养两代即可。利用RT-qPCR及ELISA方法确定稳定表达HLF细胞的成功建立。
1.5 RT-qPCR检测mRNA水平如课题组前期报道[11]所述,细胞的总RNA提取用Trizol法提取,操作按试剂说明书操作。用cDNA第一链合成试剂盒,按说明书操作,将总RNA逆转录(RT)成cDNA。实时荧光定量聚合酶链反应(qPCR)的扩增和定量使用的是CFX96系统的SYBR Green法,试剂盒为ChamQ SYBR高灵敏性定量PCR检测试剂盒,操作按产品说明书执行。其中使用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,采用2-△△Ct计算目的基因的相对表达量。LIF的上游引物为:5'-GCATCT GAGGTTTCCTCCAA-3',下游引物为:5'-TTCCAGT GCAGAACCAACAG-3';GAPDH的上游引物为:5'-GCACCGTCAAGGCTGAGAAC-3',下游引物为:5'-TGGTGAAGACGCCAGTGGA-3'。
1.6 Western blot检测蛋白质及蛋白质磷酸化水平如课题组前期报道[12]所述,细胞总蛋白提取使用RIPA裂解液,使用前加入蛋白酶抑制剂混合物及蛋白磷酸酶抑制剂混合物,冰上裂解15 min、超声破碎30 s;蛋白定量用BCA蛋白定量试剂盒,并按说明书操作。裂解液上样前加入按5:1加入6×上样缓冲液,并用1×上样缓冲液配平体积,100 ℃变性处理5 min。使用SDSPAGE蛋白电泳系统,上样量为50 µg总蛋白,电泳参数为8%~12%分离胶、5%浓缩胶,100 V电泳120 min至溴酚蓝指示剂迁移至底部后,进行电转移,使用0.2 µm的PVDF膜,300 mA冰浴电转90 min。电转结束后,膜使用5%脱脂奶粉封闭30 min,TBST漂洗1遍5 min,加入稀释的一抗工作液(按产品说明书稀释配制),4 ℃孵育过夜,TBST漂洗3遍5 min,加入稀释的二抗工作液(按产品说明书稀释配制),室温孵育1 h,TBST漂洗3遍5 min,加入ECL发光液,多功能成像仪自动成像。
1.7 ELISA测定蛋白质水平如课题组前期报道[13]所述,酶联免疫吸附试验(ELISA)参考产品说明书,提前配置好洗液、分析缓冲液、生物素标记的抗体工作液、辣根过氧化物酶标记的链霉亲和素工作液及LIF的系列浓度的标准品溶液。首先用洗液活化包埋针对LIF抗体的酶标板各检测孔,加入样品及标准品溶液,室温孵育2 h,弃上清后洗涤检测孔;然后加入生物素标记的抗体工作液,室温孵育1 h,弃上清后洗涤检测孔;随后加入辣根过氧化物酶标记的链霉亲和素工作液,室温孵育30 min,弃上清后洗涤检测孔;再加入TMB底物工作液室温避光显色10 min,即加入反应终止液。在酶标仪上,检测各孔450 nm的吸光度,并用620 nm作为参比波长,利用标准曲线法求算各样品的LIF浓度。
1.8 CCK-8法测量细胞活性如课题组前期报道[14]所述,采用96孔板作为培养介质,细胞消化、计数并铺板,接种密度约为5 000 cells/ well,置37 ℃细胞培养箱,5% CO2培养6 h;培养结束后,在0 h时间点孔,加入1/10培养液体积的CCK-8溶液,正常培养条件孵育1 h,用酶标仪测定450 nm吸光度,继续正常培养24、48、72 h;培养结束后,如上操作,测定各时间点孔的450 nm吸光度,按下列公式计算:

|
如课题组前期报道[15]所述,细胞凋亡的检测采用Annexin V-FITC/PI检测试剂盒,操作按产品说明书执行。按实验分组处理细胞规定时间后,消化收集细胞,依次孵育Annexin V-FITC和PI染液,流式细胞分析仪检测,调整并收集每个样品的前散射光(FSC)、侧散射光(SSC)、绿光(Annexin V-FITC)和橙光(PI)4个通道的信号,并以FSC/SSC作散点图圈出主细胞群,再以Annexin V-FITC/PI对主细胞群作图分出Annexin V-FITC阳性、PI阴性或阳性的凋亡细胞群,定义为凋亡细胞。
1.10 JC-1法分析细胞线粒体膜电位如课题组前期报道[16]所述,细胞线粒体膜电位采用JC-1检测试剂盒,操作按产品说明书执行。按实验分组处理细胞规定时间后,消化收集细胞,孵育JC-1染液,流式细胞分析仪检测,调整并收集每个样品的前散射光(FSC)、侧散射光(SSC)、绿光(JC-1 Green)和红光(JC-1 Red)四个通道的信号,并以FSC/SSC作散点图圈出主细胞群,再以JC-1 Green/Red对主细胞群作图分出JC-1 Green阳性、JC-1 Red阳性的高线粒体膜电位细胞。
1.11 双荧光素酶报告基因活性检测如课题组前期报道[17]所述,在Opti-MEN培养液中,分别将pSTAT3-TA-luc和pGL6-TA-luc与pRLSV40-N质粒混合,并用Lipofectamine 3000封装;同时将si-STAT3或si-RNA阴性对照(NC)分别用Lipofectamine 3000封装,按实验分组处理细胞,使细胞转染入目的质粒和siRNA片段;正常培养48 h后,利用双荧光素酶报告基因检测试剂盒检测,按说明书操作,裂解细胞后,利用多功能酶标仪自动加入底物后测定每孔的相对荧光信号(RLU),其中,先加入并测量萤火虫荧光素酶的底物及活性,间隔5 s后,加入并测量海肾荧光素酶,按下列公式计算:

|
在观察LIF过表达对子宫内膜癌细胞体外生物学影响的实验中,载有LIF编码基因的慢病毒感染细胞(HEC-1B、RL95-2)为实验组,缩写LIF组,对照组为空载体慢病毒感染细胞,缩写Vector组;在过表达LIF的两子宫内膜癌细胞中沉默STAT3的介导实验中,转染针对STAT3的siRNA片段为实验组,缩写siSTAT3组,转染无意序列的siRNA片段为对照组,缩写NC组。每次进行统计分析的实验设3复孔,且重复3次以上;数据处理分析使用Excel 2016、GraphPad7.0、SPSS 21和Illustrator CS6软件;重复试验的计量资料用均数±标准差表示,两组间采用T检验,多组间比较采用单因素方差分析,其中组间两两比较采用Tukey检验,检验水准α=0.05。
2 结果 2.1 过表达LIF子宫内膜癌细胞建立RT real-time PCR实验显示,过表达模型的两子宫内膜癌细胞(HEC-1B、RL95-2)中LIF的mRNA水平显著上升(P < 0.05,图 1A),ELISA实验显示,过表达模型的两子宫内膜癌细胞能在24 h内分泌更多的LIF(P < 0.05,图 1B)。
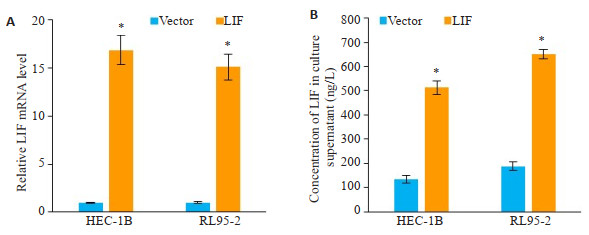
|
图 1 过表达LIF子宫内膜癌细胞建立 Fig.1 Overexpression of LIF in endometrial cancer cells. A: Real-time PCR analysis; B: ELISA analysis (n=3, *P < 0.05 vs vector). |
CCK-8实验显示,在两子宫内膜癌细胞(HEC-1B、RL95-2)细胞中过表达LIF,24 h后相对吸光度分别为2.26±0.31和2.94±0.29,对照组为2.33±0.24和2.51± 0.40,两组间差异无统计学意义(P>0.05);48 h后相对吸光度分别为4.38±0.55和5.26±0.56,对照组为4.09± 0.51和5.07±0.78,两组间差异无统计学意义(P>0.05);72 h后相对吸光度分别为9.02±0.52和9.07±0.87,对照组为8.65±0.95和8.70±0.82,两组间差异无统计学意义(P>0.05)。
2.3 过表达LIF对化疗药物杀伤癌细胞能力的影响细胞凋亡分析显示,过表达LIF能增加两子宫内膜癌细胞(HEC-1B、RL95-2)在顺铂及紫杉醇作用下的存活率(图 2),与对照组相比,差异均有统计学意义(P < 0.05)。
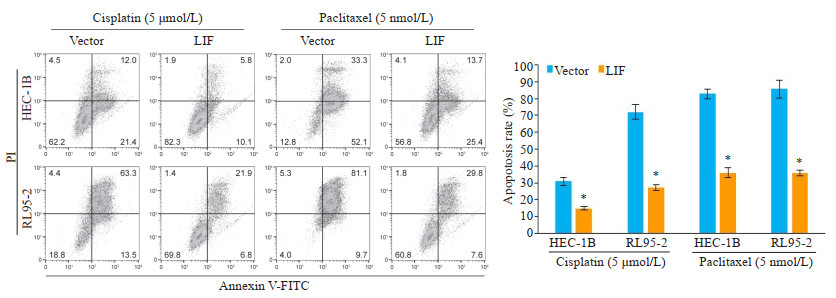
|
图 2 过表达LIF对化疗药物杀伤癌细胞能力的影响 Fig.2 Effect of LIF overexpression on cisplatin-or paclitaxel-induced apoptosis of the cells (n=3, *P < 0.05 vs vector). |
线粒体膜电位分析分析显示,过表达LIF能增加两子宫内膜癌细胞(HEC-1B、RL95-2)在顺铂及紫杉醇作用下的线粒体膜电位(图 3),与对照组相比,差异均有统计学意义(P < 0.05)。
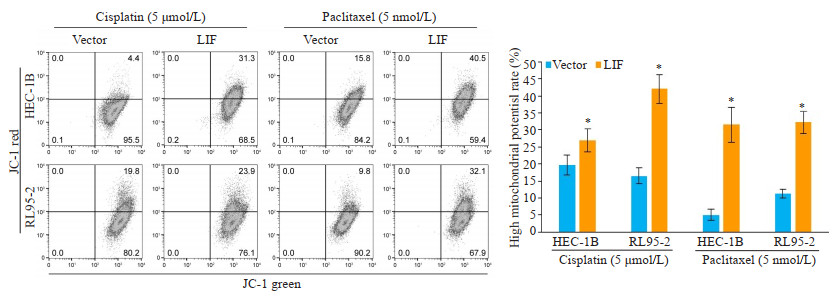
|
图 3 过表达LIF对化疗药物破坏癌细胞线粒体膜电位的影响 Fig.3 Effect of cisplatin or paclitaxel on mitochondrial membrane potential in the LIF-overexpressing cells (n=3, *P < 0.05 vs vector). |
免疫印迹显示,过表达LIF能增加两子宫内膜癌细胞(HEC-1B、RL95-2)中Bcl-2、Bcl-xL和p-STAT3的水平,降低Bax和Bad的水平,而不影响STAT3的水平(图 4)。
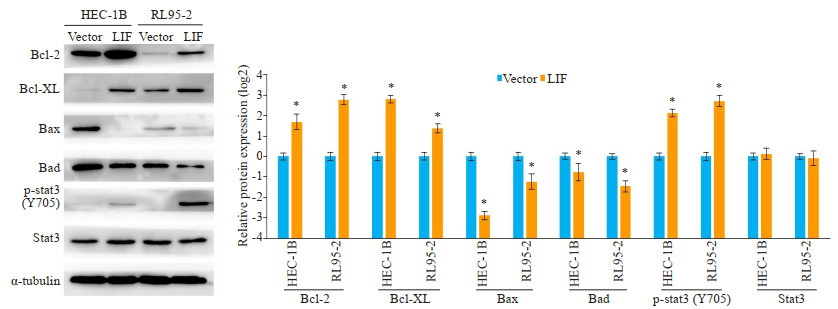
|
图 4 过表达LIF对Bcl-2家族及STAT3通路蛋白表达水平的影响 Fig.4 Western blot analysis of expressions of Bcl-2 family proteins and STAT3 pathway related proteins in LIF-overexpressing cells. *P < 0.05 vs vector. |
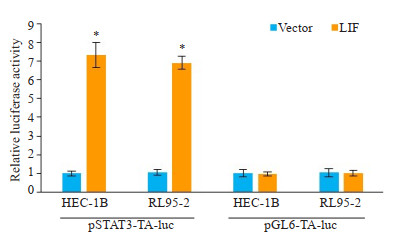
双荧光素酶报告基因实验显示,过表达LIF能增加两子宫内膜癌细胞(HEC-1B、RL95-2)中pSTAT3-TA-luc的报告基因活性,但不影响pGL6-TA-luc的活性(图 5)。
|
图 5 过表达LIF对STAT3转录活性的影响 Fig.5 Effect of LIF overexpression on STAT3 transcriptional activity in the cells (n=3, *P < 0.05 vs vector). |
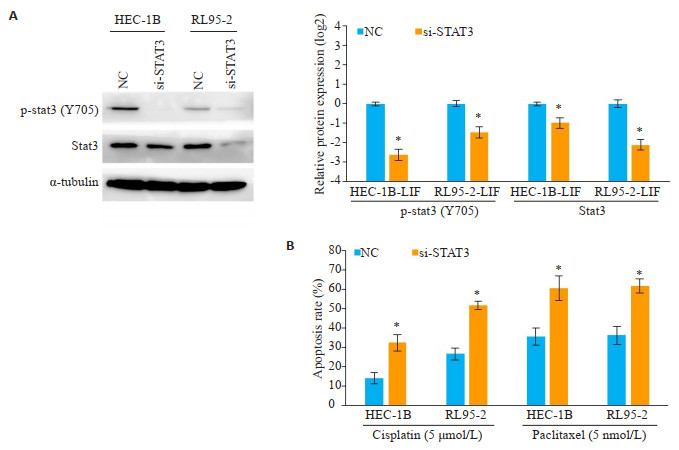
免疫印迹显示,在稳定表达LIF的两子宫内膜癌细胞(HEC-1B、RL95-2)中转染针对STAT3的小干扰RNA,能抑制STAT3及p-STAT3蛋白水平(图 6A)。细胞凋亡分析显示,在稳定表达LIF的两子宫内膜癌细胞中,沉默STAT3能显著增加顺铂及紫杉醇对细胞的杀伤作用(图 6B,P < 0.05)。
|
图 6 沉默STAT3能部分逆转过表达LIF增强的化疗抵抗 Fig.6 Effect of STAT3 silencing on apoptosis induced by cisplatin or paclitaxel in LIF-overexpressing cells.A: Western blotting; B: STAT3 transcriptional activity (n=3, *P < 0.05 vs NC). |
本文研究发现,稳定高表达LIF能增强宫内膜癌细胞对顺铂及紫杉醇的抵抗,其机制可能是LIF能激活STAT3信号通路,上调抗凋亡蛋白Bcl-2和Bcl-xL,下调诱导凋亡蛋白Bad和Bax,进而保护了线粒体的功能,降低了细胞凋亡比例。功能性的LIF是一种分泌型糖蛋白,最早因其能抑制髓样白血病M1细胞的增殖和促进其分化而得名[18],早期研究认为,人和小鼠LIF基因分别定位于第22号和第11号染色体,基因全长分别为6.0 kb和6.3 kb,均含有3个外显子和2个内含子,编码区内碱基保守性较高,其他哺乳类动物与人类基因组的同源性在78~94%[19];最近的研究显示,LIF存在多个可能存在的可变剪切体,且功能可能有一定的区别[20],而在实体瘤中,LIF还是主要以功能性细胞因子起促进肿瘤的恶性进展及放化疗抵抗[21-25]。因此,本文选用了LIF最常见,也是编码分泌型细胞因子的转录本NM_002309为研究对象,在Yu等[26]的研究中,利用逆转录病毒构建的稳定高表达LIF的结直肠癌细胞,能增加细胞分泌的LIF,激活STAT3信号通路,下调p53蛋白水平增强化疗药物对癌细胞的杀伤作用,支持了本文所构建的体外过表达LIF细胞模型的意义。
本课题组前期利用CNV分析方法,从癌症基因组图谱(TCGA, https://gdc-portal.nci.nih.gov/)数据库中,筛选22q12.2区段的扩增可能与患者化疗的抵抗相关,其中LIF为22q12.2区段的扩增热点,其拷贝数增加与患者化疗的抵抗相关[9]。然而本团队无法短时间内收集到足够的符合要求的临床标本,暂时无法利用我国人群数据,验证LIF扩增及表达情况与患者化疗反应的相关性。因此,本文采用了慢病毒将LIF编码框区域,整合进两子宫内膜癌细胞基因组中,模拟LIF的扩增,系列的体外功能实验证明,LIF扩增导致的LIF分泌增多,并不显著影响子宫内膜癌细胞的增殖活性,但能促进癌细胞在体外环境下对化疗药物的耐受。虽然未见关于LIF在基因组上的扩增与肿瘤化疗抵抗的相关报道,但是已有研究发现[27],胆管癌中存在LIF基因所在区段(22q12.2)的扩增,并与组织中LIF的免疫组化染色强度相关,且22q12.2区段的扩增与胆管癌患者更早的复发转移相关,进一步支持了本文探索LIF扩增及过表达导致子宫内膜癌细胞化疗耐受的意义。
LIF的受体为白血病抑制因子受体(LIFR),Shi等[23]指出,在胰腺癌动物模型上,中和环境中的LIF或敲除癌细胞的LIFR,均能显著抑制胰腺癌的恶性进展,增强化疗药物的有效性,延长动物的生存时间;其机制可能与LIF能通过LIFR增强STAT3的磷酸化水平及转录水平,进而调控与疾病进展及化疗抵抗相关的基因表达。本文的研究结果同样显示,即使顺铂和紫杉醇的抗癌机制各异,但都能观察到对线粒体功能的破坏并诱导细胞发生凋亡,而过表达LIF能激活STAT3信号通路,上调抗凋亡蛋白Bcl-2和Bcl-xL,下调诱导凋亡蛋白Bad和Bax,稳定线粒体膜电位并减少细胞的凋亡;结合上述研究[21-25],可以明确LIF参与了多种肿瘤的恶性进展与化疗抵抗,是潜在的治疗靶点。值得我们注意的是,正常的子宫内膜腺上皮合成并分泌LIF,呈月经周期依赖性,是启动胚泡着床及维持胚胎早期发育的关键[28-30],而LIF在增生性子宫内膜及内膜癌中表达上调,并可能参与了子宫内膜癌的恶性进展[21],因此,进一步探讨LIF在女性生殖系统及胚胎形成与发育中的作用,或许能避免抗LIF疗法带来潜在的风险。
此外,Shi等[23]的研究还指出,组织中LIF和血浆中LIF的含量水平,可以作为反映胰腺癌进展情况及治疗反应的标志物;而胰腺癌组织中的LIF主要由胰腺星形细胞,并通过旁分泌的机制作用于胰腺癌细胞。是否在子宫内膜癌中,微环境中LIF主要是肿瘤细胞相关区段扩增导致,而不是间质细胞分泌?探索这个问题将是我们后续研究的重点;而本文通过系列实验初步证明,在体外环境中,稳定高表达LIF能增强宫内膜癌细胞对顺铂及紫杉醇的抵抗。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CACancer J Clin, 2016, 66(2): 115-32. DOI:10.3322/caac.21338 |
| [3] |
林仲秋, 谢玲玲, 林荣春. 《2016 NCCN子宫肿瘤临床实践指南》解读[J]. 中国实用妇科与产科杂志, 2016, 32(2): 117-22. |
| [4] |
Morice P, Leary A, Creutzberg C, et al. Endometrial cancer[J]. Lancet, 2016, 387(123): 1094-108. |
| [5] |
Renehan AG, Tyson M, Egger M, et al. Body-mass index and incidence of cancer:a systematic review and meta-analysis of prospective observational studies[J]. Lancet, 2008, 371(9612): 569-78. DOI:10.1016/S0140-6736(08)60269-X |
| [6] |
Grady D, Gebretsadik T, Kerlikowske K, et al. Hormone replacement therapy and endometrial cancer risk:a meta-analysis[J]. Obstet Gynecol, 1995, 85(2): 304-13. DOI:10.1016/0029-7844(94)00383-O |
| [7] |
Moxley KM, Mcmeekin DS. Endometrial carcinoma:a review of chemotherapy, drug resistance, and the search for new agents[J]. Oncologist, 2010, 15(10): 1026-33. DOI:10.1634/theoncologist.2010-0087 |
| [8] |
Mcdonald ME, Bender DP. Endometrial cancer:obesity, genetics, and targeted agents[J]. Obstet Gynecol Clin North Am, 2019, 46(1): 89-105. |
| [9] |
刘琼茹, 杨文丽, 蔡育波, 等. 子宫内膜癌化疗反应相关基因的拷贝数变异分析[J]. 今日药学, 2018, 28(3): 1-10. |
| [10] |
Zhang X, Zhang L, Lin B, et al. Phospholipid phosphatase 4 promotes proliferation and tumorigenesis, and activates Ca2+-permeable cationic Channel in lung carcinoma cells[J]. Mol Cancer, 2017, 16(1): 147. DOI:10.1186/s12943-017-0717-5 |
| [11] |
张鑫, 林永文, 郑爱华, 等. 三七皂苷R1对过氧化氢诱导大鼠星形胶质细胞凋亡的影响[J]. 中华临床医师杂志:电子版, 2013, 7(15): 7048-53. |
| [12] |
廖伟华, 杨力芳, 姜武忠, 等. DCE-MRI定量参数评价放疗前后鼻咽癌肿瘤血管变化及其对预后评估的价值[J]. 南方医科大学学报, 2015, 35(7): 954-9. DOI:10.3969/j.issn.1673-4254.2015.07.05 |
| [13] |
Zhang X, Ren D, Guo L, et al. Thymosin beta 10 is a key regulator of tumorigenesis and metastasis and a novel serum marker in breast cancer[J]. Breast Cancer Res, 2017, 19(1): 15. DOI:10.1186/s13058-016-0785-2 |
| [14] |
陈纪超, 吴旭. miR-203通过靶向FABP4抑制肺癌细胞的转移[J]. 南方医科大学学报, 2018, 38(5): 578-83. DOI:10.3969/j.issn.1673-4254.2018.05.012 |
| [15] |
林碧华, 陈婧, 郭春连, 等. 鼻咽癌肿瘤干细胞高表达SOD2可对抗顺铂的杀伤作用[J]. 天津医药, 2015, 43(6): 577-81. |
| [16] |
Zhang X, Ren D, Wu X, et al. miR-1266 contributes to pancreatic cancer progression and chemoresistance by the STAT3 and NF-κB signaling pathways[J]. Mol Ther NucleicAcids, 2018, 11(1): 142-58. DOI:10.1016/j.omtn.2018.01.004 |
| [17] |
Ren D, Dai Y, Yang Q, et al. Wnt5a induces and maintains prostate cancer cells dormancy in bone[J]. J Exp Med, 2019, 216(2): 428-49. DOI:10.1084/jem.20180661 |
| [18] |
Onishi K, Zandstra PW. LIF signaling in stem cells and development[J]. Development, 2015, 142(13): 2230-6. DOI:10.1242/dev.117598 |
| [19] |
Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF)[J]. Cytokine Growth Factor Rev, 2015, 26(5): 533-44. DOI:10.1016/j.cytogfr.2015.07.001 |
| [20] |
Liu SC, Hsu T, Chang YS, et al. Cytoplasmic LIF reprograms invasive mode to enhance NPC dissemination through modulating YAP1-FAK/PXN signaling[J]. Nat Commun, 2018, 9(1): 5105. DOI:10.1038/s41467-018-07660-6 |
| [21] |
Ruan Y, He J, Wu W, et al. Nac1 promotes self-renewal of embryonic stem cells through direct transcriptional regulation of c-Myc[J]. Oncotarget, 2017, 8(29): 47607-18. DOI:10.18632/oncotarget.17744 |
| [22] |
Dolatabadi S, Jonasson E, Lindén M, et al. JAK-STAT signalling controls cancer stem cell properties including chemotherapy resistance in myxoid liposarcoma[J]. Int J Cancer, 2019, 145(2): 435-49. DOI:10.1002/ijc.32123 |
| [23] |
Shi Y, Gao W, Lytle NK, et al. Targeting LIF-mediated paracrine interaction for pancreatic cancer therapy and monitoring[J]. Nature, 2019, 569(7754): 131-5. DOI:10.1038/s41586-019-1130-6 |
| [24] |
Buckley AM, Lynam-Lennon N, Kennedy SA, et al. Leukaemia inhibitory factor is associated with treatment resistance in oesophageal adenocarcinoma[J]. Oncotarget, 2018, 9(72): 33634-47. |
| [25] |
Edwards LA, Li A, Berel D, et al. ZEB1 regulates glioma stemness through LIF repression[J]. Sci Rep, 2017, 7(1): 69. DOI:10.1038/s41598-017-00106-x |
| [26] |
Yu HY, Yue X, Zhao YH, et al. LIF negatively regulates tumoursuppressor p53 through Stat3/ID1/MDM2 in colorectal cancers[J]. Nat Commun, 2014, 5: 55218. |
| [27] |
Kang MJ, Kim J, Jang JY, et al. 22q11-q13 as a hot spot for prediction of disease-free survival in bile duct cancer:integrative analysis of copy number variations[J]. Cancer Genet, 2014, 207(3): 57-69. DOI:10.1016/j.cancergen.2014.02.003 |
| [28] |
Rosario GX, Stewart CL. The multifaceted actions of leukaemia inhibitory factor in mediating uterine receptivity and embryo implantation[J]. Am J Reprod Immunol, 2016, 75(3): 246-55. DOI:10.1111/aji.12474 |
| [29] |
Li Z, Zhu Y, Li H, et al. Leukaemia inhibitory factor in serum and follicular fluid of women with polycystic ovary syndrome and its correlation with IVF outcome[J]. Reprod Biomed Online, 2018, 36(4): 483-9. DOI:10.1016/j.rbmo.2017.12.020 |
| [30] |
Li Q, Louden E, Zhou J, et al. Stress forces first lineage differentiation of mouse embryonic stem cells; validation of a HighThroughput screen for toxicant stress[J]. Stem Cells Dev, 2019, 28(2): 101-13. DOI:10.1089/scd.2018.0157 |
 2020, Vol. 40
2020, Vol. 40

