2. 河南大学人民医院(河南省人民医院)影像科,河南 郑州 450003
2. Department of Imaging, People's Hospital of Henan University, Zhengzhou 450003, China
快速眼动睡眠行为障碍(RBD)是指在快眼动(REM)睡眠期出现的与梦境相关的异常行为,通常表现为暴力行为,可导致自身或同床者受伤,并破坏睡眠。分为特发性RBD(iRBD)及继发性RBD。iRBD病因未明,作为一种独立症状单独出现,无其他伴随症状,年发病率为0.38%~0.5%,70岁后发病率为6%[1],男性多于女性。纵向研究发现iRBD与帕金森、路易体痴呆和多系统萎缩等α-突触核蛋白病密切相关,94%的iRBD患者在患病14年后转化成为α-突触核蛋白病[2],且15%~60%的帕金森患者合并有iRBD[3],因此认为iRBD是帕金森的临床前期[4];帕金森是第2大类神经变性病,目前尚无根治药物,早诊断、早干预,可延缓疾病的发展,因此iRBD可做帕金森早期干预的窗口。iRBD颅内结构影像无明显异常,纹状体突触前膜多巴转运体摄取示踪剂能力下降[5],但需要注射示踪剂,且费用昂贵,不利于临床推广,目前尚缺乏其他有效的生物标记物。磁共振弥散张量成像(DTI)可检测白质纤维束的完整性,可用于疾病早期筛查及鉴别[6],但目前的研究报告结果不一[7],可能与样本量及分析手段有关。人脑具有网络结构特点,正常情况下呈现高效、节能“小世界”模式[8],利用图论原理分析人脑网络特点更能真实反映大脑的整合与分割功能,目前,尚无使用图论分析iRBD DTI结构网络的文献报道。因此,我们拟利用图论原理对iRBD患者的DTI成像数据进行分析,以期寻找iRBD白质纤维网络早期异常改变,为iRBD提供早期病理改变的依据。
1 资料和方法 1.1 研究对象选取2015年12月~2018年12月就诊于河南省人民医院的iRBD患者20例(男性14例),年龄62.60±9.39岁。入组标准:所有患者均行夜间多导睡眠监测(PSG),最终诊断符合睡眠障碍国际分类第3版iRBD诊断标准[9],同期选择年龄60.27±7.60岁、性别(男性13例)相匹配的22名门诊健康体检者作为健康对照(HC)组。
排除标准:排除结构磁共振异常患者;排除其他中枢或周围神经系统疾病者;排除严重心肺肝肾恶性肿瘤等全身疾病患者;排除药物、酒精依赖者;排除焦虑、抑郁等精神疾病患者;排除文盲、失聪、严重痴呆等不能配合的患者;排除继发性RBD患者;排除伴其他睡眠障碍患者;排除体内金属置入患者。所有受试者均需在知情情况下签署知情同意书。本研究已经获得河南省人民医院医学伦理委员会批准[批号:(2017)伦审第(05)号]。
1.2 方法 1.2.1 检查方法及仪器所有受试者均行量表评估、PSG及MRI检查。并通过UPDRS评分及Hoehn-Yahr分期数据进行精神、行为和情绪,日常生活活动及运动评估。PSG检查应用澳大利亚康迪E型多导睡眠监测系统,MRI应用美国GE Discovery MR 750 3.0T超导型MRI扫描仪。
1.2.2 MRI检查头部MRI检查梯度场强50 mT/m,8通道头部线圈,扫描序列包括T1-三维快速扰相梯度回波序列(3D-FSPGR)和DTI序列。T1-3D-FSPGR:重复时间(TR)8.20 ms、回波时间(TE)3.20 ms、翻转时间(T1)450 ms,扫描视野(FOV)24 cm×24 cm,矩阵256× 256,激励次数(NEX)1次,扫描层厚1 mm、层间距0 mm,扫描时间287 s、层数156层,范围覆盖颅底至颅顶全部脑组织。DTI序列:重复时间8000 ms、回波时间3.20 ms,扫描视野25.60 cm×25.60 cm,矩阵128 ×128,层厚2.50 mm、层间距0 mm,扫描时间520 s、层数63层,扫描范围覆盖颅底至颅顶全部脑组织。
1.2.3 图像数据处理DTI数据处理及网络构建:在Matlab R2016软件平台上,使用DCP(Diffusion Connectome Pipeline,https://www.nitrc.org/projects/dcp )软件进行数据处理:将DICOM格式数据转换为NIFTI格式,进行头动校正和涡流校正,计算张量值。然后进行纤维示踪:FA域值选取0.1~1.0,转角小于45 ℃,反转方向以适应跟踪。以ALL(automated anatomical labeling, ALL)90模板划分的脑区进行大脑分割,以90个脑区做为节点;将标准化MNI模板配准到个体T1,再与弥散张量空间配准,将标准化信息影射到弥散张量空间,再进行标准化,以ALL模板90个脑区为节点,构建平均弥散张量的网络矩阵;基于图论的脑网络拓扑属性特征分析:使用GRAETNA 2.0工具包(http://www.nitrc.org/projects/gretna/ )计算二值化结构脑网络拓扑属性,其中整体拓扑属性指标包括:小世界属性σ、聚类系数Cp、特征性最短路径长度Lp、整体效率Eglob、局部效率Eloc、网络同配性Assortativity;局部拓扑属性包括:节点度、节点效率、节点局部效率、节点最短路径、节点集群系数。
1.3 统计学分析使用SPSS19.0统计软件,对计量资料进行正态性及方差齐性检验,正态分布资料用均数±标准差表示,非正态分布资料用四分位数[M(Q25, Q75)]表示;正态分布资料采用独立样本T检验;非正态分布资料采用独立样本Mann-Whitney U检验;性别采用卡方检验;显著性阈值为P < 0.05。使用GRETNA 2.0软件包对脑网络整体及局部拓扑属性进行独立样本t检验,去除协变量:性别、教育程度、年龄对结果的影响,并进行FDR检验校正,显著性阈值为P < 0.05。对存在差异的网络拓扑属性与存在差异的UPDRS评分进行偏相关性分析,显著性阈值设为P < 0.05。用BrainNet软件生成图像。
2 结果 2.1 两组一般情况及量表结果iRBD组与HC组人口学统计在年龄(t=0.887,P=0.381)、性别(χ2=0.543,P=0.461)、受教育程度(t=0.333,P=0.741)差异均无统计学意义;UPDRS总分及H-Y分期两组比较显示:iRBD组UPDRS总分均高于HC组,H-Y分期评分两组间差异无统计学意义(表 1)。
| 表 1 iRBD组与HC组人口学信息及UPDRS、H-Y评分比较 Tab.1 Comparison of demographic data and UPDRS and H-Y scores between iRBD group and healthy control (HC) group |
整体拓扑属性:iRBD组与HC组比较小世界属性σ及聚类系数Cp均无统计学差异;iRBD组特征性最短路径长度Lp明显低于HC组,iRBD组整体效率Eglob、局部效率Eloc、网络同配性Assortativity明显高于HC组。
局部拓扑属性:iRBD组左苍白球节点度明显高于HC组,iRBD组左丘脑、颞上回、颞极和左右枕上回、右左豆状核以及右侧直回、杏仁核、缘上回、颞中回的节点效率明显高于HC组,左额上回、扣带回中部、顶上回和左右纺锤回以及右运动上区、中央后回、角回的节点局部效率明显高于HC组,左运动上区、苍白球、丘脑、颞上回、颞极和左右豆状核、左右枕上回以及右直回、杏仁核、缘上回、颞中回节点最短路径明显低于HC组,iRBD组左侧枕上回节点集群系数明显低于HC组(表 2)。
| 表 2 iRBD组与HC组弥散张量网络拓扑属性比较 Tab.2 Comparison of topological properties of diffusion tensor networks between iRBD and HC groups |
将iRBD组UPDRS异常评分与网络拓扑属性异常项相关分析结果显示:UPDRSⅠ评分与右侧缘上回节点效率、右侧纺锤回局部节点效率正相关(r=0.500、0.527,P < 0.05),与左侧枕上回节点集群系数负相关(r=-0.552,P < 0.05,图 1)。
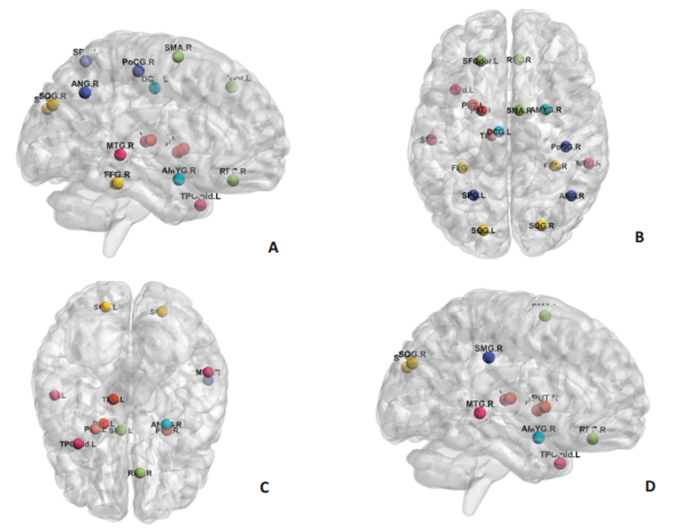
|
图 1 异常拓扑特征的节点分布图 Fig.1 Node distribution diagram of abnormal topological features. A, B: Distribution area with increased node degree, node efficiency and local efficiency; C, D: Distribution area with decreased node shortest path and node clustering coefficient. BrainNet viewer was used to generate the threedimensional images: green for frontal regions, yellow for occipital regions, red for striatal regions, pink for temporal regions, blue for marginal lobes, and dark blue for parietal regions. |
iRBD是PD的非运动症状,可能是PD的临床前期,我们使用UPDRS及HY分期对iRBD患者进行评估,结果显示:iRBD患者UPDRSⅠ、Ⅱ、Ⅲ评分均高于HC组;UPDRS Ⅰ是评价患者精神、行为和情绪方面的指标,UPDRS Ⅱ可评价患者日常生活活动,UPDRS Ⅲ评价患者运动情况,上述结果说明iRBD患者已出现精神、行为、情绪、日常生活活动及运动方面异常;HY分期评分主要评估运动损害情况,iRBD患者HY分期评分与HC组无统计学差异,提示运动情况基本正常,出现了与UPDRS Ⅲ不一致的结果,说明iRBD患者运动损害较轻。既往临床研究也发现iRBD患者存在精神、认知和运动方面异常[10]。本实验前期研究已经报告了这一结果,并且通过功能影像研究报告了其可能的病理依据即iRBD患者额叶运动区及顶叶均存在与黑质的异常功能连接[11]。
DTI能根据水分子弥散的方向和能力实现对白质纤维束的追踪及纤维完整性的探测,既往研究发现iRBD患者存在脑白质纤维损害,研究结果差异很大[7],可能与患者入选标准、磁共振扫描参数设置、样本量以及分析方法不同有关。由于大脑不同区域在处理信息时相互制约影响,脑内不同区域呈网络联系,Hagmann团队首次利用DTI建立了大脑结构连接网络,并证实其具有“小世界”特征[12];小世界属性指大脑在保证高效处理信息的同时尽可能减少所需的结构,既保证全局效率又具有较高的局部效率,同时兼顾大脑分离和整合的最佳平衡状态[13]。我们利用图论原理对iRBD患者DTI网络分析结果显示:iRBD患者的小世界属性σ和聚类系数Cp与HC相比无统计学差异,说明iRBD结构网络仍存在小世界属性;Cp可衡量局部网络的聚集程度,反映了网络局部信息传递能力;上述结果说明iRBD的结构网络在功能整合与分离方面仍具有高效、低耗能性能。特征性最短路径长度Lp衡量了全局网络的联通能力,值越小,全局信息传递能力越强;整体效率Eglob指是全局网络范围内长程信息的传递效率,局部效率Eloc是局部网络范围内短程的信息的传递效率,网络同配性是考察度值相近的节点是否倾向于互相连接;iRBD的Lp明显低于HC组、Eglob和Eloc以及网络同配性明显高于HC组,说明iRBD患者信息传递效率更高,有更多节点发生了连接,出现了网络节点错误连接,导致了网络整体及局部传输高效,伴RBD的PD患者及AD患者也出现了这种改变[14-15]。
本研究结果显示:iRBD患者额、颞、顶、枕及纹状体和边缘叶均出现节点异常特征。节点效率及局部效率均反映了节点在网络中的地位,效率越高,表明该节点输出能力越强,在网络中地位越重要;节点最短路径越小,传输信息能力越强,表明节点更高效;节点度越大说明该节点发生的连接越多,具有网络核心的作用;节点集群系数反映了网络对节点的容忍度,间接反映了网络对随机攻击的防御能力。我们的结果显示:iRBD患者右运动上区、左额上回节点局部效率增加,左运动上区节点最短路径缩短,提示iRBD患者运动上区及额上回出现了纤维功能过度代偿,可能与iRBD的运动发作有关;既往研究发现iRBD患者发作期运动上区血液过度灌注[16],非发作期呈现高糖代谢[17],同时发现iRBD患者额叶皮层萎缩,且与注意执行功能有关[18],间接支持了我们的结果。我们的结果显示:iRBD患者左颞上回、颞极节点效率显著增加、最短路径缩短,右颞中回节点效率增加、最短路径缩短,提示iRBD患者颞上、中回及颞极纤维功能过度代偿,可能与iRBD的情绪和认知损害有关;既往研究发现iRBD患者颞叶呈现过度灌注[19]及高糖代谢[17],可能与颞叶组织生发有关;同时颞叶皮层萎缩[18],与学习记忆相关[18]。我们的结果显示:iRBD患者右缘上回节点效率增加、最短路径缩短,左顶上回和右角回、中央后回节点局部效率增加,提示iRBD患者顶叶出现异常纤维连接,导致了异常的传输功能;既往研究也发现iRBD患者顶叶低灌注[20]、低糖代谢[21]。我们的结果显示:iRBD患者左右枕上回节点效率增加、最短路径缩短,左右纺锤回节点局部效率增加,左枕上回节点集群系数下降,提示iRBD患者枕叶出现了异常的纤维投射,且代偿能力下降;既往研究发现iRBD患者枕叶血流及糖代谢低下[22],炎症反应严重[23],皮质萎缩明显,且与空间认知损害有关[18],而且存在异常网络连接[24]。我们的结果显示:iRBD患者左苍白球节点度增加、最短路径缩短,左右豆状核、左丘脑节点效率增加、最短路径缩短,提示iRBD患者左侧苍白球出现了更多的连接,豆状核及丘脑也出现了大量的错误连接,导致了最短路径缩短、传输效率提高;既往大量的研究报道了iRBD纹状体区存在萎缩[25]、高糖代谢[17, 23]、突触前膜的异常[26]。我们的结果显示:iRBD患者右杏仁核及右直回节点效率增加、最短路径缩短,左扣带回中部节点局部效率增加,提示iRBD患者与情绪相关的解剖区域出现了异常的纤维连接;我们首次发现iRBD患者杏仁核异常,更好地解释了iRBD患者合并抑郁的原因。既往采用DTI研究iRBD的报道较少,仅有少数研究发现iRBD患者颞区、纹状体区及视区纤维束异常[27-28],糖代谢网络异常分布[29]与上述具有异常特征的节点分布部分吻合。伴RBD的PD患者结构网络也表现出左颞上回节点效率明显增强,也存在纺锤回、角回、直回节点拓扑特征异常,异常脑区分布在额、颞、顶、枕及纹状体区[14],与本研究结果具有相似性。而早期PD患者全脑结构网络及子网络的网络效率下降[30],与iRBD的网络属性存在不同,也提示iRBD未来可能转为快速进展型PD或伴痴呆的PD。因此本研究结果为iRBD早期病理损害提供了影像依据,也为iRBD未来转化提供了客观证据。
我们将iRBD患者UPDRS异常评分与其异常的脑网络拓扑特征进行相关分析,结果发现:UPDRS Ⅰ评分与右侧缘上回节点效率、右侧纺锤回局部节点效率正相关,与左侧枕上回节点集群系数负相关;UPDRS Ⅰ可评估患者的精神、行为和情绪方面的改变,由患者的智力、思维、抑郁及主动性构成,而缘上回与智力及思维有关[31],纺锤回及枕上回与思维与情绪有关[32],我们的相关结果进一步证实了临床症状与解剖结构的相关性。尚未发现UPDRS Ⅱ、UPDRS Ⅲ与异常的网络特征存在明显相关,可能与脑内损害程度有关。
样本量小是本实验的不足之处,仍需进一步扩大样本量,增加实验结果的可靠性;同样也需要其他实验室重复性研究进行验证。
| [1] |
Boot BP, Boeve BF, Roberts RO, et al. Probable rapid eye movement sleep behavior disorder increases risk for mild cognitive impairment and Parkinson disease: a population-based study[J]. Ann Neurol, 2012, 71(1): 49-56. DOI:10.1002/ana.22655 |
| [2] |
Gan-Or Z, Alcalay RN, Rouleau GA, et al. Sleep disorders and Parkinson disease; lessons from genetics[J]. Sleep Med Rev, 2018, 41(3): 101-12. |
| [3] |
Yoritaka A, Ohizumi H, Tanaka S, et al. Parkinson's disease with and without REM sleep behaviour disorder: are there any clinical differences[J]. Eur Neurol, 2009, 61(3): 164-70. DOI:10.1159/000189269 |
| [4] |
Postuma RB, Aarsland D, Barone P, et al. Identifying prodromal Parkinson's disease: pre-motor disorders in Parkinson's disease[J]. Mov Disord, 2012, 27(5): 617-26. DOI:10.1002/mds.24996 |
| [5] |
Bauckneht M, Chincarini A, De Carli F, et al. Presynaptic dopaminergic neuroimaging in REM sleep behavior disorder: a systematic review and meta-analysis[J]. Sleep Med Rev, 2018, 41(4): 266-74. |
| [6] |
Cochrane CJ, Ebmeier KP. Diffusion tensor imaging in parkinsonian syndromes: a systematic review and meta-analysis[J]. Neurology, 2013, 80(9): 857-64. DOI:10.1212/WNL.0b013e318284070c |
| [7] |
Bourgouin PA, Rahayel S, Gaubert M, et al. Neuroimaging of rapid eye movement sleep behavior disorder[J]. Int Rev Neurobiol, 2019, 144(7): 185-210. |
| [8] |
Sporns O. Graph theory methods: applications in brain networks[J]. Dialogues Clin Neurosci, 2018, 20(2): 111-21. |
| [9] |
Sateia MJ. International classification of sleep disorders-third edition[J]. Chest, 2014, 146(5): 1387-94. DOI:10.1378/chest.14-0970 |
| [10] |
Arnulf I. REM sleep behavior disorder: motor manifestations and pathophysiology[J]. Mov Disord, 2012, 27(6): 677-89. DOI:10.1002/mds.24957 |
| [11] |
张红菊, 白莹莹, 王泓力, 等. 快速眼动睡眠期行为障碍患者运动和认知功能障碍及脑功能连接研究[J]. 中国现代神经疾病杂志, 2017, 17(9): 648-53. DOI:10.3969/j.issn.1672-6731.2017.09.005 |
| [12] |
Hagmann P, Kurant M, Gigandet X, et al. Mapping human wholebrain structural networks with diffusion MRI[J]. PLoS One, 2007, 2(7): e597. DOI:10.1371/journal.pone.0000597 |
| [13] |
Farahani FV, Karwowski W, Lighthall NR. Application of graph theory for identifying connectivity patterns in human brain networks: a systematic review[J]. Front Neurosci, 2019, 13(5): 585. |
| [14] |
Guo T, Guan X, Zeng Q, et al. Alterations of brain structural network in parkinson's disease with and without rapid eye movement sleep behavior disorder[J]. Front Neurol, 2018, 9(2): 334. |
| [15] |
Dai ZJ, Lin QX, Li T, et al. Disrupted structural and functional brain networks in Alzheimer's disease[J]. Neurobiol Aging, 2019, 75(3): 71-82. |
| [16] |
Mayer G, Bitterlich M, Kuwert T, et al. Ictal SPECT in patients with rapid eye movement sleep behaviour disorder[J]. Brain, 2015, 138(Pt5): 1263-70. |
| [17] |
Meles SK, Renken RJ, Janzen A, et al. The metabolic pattern of idiopathic REM sleep behavior disorder reflects early-stage parkinson disease[J]. J Nucl Med, 2018, 59(9): 1437-44. DOI:10.2967/jnumed.117.202242 |
| [18] |
Rahayel S, Postuma RB, Montplaisir J, et al. Cortical and subcortical gray matter bases of cognitive deficits in REM sleep behavior disorder[J]. Neurology, 2018, 90(20): e1759-70. DOI:10.1212/WNL.0000000000005523 |
| [19] |
Dang-Vu TT, Gagnon JF, Vendette M, et al. Hippocampal perfusion predicts impending neurodegeneration in REM sleep behavior disorder[J]. Neurology, 2012, 79(24): 2302-6. DOI:10.1212/WNL.0b013e318278b658 |
| [20] |
Vendette M, Montplaisir J, Gosselin N, et al. Brain perfusion anomalies in rapid eye movement sleep behavior disorder with mild cognitive impairment[J]. Mov Disord, 2012, 27(10): 1255-61. DOI:10.1002/mds.25034 |
| [21] |
Fujishiro H, Iseki E, Kasanuki K, et al. A follow up study of nondemented patients with primary visual cortical hypometabolism: Prodromal dementia with Lewy bodies[J]. J Neurol Sci, 2013, 334(1/ 2): 48-54. |
| [22] |
Ge J, Wu P, Peng S, et al. Assessing cerebral glucose metabolism in patients with idiopathic rapid eye movement sleep behavior disorder[J]. J Cereb Blood Flow Metab, 2015, 35(12): 2062-9. DOI:10.1038/jcbfm.2015.173 |
| [23] |
Stokholm MG, Iranzo A, Østergaard K, et al. Extrastriatal monoaminergic dysfunction and enhanced microglial activation in idiopathic rapid eye movement sleep behaviour disorder[J]. Neurobiol Dis, 2018, 115(7): 9-16. |
| [24] |
Geddes MR, Tie Y, Gabrieli JD, et al. Altered functional connectivity in lesional peduncular hallucinosis with REM sleep behavior disorder[J]. Cortex, 2016, 74(6): 96-106. |
| [25] |
Ellmore TM, Hood AJ, Castriotta RJ, et al. Reduced volume of the putamen in REM sleep behavior disorder patients[J]. Parkinsonism Relat Disord, 2010, 16(10): 645-9. DOI:10.1016/j.parkreldis.2010.08.014 |
| [26] |
Knudsen K, Fedorova TD, Hansen AK, et al. In-vivo staging of pathology in REM sleep behaviour disorder: a multimodality imaging case-control study[J]. Lancet Neurol, 2018, 17(7): 618-28. DOI:10.1016/S1474-4422(18)30162-5 |
| [27] |
Unger MM, Belke M, Menzler K, et al. Diffusion tensor imaging in idiopathic REM sleep behavior disorder reveals microstructural changes in the brainstem, substantia nigra, olfactory region, and other brain regions[J]. Sleep, 2010, 33(6): 767-73. DOI:10.1093/sleep/33.6.767 |
| [28] |
张亚萌, 王泓力, 白莹莹, 等. 特发性快速眼动睡眠期行为障碍纹状体微结构磁共振成像研究[J]. 中国现代神经疾病杂志, 2017, 17(5): 356-63. DOI:10.3969/j.issn.1672-6731.2017.05.008 |
| [29] |
Verger A, Klesse E, Chawki MB, et al. Brain PET substrate of impulse control disorders in Parkinson's disease: a metabolic connectivity study[J]. Hum Brain Mapp, 2018, 39(8): 3178-86. DOI:10.1002/hbm.24068 |
| [30] |
Vriend C, van den Heuvel OA, Berendse HW, et al. Global and subnetwork changes of the structural connectome in de novo parkinson's disease[J]. Neuroscience, 2018, 386(8): 295-308. |
| [31] |
Rocca R, Coventry KR, Tylén K, et al. Language beyond the language system: dorsal visuospatial pathways support processing of demonstratives and spatial language during naturalistic fast fMRI[J]. Neuroimage, 2019, 29(8): 116128. |
| [32] |
Li F, Yin S, Feng P, et al. The cognitive up- and down-regulation of positive emotion: evidence from behavior, electrophysiology, and neuroimaging[J]. Biol Psychol, 2018, 136(7): 57-66. |
 2020, Vol. 40
2020, Vol. 40

