2. 南方医科大学 南方医院中医科,广东 广州 510515
2. Department of Traditional Chinese Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
白芍总苷(TGP)是由芍药植物根中提取的一组糖苷类物质,包括芍药苷、羟基芍药苷、芍药花苷、芍药内酯苷、苯甲酰芍药苷等,是中药白芍的主要有效成分[1]。既往研究证实TGP可通过增加Foxp3脱甲基作用增加SLE患者CD4+CD25+Foxp3+Treg的比例与数目,辅助治疗系统性红斑狼疮(SLE)[2-3];TGP可通过抑制DCs细胞的活化和成熟,影响CIA小鼠Th1和Th17的分化,缓解关节炎症损伤[4];TGP可通过降低Th17/Treg比例及IL-17、IL-6、TNF-α的分泌减轻TNBS诱导的大鼠结肠炎模型[5];另外文献报道TGP可体外抑制ConA诱导的小鼠脾脏淋巴细胞增殖及IL-4、IFN-γ的分泌[6]。因此说明TGP具有重要的免疫调节作用及治疗自身免疫病的应用前景。
自身免疫病的发生与T淋巴细胞功能异常关系密切,尤其是自身反应性T淋巴细胞,而活化诱导的细胞死亡途径(AICD)在维持免疫耐受及清除自身反应T淋巴细胞的过程中起到至关重要的作用[7-9]。目前关于TGP对T淋巴细胞AICD作用及细胞增殖的影响尚无报道,其相关的机制研究也不明确。本研究通过分析TGP对T淋巴细胞体外增殖及AICD的影响,进一步阐明其免疫调节机制,为临床用药提供科学依据。
1 材料和方法 1.1 材料 1.1.1 实验动物SPF级C57BL/6雌性小鼠,8~12周龄,购于南方医科大学实验动物中心(2011-0074)。于实验动物中心SPF级动物房检疫1周后封闭饲养。所有小鼠均单笼饲养,饲以普通饲料,自由摄食摄水,所用饲料、垫料、饮用水均经高压灭菌处理。实验环境温度24~26 ℃,湿度60%~80%,每12 h交替照明,均自动调节控制。本研究通过南方医科大学实验动物伦理委员会批准,伦理审查号:2016113。
1.1.2 药品与试剂白芍总苷(TGP,商品名称:帕夫林,宁波立华制药有限公司,国药准字H20055058),规格为每片0.4 g(含芍药苷104 mg),以PBS配成所需浓度,4 ℃保存备用。Dynabeads™ Mouse T-Activator CD3/ CD28(ThermoFisher);抗鼠FITC-CD3、FITC-CD69、APC-Cy7-CD4、PE-Cy7-CD8和anti-CD8 biotin单克隆抗体(BD);PE-FasL、FITC-Fas(Invitrogen);PE Annexin V Apoptosis Detection Kit Ⅰ(BD);Pan T Cell Isolation Kit Ⅱ及LS column(Miltenyi);cellTraceTM cfse cell proliferation kit(Invitrogen);CountBright Absolute Counting beads(ThermoFisher);RNA Isolation Kit(QIAGEN);cDNA Synthesis Kits及SYBR® Green Supermixes(Bio-rad);Western抗体:anti-Bcl-2 polyclonal antibody(Bioss);胎牛血清(Gibco)。
1.2 方法 1.2.1 小鼠T淋巴细胞制备、分组小鼠麻醉处死后,无菌条件下取出脾脏,置于70 µm/孔的尼龙滤网上研磨并冲洗,离心(300 g×10 min,下同)。去除上清,用ACK裂解红细胞,PBS+2%FBS洗涤两次,过滤,台盼蓝计数活细胞数,细胞重悬至每107/40 µL,孵育Pan T cocktail 10 min(如需获得CD4阳性T细胞,加入anti-CD8 biotin)后洗涤,继续孵育anti-biotin beads 15 min,离心重悬后,通过LS colum分选T淋巴细胞,采用FITCCD3e进行染色鉴定分选出的T淋巴细胞纯度。按照TGP溶液浓度(0、50、100、200 µg/mL)分为空白组、TGP低中高剂量组。
1.2.2 细胞培养用含10%胎牛血清,100 U/mL青霉素和100 µg/mL链霉素的RPMI 1640培养基重悬T淋巴细胞至1.25×106/mL,将600 µL T淋巴细胞悬液接种至24孔板中,7.5×105/孔,分别加入100 µL不同浓度的TGP溶液,予500 µL anti-CD3/28 beads溶液刺激T淋巴细胞活化增殖,每孔终体积为1200 µL。在37 ℃、50 mL/L CO2培养箱孵育24、48 h,分别于不同的时间点收集细胞进行检测。
1.2.3 anti-CD3/CD28 beads刺激T细胞活化增殖Dynabeads® Mouse T-Activator CD3/CD28按25 µL/ 106 T cells计算:即anti-CD3/CD28 beads试剂375 µL溶于10 mL RPMI 1640完全培养基中,使用前反复吹打混匀,24孔板中每孔加入500 µL混悬液。
1.2.4 T淋巴细胞早期活化标志CD69检测T淋巴细胞与TGP溶液、anti-CD3/CD28 beads共培养24 h后,收集各孔细胞至流式管中,经1500 r/min离心5 min后倒掉上清,每根管加入100 µL PBS、0.25 µL FITC-CD69、0.1 µL PE-cy7-CD8、0.3 µL APC-cy7-CD4,室温避光孵育10 min,加入2 mL PBS洗涤后重悬至250 µL上机检测。
1.2.5 T淋巴细胞克隆扩增检测T淋巴细胞与TGP溶液、anti-CD3/CD28 beads共培养48 h后,收集各孔细胞至流式管中,经1500 r/min离心5 min后倒掉上清,每根管加入100 µL PBS、0.1 µL PE- cy7-CD8、0.3 µL APCcy7-CD4,室温避光孵育10 min,加入2 mL PBS洗涤,接着用1×AnnexinV专用buffer 100 µL、1 µL AnnexinV、1 µL 7AAD室温避光孵育10 min,不需要离心,直接再补充150 µL PBS及50 µL CountBright Absolute Counting beads后立即上机检测,计数活细胞数目。按总细胞/总beads=细胞浓度×体积/beads浓度×体积计算。
1.2.6 T淋巴细胞活性检测T淋巴细胞与TGP溶液、anti-CD3/CD28 beads共培养24或48 h后,收集各孔细胞至流式管中,经1500 r/min离心5 min后倒掉上清,首先进行表面CD4、CD8染色(同上),接着用1×AnnexinV专用buffer 100 µL、1 µLAnnexinV、1 µL 7AAD室温避光孵育10 min,不需要离心,直接再补充150 µL PBS后立即上机检测。
1.2.7 T淋巴细胞分裂增殖检测将2× 107的T细胞重悬于1 mL PBS+5%FBS的溶液中,加入1 µL CFSE储存液(5 mmoL),迅速转移至37 ℃恒温水浴锅中,避光孵育5 min,每隔1 min摇晃几次。用FBS+2% FBS溶剂洗涤两次后计数。将标记CFSE的T淋巴细胞与TGP溶液、anti-CD3/CD28 beads共培养48 h后,收集各孔细胞至流式管中,经1500 r/min离心5 min后倒掉上清,进行表面CD4、CD8及细胞活性染色,运用流式分析活细胞分裂代数及比例。
1.2.8 RT-PCR检测通过免疫磁珠阴性分选获得CD4+ T细胞,将7.5×105 CD4+ T淋巴细胞接种于24孔板,分别加空白或TGP处理,24 h后收集细胞,使用RNA Isolation Kit提取总RNA,检测纯度后按照cDNA Synthesis Kits进行逆转录,以GAPDH为内参,检测Fas和FasL mRNA相对表达量。引物序列:(GAPDH)Forward 5'-TCGGTGTGAACGGATTTGGC-3',Reverse 5'-CCT TGACTGTGCCGTTGAATTTG-3';(FasL)forward5'-GCAGAAGGAACTGGCAGAAC-3′,Reverse5'-TTAAATGGGCCACACTCCTC-3';(Fas)forward 5'-ATGCACACTCTGCGATGAAG-3',Reverse 5'-CAGTGTTCACAGCCAGGAGA-3'。
1.2.9 流式细胞仪检测Fas\FasL蛋白表达T淋巴细胞与TGP溶液、anti-CD3/CD28 beads共培养24 h后,收集各孔细胞至流式管中,经1500 r/min离心5 min后倒掉上清,每根管加入100 µL PBS、0.1 µL PE-cy7-CD8、0.3 µLAPC-cy7-CD4、0.5 µL FITC-Fas、2.5 µL PE-FasL进行染色,温避光放置10 min,加入2 mL PBS洗涤后重悬至250 µL上机检测。
1.2.10 Western blot法分析Bcl-2表达使用免疫磁珠分选CD4+T淋巴细胞,与TGP溶液、anti-CD3/CD28 beads共培养24 h后,收集各组细胞,提取各组细胞总蛋白并定量,98 ℃下变性5 min,12%聚丙烯酰氨凝胶电泳分离含等量蛋白质样品,湿法转印至PVDF膜;用5%牛血清白蛋白(BSA)封闭液室温封闭1 h;然后将膜片与抗鼠β-actin抗体(1:1000,Bioss)、抗鼠Bcl-2抗体(1: 1000,Bioss)在4 ℃孵育过夜;室温下TBST洗膜3次,每次10 min;加入二抗工作液,室温下摇床孵育1 h,使用TBST洗涤3次,5 min/次;ECL发光试剂盒显影,采用Image J软件分析分析条带。
1.2.11 数据分析及统计学处理全部流式细胞学数据均由采用FlowJo(V10.5.3,美国BD公司)进行分析,GraphPad prism7.0(GraphPad Software,美国)进行作图及统计处理,计量资料以均数±标准差表示,组间采用非配对t检验进行比较,P <0.05为差异有统计学意义。
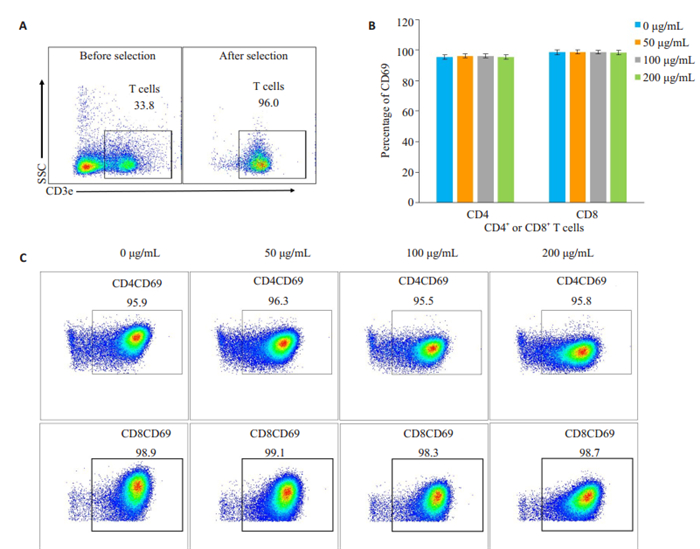
2 结果 2.1 TGP对小鼠T淋巴细胞早期活化的影响T淋巴细胞占C57BL/6小鼠脾脏细胞比例约30%左右,经免疫磁珠分选后纯度达95%以上(图 1A)。流式细胞术检测TGP处理24 h后T淋巴细胞早期活化标志CD69表达发现,各组间CD69阳性CD4或CD8 T淋巴细胞比例均大于95%,且空白组与TGP处理组间CD69比例无明显差异(图 1B,C)。
|
图 1 纯化小鼠脾脏T淋巴细胞并刺激细胞活化 Fig.1 Purification and activation of mouse T cells. A: Mouse T cells were purified from the spleen cells by MACS negative selection; B, C: Percentage of CD69-positive cells after stimulation of the cells with anti-CD3/CD28 for 24 h. |
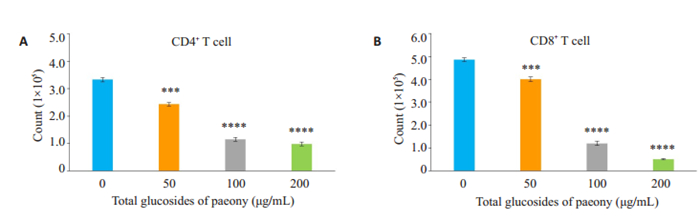
TGP处理48 h后,通过流式技术计数各组间存活(即AnnexinV阴性7AAD阴性)CD4或CD8 T淋巴细胞数目发现,随着TGP浓度的增加,存活的CD4或CD8 T淋巴细胞数目较空白组(0 μg/mL)显著降低,且药物浓度越高,降幅越明显,差异具有统计学意义(图 2,P <0.05)。
|
图 2 白芍总苷对小鼠T细胞克隆扩增的影响 Fig.2 Effects of TGP on clonal expansion of mouse T cells. A, B: Mouse T cells were stimulated with anti-CD3/CD28 and treated with TGP. After incubation for 48 h, AnnexinV-7AAD- (live) CD4- and CD8-positive T cells were counted (***P < 0.001, ****P < 0.0001 vs 0 μg/mL). |
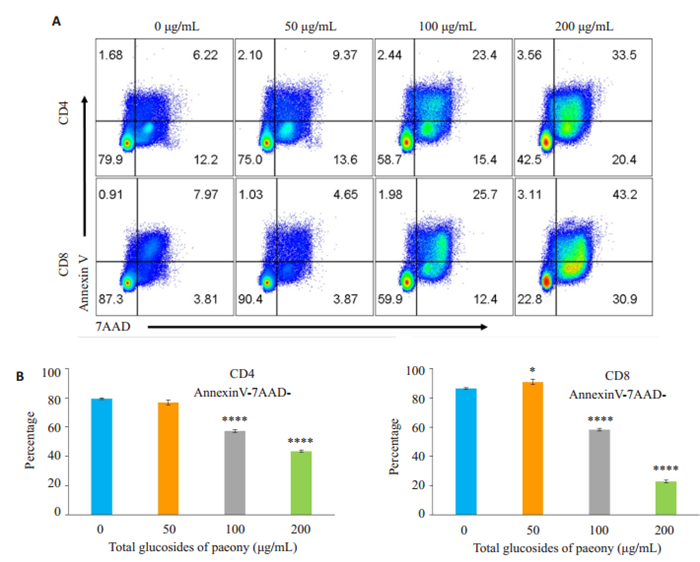
TGP处理48 h后,通过AnnexinV/7AAD染色检测T淋巴细胞存活情况发现,100 μg/mL和200 μg/mL TGP组CD4或CD8 T淋巴细胞活细胞比例明显降低,与空白组(0 μg/mL)比较具有统计学差异(图 3,P <0.05),而50 μg/mL TGP组对活化诱导的CD4 T淋巴细胞死亡无显著影响(图 3,P>0.05),甚至对活化诱导的CD8 T淋巴细胞死亡有一定抑制作用(图 3,P <0.05)。
|
图 3 白芍总苷对活化诱导T淋巴细胞死亡的影响 Fig.3 Effect of TGP on activation-induced T cell death at 48 h. A: Mouse T cells were stimulated with anti-CD3/ CD28 and treated with TGP for 48 h, followed by staining with Annexin V and 7-AAD; B: Percentages of Annexin V 7AAD- (live) CD4- and CD8-positive T cells (*P < 0.05, ****P < 0.0001 vs 0 μg/mL). |
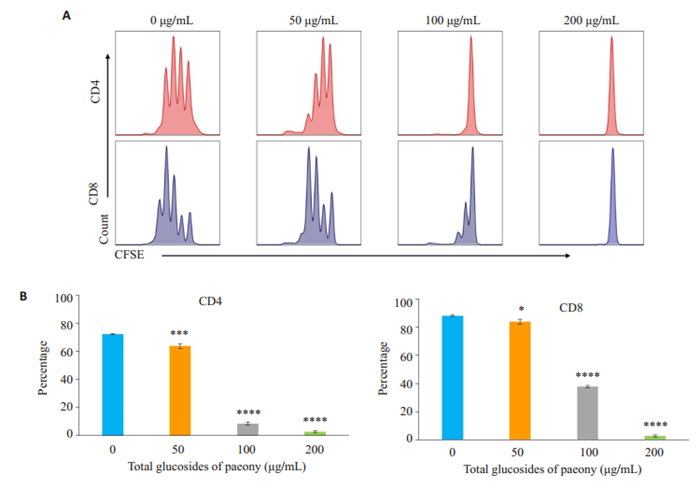
利用活细胞染料CFSE标记T淋巴细胞,予antiCD3/CD28刺激其增殖,48 h后运用流式技术检测活细胞增殖情况发现,与空白组(0 μg/mL)相比,TGP各处理组CD4或CD8 T淋巴细胞分裂代数和已分裂细胞比例显著降低,且药物浓度越高,细胞分裂代数越少、已分裂细胞比例越低,差异具有统计学意义(图 4,P <0.05)。
|
图 4 白芍总苷对小鼠T细胞增殖的影响 Fig.4 Effect of TGP treatment for 24 h on T cell proliferation. A: CFSE dilution in activated CD4- and CD8-positive T cells; B: Percentage of divided T cells at 48 h. *P < 0.05, ***P < 0.001, ****P < 0.0001 vs 0 μg/mL. |
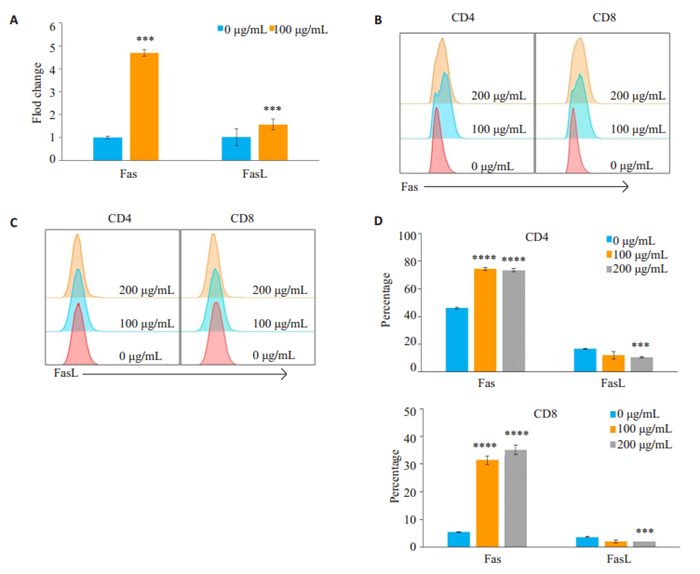
RT-PCR结果提示,100 μg/mL TGP处理CD4+ T淋巴细胞后,Fas和FasL mRNA水平较空白组(0 μg/mL)升高,其中Fas升高更明显(图 5A,P <0.05)。进一步检测T淋巴细胞表面Fas/FasL蛋白表达量,发现经TGP处理后,CD4+和CD8+T淋巴细胞表面Fas表达量明显升高,与空白组均有显著性差异(图 5B~D,P <0.05),而FasL表达量变化不明显,甚至高浓度时FasL表达量轻微降低(图 5D,P <0.05)。
|
图 5 TGP通过促进Fas表达加速T细胞AICD Fig.5 TGP accelerates activation-induced cell death (AICD) by increasing the expression of Fas. A: Fas and FasL mRNA expressions detected by RT-PCR in control and 100 μg/mL TGP-treated cells; B, C: Detection of Fas or FasL expression by flow cytometry; D: Percentage of CD4 or CD8 positivity in Fas- and FasL-positive T cells. ***P < 0.001, ****P < 0.0001 vs 0 μg/mL. |
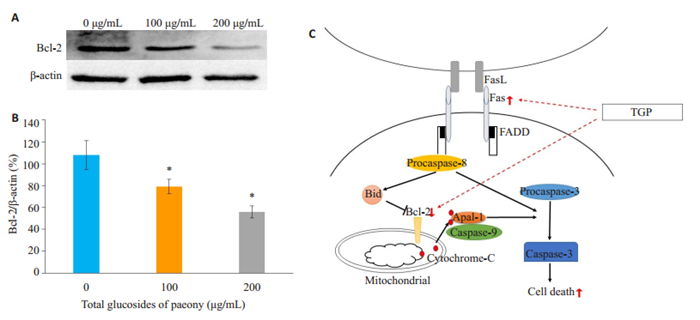
Bcl-2是Fas的下游信号通路中的重要调控分子之一(图 6C),且Bcl-2与细胞凋亡密切相关。Western blot结果显示:与空白对照组相比,中剂量和高剂量TGP处理组Bcl-2的表达量显著下调,且TGP药物浓度越高,Bcl-2表达量越低,差异具有统计学意义(图 6A,B,P <0.05)。
|
图 6 TGP对活化T淋巴细胞Bcl-2表达的影响 Fig.6 Effects of TGP on expression of Bcl-2 in activated mouse T cells. A, B: Bcl-2 protein expression was detected by Western blotting; C: Schematic illustration of the action of TGP on Fas and Bcl-2 pathway. *P < 0.05 vs 0 μg/mL group. |
在本研究中,我们发现TGP低、中、高剂量组均能显著抑制anti-CD3/CD28诱导的T淋巴细胞体外克隆扩增,表现为共培养48 h后,存活T淋巴细胞绝对计数显著降低,且抑制作用与TGP浓度呈正相关,而T淋巴细胞克隆扩增是细胞增殖和细胞死亡的综合结果[10]。首先,我们利用AnnexinV/7AAD染色观察TGP处理后细胞存活情况,研究结果显示,与空白组相比,中、高剂量TGP均可显著促进T淋巴细胞AICD作用。
AICD即活化诱导的细胞死亡,是T淋巴细胞程序性死亡的主要类型之一,是指当活化T淋巴细胞再次接受相同抗原刺激时,会自发程序性凋亡,对于维持自身耐受,清除自身反应性T淋巴细胞具有重要意义,该过程主要由Fas-FasL信号通路介导[11-13]。Fas分子也被称为“死亡分子”,是一种Ⅰ型跨膜糖蛋白,属于肿瘤坏死因子受体和神经生长因子受体超家族成员,而Fas几乎不表达于初始T淋巴细胞,但在T淋巴细胞活化后表达量升高[14-15]。当Fas与FasL结合后,将启动一系列凋亡信号的跨膜传递,首先Fas分子的胞内段修饰后与胞内的连接蛋白分子FADD结合,通过形成由Fas /FADD/ procaspase-8死亡诱导信号复合物活化直接活化caspase酶家族或通过Bcl-2等介导的线粒体凋亡途径,诱发细胞凋亡[16-17]。动物实验证实Fas基因突变将导致T淋巴细胞或B淋巴细胞无法启动由Fas/FasL介导的死亡信号传导,不能形成负反馈调节,进而导致自身反应性T淋巴细胞增多形成病理性T淋巴细胞,引起淋巴结和脾脏肿大,可呈现SLE样的全身反应[18-19]。Bcl-2是Fas的下游信号调控的关节环节之一,与细胞抗凋亡关系密切,而既往实验研究也证实敲低Bcl-2表达可显著促进jurkat T细胞AICD,而过表达Bcl-2的可抑制T淋巴细胞死亡[20-22]。本研究中,TGP中浓度处理CD4+T细胞24 h后,检测到Fas、FasL mRNA水平较空白组均有升高,其中Fas mRNA升高更明显。我们也通过流式技术证实,中、高浓度TGP处理后,活化T淋巴细胞表面Fas表达量显著升高,而FasL表达量变化不明显,进一步研究发现Fas的下游调控分子Bcl-2在TGP处理后表达量明显下调。根据以上结果,我们推测TGP可能是通过上调活化T淋巴细胞表面Fas的表达、下调Bcl-2蛋白的表达发挥促进AICD的作用,从而加速活化T淋巴细胞死亡。
T淋巴细胞增殖也是T淋巴细胞克隆扩增的关节环节之一。本研究发现,TGP具有明显的抑制T淋巴细胞增殖的作用。利用活细胞染料羧基二乙酸荧光素琥珀酰亚胺酯(CFSE)标记T淋巴细胞,根据其每分裂一代荧光强度减半的特性,结合流式细胞术,分析T淋巴细胞的增殖能力[23-24]。结果提示,TGP药物干预48 h后,CD4+或CD8+ T淋巴细胞分裂代数和已分裂细胞比例明显降低,即使是低浓度TGP也表现出明显的抑制增殖作用,而在高浓度时,T淋巴细胞增殖几乎完全受到抑制。正常情况下,机体T淋巴细胞增殖保持稳态平衡,而病理性增殖可导致疾病的发生发展[25-26]。除恶性血液疾病T淋巴细胞增殖失去控制外,常见自身免疫性疾病患者体内均存在自身反应性T淋巴细胞增殖异常,如系统性红斑狼疮、类风湿关节炎、移植物抗宿主病等[27-30]。因此,本实验不仅揭示了TGP能够通过抑制T淋巴细胞增殖发挥免疫调节作用,还证实了TGP具有治疗T淋巴细胞异常增殖疾病的潜能。
综上,本研究证实白芍总苷(TGP)能够通过促进Fas、抑制Bcl-2表达促进活化T淋巴细胞AICD作用,并且可以显著抑制T淋巴细胞增殖,为TGP更好的应用于临床提供了实验依据。
| [1] |
马丽, 李作孝. 白芍总苷的免疫调节功能及其临床应用[J]. 中国实验方剂学杂志, 2010(17): 244-6. DOI:10.3969/j.issn.1005-9903.2010.17.071 |
| [2] |
Zhao M, Liang GP, Tang MN, et al. Total glucosides of paeony induces regulatory CD4(+)CD25(+) T cells by increasing Foxp3 demethylation in lupus CD4(+) T cells[J]. Clin Immunol, 2012, 143(2): 180-7. |
| [3] |
钟益萍, 米向斌, 张堂德, 等. 白芍总苷辅助治疗SLE对患者外周血CD4-+CD25-+T细胞表达的影响[J]. 重庆医学, 2014, 43(32): 4311-3. DOI:10.3969/j.issn.1671-8348.2014.32.012 |
| [4] |
Lin JP, Xiao LB, Ouyang G, et al. Total glucosides of paeony inhibits Th1/Th17 cells via decreasing dendritic cells activation in rheumatoid arthritis[J]. Cell Immunol, 2012, 280(2): 156-63. DOI:10.1016/j.cellimm.2012.12.005 |
| [5] |
Lin HH, Zhang WY, Jiang XE, et al. Total glucosides of paeony ameliorates TNBS-induced colitis by modulating differentiation of Th17/Treg cells and the secretion of cytokines[J]. Mol Med Rep, 2017, 16(6): 8265-76. DOI:10.3892/mmr.2017.7598 |
| [6] |
徐艳, 董彦琴. 白芍总苷对小鼠淋巴细胞体外增殖活化影响的研究[J]. 中华中医药学刊, 2013, 31(4): 914-7, 972. |
| [7] |
Khan U, Ghazanfar H. T lymphocytes and autoimmunity[J]. Int Rev Cell Mol Biol, 2018, 341: 125-68. DOI:10.1016/bs.ircmb.2018.05.008 |
| [8] |
Arakaki R, Yamada A, Kudo Y, et al. Mechanism of activationinduced cell death of T cells and regulation of FasL expression[J]. Crit Rev Immunol, 2014, 34(4): 301-14. DOI:10.1615/CritRevImmunol.2014009988 |
| [9] |
Green DR, Droin N, Pinkoski M. Activation-induced cell death in T cells[J]. Immunol Rev, 2003, 193(1): 70-81. DOI:10.1034/j.1600-065X.2003.00051.x |
| [10] |
Altieri DC. T cell expansion: the survivin interface between cell proliferation and cell death[J]. Immunity, 2005, 22(5): 534-5. DOI:10.1016/j.immuni.2005.05.001 |
| [11] |
Zhang J, Xu X, Liu Y. Activation-induced cell death in T cells and autoimmunity[J]. Cell Mol Immunol, 2004, 1(3): 186-92. |
| [12] |
Hildeman DA, Zhu YN, Mitchell TC, et al. Molecular mechanisms of activated T cell death in vivo[J]. Curr Opin Immunol, 2002, 14(3): 354-9. DOI:10.1016/S0952-7915(02)00335-7 |
| [13] |
Ju ST, Panka DJ, Cui HL, et al. Fas(CD95) FasL interactions required for programmed cell death after T-cell activation[J]. Nature, 1995, 373(6513): 444-8. DOI:10.1038/373444a0 |
| [14] |
Suda T, Okazaki T, Naito Y, et al. Expression of the Fas ligand in cells of T cell lineage[J]. J Immunol, 1995, 154(8): 3806-13. |
| [15] |
胡中波. Fas在人体的表达及其意义[J]. 国外医学:免疫学分册, 2000, 23(1): 10-3. |
| [16] |
Chen X, Wang LL, Cai B, et al. Abnormal Fas/FasL and caspase-3- mediated apoptotic signaling pathways of T lymphocyte subset in patients with systemic lupus erythematosus[J]. Cell Immunol, 2006, 239(2): 121-8. DOI:10.1016/j.cellimm.2006.05.003 |
| [17] |
Van Parijs L, Peterson DA, Abbas AK. Retraction. the Fas/Fas ligand pathway and Bcl-2 regulate T cell responses to model self and foreign antigens[J]. Immunity, 2009, 30(4): 611. |
| [18] |
Le GM, Poissonnier A, Blanco P, et al. CD95/Fas, Non-apoptotic signaling pathways, and kinases[J]. Front Immunol, 2017, 8: 1216. DOI:10.3389/fimmu.2017.01216 |
| [19] |
Flynn RJ. CD95 and the MRL-lpr mouse model[J]. Methods Mol Biol, 2017, 1557: 219-28. |
| [20] |
Strasser A, Harris AW, Cory S. bcl-2 transgene inhibits T cell death and perturbs thymic self-censorship[J]. Cell, 1991, 67(5): 889-99. DOI:10.1016/0092-8674(91)90362-3 |
| [21] |
Lee YJ, Won TJ, Hyung KE, et al. Bcl-2 knockdown accelerates T cell receptor-triggered activation-induced cell death in jurkat T cells[J]. Korean J Physiol Pharmacol, 2014, 18(1): 73-8. DOI:10.4196/kjpp.2014.18.1.73 |
| [22] |
Knight T, Luedtke D, Edwards H, et al. A delicate balance-the BCL-2 family and its role in apoptosis, oncogenesis, and cancer therapeutics[J]. Biochem Pharmacol, 2019, 162(SI): 250-61. |
| [23] |
Quah BJ, Warren HS, Parish CR. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester[J]. Nat Protoc, 2007, 2(9): 2049-56. DOI:10.1038/nprot.2007.296 |
| [24] |
侯会娜, 曾耀英, 黄秀艳, 等. 金银花提取物对小鼠淋巴细胞体外活化与增殖的影响[J]. 免疫学杂志, 2008, 24(2): 178-80, 183. |
| [25] |
Fortner KA, Bond JP, Austin JW, et al. The molecular signature of murine T cell homeostatic proliferation reveals both inflammatory and immune inhibition patterns[J]. JAutoimmun, 2017, 82: 47-61. |
| [26] |
Vignali D, Monti P. Targeting homeostatic T cell proliferation to control beta-cell autoimmunity[J]. Curr Diab Rep, 2016, 16(5): 40. DOI:10.1007/s11892-016-0731-9 |
| [27] |
Kyttaris VC, Juang YT, Tsokos GC. Immune cells and cytokines in systemic lupus erythematosus: an update[J]. Curr Opin Rheumatol, 2005, 17(5): 518-22. DOI:10.1097/01.bor.0000170479.01451.ab |
| [28] |
Cope AP, Schulze-Koops H, Aringer M. The central role of T cells in rheumatoid arthritis[J]. ClinExpRheumatol, 2007, 25: S4-S11. |
| [29] |
Pulitzer M. Cutaneous T-cell lymphoma[J]. Clin Lab Med, 2017, 37(3): 527-46. DOI:10.1016/j.cll.2017.06.006 |
| [30] |
Wu YX, Heinrichs J, Bastian D, et al. MicroRNA-17-92 controls Tcell responses in graft-versus-host disease and leukemia relapse in mice[J]. Blood, 2015, 126(11): 1314-23. DOI:10.1182/blood-2015-02-627356 |
 2020, Vol. 40
2020, Vol. 40

