肌肉减少症是老龄化进程中以骨骼肌力量及质量下降为特征的临床综合征,伴细胞外基质(ECM)沉积和脂肪组织的增多[1-2]。2016年10月,国际疾病分类-10(ICD-10)将肌少症列为一个新的独立的疾病。目前,肌肉减少症已经成为老年医学领域的研究热点。
肌肉减少症的发生涉及多个方面,包括运动减少[3-4]、肌纤维凋亡[5]、蛋白合成与降解失衡[6-7]、激素[8-12]、神经-肌肉接头结构改变[13-14]、炎症反应[15-16]等,其发生机制和病理生理过程尚未完全明了,而且既往的研究多集中在肌细胞本身,对于肌细胞之外的部分关注较少。研究提示,增龄引起骨骼肌细胞外基质重塑,肌肉僵硬度增加[17],肌肉干细胞向纤维化系谱分化,肌肉再生能力受限[18-19],可能是老年肌少症患者出现肌力降低的重要原因之一,而胶原沉积、骨骼肌纤维化是骨骼肌ECM重塑特征性的病理变化[20-21]。基质金属蛋白酶(MMPs)是胶原降解的主要途径,金属蛋白酶组织抑制因子(TIMPs)是其天然抑制物[22]。我们前期的转录组学研究表明,老年肌少症大鼠骨骼肌中Ⅰ型、Ⅲ型、Ⅳ型等多种胶原蛋白基因表达降低[23],但是其肌肉中存在明显的胶原沉积,说明肌少症大鼠骨骼肌中胶原的降解受阻。目前,对于MMP-1/TIMP-1在肌少症ECM沉积中的作用尚未见研究。本实验首次探讨了肌少症大鼠骨骼肌中MMP-1、TIMP-1的变化及其对细胞外基质的影响,以期对肌少症发病机制有进一步的了解。
1 材料和方法 1.1 实验试剂和仪器兔抗大鼠MMP-1多克隆抗体(武汉三鹰公司),兔抗大鼠TIMP-1多克隆抗体(abcam),兔抗大鼠Collagen Ⅰ多克隆抗体(abcam),兔抗大鼠GAPDH多克隆抗体(武汉三鹰公司),天狼星红染色试剂盒(北京Solarbio公司),电子抓力仪(cat.47200, Ugo Basil),双能X线吸光测定仪器(Discovey A,HOLOGIC)。
1.2 实验动物和分组29只IVC级SD雄性大鼠购于重庆陆军军医大学实验动物中心,其中24月龄老年大鼠18只,5月龄成年大鼠11只。成年大鼠作为成年对照组(YC组,n=11);使用DXA测定每1只大鼠的相对瘦质量(瘦质量%,瘦质量/体质量),将老年大鼠中瘦质量%与成年组瘦质量%均数相比显著降低,且差异大于2倍SD的老年大鼠纳入老年肌少症组(OS组,n=9),其余老年鼠为老年对照组(OC组,n=9)。实验过程中大鼠分笼饲养,成年鼠每笼5只,老年鼠每笼3只,自由饮水、饮食。饲养环境恒温恒湿,每周定时清理鼠笼、更换垫料,光照周期12 h明暗交替。喂养1月后处死。取大鼠腓肠肌计算SI(Sarcopenia Index)值以验证大鼠肌肉减少症模型是否成功,SI值定义为靶骨骼肌的质量(mg)/受试体质量(g)求得的值[23]。
1.3 双能X线吸光测定(DXA)大鼠麻醉后平卧于检查床上,启动双能X线吸光测定仪器对大鼠进行扫描,记录下大鼠体质量,瘦质量,并计算瘦质量%。
1.4 大鼠前肢抓力的测量将电子抓力仪置于水平平台,提起大鼠尾部,将大鼠前肢放置在抓力仪感应横杆上,待其前肢抓紧横杆后,水平向后拖拽其尾部,至其前肢松开。抓力仪自动记录抓杆过程中的最大抓力。重复测量3次,取最大值记为大鼠前肢抓力,单位为“gf”。
1.5 HE染色和天狼星红染色处死大鼠,取出腓肠肌置于40 g/L多聚甲醛中性溶液中固定24 h,然后进行石蜡包埋、切片,常规HE染色。使用天狼星红染色试剂盒进行染色:weigert铁苏木素染色液染色10~20 min,酸性分化液分化数秒,自来水洗5~10 min,蒸馏水洗1次,天狼星红染色液滴染1 h,流水冲洗,封片。
1.6 Western blot检测蛋白表达量提取各组肌肉组织总蛋白,测定蛋白浓度。配胶,上样,进行蛋白分离电泳,设定电压为恒压80 V,待marker分开改电压为120 V至电泳结束。蛋白经湿转法转至PVDF膜上,TBST漂洗3次,5%胎牛血清(BSA)室温封闭1~2 h,将膜放入MMP-1、TIMP-1、COL-1或GAPDH的一抗稀释液中4 ℃过夜。次日用TBST漂洗3次,PVDF膜放入二抗稀释液中室温孵育1 h,TBST漂洗3次。ECL显影。Image J软件分析,计算MMP-1、TIMP-1、COL1或GAPDH条带吸光度值比值,进行统计学分析。
1.7 统计分析实验数据由Excel 2007,GraphPad Prism 7,Image J,SPSS 21统计软件处理,先用Excel 2007对数据进行简单处理,然后用SPSS 21进行统计学分析,用GraphPad Prism 7作图。结果均采用均数±标准差表示,并用单因素方差分析比较不同组间结果的差异,P < 0.05为差异有统计学意义。
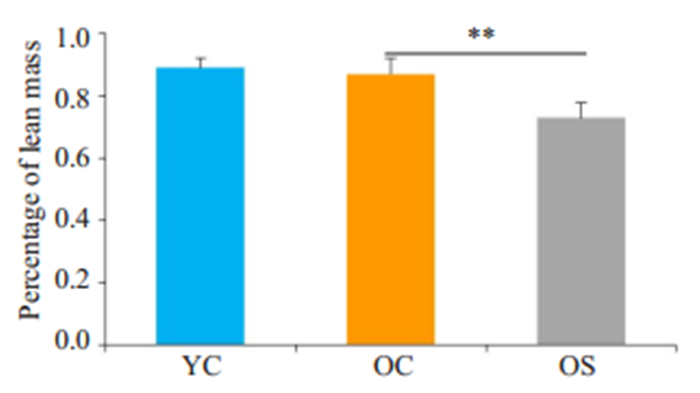
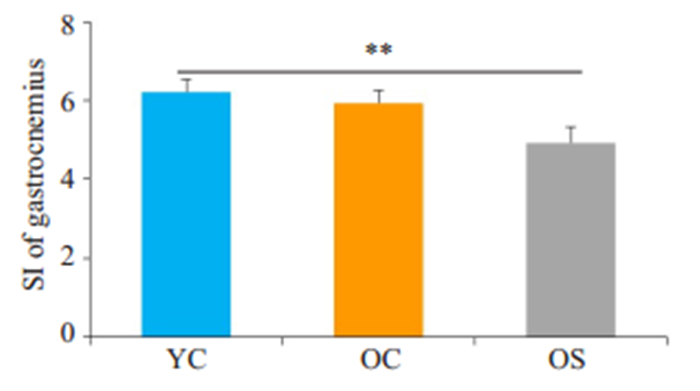
2 结果 2.1 肌少症大鼠的确定使用双能X线吸光测定仪器测定受测对象肌肉含量是诊断肌少症的金标准,本实验采用相对瘦质量(瘦质量%),即瘦质量与体质量的比值判断大鼠肌肉减少症模型是否成功,我们测定了每1只老年大鼠的相对瘦质量,将其中瘦质量%与成年组瘦质量%均数相比显著降低,且差异大于2倍SD的老年大鼠纳入老年肌少症组,其余老年鼠为老年对照组。OS组瘦质量%(0.73± 0.05)较YC组(0.89±0.03)显著下降(P < 0.01),且下降幅度大于2倍SD,OC组瘦质量%(0.87±0.05)较YC组差异无统计学意义(P>0.05,图 1)。此外,因为目前在动物中目前没有统一的肌少症诊断标准。既往研究多以动物腓肠肌作为靶肌肉,使用靶肌肉与动物体质量的比值来判断肌肉减少症动物模型成功与否[24],因此,本研究也计算了SI值以验证大鼠肌肉减少症模型是否成功。当老年组SI值与成年组相比显著降低,且差异大于2倍SD则判定为肌肉减少症[25]。如图 2所示,与YC组(6.21±0.31)相比,OS组大鼠腓肠肌SI值(4.93±0.41)显著降低(P < 0.01),且降幅达2倍SD以上。
|
图 1 各组大鼠瘦质量百分比对比 Fig.1 Percentage of lean mass of rats in different groups. **P < 0.01. YC: Control group; OC: Aged control group; OS:Aged sarcopenia group. |
|
图 2 各组大鼠SI值对比 Fig.2 SI of gastrocnemius of rats in different groups. **P < 0.01. |
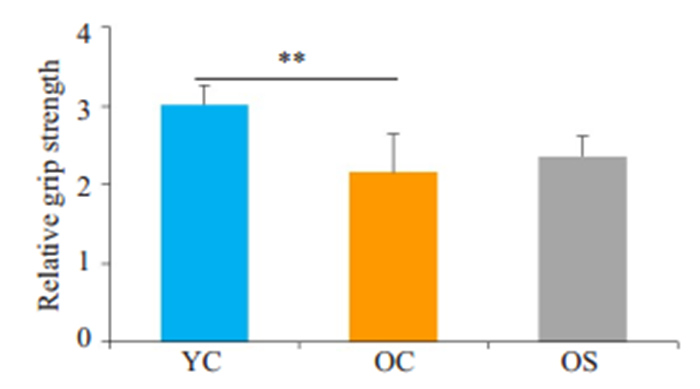
在啮齿动物中,动物的力量受体重的影响较大,为排除体重对骨骼肌力量的影响,我们用根据体质量校正后的抓力作为评估大鼠骨骼肌力量的指标[26]。OS组相对抓力(2.36±0.26)以及OC组相对抓力(2.16±0.49))较YC组(3.02±0.24)显著下降(P < 0.01);OC组相对抓力较OS组差异无统计学意义(P>0.05,图 3)。
|
图 3 各组大鼠相对抓力比较 Fig.3 Relative grip strength of the rats in different groups. **P < 0.01. |
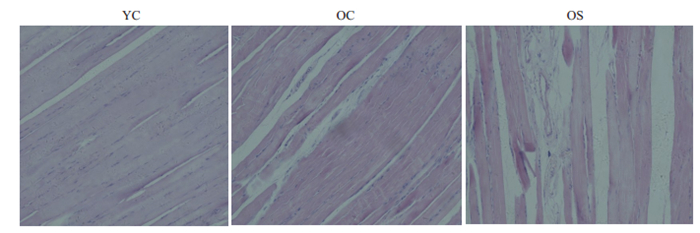
YC组肌纤维呈红色,肌纤维外膜清晰,细胞核小而规则,位于肌纤维周边,细胞外的纤维成分及其他细胞成分少;OC组肌纤维外膜稍皱缩,部分肌细胞细胞核肿胀,位于细胞中央,细胞外的纤维成分稍增多,可见少量蓝染较深且体积较小的炎性细胞;OS组肌纤维变性数目较前增多,细胞淡染,肌纤维间质中淡红色胶原纤维成分明显增加,肌纤维间结缔组织成分增多,血管管腔变小(图 4)。
|
图 4 YC、OC、OS组大鼠腓肠肌苏木精-伊红 Fig.4 HE staining of the gastrocnemius in different groups (Original magnification: ×200). |
天狼星红染色将肌细胞染成黄色,胶原纤维染成红色。YC组肌纤维间细胞外基质少,OC组肌细胞间ECM稍增多,OS组肌纤维间胶原纤维显著增多(P < 0.01,图 5)。
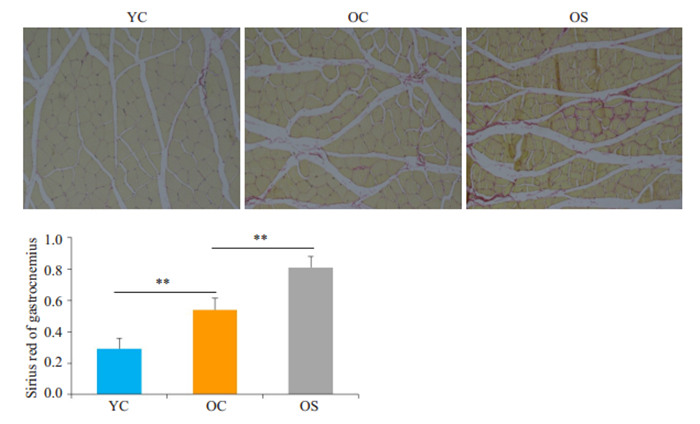
|
图 5 YC、OC、OS组大鼠腓肠肌天狼星红 Fig.5 Sirius Red staining of the gastrocnemius in different groups (×200). Results are expressed as Mean±SD (**P < 0.01). |
Ⅰ型胶原的表达在OC组明显高于YC组(P < 0.05),OS组显著高于OC组(P < 0.05);MMP-1的表达在YC组、OC组无明显差异(P>0.05),OS组表达较OC组显著降低(P < 0.05);TIMP-1的表达在OC组高于YC组(P < 0.05),OS组显著高于OC组(P < 0.05,图 6)。OC组Ⅰ型胶原的表达高于YC组,OS组Ⅰ型胶原的表达高于OC组;YC组和OC组的MMP-1表达主要存在于间质中,OS组MMP-1表达较其余两组明显减少;TIMP-1在YC组表达很少,在OC组稍增多,在OS组表达较OC组增加(图 7)。
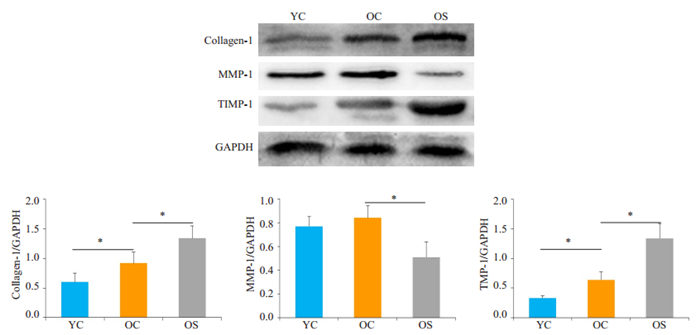
|
图 6 各组MMP-1、TIMP-1及Ⅰ型胶原的蛋白表达 Fig.6 Western blotting of MMP-1, TIMP-1, and collagen I proteins in different groups. GAPDH was used as the loading control. *P < 0.05. |
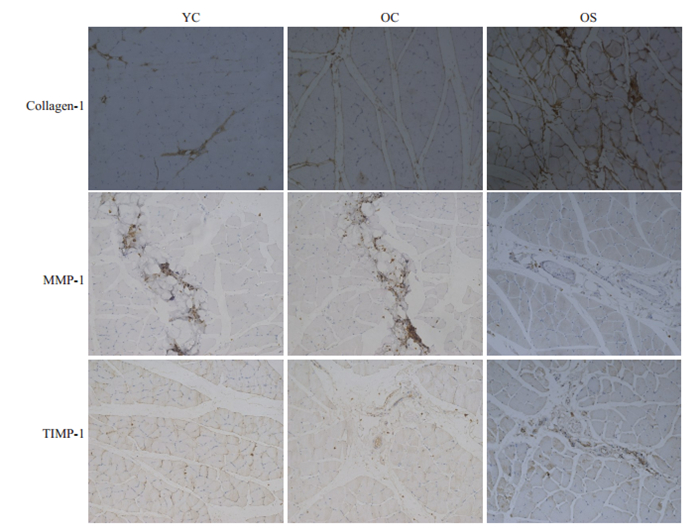
|
图 7 各组I型胶原、MMP-1以及TIMP-1免疫组化 Fig.7 Immunohistochemical staining for collagen I, MMP-1 and TIMP-1 expression in the gastrocnemius muscle of the rats (×200). |
骨骼肌ECM是肌细胞生存和活动的微环境,其组成成分和结构的改变直接影响肌细胞的活动和功能[27]。骨骼肌ECM主要成分包括胶原蛋白、蛋白聚糖、纤连蛋白、层粘连蛋白等。其中,胶原蛋白是骨骼肌ECM最丰富的结构成分,以I型胶原为主,占ECM的97%左右。以往研究提示骨骼肌胶原沉积导致骨骼肌顺应性下降、僵硬度增加,影响肌纤维收缩[28],可能参与了肌少症的发病。ECM的代谢主要由MMPs/TIMPs调控,其中MMP-1是特定作用于Ⅰ型和Ⅲ型胶原的蛋白酶,其活性受TIMP-1调节[29]。正常情况下,MMPs/TIMPs系统处在动态平衡状态。
本实验通过对成年大鼠、老年大鼠和老年肌少症大鼠的观察发现,与YC组相比,OC组前肢相对抓力降低,相对瘦质量无统计学差异,天狼星红染色显示胶原沉积增多,Western blotting示Ⅰ型胶原、TIMP-1蛋白表达增加,MMP-1蛋白表达无明显差异;与OC组相比,OS组瘦质量%明显降低,前肢相对抓力无明显差异,HE染色显示胶原沉积进一步增多,Western blot示Ⅰ型胶原、TIMP-1蛋白表达增加,MMP-1蛋白表达降低;上述结果表明,增龄过程中,MMP-1/TIMP-1失衡,可能通过引起ECM代谢受阻、Ⅰ型胶原沉积,进而影响骨骼肌质量与功能。
以往研究表明,MMPs在正常生理情况下表达量较少,在受到刺激或处于病理状态时升高[30],这可以解释本实验中OC组骨骼肌MMP-1表达与YC组没有统计学差异。而在OS组中,MMP-1表达显著下降,同时TIMP-1表达增多,意味着MMP-1在表达下降的同时,其内源性抑制又增强,使胶原降解途径进一步受抑制,胶原沉积增加,ECM发生病理性重塑。ECM重塑使其顺应性降低,刚性增加,一方面影响骨骼肌细胞力量的传导,另一方面导致肌源性祖细胞(MPC)再生潜能下降[31-32]。有研究表明,增龄使I型胶原蛋白基因表达降低[33-34],这与本实验中OC组及OS组中发现的I型胶原沉积相悖,提示衰老引起胶原沉积的机制可能是降解的减少而不是合成的增加。
既往研究提示,老年大鼠腓肠肌中TIMP-1转录水平较成年大鼠升高[33],但在蛋白水平尚无研究。我们首次观察到老年大鼠TIMP-1蛋白表达较成年大鼠增多,老年肌少症大鼠TIMP-1蛋白表达较老年大鼠进一步增加。TIMP-1表达增多,意味着MMP-1活性下降,ECM降解受阻。我们从天狼星红染色观察到ECM沉积在OC组较YC组增多、OS组较OC组增多,即ECM随增龄产生的变化与TIMP-1一致,提示TIMP-1在增龄引起的ECM沉积中有重要作用。从天狼星红染色及I型胶原表达量对比可以看出,OC组虽然骨骼肌质量较YC组没有减少,并且两组MMP-1表达无差异,但是已经出现了胶原沉积增多和相对抓力的下降,提示TIMP-1可能比MMP-1更早参与肌少症的发生,并在肌少症ECM沉积中起主要作用。
总之,我们观察到肌少症大鼠腓肠肌中MMP-I/ TIMP-1蛋白表达失衡,可能通过参与ECM中Ⅰ型胶原沉积,影响骨骼肌质量和功能,但是肌少症发生过程中,MMP-I/TIMP-1受何种分子机制调控进而影响ECM重塑目前尚不清楚,具体相关机制有待进一步研究。
| [1] |
Delmonico MJ, Harris TB, Lee JS, et al. Alternative definitions of sarcopenia, lower extremity performance, and functional impairment with aging in older men and women[J]. J Am Geriatr Soc, 2007, 55(5): 769-74. DOI:10.1111/j.1532-5415.2007.01140.x |
| [2] |
Marzetti E, Leeuwenburgh C. Skeletal muscle apoptosis, sarcopenia and frailty at old age[J]. Exp Gerontol, 2006, 41(12): 1234-8. DOI:10.1016/j.exger.2006.08.011 |
| [3] |
Rolland Y, Czerwinski S, Abellan Van Kan G, et al. Sarcopenia: its assessment, etiology, pathogenesis, Consequences and future perspectives[J]. J Nutr HealthAging, 2008, 12(7): 433-50. |
| [4] |
Goodpaster BH, Carlson CL, Visser M, et al. Attenuation of skeletal muscle and strength in the elderly: The Health ABC Study[J]. J Appl Physiol, 2001, 90(6): 2157-65. DOI:10.1152/jappl.2001.90.6.2157 |
| [5] |
Marzetti E, Calvani R, Bernabei R, et al. Apoptosis in skeletal myocytes: a potential target for interventions against sarcopenia and physical frailty-a mini-review[J]. Gerontology, 2012, 58(2): 99-106. DOI:10.1159/000330064 |
| [6] |
Gatineau E, Savary- Auzeloux I, Migné C, et al. Chronic intake of sucrose accelerates sarcopenia in older male rats through alterations in insulin sensitivity and muscle protein synthesis[J]. J Nutr, 2015, 145(5): 923-30. DOI:10.3945/jn.114.205583 |
| [7] |
Jana NR. Protein homeostasis and aging: role of ubiquitin protein ligases[J]. Neurochem Int, 2012, 60(5): 443-7. DOI:10.1016/j.neuint.2012.02.009 |
| [8] |
Kovacheva EL, Hikim A, Shen R, et al. Testosterone supplementation reverses sarcopenia in aging through regulation of myostatin, c-Jun NH2-terminal kinase, Notch, and Akt signaling pathways[J]. Endocrinology, 2010, 151(2): 628-38. DOI:10.1210/en.2009-1177 |
| [9] |
Smith GI, Yoshino J, Reeds DN, et al. Testosterone and progesterone, but not estradiol, stimulate muscle protein synthesis in postmenopausal women[J]. J Clin Endocrinol Metab, 2014, 99(1): 256-65. DOI:10.1210/jc.2013-2835 |
| [10] |
Saad F, Röhrig G, von Haehling S, et al. Testosterone deficiency and testosterone treatment in older men[J]. Gerontology, 2017, 63(2): 144-56. DOI:10.1159/000452499 |
| [11] |
Lee JW, Kim NH, Milanesi A. Thyroid hormone signaling in muscle development, repair and metabolism[J]. J Endocrinol Diabetes Obes, 2014, 2(3): 1046-54. |
| [12] |
Milanesi A, Lee JW, Yang A, et al. Thyroid hormone receptor α is essential to maintain the satellite cell niche during skeletal muscle injury and sarcopenia of aging[J]. Thyroid, 2017, 27(10): 1316-22. DOI:10.1089/thy.2017.0021 |
| [13] |
Kung TA, Cederna PS, van der Meulen JH, et al. Motor unit changes seen with skeletal muscle sarcopenia in oldest old rats[J]. J Gerontol ABiol Sci Med Sci, 2014, 69(6): 657-65. DOI:10.1093/gerona/glt135 |
| [14] |
Doherty TJ. Invited review: Aging and sarcopenia[J]. J Appl Physiol, 2003, 95(4): 1717-27. DOI:10.1152/japplphysiol.00347.2003 |
| [15] |
Biolo G, Cederholm T, Muscaritoli M. Muscle contractile and metabolic dysfunction is a common feature of sarcopenia of aging and chronic diseases: from sarcopenic obesity to cachexia[J]. Clin Nutr, 2014, 33(5): 737-48. DOI:10.1016/j.clnu.2014.03.007 |
| [16] |
Wilson D, Jackson T, Sapey E, et al. Frailty and sarcopenia: the potential role of an aged immune system[J]. Ageing Res Rev, 2017, 36: 1-10. DOI:10.1016/j.arr.2017.01.006 |
| [17] |
Kjaer, M. Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading[J]. Physiol Rev, 2004, 84(2): 649-98. |
| [18] |
Stearns-reider KM, D'amore A, Beezhold K, et al. Aging of the skeletal muscle extracellular matrix drives a stem cell fibrogenic conversion[J]. Aging Cell, 2017, 16(3): 518-28. DOI:10.1111/acel.12578 |
| [19] |
Kragstrup TW, Kjaer M, Structural MA, et al. And functional changes in skeletal muscle extracellular matrix with aging[J]. Scand J Med Sci Sports, 2011, 21(6): 749-57. DOI:10.1111/j.1600-0838.2011.01377.x |
| [20] |
Brack, S A, Conboy MJ, et al. Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis[J]. Science, 2007, 317(5839): 807-10. DOI:10.1126/science.1144090 |
| [21] |
Horii, N, Uchida M, et al. Resistance training prevents muscle fibrosis and atrophy via down-regulation of C1q-induced Wnt signaling in senescent mice[J]. Faseb J, 2018, 32(7): 3547-59. DOI:10.1096/fj.201700772RRR |
| [22] |
Siqueira AS, Carvalho MR, Monteiro AC, et al. Matrix metalloproteinases, TIMPs and growth factors regulating ameloblastoma behaviour[J]. Histopathology, 2010, 57(1): 128-37. DOI:10.1111/j.1365-2559.2010.03596.x |
| [23] |
Zhou J1, Liao Z1, Chen J1, et al. Integrated study on comparative transcriptome and skeletal muscle function in aged rats[J]. Mech Ageing Dev, 2018, 169: 32-9. DOI:10.1016/j.mad.2018.01.001 |
| [24] |
Sarcopenia EE. Thesis of department of neuroscience karolinska institute, Stockholm[Z], 2005: 12-24.
|
| [25] |
Edstrom E, Ulfhake B. Sarcopenia is not due to lack of regenerative drive in senescent skeletal muscle[J]. Aging Cell, 2005, 4(2): 65-77. |
| [26] |
Baumgartner RN, Koehler KM, Gallagher D, et al. Epidemiology of sarcopenia among the elderly in New Mexico[J]. Am J Epidemiol, 1998, 147(8): 755-63. DOI:10.1093/oxfordjournals.aje.a009520 |
| [27] |
Liao ZY, Chen JL, Xiao MH, et al. The effect of exercise, resveratrol or their combination on Sarcopenia in aged rats via regulation of AMPK/Sirt1 pathway[J]. Exp Gerontol, 2017, 11(98): 177-83. |
| [28] |
Gillies AR, Lieber RL. Structure and function of the skeletal muscle extracellular matrix[J]. Muscle Nerve, 2011, 44(3): 318-31. |
| [29] |
Alnaqeeb MA, Al Zaid NS, Goldspink G. Connective tissue changes and physical properties of developing and ageing skeletal muscle[J]. JAnat, 1984, 139(Pt4): 677-89. |
| [30] |
Pan H, Vojnits K, Liu TT, et al. MMP1 gene expression enhances myoblast migration and engraftment following implanting into mdx/ SCID mice[J]. CellAdh Migr, 2015, 9(4): 283-92. |
| [31] |
Mittal R, Patel A, Debs L, et al. Intricate functions of matrix metalloproteinases in physiological and pathological conditions[J]. J Cell Physiol, 2016, 231(12): 2599-621. DOI:10.1002/jcp.25430 |
| [32] |
Lacraz G1, Rouleau A, Couture V1, et al. Increased stiffness in aged skeletal muscle impairs muscle progenitor cell proliferative activity[J]. PLoS One, 2015, 10(8): e0136217. DOI:10.1371/journal.pone.0136217 |
| [33] |
Fry C, Kirby T, Kosmac K3, et al. Myogenic progenitor cells control extracellular matrix production by fibroblasts during skeletal muscle hypertrophy[J]. Cell Stem Cell, 2017, 20(1): 56-69. DOI:10.1016/j.stem.2016.09.010 |
| [34] |
Guzzoni V, Ribeiro M, Lopes GN, et al. Effect of resistance training on extracellular matrix adaptations in skeletal muscle of older rats[J]. Front Physiol, 2018, 11(9): 374. |
 2020, Vol. 40
2020, Vol. 40

