2. 暨南大学光电工程系,广东 广州 510632;
3. 华南师范大学生物光子学研究院,广东 广州 510631
2. Department of Photoelectric Engineering, Jinan University, Guangzhou 510632, China;
3. Institute of Biological Photonics, South China Normal University, Guangzhou 510631, China
胃癌是最常见的恶性肿瘤之一,中国胃癌发病率和死亡率均高于全球平均水平,胃癌防治任务十分艰巨[1]。早期诊断对胃癌的早期治疗至关重要。拉曼光谱能在分子水平上反映出物质结构、分子组成和构象等信息,具有快捷、客观、准确、无损的特点[2],逐步成为鉴别肿瘤组织与正常组织的有力技术。拉曼光谱用于消化道肿瘤的诊断研究已经有十余年[3-5],研究的对象有基因组DNA [6]、蛋白质组成[7]、细胞[8]、组织[9]、血液[10]和动物模型[11],研究手段多种多样[12-14],从多种角度证实了拉曼光谱能够鉴别正常胃组织和胃癌组织,但是这些研究的技术手段主要依赖共聚焦显微拉曼光谱仪[15-16],这种仪器体积巨大价格昂贵,检测过程需要再暗室中进行以减少外界光干扰提高检测精度,不利于临床应用,随着技术的进步,光纤和微型光谱仪的应用使拉曼光谱采集更加方便,也使研究胃镜可搭载的光纤拉曼内窥探头成为可能,国内有课题组利用光纤拉曼技术进行研究[17],但其研究着重于良恶性组织光谱差异的分析,所使用的光纤拉曼光谱仪不能满足临床应用。为进一步将“快速、无损、高效”的拉曼光谱技术推向临床应用,本课题组研制了可加载于胃镜的光纤拉曼内窥探头,结合共聚焦显微拉曼光谱仪的检测结果及病理检查,探讨光纤拉曼内窥探头在鉴别胃正常组织和胃癌组织的效能,为下一步开发“拉曼胃镜”实现在体原位诊断奠定理论和实践基础。
1 对象和方法 1.1 光纤内窥拉曼系统介绍光纤内窥拉曼系统主要包括激光发射器、光纤拉曼探头、光谱仪(图 1)。激光发射器可以发射785 nm近红外波段的激光作为光源照射样品产生拉曼效应,光纤探头总长度1.6 m,直径2 mm,满足常规胃镜的需要,光纤内窥探头的镜身由特殊光纤制成,起到传导入射光和收集散射光的双重作用,镜身柔软,刚性适中,具有较高的灵活性。光谱仪将接收到的拉曼散射光进行光电转换,经过电子计算机的软件处理后导出可视化光谱。

|
图 1 光纤拉曼内窥探头 Fig.1 The fiber Raman endoscopic probe. A: Laser emitter and Spectrometer; B: The fiber Raman endoscopic probe. |
收集我院2018年7~11月行电子胃镜检查并经病理证实的正常胃粘膜组织和胃癌组织,共72例。正常组织均来源于常规体检的患者,胃癌组织均来源于新发现的原发性胃癌患者,本研究符合人体实验伦理学标准。其中胃癌组织36例(男21例,女15例,年龄62.18± 8.33岁),正常组织36例(男17例,女19例,年龄52.47± 10.05岁)。所有标本离体后即用生理盐水冲洗血迹及坏死组织,均分为两份,一份存入冻存管置于-80 ℃低温冰箱保存,一份用福尔马林溶液固定后石蜡包埋做切片做病理诊断。
1.3 拉曼光谱的获取 1.3.1 光纤拉曼内窥探头将硅片置于胃模型内部,待测样本置于硅片表面,将胃镜固定后将光纤拉曼内窥探头通过胃镜操作孔道进入胃模型内部的待检测点,探测端与待测标本紧密接触,以模拟临床原位检测(图 2)。激发光波长785 nm,扫描范围785~1800 cm-1,激发功率250 mw,经过光栅和滤光片后,实际照射到标本上功率约为15 mw,经3次扫描累加,信号采集时间为100 s,每个样品重复测量3次取平均值,共获取有效光谱72个。

|
图 2 光纤拉曼内窥探头检测标本 Fig.2 Illustration of the examination using the fiber Raman endoscopic probe. |
在暗室中,将待测标本置于载物台的铝片上,在显微镜下找到组织黏膜,20倍物镜聚焦激光和收集拉曼光谱信号。激发光波长785 nm,扫描范围700~1800 cm-1激发功率300 mW,经过光栅和滤光片后,实际照射到标本上功率约为5 mW,经5次扫描累加,信号采集时间为5 s,每个样品重复测量3次取平均值,共获取有效光谱72个。
1.3.3 拉曼光谱数据处理和分析胃组织的原始光谱信号包括自体荧光信号、噪音和拉曼信号。利用RamanWire3.2软件和一种基于R语言的背景扣除程序,只留下组织的拉曼光谱信号。主成分分析(PCA)是一种在光谱处理中常用的降维方法,通过对原始光谱矩阵数据空间的投影,使每条光谱值留下数个主成分来表征其大部分光谱信息。线性判别分析(LDA)是一种根据样本点距离做判断进行分组的判别方法。在Matlab R2014a (Math Work Inc, South Natick, MA, USA)中自编程序,对预处理后的光谱数据执行PCA-LDA判别。以组织病理学诊断结果作为金标准,计算灵敏度、特异性和正确率。对光纤拉曼内窥探头的诊断效果进行评价。
2 结果 2.1 平均光谱和归属 2.1.1 光纤拉曼内窥探头的平均光谱及其归属由于光纤拉曼内窥探头的扫描范围为785~1800 cm-1,获取的主要的拉曼光谱波峰位于828、853、1003、1034、1089、1130、1160、1320、1450和1662 cm-1。正常组织的平均光谱强度高于胃癌组织(图 3),但是在1003 cm-1(蛋白质、核酸,C-C伸缩振动)、1089 cm-1(核酸,磷酸二酯基团对称伸缩)、1130 cm-1(酪氨酸, C-C伸缩振动)、1450 cm-1(蛋白质、脂类,CH2变形振动)、1662 cm-1(蛋白质、脂类,氨基化合物I,α螺旋)波峰处,肿瘤组织的平均光谱强度高于正常组织,上述波峰所表征的生物分子来源以蛋白质、脂质、核酸和类胡萝卜素为主。
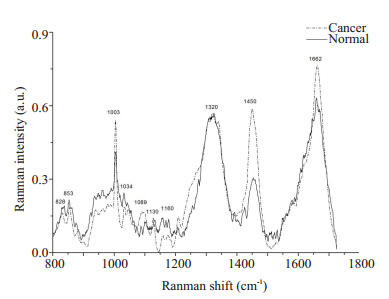
|
图 3 正常胃组织(实线)和胃癌组织(虚线)的平均拉曼光谱(光纤拉曼内窥探头) Fig.3 Average Raman spectra of normal tissue (solid lines) and gastric cancer tissue (dashed lines) obtained by the fiber Raman endoscopic probe. |
图 4显示主要的拉曼光谱波峰位于828、853、1003、1034、1089、1130、1160、1320、1450和1662 cm-1。从平均光谱图中可以看出在1089 cm-1(核酸,磷酸二酯基团对称伸缩)、1130 cm-1(酪氨酸,C-C变形振动)、1320 cm-1(脂类、核酸,CH2CH3伸缩振动)、1450 cm-1(蛋白质、脂类,CH2变形振动)和1662 cm-1(蛋白质,氨基化合物I,α螺旋)处胃癌组织的平均光谱强度明显高于正常组织,这几处的波峰所表征的生物分子来源以蛋白质和核酸为主。
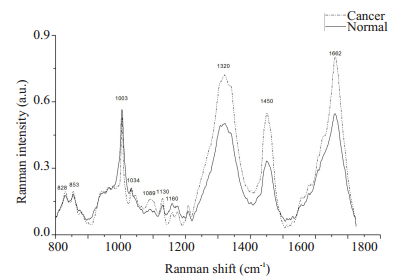
|
图 4 正常胃组织(实线)和胃癌组织(虚线)的平均拉曼光谱(显微拉曼光谱仪) Fig.4 Average Raman spectra of normal tissue (solid lines) and gastric cancer tissue (dashed lines) obtained by confocal microRaman spectrometer. |
本实验中采集的胃癌和正常组织的拉曼光谱变量多,数据量大,信息丰富但却繁杂,仅仅依据某个拉曼峰的位置、形状和强度进行正常组织和胃癌组织的鉴别是不够科学合理的,需要采用全光谱信息进行判别。主成分-线性判别分析是常用的分析方法。
2.2.1 光纤拉曼内窥探头光谱主成分分析在Matlab R2014a(Math Work Inc, South Natick, MA, USA)中自编程序,对预处理(平滑、去荧光和归一化)后的光谱数据执行PCA-LDA判别。主成分分析结果提示前3个主成分的累积贡献率高于90%,能够完全反应原始数据的信息,结果显示,正常组织和胃癌组织两组数据明显得分布于判别界面两侧区域(图 5),以3个主成分的得分进一步做LDA分析,并进行交叉验证分析,得到灵敏度、特异性和准确率分别为80.56%(29/36)、88.89%(32/36)、84.72%(61/72)。
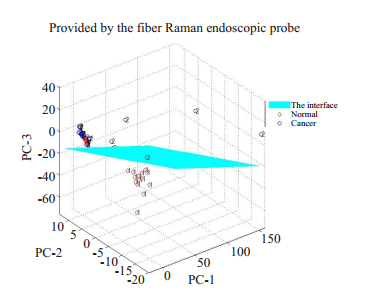
|
图 5 两种不同组织PC1、PC2、PC3的三维散点图(光纤拉曼内窥探头) Fig.5 Three-dimensional scatter plot of different tissues generated based on the data obtained using the fiber Raman endoscopic probe. |
用同样的方法对显微拉曼光谱仪获得的两类组织的光谱进行预处理和分析。选择累积贡献率高于90%的3个主成分,结果显示,正常组织和胃癌组织区分明显(图 6),以3个主成分的得分进一步做LDA分析,并进行交叉验证分析,得到灵敏度、特异性和准确率分别为100%(36/36)、94.4%(34/36)、97.2%(70/72)。
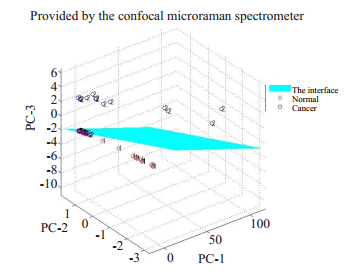
|
图 6 两种不同组织PC1、PC2、PC3的三维散点图(显微拉曼光谱仪) Fig.6 Three-dimensional scatter plot of different tissues generated based on the data obtained by confocal microRaman spectrometer. |
早期诊断对胃癌的治疗和预后具有重要的意义,随着光学技术的发展,在普通白色光源基础上出现了窄带成像、蓝色激光成像、共聚焦成像、近红外线成像等技术[25-27],为内镜医生提供直观的图像信息,其中激光共聚焦内镜能够提供千倍放大图像对黏膜、黏膜下血管以及细胞乃至亚细胞结构进行实时观察及鉴别诊断被称为“光学活检”,该技术在观察微结构的同时会出现检查时间延长、荧光剂风险等问题,且对正常组织和病变组织微观结构的鉴别对内镜医师经验水平要求较高,带有一定的主观性。光纤拉曼内窥探头可在观察粘膜组织的同时获取光谱信息,利用经过机器学习验证的算法程序,可直接分析光谱的差异判别粘膜组织的性质,具有较好的时效性和客观性,为胃癌诊断提供了新思路。目前活组织病理诊断还是不能被取代的诊断金标准,但是激光共聚焦内镜和光纤拉曼内窥探头均能够通过其优势为活检取材提供依据,以期提高活检精确度。拉曼光谱在胃癌诊断的研究已有多年,丰富的光谱学研究提供了理论基础[28],主成分分析、判别分析、机器学习等计算机程序的应用提高了光谱分析的效率和准确率,甚至可以直接输出判别结果为临床诊断提供参考依据。显微共聚焦拉曼光谱仪及普通的光纤拉曼光谱仪受限于体积及检测环境,难以实现临床应用,本研究自主设计开发的光纤拉曼内窥探头具有激发、采集、传输三位一体功能,可通过操作孔道加载于普通胃镜中实现快速、客观、高效、准确的“光谱活检”,可为诊断提供有力依据,具有较大的临床应用潜能。
结合光谱归属[18-22],本研究光纤拉曼内窥探头的平均光谱提示,谱峰强度的增加反映出胃癌组织中蛋白质、脂质、和核酸的含量较正常组织增多,这是细胞癌变后出现细胞核增大,DNA复制增多及细胞增殖加快的结果[23-24]。显微拉曼光谱仪的平均光谱及其归属提示胃癌组织与正常组织相比,蛋白质及核酸的含量更高,这是癌细胞的不断增殖分化及遗传信息改变所导致的,与已知的研究结果相符合[23-24]。
对比由光纤拉曼内窥探头和显微共聚焦拉曼光谱仪采集的拉曼光谱图像,光谱形态和特征峰的分部大体相同,提示良恶性组织的物质构成基本一致,正常组织和胃癌组织在828、853、1003、1034、1089、1130、1160、1320、1450和1662 cm-1的波峰强度有差异,是与癌变后组织内蛋白质、脂质、核酸等含量变化有关,这与已有研究[29-30]基本符合。本研究中,利用光纤拉曼内窥探头采集的光谱图像,在1320 cm-1处对两种不同组织的区分不明显,且在800~1800 cm-1范围内的光谱中出现较多锯齿状小峰,暂无文献报道,考虑是传导光纤本身的噪声和外界光噪引起,通过改进设备和减少外界光干扰或可减少这些波形的出现,将会进一步进行研究。
目前临床上对胃癌前病变的诊断十分重视,国内有研究利用共聚焦显微拉曼光谱仪采集的拉曼光谱也能反映出癌前病变是正常组织和癌组织的过渡形态[23],为下一步利用光纤拉曼内窥探头进行癌前病变的检测提供了研究基础。拉曼光谱数据量巨大,以往对较少量样本的研究常用的方法有主成分分析、判别分析、聚类分析等,随着机器学习技术的出现,可通过多中心研究,扩大不同种类的组织样本数量,利用支持向量机、人工神经网络、深度学习等高级算法实现对不同组织拉曼光谱差异的对比分析,能够提高诊断结果的正确率。
综上所述,本文利用光纤拉曼内窥探头模拟在体检测,对正常胃组织和胃癌组织进行鉴别诊断研究,同时以显微拉曼光谱仪的鉴别诊断结果作为对比,以评价光纤拉曼内窥探头的诊断效能。光纤拉曼内窥探头能够获取正常胃组织及胃癌组织的拉曼光谱,借助于光纤拉曼内窥探头结合主成分分析和判别分析能够快速、有效地鉴别胃癌组织,为下一步研发应用于临床的光纤拉曼内窥探头奠定了理论和实践基础。
| [1] |
左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1): 52-8. DOI:10.3969/j.issn.1000-8179.2017.01.881 |
| [2] |
Kallaway C, Almond LM, Barr H, et al. Advances in the clinical application of raman spectroscopy for cancer diagnostics[J]. Photodiagn Photodyn Ther, 2013, 10(3): 207-19. DOI:10.1016/j.pdpdt.2013.01.008 |
| [3] |
Hsu CW, Huang CC, Sheu JH, et al. Novel method for differentiating histological types of gastric adenocarcinoma by using confocal raman microspectroscopy[J]. PLoS One, 2016, 11(7): e159829-40. |
| [4] |
Jin S, Luo, et al. Discrimination of premalignant lesions and cancer tissues from normal gastric tissues using raman spectroscopy[J]. J Biomed Opt, 2013, 18(6): 67001-4. DOI:10.1117/1.JBO.18.6.067001 |
| [5] |
Li Pengpeng, Chen, et al. Drop coating deposition Raman spectroscopy of blood plasma for the detection of colorectal cancer[J]. J Biomed Opt, 2015, 20(3): 1207-18. |
| [6] |
代剑华, 彭贵勇, 冉曾令, 等. 胃粘膜正常和癌变细胞基因组DNA的表面增强拉曼光谱研究[J]. 激光生物学报, 2011, 20(3): 299-303. DOI:10.3969/j.issn.1007-7146.2011.03.004 |
| [7] |
陈瑶, 代剑华, 周学谦, 等. 拉曼光谱分析癌变胃黏膜组织中蛋白质改变的研究[J]. 重庆医学, 2014, 44(29): 3875-8. DOI:10.3969/j.issn.1671-8348.2014.29.010 |
| [8] |
黄鹰, 陶家友, 蔺蓉, 等. 用激光拉曼光谱区分胃癌变细胞与正常细胞[J]. 光谱学与光谱分析, 2007, 27(11): 2262-5. |
| [9] |
Teh SK, Zheng W, Ho KY, et al. Near-infrared Raman spectroscopy for early diagnosis and typing of adenocarcinoma in the stomach[J]. British J Surg, 2010, 97(4): 550-61. DOI:10.1002/bjs.6913 |
| [10] |
陶家友, 冷爱民, 王华秀, 等. 胃癌患者手术前后血清的激光拉曼光谱研究[J]. 激光生物学报, 2011, 20(5): 595-9. DOI:10.3969/j.issn.1007-7146.2011.05.006 |
| [11] |
马君, 徐明, 巩龙静, 等. 近红外激光拉曼技术在体探测胃癌腹膜播散[J]. 中国激光, 2011, 38(9): 209-14. |
| [12] |
Lin K, Wang J, Zheng W, et al. Rapid fiber-optic raman spectroscopy for real-time in vivo detection of gastric intestinal metaplasia during clinical gastroscopy[J]. Cancer Prev Res (Phila), 2016, 9(6): 476-83. DOI:10.1158/1940-6207.CAPR-15-0213 |
| [13] |
凌晓锋, 李维红, 宋苑苑, 等. 胃癌组织的拉曼光谱初探[J]. 光谱学与光谱分析, 2000, 20(5): 692-3. DOI:10.3321/j.issn:1000-0593.2000.05.035 |
| [14] |
刘燕玲, 黄丽韫, 钟会清, 等. 表面增强拉曼光谱在胃癌诊断和分期中的应用[J]. 世界华人消化杂志, 2018(18): 1102-10. |
| [15] |
Ito H, Inoue H, Hasegawa K, et al. Use of surface-enhanced raman scattering for detection of cancer-related serum-constituents in gastrointestinal cancer patients[J]. Nanomedicine, 2014, 10(3): 599-608. DOI:10.1016/j.nano.2013.09.006 |
| [16] |
周学谦, 陈瑶, 于乐泳, 等. 体外联合使用指纹区及高波数区拉曼光谱诊断胃癌[J]. 激光生物学报, 2016, 25(1): 27-32. DOI:10.3969/j.issn.1007-7146.2016.01.004 |
| [17] |
易伟松, 钱辉跃, 江厚敏. 光纤和显微拉曼光谱结合化学计量学鉴别胃癌组织[J]. 中国医学物理学杂志, 2016, 33(2): 134-40. DOI:10.3969/j.issn.1005-202X.2016.02.006 |
| [18] |
Teh SK, Zheng W, Ho KY, et al. Diagnostic potential of nearinfrared Raman spectroscopy in the stomach: differentiating dysplasia from normal tissue[J]. Br J Cancer, 2008, 98(2): 457-65. DOI:10.1038/sj.bjc.6604176 |
| [19] |
Kawabata T, Kikuchi H, Okazaki S, et al. Near-infrared multichannel Raman spectroscopy with a 1064 nm excitation wavelength for ex vivo diagnosis of gastric cancer[J]. J Surg Res, 2011, 169(2): e137-43. |
| [20] |
Oliveira AF, Santos ID, Cartaxo SB, et al. Differential diagnosis in primary and metastatic cutaneous melanoma by FT-Raman spectroscopy[J]. Acta Cir Bras, 2010, 25(5): 434-9. DOI:10.1590/S0102-86502010000500009 |
| [21] |
Nemecek D, Stepanek J, Thomas GJ. Raman spectroscopy of proteins and nucleoproteins[J]. Protein Sci, 2013, 17(2): t17-8. |
| [22] |
Duraipandian S, Zheng W, Ng J, et al. Simultaneous fingerprint and high-wavenumber confocal Raman spectroscopy enhances early detection of cervical precancer in vivo[J]. Anal Chem, 2012, 84(14): 5913-9. DOI:10.1021/ac300394f |
| [23] |
金少琴, 毛华. 近红外线激光拉曼光谱具有在分子水平诊断胃癌的价值[J]. 南方医科大学学报, 2014, 34(3): 391-5. |
| [24] |
Zhou X, Dai J, Chen Y, et al. Evaluation of the diagnostic potential of ex vivo raman spectroscopy in gastric cancers: fingerprint versus high wavenumber[J]. J Biomed Opt, 2016, 21(10): 105002-13. DOI:10.1117/1.JBO.21.10.105002 |
| [25] |
Kaneko K, Oono Y, Yano T, et al. Effect of novel bright image enhanced endoscopy using blue laser imaging(BLI)[J]. Endosc Int Open, 2014, 2(4): E212-9. DOI:10.1055/s-0034-1390707 |
| [26] |
Miyaki R, Yoshida S, Tanaka S, et al. A computer system to be used with laser-based endoscopy for quantitative diagnosis of early gastric cancer[J]. J Clin Gastroenterol, 2014, 49(2): 212-9. |
| [27] |
Kakeji Y, Yamaguchi S, Yoshida D, et al. Development and assessment of morphologic criteria for diagnosing gastric cancer using confocal endomicroscopy: an ex vivo and in vivo study[J]. Endoscopy, 2006, 38(9): 886-97. DOI:10.1055/s-2006-944735 |
| [28] |
Wan QS, Wang T, Zhang KH. Biomedical optical spectroscopy for the early diagnosis of gastrointestinal neoplasms[J]. Tumour Biol, 2017, 39(7): 71680-91. |
| [29] |
Luo S, Chen C, Mao H, et al. Discrimination of premalignant lesions and cancer tissues from normal gastric tissues using Raman spectroscopy[J]. J Biomed Opt, 2013, 18(6): 67004-15. DOI:10.1117/1.JBO.18.6.067004 |
| [30] |
陈瑶, 代剑华, 张华, 等. 正常和癌变胃粘膜组织的共焦拉曼光谱初探[J]. 激光生物学报, 2014(1): 45-50. DOI:10.3969/j.issn.1007-7146.2014.01.009 |
 2019, Vol. 39
2019, Vol. 39

