2. 西安交通大学医学部附属口腔医院修复科,陕西 西安 710004;
3. 陕西省颅颌面精准医学研究重点实验室,陕西 西安 710004
2. Department of Prosthodontics, College of Stomatology, Xi'an Jiaotong University, Xi'an 710004, China;
3. Key Laboratory of Shaanxi Province for Craniofacial Precision Medicine Research, Xi'an Jiaotong University School of Medicine, Xi'an 710061, China
棕色化的白色脂肪组织(WAT)具有经典棕色脂肪组织(BAT)产热及消耗能量的功能[1-3]。促进WAT棕色化,将有助于改善能量平衡失调引发的肥胖和机体代谢紊乱[4-6]。因而,WAT棕色化已成为预防和治疗肥胖及相关代谢疾病的新靶点,也是目前该领域的研究热点。近年来,科研工作者发现越来越多的基因和调控因子参与调节WAT棕色化[7-10]。作为调控因子,长链非编码RNA(lncRNA)也参与其中[11]。有研究证实lncRNA Blnc1能促进棕色脂肪细胞的形成和分化[12-14]。新近研究表明,一种新发现的名为AK079912的lncRNA促进了脂肪细胞分化及电子传递链的活化[15-16]。但AK079912在代谢相关组织中的表达模式及脂肪组织发育和棕色化过程中的变化规律,还鲜有报道。
本课题组近年研究发现,冷刺激1~5 d可诱导C57BL/6J小鼠脂肪组织棕色化,并表现出先“冷重构(1~3 d)”后“冷适应(4~5 d)”的动态过程,但不同部位的脂肪组织棕色化程度并不一致[17]。进一步利用β-3肾上腺素能受体激动剂CL316,243诱导原代培养脂肪细胞棕色化发现,在此过程中,炎性脂肪细胞因子及血管新生标志因子等表现出不同的时效性变化特点[18-19]。腹腔注射β-3肾上腺素受体激动剂CL316,243 1~5 d,能显著促进小鼠脂肪组织中棕色标志基因的表达[20]。然而,在脂肪组织发育及棕色化过程中,lncRNA AK079912的表达情况具有怎样的时序性和部位特异性,目前仍未可知。因此,本研究选取小鼠肝脏、肌肉组织和不同发育阶段的小鼠脂肪组织及原代培养脂肪细胞为研究对象,采用冷刺激和CL316,243诱导脂肪棕色化,利用RTqPCR检测lncRNAAK079912的时序表达变化,以期为深入研究该lncRNA在脂肪组织棕色化过程中的作用奠定基础,为肥胖及相关代谢疾病的防治提供新的研究思路。
1 材料和方法 1.1 试剂β-3肾上腺素能受体激动剂CL316,243(Tocris Bioscience),反转录试剂盒RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific),Trizol裂解液和实时定量SYBR Premix Ex Taq Ⅱ(TaKaRa);DMEM/F12培养基和胎牛血清(GIBCO),Ⅰ型胶原酶、牛血清白蛋白、罗格列酮(BRL-49653)、吲哚美辛、胰岛素、地塞米松、3-异丁基-1-甲基黄嘌呤、三碘甲状腺氨酸(T3)(Sigma)。
1.2 实验动物实验中所用C57BL/6J小鼠均由西安交通大学实验动物中心提供。饲养环境为SPF级鼠房,自由取食与饮水,食物为标准小鼠饲料。收集不同组织时,随机选取8周龄C57BL/6J雄鼠10只,断颈处死,取iBAT、sWAT、eWAT、肝脏和股二头肌;收集不同发育阶段脂肪组织时,随机选取出生后0 d、21 d、8周和6月龄C57BL/ 6J小鼠各10只,雌雄不拘,断颈处死,取iBAT、sWAT和eWAT,立即以液氮冷冻,-80 ℃保存备用。
收集冷刺激脂肪组织时,选取8周龄雄性C57BL/ 6J鼠,18 ℃冷适应1周后,随机分为6组,1组为室温对照组(n=6),另5组为冷刺激组并分别置于4 ℃环境下1、2、3、4、5 d(n=6/group)。所有小鼠均单笼饲养,其饮水及食物完全一致,实验期间每天称量小鼠的体质量和食物。收集CL处理的脂肪组织时,选取10周龄雄性C57/ BL6J鼠,随机分为4组,1组为对照组(vehicle,n=6),以1 μL/(g·d)剂量腹腔注射无菌生理盐水,其余3组为实验组并分别连续腹腔注射1 μg/g CL316,243 1、3、5 d(CL, n=6/group),实验共5 d。实验结束后,立即断颈处死小鼠并取不同部位脂肪组织样本液氮冷冻,-80 ℃保存备用。所有动物实验均经西安交通大学伦理委员会批准(编号:XJTU-2012-03-06-0037)。
1.3 原代前体脂肪细胞的分离培养在超净工作台内断颈处死刚离乳小鼠(21 d龄),无菌采集小鼠sWAT及iBAT。分离出的sWAT及iBAT分别用眼科剪剪成2~3 mm3左右的小颗粒。将脂肪组织小颗粒放入4倍于其体积的Ⅰ型胶原酶消化液中,置于37 ℃消化孵箱中震荡消化孵育40~70 min。用200目筛网过滤消化液,室温700 r/min离心10 min。弃上层清液及漂浮的细胞,加红细胞裂解液4 mL并反复吹打混匀,37 ℃吹打后置于孵箱静置10 min。再次室温700 r/min离心10 min。弃上层清液,加入细胞培养液4~5 mL后吹打混匀。于25 cm2培养瓶中接种,并置于培养箱中培养,温度37 ℃,饱和湿度,5% CO2。前体脂肪细胞生长至70%融合时传代备用。
1.4 前体脂肪细胞的诱导分化及CL316,243处理选取二代前体脂肪细胞,培养至完全融合且接触抑制状态时,用标准的诱导分化液诱导其向成熟脂肪细胞分化,在诱导分化的第9天,对细胞进行饥饿处理12 h。随后用CL316,243(2.0 μmol/L)处理液分别处理细胞1、2、3、4、5、6、12、24 h,Trizol收集细胞备用。
1.5 总RNA的提取及cDNA的合成根据试剂说明书利用Trizol试剂从组织和细胞样本中提取总RNA。用无RNA水解酶的DNA水解酶Ⅰ处理样本中的基因组DNA,提取后总RNA后,Nanodrop软件检测RNA的纯度和浓度,根据Thermo反转录试剂盒说明书步骤反转录合成cDNA。
1.6 实时定量PCRBio-Rad iQ5软件进行实时定量PCR,20 μL PCR反应体系:SYBR green 10 μL、2 μmol/L上游引物和下游引物2 μL、ddH2O 6 μL、cDNA模板2 μL。反应条件:95 ℃预变性5 s,每个循环60 ℃ 20 s。利用Bio-Rad Rotor Gene real time Analysis Software 6.0分析, 使用亲环素(Cyclophilin)作为内参基因,运用相对Ct法计算mRNA的表达,标准Ct值0.035,目的基因的值=2^(Ct Ref Gene - Ct GOI)。PCR所需引物由北京奥科鼎盛生物合成公司合成,引物序列如下:AK079912-F:5'-GGACAAGTTGCTCCTTCCTT-3';AK079912-R:5'-CAGAAGGCTTGTGTGTCAGA-3';cyclophlin-F:5'-CATACAGGTCCTGGCATCTTGTC-3';cyclophlin-R:5'-AGACCACATGCTTGCCATCCAG-3'。
1.7 数据统计分析采用GraphPad Prism 6.0分析,采用t检验分析两组数据间差异,采用one-way ANOVA结合Tukey's post-hoc检验分析3组及3组以上数据之间的差异,实验数据以均数±标准误表示。P < 0.05为差异有统计学意义。
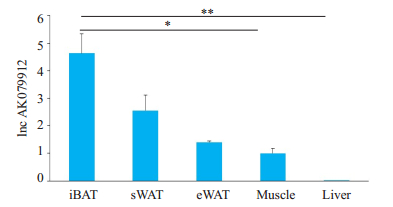
2 结果 2.1 不同组织中LncRNA AK079912的表达RT-qPCR检测可见,LncRNA AK079912在肝脏中表达量极低,在脂肪组织中高表达,但因脂肪组织种类不同而表达存在明显差异(图 1)。棕色脂肪组织中表达水平高于白色脂肪组织,而在白色脂肪组织中,LncRNA AK079912的表达水平在sWAT中较eWAT中更高。肌肉组织也有LncRNA AK079912的表达,但表达水平相对较低(图 1)。
|
图 1 lnc AK079912在小鼠代谢相关组织中的表达 Fig.1 Relative RNA expression of lnc AK079912 detected by real-time PCR in iBAT, sWAT, eWAT, muscle and liver of adult mice. n=10. *P < 0.05; **P < 0.01. |
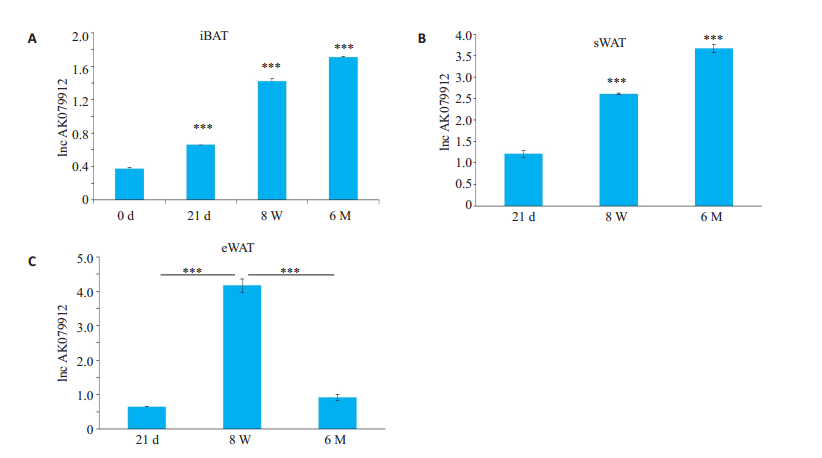
随iBAT的发育,AK079912的表达水平逐渐增高,且不同阶段之间具有显著性差异(图 2A),而在不同部位白色脂肪组织中表达状况却不同。随着sWAT的发育,AK079912的表达呈上升趋势(图 2B)。在eWAT为代表的内脏白色脂肪中AK079912的表达先达到峰值继而下降,下降过程发生在小鼠性成熟期(图 2C)。
|
图 2 lnc AK 079912在脂肪组织不同发育阶段的表达 Fig.2 Relative expression of lnc AK079912 in iBAT (A), sWAT (B), and eWAT (C) of the mice in different developmental phrases detected by real-time PCR (n=10); ***P < 0.001 vs 0 day (iBAT) or 21 days (sWAT and eWAT). |
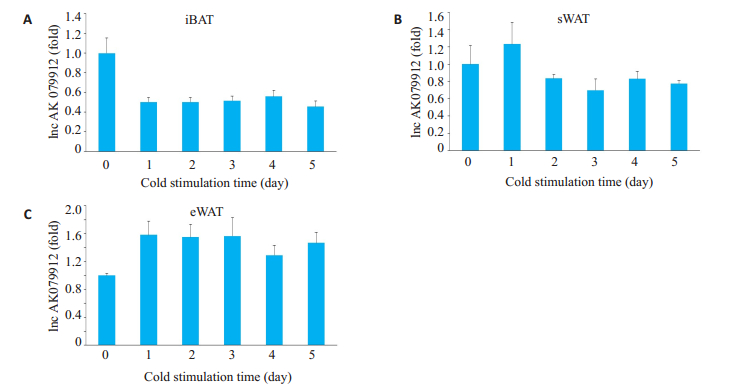
利用本实验室已建立的冷刺激诱导小鼠WAT棕色化模型,观察冷刺激1~5 d内不同类型的脂肪组织中AK079912的表达变化情况。在棕色脂肪组织中,经冷刺激后AK079912表达量有下降趋势,但未出现显著差异(图 3A)。在白色脂肪组织中,经过冷刺激后可发现AK079912表达量略有增高,但也未出现显著差异(图 3B、C)。
|
图 3 lnc AK079912在不同脂肪组织经不同时长冷刺激处理后的表达 Fig.3 Relative RNA expression of lnc AK079912 in different adipose tissues of the mice during cold stimulation at 4 ℃. Lnc AK079912 expression in iBAT (A), sWAT (B), and eWAT (C) were detected by real-time PCR (n=6). |
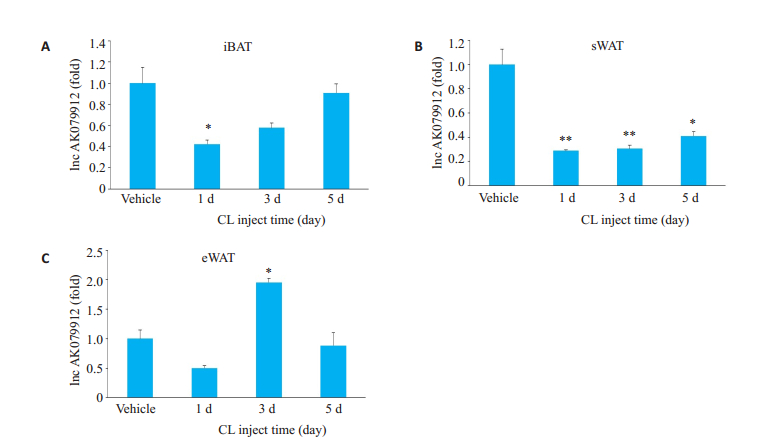
在iBAT中,CL注射1 d时,LncRNA AK079912的表达量显著下降(P < 0.05),但在CL处理的第3天和第5天,其表达量又恢复到正常水平(图 4A)。在sWAT中,CL注射第1、3、5天,均显著降低LncRNA AK079912的表达(图 4B)。在eWAT中,CL注射第3天显著促进LncRNA AK079912的表达,而其他时间点均未见其表达量的显著改变(图 4C)。
|
图 4 lnc AK079912在不同脂肪组织经CL316, 243处理后的表达 Fig.4 Relative RNA expression of lnc AK079912 in different adipose tissues of the mice with CL316.243 injection. Lnc AK079912 expression in iBAT (A), sWAT (B), and eWAT (C) were detected by real-time PCR (n=6). *P < 0.05, **P < 0.01 vs vehicle. |
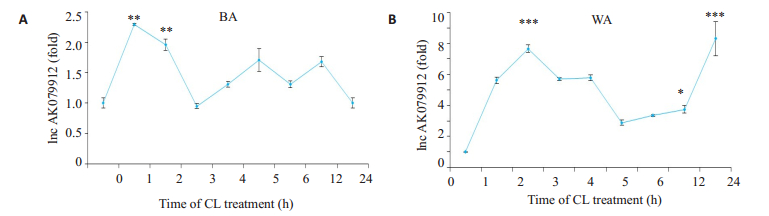
进一步采用离体培养的脂肪细胞,利用CL316,243诱导棕色化1~24 h,RT-qPCR检测AK079912的表达情况。实验结果表明,在CL316,243处理后1~2 h内的BAT中,AK079912上升,之后其表达量呈下调趋势(图 5A)。在诱导形成的WAT中,AK079912的表达量在处理后的12 h开始上调,并在24 h时达到新的高峰(图 5B)。
|
图 5 lnc AK079912在不同种类脂肪细胞中经CL316, 243处理后的表达 Fig.5 Expression of lnc AK079912 in different adipocytes after CL316, 243 (2 μmol/L) treatment for different durations. Lnc AK079912 expression in brown adipocyte (A) and white adipocyte (B) were detected by real-time PCR. Results are expressed as fold changes vs 0 h. CL: CL316, 243 treatment; BA: Brown adipocytes; WA: White adipocytes. *P < 0.05, **P < 0.01, ***P < 0.001 vs 0 h. |
lncRNA作为转录调节因子,与mRNA一样具有转录功能,但缺乏编码蛋白的潜力[21]。lncRNA可通过多种机制调节基因表达,在细胞分化、组织形成和个体发育方面起着重要的调控作用,其表达或功能的异常与人类疾病发生密切相关[22-24]。因此,lncRNA的研究已成为揭示某些疾病发生发展分子机制的一个新靶点,并成为当今生物学领域研究的一个热点。据报道,lncRNA AK079912能促进棕色脂肪细胞的分化,是棕色脂肪形成的正调控因子[16]。但是,AK079912在脂肪组织发育及WAT棕色化过程中的时序表达情况仍不清楚。本研究首先检测了AK079912在C57BL/6J小鼠肝脏、肌肉组织和不同部位脂肪组织中的表达情况,发现其在小鼠脂肪组织,尤其是棕色脂肪组织中的表达量甚高,而在小鼠肝脏和肌肉组织中未见显著表达或表达量极低。上述结果与Xiong等[16]的研究结果基本吻合,提示lnc AK079912在小鼠脂肪组织中有着重要的调控作用。
机体内的脂肪组织具有极强的可塑性,根据发育阶段或能量摄入情况不同,脂肪细胞可通过数目增多或体积增大两种方式调节其在机体的占比情况[25-26]。研究表明,小鼠BAT从胚胎15.5 d起开始发育,早期的BAT呈现出成纤维样细胞形态,胞内很少见脂滴充盈,到出生时,BAT内才开始聚集大量的脂滴[27-28]。但白色脂肪组织由于分布不同,其发育时间也不尽相同:sWAT从胚胎14~18 d开始发育,出生后才开始迅速充盈脂滴,而eWAT直到出生后才开始发育[29]。本研究中,由于采样手段的局限性,只采集了肉眼可见并易于分离的小鼠脂肪组织发育的几个典型时期,即出生(0 d)、离乳期(出生后第21天)、出生后第8周的性成熟期及中年期(6月龄),来研究AK079912在脂肪组织发育过程中的时序表达情况。实验结果表明,伴随着小鼠iBAT和sWAT的发育,AK079912的表达呈时序性上升趋势,但在eWAT中,AK079912的表达量在性成熟期达到高峰,后又呈现一定程度的下调。这提示,AK079912在不同部位的白色脂肪组织中的作用并不完全一致。有研究证实,脂肪组织由于其分布不同,功能也存在显著差异:皮下脂肪由于能分泌更多的抗炎性脂肪细胞因子而具有缓解胰岛素抵抗的作用,而内脏脂肪与胰岛素抵抗正相关[30-33]。那么,在不同部位脂肪组织发育过程中,AK079912的表达模式存在差异是否与脂肪组织不同功能相关?还有待于进一步研究证实。
前期研究发现,在冷刺激诱导的WAT棕色化过程中,不同部位脂肪组织也表现出部位差异性,这种组织特异性使得各部位脂肪组织在不同程度上参与了棕色化对组织炎性稳态、线粒体功能及血管新生平衡的调控作用[17-19]。让人意想不到的是,在本研究中,AK079912的表达在冷刺激5 d内的iBAT、sWAT或eWAT中,均未出现显著变化,然而腹腔注射CL316,243后,AK079912的表达量在iBAT和sWAT中显著降低,仅仅在eWAT中短暂上升。与之不同的是,有研究报道在冷刺激7 d的小鼠iBAT及sWAT中,AK079912的表达量是显著上升的[16]。该差异是否与诱导脂肪组织棕色化的时长有关,抑或是小鼠诱导的操作上存在差异?还有待进一步研究证实。然而,在β-3肾上腺素能受体激动剂诱导棕色化的模型中,伴随着CL316,243处理1~24 h,AK079912的表达量在棕色和白色脂肪细胞中均出现了明显的上调,且在白色脂肪细胞中变化更加明显。这提示,AK079912参与了早期beige细胞的形成,但这一作用的具体发生机制仍需进一步研究阐明。
综上所述,AK079912作为新发现的lncRNA,在小鼠脂肪组织特别是BAT中高表达,随着脂肪组织的发育,AK079912的表达量显著上升,但不同部位脂肪组织表现出部位差异性。AK079912在冷刺激诱导的WAT棕色化中无明显变化,但在CL316, 243诱导的beige细胞形成早期高表达,可能与其参与调节脂肪棕色化的时间点有关,然而其具体机制尚需进一步研究证实。
| [1] |
Cypess AM, Lehman S, Williams G, et al. Identification and importance of brown adipose tissue in adult humans[J]. N Engl J Med, 2009, 360(15): 1509-17. DOI:10.1056/NEJMoa0810780 |
| [2] |
Zhang F, Hao GY, Shao ML, et al. An adipose tissue atlas: an imageguided identification of human-like BAT and beige depots in rodents[J]. Cell Metab, 2018, 27(1): 252-61. DOI:10.1016/j.cmet.2017.12.004 |
| [3] |
Sidossis L, Kajimura S. Brown and beige fat in humans:thermogenic adipocytes that control energy and glucose homeostasis[J]. J Clin Invest, 2015, 125(2): 478-86. DOI:10.1172/JCI78362 |
| [4] |
Kajimura S, Spiegelman BM, Seale P. Brown and beige fat: physiological roles beyond heat generation[J]. Cell Metab, 2015, 22(4): 546-59. DOI:10.1016/j.cmet.2015.09.007 |
| [5] |
Wang SY, Pan MH, Hung WL, et al. From white to beige adipocytes: therapeutic potential of dietary molecules against obesity and their molecular mechanisms[J]. Food Funct, 2019, 10(3): 1263-79. DOI:10.1039/C8FO02154F |
| [6] |
Cohen P, Spiegelman BM. Brown and beige fat:molecular parts of a thermogenic machine[J]. Diabetes, 2015, 64(7): 2346-51. DOI:10.2337/db15-0318 |
| [7] |
Wang YM, Paulo E, Wu DM, et al. Adipocyte liver kinase b1 suppresses beige adipocyte renaissance through class Ⅱa histone deacetylase 4[J]. Diabetes, 2017, 66(12): 2952-63. DOI:10.2337/db17-0296 |
| [8] |
Fukunaka A, Fukada T, Bhin J, et al. Zinc transporter ZIP13 suppresses beige adipocyte biogenesis and energy expenditure by regulating C/EBP- beta expression[J]. PLoS Genet, 2017, 13(8): e1006950-61. DOI:10.1371/journal.pgen.1006950 |
| [9] |
Gao Z, Daquinag AC, Su F, et al. PDGFR alpha/PDGFR beta signaling balance modulates progenitor cell differentiation into white and beige adipocytes[J]. Development, 2018, 145(1): 320-31. |
| [10] |
Ni B, Farrar JS, Chen SS, et al. A novel role for PTK2B in cultured beige adipocyte differentiation[J]. Biochem Biophys Res Commun, 2018, 501(4): 851-7. DOI:10.1016/j.bbrc.2018.05.021 |
| [11] |
Wei SJ, Du M, Jiang ZH, et al. Long noncoding RNAs in regulating adipogenesis: new RNAs shed lights on obesity[J]. Cell Mol Life Sci, 2016, 73(10): 2079-87. DOI:10.1007/s00018-016-2169-2 |
| [12] |
Zhao XY, Li SM, Wang GX, et al. A long noncoding RNA transcriptional regulatory circuit drives thermogenic adipocyte differentiation[J]. Mol Cell, 2014, 55(3): 372-82. DOI:10.1016/j.molcel.2014.06.004 |
| [13] |
Zhao XY, Li SM, Delproposto JL, et al. The long noncoding RNA Blnc1 orchestrates homeostatic adipose tissue remodeling to preserve metabolic health[J]. Mol Metab, 2018, 14(1): 60-70. |
| [14] |
Mi L, Zhao XY, Li SM, et al. Conserved function of the long noncoding RNA Blnc1 in brown adipocyte differentiation[J]. Mol Metab, 2017, 6(1): 101-10. DOI:10.1016/j.molmet.2016.10.010 |
| [15] |
Yang L, Li P, Yang WJ, et al. Integrative transcriptome analyses of metabolic responses in mice define pivotal LncRNA metabolic regulators[J]. Cell Metab, 2016, 24(4): 627-39. DOI:10.1016/j.cmet.2016.08.019 |
| [16] |
Xiong Y, Yue F, Jia ZH, et al. A novel brown adipocyte-enriched long non- coding RNA that is required for brown adipocyte differentiation and sufficient to drive thermogenic gene program in white adipocytes[J]. Biochimic Biophysic Acta-Molecul Cell Biol Lipids, 2018, 1863(4): 409-19. |
| [17] |
Jia R, Luo XQ, Wang G, et al. Characterization of cold-induced remodelling reveals depot- specific differences across and within brown and white adipose tissues in mice[J]. Acta Physiol (Oxf), 2016, 217(4): 311-24. DOI:10.1111/apha.12688 |
| [18] |
Luo X, Jia R, Zhang QL, et al. Cold-Induced browning dynamically alters the expression profiles of inflammatory adipokines with tissue specificity in mice[J]. Int J Mol Sci, 2016, 17(5): 1306-17. |
| [19] |
Luo X, Jia R, Luo XQ, et al. Cold exposure differentially stimulates angiogenesis in BAT and WAT of mice: implication in adrenergic activation[J]. Cell Physiol Biochem, 2017, 42(3): 974-86. DOI:10.1159/000478680 |
| [20] |
贾如, 黄佳琪, 魏晓静, 等. β3肾上腺素能受体激动剂诱导小鼠脂肪组织棕色化的时效性作用[J]. 中南大学学报:医学版, 2019, 44(10): 1099-106. |
| [21] |
Wu H, Yang L, Chen LL. The diversity of long noncoding RNAs and their generation[J]. Trends Genet, 2017, 33(8): 540-52. DOI:10.1016/j.tig.2017.05.004 |
| [22] |
Kopp F, Mendell JT. Functional classification and experimental dissection of long noncoding RNAs[J]. Cell, 2018, 172(3): 393-407. DOI:10.1016/j.cell.2018.01.011 |
| [23] |
Alvarez-Dominguez JR, Lodish HF. Emerging mechanisms of long noncoding RNA function during normal and malignant hematopoiesis[J]. Blood, 2017, 130(18): 1965-75. DOI:10.1182/blood-2017-06-788695 |
| [24] |
Beermann J, Piccoli MT, Viereck J, et al. Non- coding RNAs in development and disease: background, mechanisms and therapeutic approaches[J]. Physiol Rev, 2016, 96(4): 1297-325. DOI:10.1152/physrev.00041.2015 |
| [25] |
Jackson AS, Stanforth PR, Gagnon J, et al. The effect of sex, age and race on estimating percentage body fat from body mass index: the heritage family study[J]. Int J Obes Relat Metab Disord, 2002, 26(6): 789-96. DOI:10.1038/sj.ijo.0802006 |
| [26] |
Pellegrinelli V, Carobbio S, Vidal-Puig A. Adipose tissue plasticity: how fat depots respond differently to pathophysiological cues[J]. Diabetologia, 2016, 59(6): 1075-88. DOI:10.1007/s00125-016-3933-4 |
| [27] |
Schmid P, Lorenz A, Hameister H, et al. Expression of p53 during mouse embryogenesis[J]. Development, 1991, 113(3): 857-65. |
| [28] |
Schulz TJ, Huang P, Huang TL, et al. Brown- fat paucity due to impaired BMP signalling induces compensatory browning of white fat[J]. Nature, 2013, 495(7441): 379-83. DOI:10.1038/nature11943 |
| [29] |
Wang QA, Tao C, Gupta RK, et al. Tracking adipogenesis during white adipose tissue development, expansion and regeneration[J]. Nat Med, 2013, 19(10): 1338-44. DOI:10.1038/nm.3324 |
| [30] |
Ibrahim MM. Subcutaneous and visceral adipose tissue: structural and functional differences[J]. Obes Rev, 2010, 11(1): 11-8. |
| [31] |
Marinou K, Hodson L, Vasan SK, et al. Structural and functional properties of deep abdominal subcutaneous adipose tissue explain its association with insulin resistance and cardiovascular risk in men[J]. Diabetes Care, 2014, 37(3): 821-9. DOI:10.2337/dc13-1353 |
| [32] |
Peppler WT, Townsend LK, Knuth CM, et al. Subcutaneous inguinal white adipose tissue is responsive to, but dispensable for, the metabolic health benefits of exercise[J]. Am J Physiol Endocrinol Metab, 2018, 314(1): E66-77. DOI:10.1152/ajpendo.00226.2017 |
| [33] |
Kadiri S, Auclair M, Capeau J, et al. Depot-Specific response of adipose tissue to diet- induced inflammation: the retinoid- related orphan receptor (ROR) involved[J]. Obesity (Silver Spring), 2017, 25(11): 1948-55. DOI:10.1002/oby.22006 |
 2019, Vol. 39
2019, Vol. 39

