2. 重庆市生物医学工程学重点实验室,重庆 400016
2. Chongqing Key Laboratory of Biomedical Engineering, Chongqing 400016, China
外阴慢性单纯性苔藓(LSC)属于外阴色素减退性疾病,是外阴瘙痒最常见的原因之一,好发于中老年妇女,其发病率至今尚不明确[1-4]。其病理特征为外阴皮肤表层鳞状上皮增生,细胞过度角化或角化不全,真皮浅层胶原纤维化伴有不等量炎细胞浸润[5-6]。临床各种治疗外阴LSC方法均有其局限性,复发率较高[7-8],而聚焦超声治疗外阴LSC效果显著,复发率极低[9],但关于聚焦超声降低外阴LSC的复发率机制的研究尚未见报道。本实验通过研究notch1及c-fos蛋白聚焦超声治疗前后在SD大鼠外阴LSC模型外阴皮肤组织中的变化,探寻聚焦超声通过抑制SD大鼠外阴LSC模型真皮浅层胶原纤维化,从而降低外阴LSC复发率的机制。
外阴LSC真皮浅层胶原纤维化,其真皮层成纤维细胞增多,胶原纤维过度沉积的病理改变与瘢痕疙瘩类似[10],因此猜想外阴LSC因具有瘢痕疙瘩纤维化的特性,而导致疾病易反复发作、不易根治,针对这种纤维化的特性进行动物实验设计,探究聚焦超声通过抑制其外阴皮肤组织纤维化,降低外阴LSC复发率的机制。有文献通过建立SD大鼠外阴LSC模型对聚焦超声缓解外阴LSC的瘙痒症状进行研究[11],但尚未有学者研究聚焦超声降低外阴LSC复发率的机制。本实验采用二甲基苯并蒽(7, 12-DMBA)溶液涂抹于健康SD大鼠外阴数周诱导出SD大鼠外阴LSC模型[11-12],然后进行聚焦超声治疗,观察聚焦超声对SD大鼠的治疗效果,治疗前后大鼠外阴组织中notch1和c-fos的变化以及真皮浅层胶原纤维化的程度,研究聚焦超声降低外阴LSC复发率的机制。
1 材料和方法 1.1 实验动物健康雌性SD大鼠60只,体质量160~180 g,6~8周龄,由重庆医科大学实验动物中心提供[动物使用许可证号:SYXK(渝)2018-0003],所有动物实验已经重庆医科大学伦理委员会批准。
1.2 试剂及仪器二甲基苯并蒽(美国Sigma);分析纯丙酮溶液(上海阿拉丁);masson三色染色液(武汉赛维尔生物科技有限公司);二甲苯(国药集团化学试剂有限公司);notch1单克隆抗体、c-fos单克隆抗体(武汉赛维尔生物科技有限公司);DAB显色试剂盒(北京中杉金桥)。海极星®CZF型超声波妇科治疗仪(重庆海扶医疗科技股份有限公司)。
1.3 实验方法 1.3.1 动物模型的建立及分组将60只雌性SD大鼠备皮消毒后,硬毛牙刷刷大鼠外阴皮肤,刷至皮肤充血发红即可。用勾线笔蘸0.5% DMBA丙酮溶液涂布于外阴皮肤。每周一、三、五3次涂药,连续12周。外阴活检确定模型建立成功[11]的50只雌性SD大鼠,按随机数字表随机分为治疗组和对照组(n=25)。
1.3.2 聚焦超声治疗治疗组:1.0%戊巴比妥钠腹腔麻醉SD大鼠后,备皮消毒,治疗区域涂超声治疗专用耦合剂。CZF治疗参数:频率10.02 MHz;脉冲1000 Hz;焦距3.5 mm;功率2.8 W;根据皮损的范围、程度和局部对超声辐照的反应确定辐照时间,一般69±18.855 s;均采用单次治疗的方式,治疗剂量为193.2±53.795 J。治疗头紧贴大鼠外阴皮肤,辐照方式为匀速直线辐照,速度为5~10 mm/s。TES-1310测温仪测量外阴皮肤温度,当温度达到40~43 ℃ [13]时停止辐照。对照组:治疗过程与治疗组相同,但仪器无功率输出。
1.3.3 肉眼及病理观察每次实验前对全部SD大鼠进行称重和观察及触诊大鼠全身是否有肿块,淋巴结是否肿大。对照组观察DMBA涂抹后外阴皮肤是否有充血;触摸时皮肤是否有紧绷和增厚感,皮肤弹性是否减弱;药物涂抹一段时间后皮肤表面是否有肿瘤样新生物生长等变化。治疗组肉眼观察聚焦超声治疗后第1、4、7、14、21天外阴皮肤是否有水肿溃疡,皮下硬结,瘢痕增生等变化。在治疗4周取外阴皮肤活检进行组织学观察,对照组也同时活检,取下的皮肤组织由4%多聚甲醛固定,脱水,石蜡包埋,切片,HE染色和masson染色。
1.3.4 胶原纤维密度取活检确定为LSC和聚焦超声治疗后4周的大鼠皮肤组织石腊块,脱蜡、水化组织切片;切片入重铬酸钾浸泡过夜,自来水冲洗;铁苏木素A液与B液等比混合成铁苏木素染液染色;丽春红酸性品红染色、磷钼酸染色后经甲苯胺蓝染色;1%冰醋酸分化后透明封片。masson染色后真皮层胶原纤维呈蓝色,采用IPP 6.0软件对切片的染色信号进行光密度分析,平均光密度值代表真皮层胶原纤维的平均密度。每张切片在高倍镜(×400)下随机选取5个视野,计算其平均光密度值。
1.3.5 透射电镜观察取活检确定为LSC和聚焦超声治疗后4周的大鼠外阴皮肤组织,0.9%生理盐水清洗干净至组织块表面无血迹,置4%戊二醛液(pH 7.4)、4 ℃冰箱冷藏预固定2 h以上,再用1%四氧化锇后固定,乙醇梯度脱水,环氧树脂包埋,经半薄切片光镜下定位表皮及真皮组织,进行超薄切片,醋酸铀及枸橼酸铅双重染色后Hitachi-7500型透射电镜观察、拍照。
1.3.6 免疫组织化学取活检确定为LSC和聚焦超声治疗后4周的大鼠皮肤组织石腊块,脱蜡、水化组织切片;组织切片置于盛满柠檬酸抗原修复缓冲液(pH6.0)的修复盒中于微波炉内进行抗原修复;3% H2O2去离子水室温避光孵育25 min,在PBS(pH7.4)溶液中洗涤3次,每次5 min;3%BSA室温封闭30 min,滴加相应的按一定比例与PBS配比的一抗,4 ℃孵育过夜;滴加相应的二抗,PBS冲洗3次,DAB显色液显色,复染、脱水封片。在高倍显微镜(×400)下观察,notch1以细胞膜和/或胞浆出现棕黄色颗粒为阳性,c-fos以细胞核出现棕黄色颗粒为阳性,采取到的图像采用软件IPP6.0进行光密度分析,平均光密度值代表蛋白表达的强度,每张切片随机选取5个视野,计算平均光密度值。
1.3.7 Western blot检测取保存于-80 ℃的活检确定为LSC的外阴皮肤组织,组织研磨后加入匀浆液(每60 mg组织加入200 μL匀浆液)提取皮肤组织细胞浆或细胞核蛋白,BCA蛋白浓度测定试剂盒测蛋白浓度。蛋白样品在SDS-聚丙烯酰氨凝胶中电泳分离后采用湿转法将凝胶上的蛋白质转移到PVDF膜上(300 mA,30 min),5%脱脂牛奶(0.5% TBST配)于室温下封闭4 h,先后加入一抗(TBST溶解的5%脱脂牛奶,磷酸化蛋白使用TBST溶解的5% BSA)和相对应的二抗(TBST稀释比例1:3000),最后经化学发光法显像。图像结果采用凝胶成像系统进行图象分析,Alpha软件处理系统分析目标带的光密度值。
1.4 统计学分析应用SPSS22.0统计软件进行分析处理。样本量的估算采用完全随机设计的两个总体率假设检验。治疗后治愈率的比较采用连续校正χ2检验。计量资料用均数±标准差表示,本实验采用Shapiro-Wilk检验法进行数据的正态性检验,符合正态性、方差齐性,因此采用两独立样本t检验,P < 0.05认为差异有统计学意义。
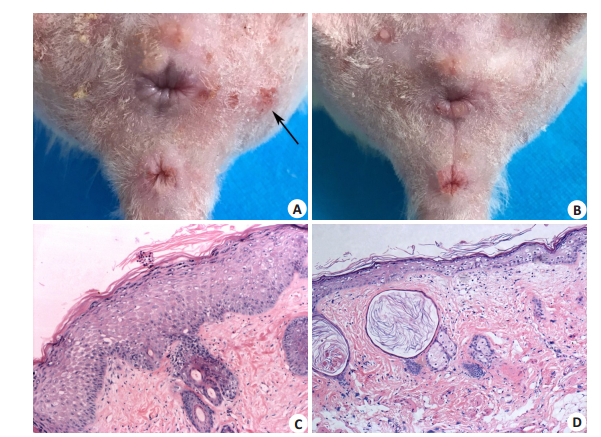
2 结果 2.1 外阴皮肤形态及病理观察对照组SD大鼠(聚焦超声治疗前)肉眼观外阴皮肤表面基本无毛发生长,弹性差,有紧绷和增厚感,表面较粗糙,增厚明显的部位有发红现象(图 1A)。治疗组聚焦超声辐照后第1天,SD大鼠外阴皮肤表皮完好,有轻度充血水肿现象。第4天SD大鼠充血水肿消退,有轻度结痂现象。第7天SD大鼠外阴仍然存在轻度结痂现象。第14天SD大鼠外阴结痂脱落,外阴皮肤基本恢复正常。第21天SD大鼠外阴有毛发生长,触之弹性较好,皮肤功能基本恢复正常(图 1B)。
|
图 1 SD大鼠外阴皮肤形态学和病理学 Fig.1 Morphology and pathology of SD rat genital skin. A: Genital skin of a rat with vulvar lichen simplex chronicus (LSC) showing reddened skin indicating hyperplasia (arrow); B: Genital skin of a rat after focus ultrasound therapy; C, D: pathological examination of the skin tissue of rats with vulvar LSC and after focus ultrasound therapy (HE staining, original magnification: ×100). |
病理检查结果显示,对照组SD大鼠外阴皮肤表皮复层鳞状上皮增生,主要为棘细胞层增生,表皮过度角化或角化不全,真皮层胶原纤维过度增生和沉积,胶原纤维均质化,伴炎细胞浸润(图 1C)。治疗组聚焦超声辐照后第1天, 真皮乳头层水肿;第4天水肿消退, 有慢性炎性细胞浸润;第7天真皮层可见新生毛细血管增生;第14天真皮层胶原纤维数量减少;第21天SD大鼠外阴皮肤表皮增生较聚焦超声治疗前减弱,真皮层胶原纤维密度较治疗前减小,排列疏松(图 1D)。
2.2 病理学结果统计聚焦超声治疗4周后,对照组中有19只(76%)大鼠继续进展为外阴低级别鳞状上皮内病变(LSIL),3只(12%)仍然表现为LSC,3只(12%)恢复正常。经过聚焦超声干预的治疗组大鼠中,16%(4/25)大鼠继续进展为LSIL,4%(1/25)大鼠仍为LSC,80% (20/25)实验大鼠外阴皮肤恢复正常(表 1),两组治愈率差异有统计学意义(χ2=20.620,P < 0.05)。
| 表 1 各组病理学改变 Tab.1 Pathological changes in each group |
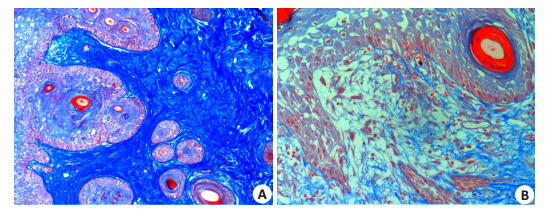
对照组SD大鼠经过masson染色观察,在表皮基底层与真皮交界的部位胶原纤维过度增生和沉积,蓝染部位密度明显增大(图 2A),经检测光密度值为0.2077± 0.0205。治疗组的SD大鼠在治疗后真皮浅层胶原纤维蓝染部位密度明显减小(图 2B),经检测光密度值为0.1287±0.0165,两组差异具有统计学意义(P < 0.05)。
|
图 2 真皮浅层胶原纤维masson染色 Fig.2 Masson staining showing the superfical collagen fiber (×200). A: Control group; B: Treatment group. |
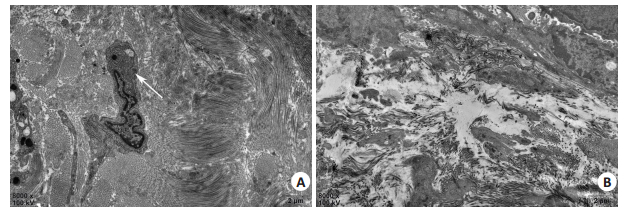
对照组SD大鼠透射电镜观察到表皮层棘细胞层细胞数量增多,可见大量淋巴细胞浸润,线粒体肿胀。真皮层可见致密的平行或交错分布的胶原纤维束,成纤维细胞内粗面内质网明显。表皮与真皮交界处可见淋巴细胞浸润,偶有水肿现象,可见肥大细胞的脱颗粒现象(图 3A)。治疗组的SD大鼠外阴皮肤表皮层结构与正常SD大鼠无异,棘细胞层仅有轻微增生现象。真皮层胶原纤维密度明显减小,可见成纤维细胞和纤维细胞。表皮与真皮交界处可见少量淋巴细胞浸润(图 3B)。
|
图 3 真皮浅层透射电镜观察 Fig.3 Transmission electron microscopy of the superficial dermis (× 8000). A: Transmission electron microscopy in the control group showing dense parallel or staggered collagen fiber bundles, and rough endoplasmic reticulum in fibroblasts is clearly visible (arrow); B: Transmission electron microscopy in the treatment group showing obviously lowered density of collagen fibers in the superficial dermis, and the epithelial basal cells are visible. |
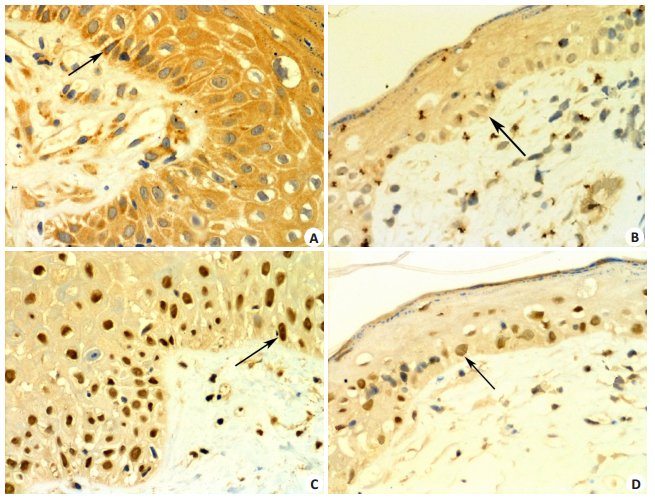
对照组SD大鼠外阴皮肤中notch1和c-fos表达较多,呈棕黄色颗粒,着色较深,notch1的阳性表达部位主要位于表皮层胞质内,c-fos的阳性表达部位主要位于表皮层胞核内,二者均呈强阳性表达,真皮层仅有少量表达(图 4A、C)。治疗组仅有少量表达,且着色较浅,呈弱阳性或者阴性,阳性细胞数量明显较少(图 4B、D)。与对照组相比,治疗组notch1表达量明显降低(t=15.573,P < 0.05);治疗组c-fos的表达量也明显降低(t=19.996,P < 0.05,表 2)。
|
图 4 免疫组织化学检测notch1和c-fos蛋白在SD大鼠外阴皮肤中的表达 Fig.4 Expression of notch1 and c-fos proteins in the vulvar skin of SD rats detected by immunohistochemistry (× 400). A: Strong Notch1 protein expression in the vulvar skin of a control rat, locating mainly in the cytoplasm (arrow); B: Relatively weak Notch1 expression (arrow) and significantly decreased positive cells in a rat in the treatment group; C: Strong C-fos protein expression in the vulvar skin of a control rat, located mainly in the cell nuclei (arrow); D: Lowered C-fos expression (arrow) and decreased number of positive cells in the treatment group. |
| 表 2 SD大鼠外阴组织皮肤中notch1和c-fos蛋白的相对表达量 Tab.2 Relative expression of notch1 and c-fos protein in the genital skin of SD rats (Mean±SD) |
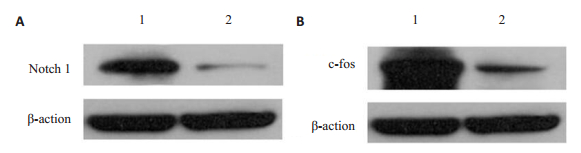
治疗组notch1、c-fos的条带明显比对照组细(图 5A、B),治疗组大鼠外阴皮肤组织中notch1、c-fos蛋白的相对表达量明显降低,两组差异具有统计学意义(P < 0.05,表 2)。
|
图 5 Western blot检测大鼠外阴皮肤中notch1、c-fos蛋白的表达 Fig.5 Expression of notch1 and c-fos proteins in the vulvar skin of the rats detected by Western blotting. A: Notch1 protein expression; B: C-fos protein expression; 1: control group; 2: Treatment group. |
外阴LSC可能主要继发于各种慢性刺激导致外阴顽固性瘙痒的疾病[14-15]。聚焦超声治疗外阴LSC有效性高,安全性好,具有明显的高效治疗和低复发率的优势,目前在我国已广泛用于治疗外阴上皮内非瘤样病变[9, 16-17]。外阴LSC真皮层胶原纤维化,其真皮层成纤维细胞增多,胶原纤维过度增生和沉积的病理改变与瘢痕疙瘩类似[18-19]。因外阴LSC瘙痒所致的外阴瘢痕性增生具有瘢痕疙瘩的特性,易反复发作、不易根治、瘙痒难忍等[20-21]。针对这种纤维化特性,本实验通过建立SD大鼠外阴LSC模型,探寻聚焦超声通过抑制SD大鼠外阴LSC模型外阴皮肤组织中notch1及c-fos的表达,从而抑制SD大鼠外阴LSC模型真皮浅层胶原纤维化,降低外阴LSC复发率的机制。notch1和c-fos蛋白均参与和控制真皮层胶原纤维化的相关过程。notch1蛋白存在于角质形成细胞表面的配体,通过notch1信号途径促进真皮成纤维细胞胶原蛋白的释放和纤维化[22]。c-fos可被角质形成细胞释放的KDAF蛋白激活,导致真皮层成纤维细胞中的MMP-1mRNA过表达,从而影响成纤维细胞分化增殖或者转化、胶原合成与降解的过程[23-25]。
在本研究中,模型建立成功的SD大鼠,即对照组SD大鼠的外阴皮肤组织表皮层,经过免疫组织化学检测和Western blot检测后可知,notch1和c-fos蛋白表达明显增加。免疫组织化学检测后高倍显微镜下观察对照组SD大鼠外阴皮肤组织,被染为棕黄色的细胞颗粒较多,蛋白表达具有明显阳性。Western blot检测后观察对照组SD大鼠外阴条带明显粗于治疗组,结果表明对照组SD大鼠蛋白表达较多。本研究对照组SD大鼠经过maason染色后可知真皮浅层胶原纤维化明显,表现为成纤维细胞增多,透射电镜观察可见明显的粗面内质网,粗面内质网增多,结果表明胶原蛋白分泌活跃,因此导致胶原蛋白过度沉积,真皮层胶原纤维密度增大;而聚焦超声治疗后的SD大鼠经过maason染色后真皮浅层胶原纤维细胞较治疗前密度明显减少,排列疏松,电镜下观察成纤维细胞和纤维细胞偶见。同时,治疗组通过免疫组织化学和Western blot检测可知,与纤维化相关的蛋白notch1及c-fos蛋白的表达均减少,表现为细胞黄染颗粒较少,染色较浅,Western blot条带较细,蛋白表达量较少;该结果表明表皮层与纤维化相关的蛋白表达被抑制,表明聚焦超声治疗可以通过表皮层notch1及c-fos蛋白抑制真皮层两种蛋白纤维化相关的通路,从而抑制SD大鼠外阴LSC外阴皮肤组织纤维化,降低LSC的复发率。临床治疗增生性瘢痕和瘢痕疙瘩手段繁多[26-28],但各种治疗方式均有其局限性,聚焦超声应用于瘢痕疙瘩治疗可发挥其无辐射等优势。
总之,聚焦超声治疗可以降低LSC患者术后的复发率,动物模型的研究也证实了外阴LSC经聚焦超声治疗后真皮浅层胶原纤维化程度减弱,其恢复程度接近于正常皮肤组织,与纤维化相关的蛋白如notch1和c-fos蛋白的表达降低也可能与聚焦超声治疗有关。探寻聚焦超声治疗减低外阴LSC的复发率机制,有利于临床进一步研究外阴LSC的发病机制,为临床彻底治愈外阴LSC的探索提供理论依据。
| [1] |
谢幸, 孔北华, 段涛, 等. 妇产科学[M]. 9版. 北京: 人民卫生出版杜, 2018: 234-5.
|
| [2] |
Fruchter R, Melnick L, Pomeranz MK. Lichenoid vulvar disease: a review[J]. Int J Women's Dermatol, 2017, 3(1): 58-64. DOI:10.1016/j.ijwd.2017.02.017 |
| [3] |
Kellogg Spadt S, Kusturiss E. Vulvar dermatoses: a primer for the sexual medicine clinician[J]. Sexual Med Rev, 2015, 3(3): 126-36. DOI:10.1002/smrj.55 |
| [4] |
van Meijden WI, Boffa MJ, Ter Harmsel WA, et al. 2016 European guideline for the management of vulval conditions[J]. J Eur Acad Dermatol Venereol, 2017, 31(6): 925-41. DOI:10.1111/jdv.14096 |
| [5] |
Chan MP, Zimarowski MJ. Vulvar dermatoses: a histopathologic review and classification of 183 cases[J]. J Cutan Pathol, 2015, 42(8): 510-8. DOI:10.1111/cup.12541 |
| [6] |
Mai PH, Selim MA, Smoller B. Histological clues in interpreting vulvar inflammatory and autoimmune dermatoses[M]. Springer New York: Vulvar Pathology, 2015: 21-9.
|
| [7] |
Virgili A, Minghetti S, Borghi A, et al. Phototherapy for vulvar lichen simplex chronicus: an 'off-label use' of a comb light device[J]. Photodermatol Photoimmunol Photomed, 2014, 30(6): 332-4. DOI:10.1111/phpp.12120 |
| [8] |
Wu C, Zou M, Xiong Y, et al. Short- and long-term efficacy of focused ultrasound therapy for non-neoplastic epithelial disorders of the vulva[J]. Int J Obstetrics Gynaecol, 2017, 124(3, SI): 87-92. |
| [9] |
Ye MZ, Deng XL, Mao SP, et al. High intensity focused ultrasound treatment for non-neoplastic epithelial disorders of the vulva: factors affecting effectiveness and recurrence[J]. Int J Hyperthermia, 2015, 31(7): 771-6. DOI:10.3109/02656736.2015.1053101 |
| [10] |
Ogawa R. Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis[J]. Int J Mol Sci, 2017, 18(3): 1-10. |
| [11] |
Yang H, Fu ZH, Tang HJ, et al. Establishment of a SD rat model of vulvar lichen simplex chronicus and detection of the expression of protease activated receptor 2[J]. J Southern Med Univ, 2017, 37(1): 30-5. |
| [12] |
Fan Y, Tang H, Liu Y, et al. Establishment of a rat model of dimethylbenzanthracene-induced vulvar squamous intraepithelial lesions[J]. J Southern Med Univ, 2018, 38(11): 1318-24. |
| [13] |
Jia Y, Wu J, Chen L, et al. Focused ultrasound therapy for vulvar intraepithelial neoplasia in a mice model[J]. Am J Med Sci, 2013, 346(4): 303-7. DOI:10.1097/MAJ.0b013e318272087a |
| [14] |
Stewart KM. Clinical care of vulvar pruritus, with emphasis on one common cause, lichen simplex chronicus[J]. Dermatol Clin, 2010, 28(4): 669-80. DOI:10.1016/j.det.2010.08.004 |
| [15] |
Thorstensen KA, Birenbaum DL. Recognition and management of vulvar dermatologic conditions: lichen sclerosus, lichen planus, and lichen simplex chronicus[J]. J Midwifery Womens Health, 2012, 57(3): 260-75. DOI:10.1111/j.1542-2011.2012.00175.x |
| [16] |
Marinova M, Rauch M, Schild HH, et al. Novel non-invasive treatment with high-intensity focused ultrasound (HIFU)[J]. Ultraschall Med, 2016, 37(1): 46-55. |
| [17] |
Ruan L, Xie Z, Wang H, et al. High-intensity focused ultrasound treatment for non-neoplastic epithelial disorders of the vulva[J]. Int J Gynaecol Obstet, 2010, 109(2): 167-70. DOI:10.1016/j.ijgo.2009.12.014 |
| [18] |
Marnach ML, Torgerson RR. Vulvovaginal issues in mature women[J]. Mayo Clin Proc, 2017, 92(3): 449-54. DOI:10.1016/j.mayocp.2016.10.031 |
| [19] |
Carrillomeléndrez H, Villamilcerda D, Espinozahernández J, et al. Vulvar pruritus: determination of the most common causes and their treatments[J]. Ginecolog Obstet Mex, 2015, 83(3): 179-88. |
| [20] |
刘洁. 综合疗法治疗外阴瘙痒所致瘢痕疙瘩的临床疗效观察[J]. 医学理论与实践, 2017, 30(6): 865-6. |
| [21] |
Zhang MZ, Dong XH, Guan EL, et al. A comparison of apoptosis levels in keloid tissue, physiological scars and normal skin[J]. Am J Transl Res, 2017, 9(12): 5548-57. |
| [22] |
Syed F, Bayat A. Notch signaling pathway in keloid disease: enhanced fibroblast activity in a Jagged-1 peptide-dependent manner in lesional vs extralesional fibroblasts[J]. Wound Repair Regen, 2012, 20(5): 688-706. DOI:10.1111/j.1524-475X.2012.00823.x |
| [23] |
Zhu ZS, Ding J, Heather A, et al. The molecular mechanism of hypertrophic scar[J]. J Cell Commun Signal, 2013, 7(4): 239-52. DOI:10.1007/s12079-013-0195-5 |
| [24] |
Medina A, Ghaffari A, Kilani RT, et al. The role of stratifin in fibroblast-keratinocyte interaction[J]. Mol Cell Biochem, 2007, 305(1/2): 255-64. |
| [25] |
Ponticos M, Papaioannou I, Xu S, et al. Failed degradation of JunB contributes to overproduction of type Ⅰ collagen and development of dermal fibrosis in patients with systemic sclerosis[J]. Arthritis Rheumatol, 2015, 67(1): 243-53. DOI:10.1002/art.38897 |
| [26] |
Lee YI, Kim J, Yang CE, et al. Combined therapeutic strategies for keloid treatment[J]. Dermatol Surg, 2019, 45(6): 802-10. DOI:10.1097/DSS.0000000000001695 |
| [27] |
Zhang Z, Cheng L, Wang R, et al. Effects and safety of triamcinolone acetonide-controlled common therapy in keloid treatment: a bayesian network meta-analysis[J]. Ther Clin Risk Manag, 2018, 14(9): 973-80. |
| [28] |
Bijlard E, Timman R, Verduijn GM, et al. Intralesional cryotherapy versus excision with corticosteroid injections or brachytherapy for keloid treatment: randomised controlled trials[J]. J Plastic Reconstruct Aesthetic Surg, 2018, 71(6): 847-56. DOI:10.1016/j.bjps.2018.01.033 |
 2019, Vol. 39
2019, Vol. 39

