2. 蚌埠医学院 科研中心,安徽 蚌埠 233030
2. Scientific Research Center, Bengbu Medical College, Bengbu, Anhui, China, 233030
氯氰菊酯(CYP)是Ⅱ型拟除虫菊酯(Py)类农药。目前,该类杀虫剂的应用已超过全世界杀虫剂的30% [1]。CYP可造成哺乳类动物免疫系统、生殖系统、神经系统[2-5]等多系统损害。按照Py类化学结构及毒性症状表现在周围神经系统或者中枢神经系统,将其分为T综合症(Ⅰ型)及CS综合症(Ⅱ型)[6-8]。文献记载,CYP能够跨过血脑屏障,选择性地作用于脑组织,诱导该部位产生氧化应激,进而导致细胞损伤、凋亡或坏死[9-10]。Nrf2/ARE信号通路是机体抵抗内外界氧化和化学等刺激的防御性转导通路。核转录因子NF- E2相关因子2(Nrf2)在减轻氧化应激导致的损害中起关键性作用[11]。生理状态下Nrf2处于抑制状态,当受到内外界自由基和化学物质刺激时,Nrf2活化,进而由胞质进入胞核,与抗氧化反应元件(ARE)结合,同时激活下游血红素氧合酶-l(HO-1)、醌氧化还原酶1(NQO1)等Ⅱ相解毒酶的表达,以保护机体免受侵害[12-14]。
作为Ⅱ型拟除虫菊酯类杀虫剂,CYP近年来已成为环境和农产品中普遍存在的残留农药。CYP的神经毒性一直备受关注,然而,现有的文献对大脑皮层神经元的毒性研究较少。在CYP诱导损伤时,Nrf2/ARE信号通路在大脑皮层神经元损伤过程中的作用,国内外未见报道。大脑皮层作为神经系统的中枢,参与到生命体尤其是高等生物的学习[15]、记忆[16]、情感[17]、运动[18]等一系列生物过程。原代培养的新生鼠大脑皮层神经元,与活体小鼠大脑皮层细胞的形态结构和功能活动相似性很大,能较好地反映生物体内生活状态,研究CYP对大脑皮层神经元的毒性对于间接了解生物体内状态非常关键。本实验原代培养新生鼠大脑皮层神经元细胞,构建CYP诱导细胞损伤模型,研究Nrf2/ARE信号通路在CYP诱导的C57BL/6小鼠大脑皮层神经元损伤中的作用及其机制,更加深入地了解CYP的神经毒性效应,为正确认识、规范应用Py类农药提供参考依据。
1 材料和方法 1.1 动物、试剂和仪器 1.1.1 动物和试剂C57BL/6乳鼠,SPF级(许可证号:SCXK(苏)2017-0001),乳鼠系蚌埠医学院实验动物中心提供,动物使用过程符合蚌埠医学院实验动物伦理规定。氯氰菊酯标准品、多聚-L-赖氨酸(Sigma);Neurobasal Medium、B27、胎牛血清(Gibco);CCK-8试剂盒、ROS检测试剂盒(碧云天);Total RNA Kit(TIANGEN);AnnexinV-FITC/PI凋亡检测试剂盒(康为);Neuronspecific enolase(NSE)antibody (Affinity);Anti-Nrf2 antibody、Anti-HO-1 antibody、Anti-NQO1 antibody(Abcam);β-actin antibody(CST)。
1.1.2 主要仪器荧光显微镜、激光共聚焦显微镜(Olympus)、Synergy 2酶标仪(BioTek)、化学发光凝胶成像分析系统(Alpha Innotech)、超声细胞破碎仪(Branson);流式细胞仪(BD)。
1.2 方法 1.2.1 神经元原代培养取新生3~5 d小鼠,消毒后断头,置于预冷D-hank液中洗去血污,剪开颅骨,取出脑组织,分离大脑皮质,0.25%胰酶消化10 min后加入含血清培养基终止消化,取上清离心,调整细胞密度至5×105,接种于多聚-L-赖氨酸处理的培养板内,4 h换成含10%胎牛血清的DMEM/F12培养基,24 h换成Neurobasal-B27无血清培养基,培养第5天,神经元网络形成,用于后续实验。
1.2.2 神经元细胞鉴定采用NSE免疫荧光对培养的神经元进行鉴定。将细胞悬液接种于内置盖玻片的12孔培养板内,细胞培养第5天,取出孔板内盖玻片,PBS冲洗,多聚甲醛固定,TritonX-100破膜,山羊血清封闭,滴加NSE兔抗鼠多克隆抗体及羊抗兔FITC荧光二抗,抗荧光淬灭剂封片,激光共聚焦显微镜下拍照。
1.2.3 实验分组将培养的神经元细胞随机分成4组:CYP 0(未暴露组)、25、50、100 μmol/L剂量组,将不同剂量CYP分别与细胞孵育48 h。
1.2.4 CCK-8检测细胞活性将细胞悬液按每孔100 µL接种于96孔培养板,分别设置空白对照组及CYP各剂量组。每孔加入CCK-8试剂10 µL,继续培养3 h,酶标仪450 nm波长处检测各孔细胞吸光度,每组设5个复孔,取平均值,计算各组细胞存活率。
1.2.5 细胞内ROS检测细胞接种于24孔培养板,分组处理后加入1 : 1000稀释的DCFH-DA(终浓度为10 μmol/L),培养箱孵育20 min,无血清培养液洗涤,荧光显微镜下观察、拍照。用H2O2处理做阳性对照,用ROS清除剂N-乙酰半胱氨酸(NAC)处理做阴性对照,荧光强度采用ImageJ软件进行分析。
1.2.6 Hoechst 33342染色观察细胞核形态每孔加入5 μg/mL Hoechst 33342,冰浴10 min,PBS清洗,荧光显微镜观察细胞核形态变化,随机拍照。
1.2.7 流式细胞仪检测细胞凋亡率收集细胞,每组加入100 µL bind buffer重悬细胞,制备单细胞悬液,分别加入AnnexinⅤ 5 µL、PI 10 µL避光15 min,流式细胞仪检测各组细胞凋亡率。
1.2.8 荧光定量PCR(qPCR)检测Nrf2及其下游基因HO-1、NQO1的mRNA表达提取各组细胞总RNA,测定样品浓度和纯度后进行扩增。反应体系为20 μL,反应条件:96 ℃ 3 min,96 ℃ 30 s,58 ℃ 45 s,72 ℃ 50 s,40个循环。用2-△△Ct法计算各组基因相对表达量。引物序列由上海生工生物工程有限公司合成,各引物序列及扩增产物长度见表 1。
| 表 1 qPCR引物列表 Tab.1 List of qPCR primers |
分组提取蛋白,BCA法调整蛋白浓度,煮沸、电泳、转膜、封闭、抗体孵育。使用化学发光凝胶成像分析系统检测ECL发光并采集图像,ImageJ软件分析图像灰度。
1.3 统计学分析不同批次神经元细胞重复3次,数据以Mean±SD表示,应用统计软件SPSS 16.0进行数据分析,组间差异比较采用单因素方差分析(ANOVA),CYP不同剂量对神经元细胞活性的影响采用Pearson相关进行分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 原代培养的大脑皮层神经元免疫荧光鉴定NSE定位于胞质和突起,以胞质和突起呈现绿色荧光为阳性细胞。采用Image J软件对细胞计数,神经元纯度=(阳性细胞数/全部细胞数)×100%,NSE阳性细胞大于90%(图 1)。
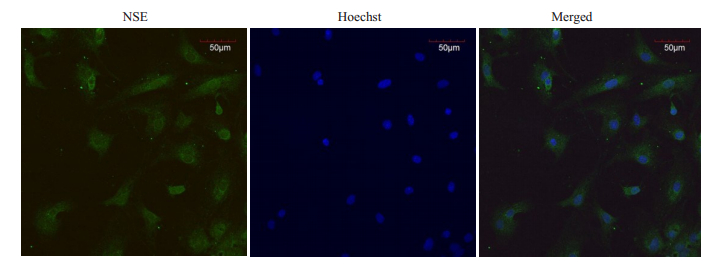
|
图 1 NSE免疫荧光鉴定小鼠大脑皮层神经元 Fig.1 Identification of primary mouse cortical neurons by NSE immunofluorescence (Original magnification: × 200). |
CCK-8显示,与0 μmol/L组相比,各剂量组CYP对神经元活性均有抑制,随着CYP剂量增加,神经元细胞活性逐渐下降,存在剂量效应关系,相关系数r=0.899(图 2)。
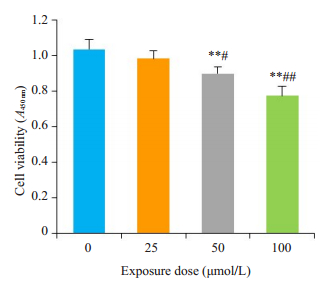
|
图 2 CYP暴露对神经元细胞活性的影响 Fig.2 Effects of cypermethrin on viability of the primary cerebral cortical neurons (Mean±SD, n=3). **P < 0.01 vs CYP 0 μmol/L; #P < 0.05, ##P < 0.01 vs CYP 25 μmol/L. |
细胞内ROS可以将无荧光的还原型二氯荧光素(DCFH)氧化成具有荧光的二氯荧光素(DCF),用荧光探针DCFH-DA检测DCF的荧光可以评估细胞内ROS水平。0 μmol/L组细胞内ROS比较微弱,随着CYP剂量增加,细胞内荧光强度随之增强(图 3)。
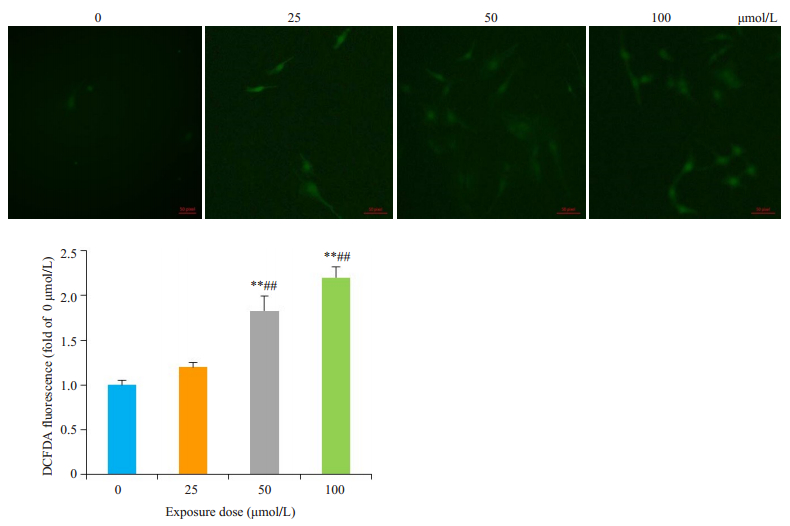
|
图 3 CYP对细胞内ROS的影响 Fig.3 Effects of cypermethrin on intracellular ROS in the primary cerebral cortical neurons (× 200). *P < 0.05, **P < 0.01 vs CYP 0 μmol/L; ##P < 0.01 vs CYP 25 μmol/L. |
0 μmol/L组细胞核体积大而圆,表面光滑,细胞核均匀蓝染。随着CYP剂量增加,细胞核逐渐聚集成团,浓染致密,呈现折光性强的亮蓝色小点(图 4)。
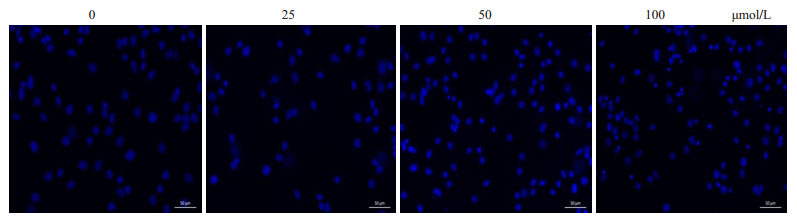
|
图 4 Hoechst 33342染色观察凋亡细胞核形态变化 Fig.4 Morphological changes of the nuclei of the primary cerebral cortical neurons following cypermethrin treatment (Hoechst 33342 staining, ×200). |
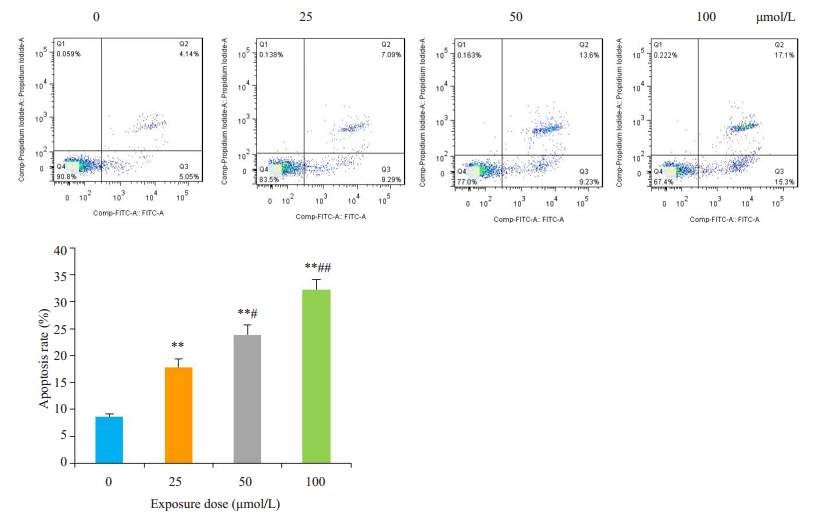
0 μmol/L组神经元细胞凋亡率较低,随着CYP暴露剂量增加,细胞凋亡率逐渐升高,且CYP剂量越高,神经元凋亡程度越严重,对Q2和Q3象限的凋亡率之和进行分析,如图所示(图 5)。
|
图 5 流式细胞术分析神经元细胞凋亡率 Fig.5 Apoptosis rate of cypermethrin-treated primary cerebral cortical neurons analyzed by flow cytometry. **P < 0.01 vs CYP 0 μmol/L; #P < 0.05, ##P < 0.01 vs CYP 25 μmol/L. |
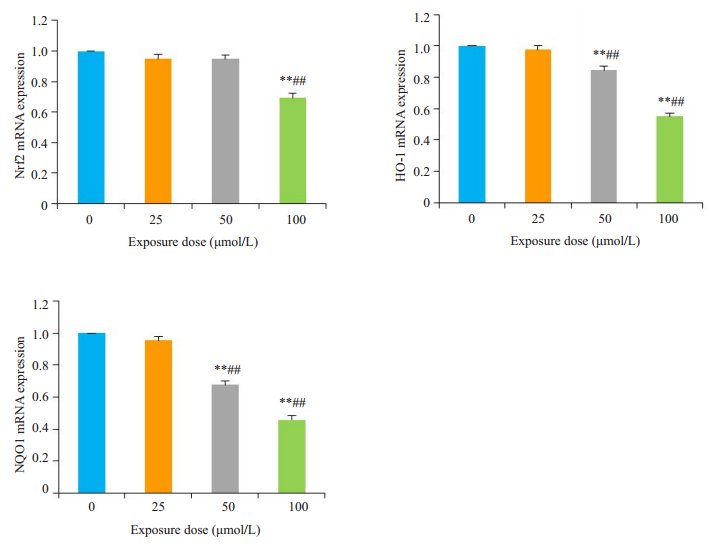
通过qPCR分析神经元细胞Nrf2、HO-1、NQO1 mRNA的相对表达。与0 μmol/L组相比,CYP 50 μmol/L组HO-1、NQO1基因表达下调(P < 0.01),CYP 100 μmol/L组Nrf2、HO-1和NQO1的基因表达下调(P < 0.01)。与CYP 25 μmol/L组相比,CYP 50及100 μmol/L组基因表达量普遍降低(P < 0.01,图 6)。
|
图 6 qPCR分析Nrf2、HO-1和NQO1的mRNA表达 Fig.6 mRNA expressions of Nrf2, HO-1 and NQO1 in cypermethrin-treated mouse cortical neurons detected by qPCR. **P < 0.01 vs CYP 0 μmol/L; ##P < 0.01 vs CYP 25 μmol/L. |
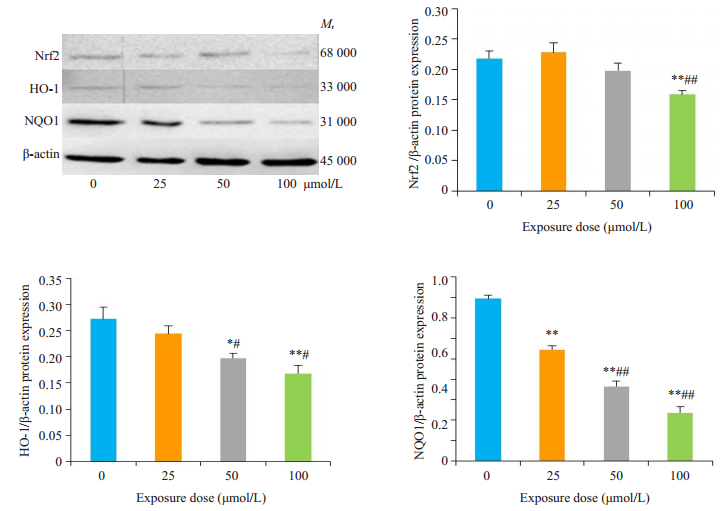
与0 μmol/L组相比,CYP 25 μmol/L组NQO1的蛋白表达下调(P < 0.01),CYP 50 μmol/L组HO-1、NQO1蛋白表达下调(P < 0.05)、CYP 100 μmol/L组Nrf2、HO-1、NQO1的蛋白表达下调(P < 0.01)。与CYP 25 μmol/L组相比,CYP 50 μmol/L及100 μmol/L组蛋白表达量普遍降低(P < 0.05,图 7)。
|
图 7 Western blotting分析Nrf2、HO-1、NQO1蛋白表达 Fig.7 Protein expressions of Nrf2, HO- 1 and NQO1 in cypermethrin-treated primary cortical neurons detected by Western blotting. *P < 0.05, **P < 0.01 vs CYP 0 μmol/L; #P < 0.05, ##P < 0.01 vs CYP 25 μmol/L. |
氯氰菊酯性质稳定,水中溶解度低,半衰期长,已成为环境和农业产品中普遍存在的残留农药[19]。长期低剂量接触Py类农药,可导致神经系统失调、黑质纹状体多巴胺能神经元变性、海马区细胞凋亡、缺陷,进而导致实验动物学习障碍[20-22]。参考文献[23]并结合预实验结果,本实验选用0~100 μmol/L的CYP暴露神经元48 h。结果显示,不同剂量CYP对神经元细胞活性均有抑制,且CYP浓度越高,神经元活性越低,存在剂量效应关系。
我们采用荧光探针DCFH-DA检测细胞内ROS活性氧水平,发现随着CYP浓度的增加,细胞内ROS生成逐渐增加,从神经元细胞核形态上也看出,随着CYP剂量增加,细胞核逐渐出现浓染致密,染色质固缩等典型凋亡特征。ROS可直接损伤DNA,ROS的中间产物自由基可直接作用于核酸,引起碱基修饰和DNA链断裂,进而导致细胞凋亡[24-26]。
细胞在进化过程中建立了复杂的抗氧化防御体系,其中Keap1-Nrf2-ARE通路是机体抵抗内外界氧化和化学等刺激的关键性通路[27]。生理状态下,Nrf2被合成的同时被不断降解,因此在细胞内处于低水平,未被降解的Nrf2被Keap1锚定于细胞质中,Nrf2这种状态使抗氧化系统处于基础表达水平,保证了细胞的稳态。当细胞受到ROS刺激时,Keap1构象发生变化,Nrf2被激活继而从Keap1上解离,进入细胞核与基因中的Maf蛋白结合成异源二聚体后识别并结合ARE,启动下游Ⅱ相解毒酶基因的转录,提高细胞应对氧化应激的能力[28-30]。我们发现,随着CYP剂量增加,细胞损伤程度愈发严重,Nrf2及下游基因HO-1、NQO1 mRNA及蛋白表达明显下调。与此同时,我们还发现CYP在低剂量(25 μmol/L)时引起Nrf2蛋白表达短暂上调。Nrf2是氧化应激反应的关键因子,这一现象说明Nrf2在稳定氧化-抗氧化平衡中的关键作用。本实验室前期研究发现,当CYP暴露时间短,暴露剂量低时,Nrf2被激活并启动下游基因HO-1及NQO1的表达,以提高细胞应对氧化应激的能力。但细胞应对氧化应激的能力是有限的,一旦CYP暴露剂量增加,暴露时间延长,Nrf2及HO-1、NQO1的基因及蛋白表达就会受到抑制。HO-1和NQO1属于Ⅱ相解毒酶,是经Nrf2/ARE通路主要的抗氧化蛋白酶,在抗氧化过程中起到重要作用,它们的表达依赖于Nrf2的激活[31-32]。当Nrf2活性被抑制不能与ARE结合时,下游抗氧化蛋白酶HO-1、NQO1也不能够被诱导激活。进而,Nrf2/ARE信号通路被抑制,机体抗氧化能力下降,细胞受到损伤。
综上所述,我们的研究表明,CYP暴露抑制C57BL/6小鼠大脑皮层神经元细胞活性,诱导细胞ROS产生,CYP抑制Nrf2的活化,进而抑制下游基因HO-1与NQO1的mRNA和蛋白表达,最终导致Nrf2/ARE信号通路无法被激活,削弱机体抗氧化应激的能力进而导致神经元细胞产生氧化损伤和凋亡。
| [1] |
Pietrantonio PV, Junek TA, Parker R, et al. Detection and evolution of resistance to the pyrethroid cypermethrin in helicoverpa zea (lepidoptera: noctuidae) populations in texas[J]. Environ Entomol, 2007, 36(5): 1174-88. DOI:10.1603/0046-225X(2007)36[1174:DAEORT]2.0.CO;2 |
| [2] |
Jin Y, Zheng S, Fu Z. Embryonic exposure to cypermethrin induces apoptosis and immunotoxicity in zebrafish (danio rerio)[J]. Fish Shellfish Immunol, 2011, 30(4-5): 1049-54. DOI:10.1016/j.fsi.2011.02.001 |
| [3] |
Maalej A, Mahmoudi A, Bouallagui Z, et al. Olive phenolic compounds attenuate deltamethrin-induced liver and kidney toxicity through regulating oxidative stress, inflammation and apoptosis[J]. Food Chem Toxicol, 2017, 106: 455-65. DOI:10.1016/j.fct.2017.06.010 |
| [4] |
Sharma P, Huq AU, Singh R. Cypermethrin-induced reproductive toxicity in the rat is prevented by resveratrol[J]. J Hum Reprod Sci, 2014, 7(2): 99-106. DOI:10.4103/0974-1208.138867 |
| [5] |
Abdelhafidh K, Mhadhbi L, Mezni A, et al. Protective effect of Zizyphus lotus jujube fruits against cypermethrin-induced oxidative stress and neurotoxicity in mice[J]. Biomarkers, 2018, 23(2): 167-73. |
| [6] |
DM Soderlund, JM Clark, LP Sheets, et al. Mechanisms of pyrethroid neurotoxicity: implications for cumulative risk assessment[J]. Toxicology, 2002, 171(1): 3-59. DOI:10.1016/S0300-483X(01)00569-8 |
| [7] |
H De Souza Spinosa, YMA Silva, AA Nicolau, et al. Possible anxiogenic effects of fenvalerate, A type Ⅱ pyrethroid pesticide, in rats[J]. Physiol Beh, 1999, 67(4): 611-5. DOI:10.1016/S0031-9384(99)00106-7 |
| [8] |
Moloney JN, Cotter TG. ROS signalling in the biology of cancer[J]. Semin Cell Dev Biol, 2018, 80: 50-64. DOI:10.1016/j.semcdb.2017.05.023 |
| [9] |
Singh AK, Tiwari MN, Dixit A, et al. Nigrostriatal proteomics of cypermethrin-induced dopaminergic neurodegeneration microglial activation dependent and independent regulations[J]. Toxicol Sci, 2011, 122: 526-38. DOI:10.1093/toxsci/kfr115 |
| [10] |
Galal MK, Khalaf AA, Ogaly HA, et al. Vitamin E attenuates neurotoxicity induced by deltamethrin in rats[J]. BMC Complement Altern Med, 2014, 14: 458. DOI:10.1186/1472-6882-14-458 |
| [11] |
Zhang H, Liu YY, Jiang Q, et al. Salvianolic acid A protects RPE cells against oxidativestress through activation of Nrf2/HO-1 signaling[J]. Free RadicBiol Med, 2014, 69: 219-28. DOI:10.1016/j.freeradbiomed.2014.01.025 |
| [12] |
Nguyen T, Nioi P, Pickett CB. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J]. J Biol Chem, 2009, 284(20): 13291-5. DOI:10.1074/jbc.R900010200 |
| [13] |
René C, Lopez E, Claustres M, et al. NF-E2-related factor 2, a key inducer of antioxidant defenses, negatively regulates the CFTR transcription[J]. Cell Mol Life Sci, 2010, 67(13): 2297-309. DOI:10.1007/s00018-010-0336-4 |
| [14] |
Ahmed SM, Luo L, Namani A, et al. Nrf2 signaling pathway: pivotal roles in inflammation[J]. Biochim Biophys Acta, 2017, 1863(2): 585-97. DOI:10.1016/j.bbadis.2016.11.005 |
| [15] |
Makino H, Hwang EJ, Hedrick NG, et al. Circuit mechanisms of sensorimotor learning[J]. Neuron, 2016, 92(4): 705-21. DOI:10.1016/j.neuron.2016.10.029 |
| [16] |
Katkov M, Romani S, Tsodyks M. Memory retrieval from first principles[J]. Neuron, 2017, 94(5): 1027-32. DOI:10.1016/j.neuron.2017.03.048 |
| [17] |
Berridge KC, Kringelbach ML. Pleasure systems in the brain[J]. Neuron, 2015, 86(3): 646-64. DOI:10.1016/j.neuron.2015.02.018 |
| [18] |
Mendelsohn AI, Dasen JS, Jessell TM. Divergent hox coding and evasion of retinoid signaling specifies motor neurons innervating digit muscles[J]. Neuron, 2017, 93(4): 792-805. DOI:10.1016/j.neuron.2017.01.017 |
| [19] |
Carriquiriborde P, Díaz J, Mugni H, et al. Impact of cypermethrin on stream fish populations under field-use in biotech-soybean production[J]. Chemosphere, 2007, 68(4): 613-21. DOI:10.1016/j.chemosphere.2007.02.051 |
| [20] |
Singh AK, Tiwari MN, Patel DK, et al. Long term exposure to cypermethrin induces nigrostriatal dopaminergic neurodegeneration in adult rats: postnatal exposure enhances the susceptibility during adulthood[J]. Neurobiol Aging, 2012, 33(2): 404-15. DOI:10.1016/j.neurobiolaging.2010.02.018 |
| [21] |
Agrawal S, Singh A, Tripathi P, et al. Cypermethrin-induced nigrostriatal dopaminergic neurodegeneration alters the mitochondrial function: a proteomics Study[J]. Mol Neurobiol, 2015, 51(2): 448-65. DOI:10.1007/s12035-014-8696-7 |
| [22] |
Hossain MM, DiCicco-Bloom E, Richardson JR. Hippocampal ER stress and learning deficits following repeated pyrethroid exposure[J]. Toxicol Sci, 2015, 143(1): 220-8. DOI:10.1093/toxsci/kfu226 |
| [23] |
Huang F, Liu Q, Xie S, et al. Cypermethrin induces macrophages death through cell cycle arrest and oxidative stress-mediated JNK/ ERK signaling regulated apoptosis[J]. Int J Mol Sci, 2016, 17: 17. |
| [24] |
Circu ML, Aw TY. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radic Biol Med, 2010, 48(6): 749-62. DOI:10.1016/j.freeradbiomed.2009.12.022 |
| [25] |
Hekimi S, Wang Y, Noë A. Mitochondrial ROS and the effectors of the intrinsic apoptotic pathway in aging cells: the discerning killers[J]. Front Genet, 2016, 14: 7: 161. |
| [26] |
Tretter L, Adam-Vizi V. Generation of reactive oxygen species in the reaction catalyzed by alpha ketoglutarate dehydrogenase[J]. J Neurosci, 2004, 24(36): 7771-8. DOI:10.1523/JNEUROSCI.1842-04.2004 |
| [27] |
Stewart JD, Hengstler JG, Bolt HM. Control of oxidative stress by the Keap1-Nrf2 pathway[J]. Archives of Toxicology, 2011, 85: 239. DOI:10.1007/s00204-011-0694-1 |
| [28] |
Lu MC, Ji JA, Jiang ZY, et al. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target: an update[J]. Med Res Rev, 2016, 36(5): 924-63. DOI:10.1002/med.21396 |
| [29] |
De Freitas Silva M, Pruccoli L, Morroni F, et al. The Keap1/Nrf2- ARE Pathway as a Pharmacological Target for Chalcones[J]. Molecules, 2018, 23(7): pii: E1803. DOI:10.3390/molecules23071803 |
| [30] |
Kensler TW, Wakabayashi N, Biswal S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annu Rev Pharmacol Toxicol, 2007, 47: 89-116. DOI:10.1146/annurev.pharmtox.46.120604.141046 |
| [31] |
Jin X, Xu Z, Cao J, et al. HO-1/EBP interaction alleviates cholesterol-induced hypoxia through the activation of the AKT and Nrf2/mTOR pathways and inhibition of carbohydrate metabolism in cardiomyocytes[J]. Int J Mol Med, 2017, 39(6): 1409-20. DOI:10.3892/ijmm.2017.2979 |
| [32] |
Osman NATAG, Abd El-Maqsoud NMR, El Gelany SAA. Correlation of NQO1 and Nrf2 in female genital tract cancer and their precancerous lesions (cervix, endometrium and ovary)[J]. World J Oncol, 2015, 6(3): 364-74. DOI:10.14740/wjon931w |
 2019, Vol. 39
2019, Vol. 39

