2. 固原市原州区人民医院神经脊柱外科,宁夏 固原 756000
2. Department of Spinal Surgery, People's Hospital of Yuanzhou District, Guyuan 756000, China
帕金森病是最常见的神经退行性疾病之一,给人类社会和家庭带来沉重负担。病情早期,通过药物修饰治疗与左旋多巴替代治疗,多数能较好控制帕金森病的运动症状[3]。但随着病程进展,药物疗效下降伴随出现的“开-关”现象及异动症等并发症仍严重影响患者生存质量[4]。脑深部刺激术(DBS)对帕金森病临床症状改善的显著意义已被认可,是中晚期帕金森病重要的治疗手段[5],远期疗效的明确与技术精细化的提高,使得接受DBS治疗的帕金森病患者数量逐年快速增加[6]。颅内电极植入的准确性,直接影响着DBS的手术疗效与程控治疗难度[7]。如何准确评估颅内电极位置,也是DBS治疗关键的一步,既往主要依靠术后MRI,但金属电极植入后对于局部结构的MR成像存在一定漂移误差,影响颅内电极位置评估的可靠性。因此临床更多应用术后三维CT与术前MRI融合的方式评估颅内电极位置,但是仅能从二维断层影像的角度来判断电极位置,对于进一步判断电极尖端4个刺激触点与目标核团的空间位置关系,存在局限性,因此仅能依靠繁琐的程控步骤逐点刺激与评估来筛选理想触点。近年来,有基于模板匹配的软件应用于DBS的电极重建成像,但操作步骤及耗时较多,且大多需基于MATLABTM数学软件平台运行,不利于临床即时应用于指导DBS程控治疗,因此其临床应用尚待论证[8-9]。本研究基于临床常用的神经导航工作站进行DBS颅内电极与深部核团重建,方便临床工作中即时进行电极与触点位置分析,进一步评估该项技术临床应用的可靠性,目前在临床上尚未见相关的研究报道。
1 资料和方法 1.1 临床资料回顾性分析2016年1月~2017年12月于福建医科大学附属第一医院神经外科接受双侧丘脑底核(STN)DBS治疗并随访超过1年的PD患者。本研究纳入标准:经帕金森病内外科协作团队诊断原发性帕金森病明确;年龄75周岁以下;病程5年以上并且既往曾对左旋多巴替代治疗效果显著;不存在痴呆及严重精神性疾病;理解DBS植入性设备的相关疗效及风险,并要求进行手术治疗;配合随访并且临床资料完整。排除标准:既往接受过开颅手术;存在对运动功能具有明确影响的其他疾病;术前颅脑MR扫描的场强低于3.0 T;术后颅脑CT非三维薄层扫描;DBS植入耗材非PINS-301系列。本研究通过福建医科大学附属第一医院伦理委员会审查,所有患者知情纳入临床研究。统计患者的一般资料及随访资料包括性别、年龄、病程、Hoehn-Yahr分期、日左旋多巴等效剂量(LEDD)、统一帕金森病评定量表(UPDRS)中的运动评分(UPDRS Ⅲ)、Schwab & England日常活动评分(SEADL),以及开机程控参数。
1.2 手术方法手术病例符合《中国帕金森病脑深部电刺激疗法专家共识》的DBS治疗适应证与病例选择原则,并且符合福建医科大学附属第一医院伦理委员会关于DBS植入性耗材使用原则。术日患者局麻下安装Leksell-G立体定向头架基座,基座轴位平面尽量平行于前/后联合(AC-PC)的头皮参考线,随后进行颅脑薄层CT扫描。将扫描获取的CT数据导入BrainLab手术计划系统(iCranial v.3.0 Stereotacxy,BrainLab)。先将术前获取的3.0T MRI的T2、SWI序列与MPRAGE序列进行融合,随后将颅脑CT数据与MPRAGE序列进行融合。上述融合方法采用软件自动融合方式,结合轴位、冠状位、矢状位进行融合精度检查,必要时通过手动微调方式进行融合误差校准。由两位具有5年以上DBS手术经验的医师(第一作者与第二作者)共同选取STN电极植入靶点,并获得Leksell-G头架立体定向参数。术中安装Leksell头架弧形弓后,局部麻醉下立体定向引导颅骨钻孔,微电极电生理记录(MER)并评估粗刺激反应,随后植入脑深部刺激电极(PINS-301,品驰公司),经刺激电极进行粗刺激测试不良反应阈值,确定最终刺激电极植入位置,Leadlock(LF01)电极固定装置固定电极远端于颅骨骨孔。随后全身麻醉下将颅内电极远端经皮下隧道与植入式双列脉冲发生器(品驰公司)相连,脉冲发生器植入胸部皮下囊袋并经锁骨下骨膜固定。术后常规CT扫描排除颅内出血及明显电极位置偏差等情况。术后3~4周返院进行颅脑薄层CT扫描,并依据《帕金森病脑深部电刺激疗法术后程控中国专家共识》原则[10]进行开机与程控治疗。
1.3 影像学扫描参数磁共振(3.0T,西门子公司)MPRAGE序列采用T1加权扫描,1.0 mm层厚,无间距,颅顶至下颌角;T2与SWI序列均为2.0 mm层厚,无间距,侧脑室顶部至桥延沟水平;三维薄层CT为0.625 mm,无间距,颅顶至下颌角。磁共振序列平行于AC-PC连线扫描,术前及术后薄层CT扫描切面均尽量与眶耳线成10°夹角,以尽量平行AC-PC连线。详细放射学扫描参数参照引文资料[11-12]。
1.4 颅内电极及核团三维重建将术后薄层CT数据导入BrainLab Stereotacxy手术计划系统,与术前MPRAGE序列进行自动融合,必要时经微调模式进行平移或旋转校准融合误差,并将MPRAGE序列与计划系统内Schaltenbrand & Wahren图谱进行融合匹配。随后根据CT数据中电极与脑组织的CT值,设定最大分割片段数量,剪除影像金属伪影及软组织影,根据电极范围设定感兴趣区域(ROI),限定自动分割范围,随后进行自动分割提取电极数据(图 1)。STN及红核采用灰度匹配方式在磁共振T2或SWI上进行半自动边界勾勒,并基于标准化后的系统图谱辅助判定丘脑底核与黑质等周围结构的边界进行微调修正边界。最后系统基于3D容积体绘算法自动进行电极及核团立体重建(图 2A)。
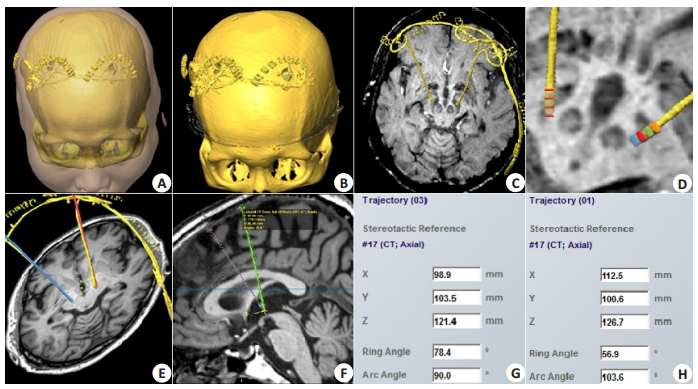
|
图 1 颅内电极重建与坐标系建立流程 Fig.1 Procedure of intracranial lead reconstruction and establishment of the coordinate system. A: Initial reconstruction of a patient's head with intracranial DBS lead; B: Subtraction of the scalp and face; C: Subtraction of the skull; D: Labeling of the stimulating contacts in the lead tip; E: Localization of the anterior commissure (AC), posterior commissure (PC) and mid-point (MP); F-G: Stereotactic parameters of MP to the Leksell frame; H: Stereotactic parameters of a lead implantation target to the Leksell frame. |
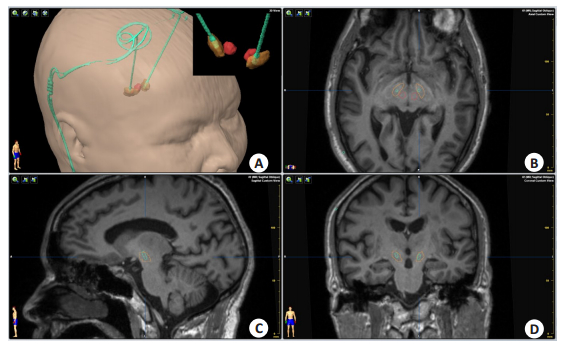
|
图 2 基于BrainLab导航手术工作站DBS电极重建与三维断层影像 Fig.2 DBS lead reconstruction and three-dimensional image at the BrainLab surgical navigation planning station. A: DBS lead (green) and deep brain nucleus: STN (orange) and red nucleus (red) reconstruction; A-1: top-right subgraph for details of DBS lead tip and nucleus; B-D: Outline of DBS lead (green) segmented automatically. The STN (orange) and red nucleus (red) are normalized by Schaltenbrand & Wahren Atlas and finely adjusted manually. |
影像三维重建后,由上述手术靶点制定医师(第一作者与第二作者)基于颅内电极各触点与STN的位置关系,选取与“理想刺激点”空间距离最近的触点为最佳刺激触点(图 1D,图 2A~D),“理想刺激点”定义为经AC-PC连线校准后磁共振T2轴位像红核最大切面层,以垂直于AC-PC连线的红核前缘切线(Bejjani线)与STN内侧边界交点为参考点,外侧旁开2.8 mm,向前1.7 mm,向上2.5 mm [13]。
1.6 颅脑坐标系建立与电极触点三维参数获取分别以AC、PC为靶点制定计划轨迹,获取AC及PC的空间参数值,二者平均值即为颅脑原点(MP)空间参数,随后以MP为靶点,垂直AC-PC连线做一计划轨迹,获取该计划轨迹参数(图 1E~F)。随后以电极最佳触点几何中心为靶点,依据电极轨迹制定新计划轨迹,获取的轨迹参数与上述MP轨迹参数相减即得电极最佳触点相对MP的三维参数(图 1G~H)。基于影像重建所选最佳触点与开机初次程控所选触点对应于影像重建电极触点的三维参数,均由如上方法得出(图 1E~H)。
1.7 研究分组与依据根据基于电极重建筛选的最佳电极触点的几何中心与STN边界的位置关系,将病例分为3组,组A为双侧电极最佳触点几何中心均位于STN边界内,组B为一侧位于STN边界内,组C为双侧均位于STN边界外。
1.8 统计学分析应用SPSS 22.0统计软件分析数据。流行病学资料及随访资料采用均数±标准差表示。术前的临床指标比较计量数据采用单因素方差分析,计数数据采用列联表卡方检验。术后临床指标改善情况,数据符合正态分布,采用重复测量方差分析并以Bonferroni方法进行事后两两比较,时点与组间交互效应采用Type-Ⅳ平方和检验,明显偏态分布则采用相关样本Friedman秩和方差分析及事后比较。同一随访节点的组间比较,数据符合正态分布,采用单因素方差分析,否则采用独立样本非参数检验并Kruskal-Wallis事后比较,P < 0.05为差异具有统计学意义。
2 结果 2.1 病例分组情况与基线资料总共41例帕金森病患者接受DBS手术,排除8例术前磁共振或术后CT扫描数据不符合影像融合要求,以及6例接受的植入性耗材为非PINS-301系列,剩余27例患者进行分组并纳入统计学分析,其中15例患者纳入组A,8例纳入组B,4例纳入组C。3组病例的性别构成、年龄、病程以及Hoehn-Yahr分期、UPDRS Ⅲ总分值、SE-ADL分值、LEDD差异均无统计学意义(表 1),3组病例药物开-关状态的UPDRS Ⅲ分值波动比例分别为(44.04±8.01)%、(31.56±9.97)%、(36.25±12.33)%,3组间差异无统计学意义(P>0.05)。
| 表 1 三组病例基本信息与基线指标 Tab.1 Demographic factors and baseline measurements of the 3 groups (Mean±SD or No. of patients) |
在药物-关期,3组病例DBS术后6月与12月H-Y分期均显著高于基线水平(P < 0.001,图 3A),但经分组检验后,仅有组A病例术后6月与术后12月相较基线存在显著性差异(P < 0.005),组B与组C病例术后6月与12月相较基线差异无统计学意义(P>0.05,图 3A)。在药物-开期,仅有组A病例在H-Y分期总体上存在显著改善(P=0.012),但经事后两两比较校验后,3个观察节点的H-Y分期差异均无统计学意义(P>0.10,图 3B)。
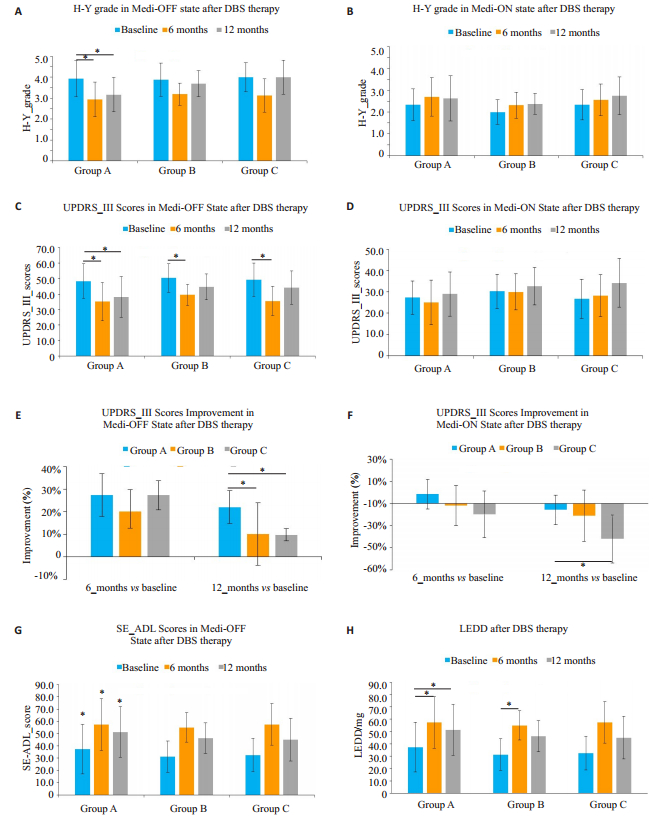
|
图 3 DBS术后3组病例临床指标改善情况组间与组内比较 Fig.3 Intra- and inter-group comparisons of outcome measures among the 3 groups after DBS surgery. A: Intra-group comparison of Hoehn-Yahr stage in medication-off state; B: Inter-group comparison of Hoehn-Yahr stage in medication-on state; C: Intragroup comparison of UPDRS-Ⅲ scores in medication-off state; D: Inter-group comparison of UPDRS-Ⅲ scores in medication-on state; E: Inter-group comparison of improvement rate of UPDRS-Ⅲ scores in medication-off state; F: Inter-group comparison of improvement rate of UPDRS-Ⅲ scores in medication-on state; G: Intra-group comparison of Schwab & England Activity of Daily Living scores; H: Intra-group comparison of daily levodopa equivalent dose. *P < 0.05. |
在药物-关期,总体上在不同观察节点的UPDRS Ⅲ总分值差异有统计学意义(P < 0.001),且这种差异不受分组因素的影响(P=0.103,图 3C)。相较于基线水平,DBS治疗术后6月3组病例的UPDRS Ⅲ总分均显著下降(P < 0.005),但术后12月UPDRS Ⅲ总分值均有所上升,而仅组A病例的分值下降仍然显著(P < 0.001,图 3C)。上述变化同样体现在UPDRS Ⅲ总分值的改善率方面,术后6月3组的改善率分别为(27.41±9.53)%、(20.03±9.79)%、(27.27±6.41)%,差异无统计学意义(P=0.193),但术后12月3组改善率分别为(21.97±7.32)%、(10.04±13.78)%、(9.68±2.73)%,组A的改善率显著高于组B与组C(P=0.011,图 3E)。
在药物-开期,术后12月UPDRS Ⅲ总分值上升,相对于基线水平差异有统计学意义(P=0.009),并且这种差异不受分组因素的影响(P=0.115,图 3D)。相对应的,术后12月的药物-开期UPDRS Ⅲ分值改善率相比术后6月显著下降(P < 0.001),并且也不存在分组因素的影响(P=0.328)。术后12月3组的UPDRS Ⅲ分值改善率分别为(-5.69±13.40)%、(-10.95±23.01)%、(-31.90±21.72)%,组A与组C间差异有统计学意义(P=0.050,图 3F)。
日常生活能力方面,药物-关期总体上DBS术后6月与12月SE-ADL评分相较基线水平显著增高(P < 0.001),且3组的变化趋势差异无统计学意义(P=0.769,图 3G)。
在LEDD方面,DBS治疗后,总体上术后6月及12月LEDD相较基线水平均显著下降(P < 0.001)。术后6月组A与组B的平均LEDD均显著下降(P < 0.05),但术后12月,则仅组A平均LEDD相较基线水平仍有显著降低(P < 0.001),而组C病例术后6月与术后12月平均LEDD服用量相较基线水平均未显著下降(P=0.133,图 3H)。
2.3 两种方式筛选的最佳触点吻合情况及其几何中心的空间坐标比较在基于重建电极筛选的最佳触点与开机程控所选触点的吻合情况方面(表 2),左侧的吻合率为74.07%(20/27),右侧为81.48%(22/27),总体的吻合率为77.78%(42/54),两侧吻合率之间差异无统计学意义(P=0.513)。虽然组1的吻合率高于组2与组3,但3组吻合率差异无统计学意义(P=0.204)。
| 表 2 两种筛选方法的最佳触点吻合情况 Tab.2 Concordance of the optimal contacts selected by the two methods |
在最佳触点的空间坐标方面(表 3),左右两侧基于颅内电极重建后筛选的触点坐标值:中线旁开距离(X值)均小于开机程控所选触点坐标值,其差值分别为-0.08±0.41 mm、-0.03±0.31 mm;距大脑原点前后距离(Y值)均大于开机程控所选触点坐标值;距大脑原点矢状距离(Z值)均大于开机程控所选触点坐标值,但上述空间三轴上的差值差异均无统计学意义(P>0.1)。
| 表 3 两种筛选方法的最佳触点空间坐标 Tab.3 Coordinates to the brain MP of the optimal contacts selected by the two methods (Mean±SD) |
随着立体定向技术的提高,脑深部刺激术治疗中晚期帕金森病的疗效也在进一步提高,接受DBS治疗的PD患者越来越多[6, 14-15]。颅内电极的准确性是影响PD患者DBS疗效的关键因素[7, 16],精确的刺激电极植入伴随着更稳定的远期症状的改善[17-18]。而准确适宜的术后程控,也是进一步发挥DBS可调控性与疗效优化的一个重要因素,特别是在电极植入位置欠理想的的情况下,准确的程控在取得疗效优化与降低电刺激不良反应之间的平衡起到关键作用[10, 19]。因此,对于临床医师来说,准确分析颅内电极的空间位置,对于预判术后的疗效及程控方案的选择有重要的指导意义[18, 20]。
既往判断颅内电极位置的方法早期依赖于术后磁共振平扫,但人体植入脉冲发生器及与颅内电极连通后,仅能执行低场强的磁共振扫描,对于颅内DBS电极植入的目标核团的轮廓及其与周围结构的位置关系,显像欠清晰,且金属植入后对于周围组织的磁共振成像也存在影响,因此,对于准确评估电极位置具有一定的局限性。而后发展的基于术后薄层CT与术前磁共振融合技术判断颅内电极位置,使得CT成像的电极金属影像能够成像在术前的磁共振影像中,能够提高判断颅内电极位置的准确性,也是目前临床应用的主要方法[14, 21-22]。但该技术呈现的是二维的断层影像,对于分析颅内电极与STN等目标核团的三维空间关系,欠缺直观,并且进一步判断电极尖端各个刺激触点与核团功能区域的位置关系较为困难。近期,有学者基于“lead-dbs”软件进行DBS颅内电极三维重建,对于研究DBS与脑网络的关系,具有重要的科研意义[8, 23],但其重建过程需将颅脑组织信号分类提取后进行“归一化”处理,然后匹配到“标准”脑模板中,同样的,颅内电极信号提取后匹配到相应的预设“电极”模板,是一种应用于大数据统计的研究工具,其研发目标更多倾向于科研应用,并且软件的运行步骤较多,运行过程需要庞大的系统容量与较长的时间,将其应用于临床的个体化病人,进行最佳刺激触点的筛选,尚待进一步研究与商榷[24]。而本研究基于神经外科常用的神经导航工作站进行颅内电极与目标核团的三维重建,避免了将颅脑组织与电极信号进行分割提取后,再与基于欧美人种颅脑MR建立的“标准”脑模板以及预存的电极模型相匹配的过程,更直接的对单个体的颅脑深部电极与目标核团进行重建,可能更适合应用于临床应用,相应的,本研究也对该项技术临床应用的可靠性进行了论证。
本研究中,基于颅内电极重建技术,根据电极与STN的位置关系对纳入病例进行分组,在DBS术后临床症状的改善方面,从H-Y分期、UPDRS Ⅲ分值及SEADL分值的改善情况来看,STN-DBS治疗对中晚期PD在药物关期运动功能改善显著,即使是电极位置不够理想的组B与组C病例,由于触点刺激电场的有效激活范围仍能覆盖STN的感觉运动区,因此术后6个月时临床指标的改善同样显著(图 3),这也体现了DBS治疗的可调控性与效益性[25-26]。然而,仅有双侧电极位置均在STN内的组A病例在术后12个月时临床指标仍然是显著改善(图 3A、C),这一特点在UPDRS Ⅲ分值改善率上体现得更加明显(图 3E),并且在药物-开期,随着病程进展,电极位置准确的病例运动功能下降是相对缓慢的(图 3C、E),以上均提示双侧颅内电极位置均理想,与临床症状改善的稳定性与持久性存在相关性,这与之前的临床研究报道是吻合的[17, 27-28]。同时,颅内电极位置理想,则伴随着更稳定的LEDD需求量的降低(图 3H)[28-29]。基于以上研究结果,可以佐证颅内电极重建技术应用于研究DBS临床疗效的准确性与可行性,可以更加细化研究颅内电极植入的准确性与临床指标改善程度的相关性。
本研究进一步分析了基于重建电极筛选的最佳触点与标准开机流程所选触点的吻合度(表 2),探讨该项技术临床应用的准确性及可靠性。两种方式所选的最佳触点的吻合度达77.78%(42/54),统计学分析上侧别不对其吻合度有影响,一方面提示了刺激触点的位置与STN的运动感觉区(理想刺激区)越接近,临床疗效越明显[27],另一方面也提示本研究中颅内电极重建技术应用于临床筛选最佳程控触点的准确性可被接受。研究中进一步比较了两种方式所选最佳触点的大脑三维坐标之间的差异,基于重建电极筛选的最佳触点坐标更靠内侧、后侧以及深度更深,可能与基于程控预刺激筛选最佳触点更容易观察到震颤症状的改善,因此更倾向偏STN背侧方向的触点,而基于电极重建筛选的最佳触点,更倾向选择与STN感觉运动区的几何中心更接近的触点有关,但这些差异的统计学意义不显著(表 3),结合本研究存在临床病例基数较少的不足,因此尚需要更多的临床应用与随访进行研究论证。
综上所述,基于本研究的颅内电极重建技术能够立体直观呈现颅内电极与DBS靶点核团丘脑底核的空间位置关系,有利于细化研究颅内电极植入位置与临床疗效的相关性,并且可能可以作为术后程控最佳DBS触点筛选的另一种更直观而简便的方法,以进一步优化临床疗效有帮助,但仍需更深一步的临床应用研究来进一步论证。
| [1] |
Rajiah K, Maharajan MK, Yeen SJ, et al. Quality of life and caregivers'burden of Parkinson's disease[J]. Neuroepidemiology, 2017, 48(3/4): 131-7. |
| [2] |
Ou R, Hou Y, Song W, et al. Clinical characteristics and quality of life in chinese patients with Parkinson's disease beyond 20 years[J]. Neurol Res, 2018, 40(4): 312-7. DOI:10.1080/01616412.2018.1438227 |
| [3] |
Espay AJ, Brundin P, Lang AE. Precision medicine for disease modification in parkinson disease[J]. Nat Rev Neurol, 2017, 13(2): 119-26. |
| [4] |
Haaxma CA, Horstink MW, Zijlmans JC, et al. Risk of disabling response fluctuations and dyskinesias for dopamine agonists versus levodopa in Parkinson's disease[J]. J Parkinsons Dis, 2015, 5(4): 847-53. |
| [5] |
Deuschl G, Fogel W, Hahne M, et al. Deep-brain stimulation for Parkinson's disease[J]. N Engl J Med, 2002, 249(3): ⅱ36-9. |
| [6] |
Lezcano E, Gómez-Esteban JC, Tijero B, et al. Long-term impact on quality of life of subthalamic nucleus stimulation in Parkinson's disease[J]. J Neurol, 2016, 263(5): 895-905. DOI:10.1007/s00415-016-8077-4 |
| [7] |
Bari AA, Fasano A, Munhoz RP, et al. Improving outcomes of subthalamic nucleus deep brain stimulation in Parkinson's disease[J]. Expert Rev Neurother, 2015, 15(10): 1151-60. DOI:10.1586/14737175.2015.1081815 |
| [8] |
Horn A, Kühn AA. Lead-DBS: a toolbox for deep brain stimulation electrode localizations and visualizations[J]. Neuroimage, 2015, 107(107): 127-35. |
| [9] |
Lauro PM, Vanegas-Arroyave N, Huang L, et al. DBSproc: an open source process for DBS electrode localization and tractographic analysis[J]. Hum Brain Mapp, 2016, 37(1): 422-33. DOI:10.1002/hbm.23039 |
| [10] |
中华医学会神经外科学分会功能神经外科学组, 中华医学会神经病学分会帕金森病与运动障碍学组. 帕金森病脑深部电刺激疗法术后程控中国专家共识[J]. 中华神经外科杂志, 2016, 32(12): 153-5. |
| [11] |
Polanski WH, Martin KD, Engellandt K, et al. Accuracy of subthalamic nucleus targeting by T2, FLAIR and SWI-3-Tesla MRI confirmed by microelectrode recordings[J]. Acta Neurochir (Wien), 2015, 157(3): 479-86. DOI:10.1007/s00701-014-2328-x |
| [12] |
Xia J, He P, Cai X, et al. Magnetic resonance and computed tomography image fusion technology in patients with Parkinson's disease after deep brain stimulation[J]. J Neurol Sci, 2017, 381(7): 250-5. |
| [13] |
Bot M, Schuurman PR, Odekerken VJJ, et al. Deep brain stimulation for Parkinson's disease: defining the optimal location within the subthalamic nucleus[J]. J Neurol Neurosurg Psychiatry, 2018, 89(5): 493-8. DOI:10.1136/jnnp-2017-316907 |
| [14] |
Aum DJ, Tierney TS. Deep brain stimulation: foundations and future trends[J]. Front Biosci (Landmark Ed), 2018, 23(7): 162-82. |
| [15] |
Ughratdar I, Samuel M, Ashkan K. Technological advances in deep brain stimulation[J]. J Parkinsons Dis, 2015, 5(3): 483-96. DOI:10.3233/JPD-150579 |
| [16] |
Mirzadeh Z, Chen T, Chapple KM, et al. Procedural variables influencing stereotactic accuracy and efficiency in deep brain stimulation surgery[J]. Oper Neurosurg (Hagerstown), 2019, 17(1): 70-8. DOI:10.1093/ons/opy291 |
| [17] |
Paek SH, Yun JY, Song SW, et al. The clinical impact of precise electrode positioning in STN DBS on three-year outcomes[J]. J Neurol Sci, 2013, 327(1/2): 25-31. |
| [18] |
Mcclelland S, Ford B, Senatus PB, et al. Subthalamic stimulation for Parkinson disease: determination of electrode location necessary for clinical efficacy[J]. Neurosurg Focus, 2005, 19(5): E12. |
| [19] |
Dayal V, Limousin P, Foltynie T. Subthalamic nucleus deep brain stimulation in parkinson's disease: the effect of varying stimulation parameters[J]. J Parkinsons Dis, 2017, 7(2): 235-45. |
| [20] |
Bot M, Schuurman PR, Odekerken V, et al. Deep brain stimulation for Parkinson's disease:defining the optimal location within the subthalamic nucleus[J]. J Neurol Neurosurg Psychiatry, 2018, 89(5): 493-8. DOI:10.1136/jnnp-2017-316907 |
| [21] |
Lee JY, Jeon BS, Paek SH, et al. Reprogramming guided by the fused images of MRI and CT in subthalamic nucleus stimulation in Parkinson disease[J]. Clin Neurol Neurosurg, 2010, 112(1): 47-53. DOI:10.1016/j.clineuro.2009.10.008 |
| [22] |
Geevarghese R, Tuura RO, Lumsden DE, et al. Registration accuracy of CT/MRI fusion for localisation of deep brain stimulation electrode position: an imaging study and systematic review[J]. Stereotact Funct Neurosurg, 2016, 94(3): 159-63. DOI:10.1159/000446609 |
| [23] |
Horn A, Wenzel G, Irmen F, et al. Deep brain stimulation induced normalization of the human functional connectome in Parkinson's disease[J]. Brain, 2019, 142(10): 3129-43. DOI:10.1093/brain/awz239 |
| [24] |
Zhang D, Lin H, Liu J, et al. Electrode Reconstruction assists postoperative contact selection in deep brain stimulation[J]. World Neurosurg, 2019, 125(125): e442-7. |
| [25] |
Marks WJ. Surgical treatment of Parkinson's disease: ablation, stimulation and transplantation[J]. Expert Rev Neurother, 2001, 1(2): 239-46. DOI:10.1586/14737175.1.2.239 |
| [26] |
Maks CB, Butson CR, Walter BL, et al. Deep brain stimulation activation volumes and their association with neurophysiological mapping and therapeutic outcomes[J]. J Neurol Neurosurg Psychiatry, 2009, 80(6): 659-66. DOI:10.1136/jnnp.2007.126219 |
| [27] |
Wodarg F, Herzog J, Reese R, et al. Stimulation site within the MRIdefined STN predicts postoperative motor outcome[J]. Mov Disord, 2012, 27(7): 874-9. DOI:10.1002/mds.25006 |
| [28] |
Koivu M, Huotarinen A, Scheperjans F, et al. Motor outcome and electrode location in deep brain stimulation in Parkinson's disease[J]. Brain Behav, 2018, 8(7): e01003. DOI:10.1002/brb3.1003 |
| [29] |
Park YS, Kim HY, Chang WS, et al. A comparison of LEDD and motor scores following STN-DBS treatment in patient with young onset vs late onset Parkinson's disease[J]. Neuromodulation, 2010, 13(4): 255-60. DOI:10.1111/j.1525-1403.2009.00273.x |
 2019, Vol. 39
2019, Vol. 39

