2. 广西医科大学附属柳铁中心医院检验科,广西 柳州 545007
2. Department of Clinical Laboratory, Affiliated Liutie Central Hospital of Guangxi Medical University, Liuzhou 545007, China
外泌体是由细胞分泌的微小囊泡,具有双分子层脂质结构,内含丰富的蛋白、核酸及脂质等分子且广泛分布于各种体液[1-2],在疾病的发生发展过程中起重要作用[3-4]。目前外泌体作为研究热点,尤其是在外泌体的分离纯化和表征鉴定(亚型和计数)、细胞间交流作用机理、新型标志物寻找及疾病治疗应用等[5-7]方面受到广泛关注。
大量研究证明外泌体携带的膜蛋白被认为是具有广泛应用前景的新型生物标志物[8-9],但常规鉴定方法如免疫印迹技术,耗时长、操作复杂、检测灵敏度低、需多重抗体与大量纯化外泌体,不利于外泌体膜蛋白的快速鉴定和临床检测。因此,开发适用于纳米尺度囊泡的分离纯化及检测鉴定一体化新技术是外泌体研究临床转化应用的迫切需求。
目前,超速离心法是外泌体分离纯化[6-7, 10]的常规方法和金标准,但仍存在操作复杂、回收率低、缺乏特异性、纯度难保证等缺点。基于免疫亲和的磁性分离方法具有特异性强、纯度较高、操作简便的特点,可用于外泌体亚群分离和特异性检测。此外,由于磁性分离设备经济小巧,且需要样本体积少,可用于构建外泌体分离及检测一体化平台,为外泌体生物标志物快速床旁检测(POCT)技术开发打下基础。例如Yu等[11]开发了基于磁性分离和CD63适配体(Apt)识别外泌体的竞争检测新方法,但其仅检测单一外泌体高丰度膜蛋白CD63,且因目标分子和荧光信号是一对一关系,无放大效应,检测灵敏度低,无法识别到具有更高疾病诊断价值的低丰度外泌体膜蛋白。
催化发夹组装[12-14] (CHA)可在常温无酶条件下对核酸反应进行快速有效的信号放大,已广泛应用于体液中循环核酸分子的高灵敏度检测分析。适配体[15-16]是经体外筛选得到的寡核苷酸序列,既具有核酸分子碱基互补配对特性,又能特异性识别和结合目标蛋白。因此,适配体在特异性识别目标蛋白后,启动催化发夹组装反应,对适配体识别蛋白的信号进行快速放大,有效提高检测灵敏度,可用于构建基于磁性分离技术。
前期研究已证实上皮细胞粘附分子(EpCAM)在人类癌细胞(如乳腺癌等),尤其是腺癌和鳞状细胞癌中高表达,可作为肿瘤细胞鉴定的分子标志物[17]。Zhang等[18]用EpCAM抗体识别乳腺癌来源外泌体,Kwizera等[19]证实HER2阳性乳腺癌患者血浆中的外泌体EpCAM比健康供者的水平更高(P≤0.01)。
因此,本文以EpCAM适配体(AptEpCAM)为识别元件,结合CD63抗体包被磁珠和荧光修饰的催化发夹组装技术,建立外泌体分离和检测一体化平台。该检测平台可用于同步检测外泌体两种膜蛋白,排除游离蛋白的干扰,高效鉴别乳腺癌细胞来源外泌体上CD63和EpCAM的共表达。目前,基于磁性分离和催化发夹组装的外泌体的蛋白共表达检测平台未见报道。此外,本方法无需昂贵的分离和检测设备,同时鉴定两种外泌体蛋白的存在,结果直观且检测灵敏度高,因此同样适合于临床标本的快速便携式检测,同时为外泌体多靶标膜蛋白临床快速检测提供思路。
1 材料和方法 1.1 材料 1.1.1 细胞系人乳腺癌细胞(MDA-MB-231)和人正常乳腺上皮细胞(MCF-10a)购于中国科学院上海生命科学研究院细胞资源中心。
1.1.2 仪器与试剂主要仪器:LS-55荧光分光光度计(Perkin-Elmer)、智能高速冷冻离心机3H16RI(赫西)、超速离心机Optima XPN-100(Beckman Coulter)、Nanosight NS300纳米粒度分析仪(Malvern)、透射电子显微镜H-7650(HITACHI)、超分辨显微镜(尼康N-STORM)。
主要试剂:DMEM basic(1X)、磷酸盐缓冲液(PBS,pH 7.4)、胰酶(含EDTA-2K)、青霉素-链霉素双抗(Gibco)、胎牛血清(Biowest)、Exosome-depleted FBS(乏Exosomes专用血清)(System Biosciences),MCF-10a细胞专用培养液(Procell)。
实验室的CHA序列均由生工生物工程(上海)合成,具体序列见表 1。
| 表 1 CHA反应所需序列 Tab.1 Oligonucleotide sequences used in the study |
(1)细胞复苏后放置于37 ℃、5% CO2温箱培养,待细胞生长至培养皿底面积的70%~80%时传代。
(2)细胞上清液收集与前处理:细胞生长至培养皿底面积的70%~80%时,进行饥饿培养,培养12 h后弃去培养液,PBS洗涤1次,加入1%去外泌体血清培养液,培养48 h后收集细胞培养液,根据文献[20]报道参数进行前处理:300 g离心10 min,收集上清液;2000 g离心20 min,收集上清液;10 000 g离心30 min,收集上清液备用。
(3)细胞上清液外泌体分离纯化[21]:用低温超速离心机Optima XPN-100离心2次(135 000 g离心70 min,收集沉淀,加入适量的PBS重悬,135 000 g离心70 min,收集沉淀),100 µL PBS重悬,分装后放置于-80 ℃冰箱保存。
1.2.2 细胞来源外泌体表征(1)透射电子显微镜(TEM)鉴定细胞来源外泌体的形态和大小:将分离纯化的外泌体进行不同倍数稀释,从中吸取15 µL的外泌体样本滴于电镜专用的铜网上,室温静止2 min,然后从铜网的另一侧用滤纸吸干液体,在铜网上滴加20 µL的2%磷钨酸染液,室温静止10 min,滤纸吸干多余的磷钨酸,蒸馏水清洗1~2次,每次用滤纸吸干蒸馏水,室温静置10 min,待铜网干燥后,透射电子显微镜H-7650下观察外泌体形态并拍摄分析。
(2)Nanosight NS300纳米粒度分析仪(NTA)检测细胞来源外泌体的浓度及粒径:
用注射器吸取1 mL的稀释样品溶液(1: 100),缓慢推入检测管道,待液流稳定后进行视频拍摄,每次拍摄持续60 s(30 frames/s)的视频。运用NTA software(Version 3.2, NanoSight)软件对视频中布朗运动的粒子进行计算分析:粒子的浓度和流体力学直径,绘制外泌体粒子浓度与粒径分布图。
(3)Western blot检测外泌体膜蛋白
将分离纯化得到的外泌体用含有变性剂和蛋白酶抑制剂的缓冲裂解溶液处理,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离裂解物,然后转移到硝酸纤维素膜上进行特定蛋白质的免疫印迹。
1.2.3 基于磁性分离和CHA信号放大策略的外泌体膜蛋白检测平台可行性 1.2.3.1 超分辨成像技术与免疫印迹实验验证CD63在外泌体膜上的表达将外泌体固定在共聚焦皿上,CD63抗体结合60 min,PBS洗涤3次除去游离抗体后加入AF647荧光二抗孵育45 min,PBS洗涤。加入PKH67染料染色外泌体膜,洗涤除去游离染料后在超分辨显微镜下观察。
免疫印迹实验见1.2.2的免疫印迹技术。
1.2.3.2 不同浓度外泌体与AptEpCAM-T催发链反应电泳图以验证EpCAM适配体与外泌体结合1 μmol/LAptEpCAM-T催发链与不同数量(1.33×109、3.99×109、7.98×109)外泌体常温反应1 h(总体积10 μL,Tris-HCl补齐),进行聚丙烯酰胺凝胶电泳实验。
1.2.4 基于磁性分离和CHA检测平台检测原理及可行性验证 1.2.4.1 检测平台设计原理使用CD63抗体包被磁珠以捕获外泌体,加入AptEpCAM-T催发链识别外泌体表面膜蛋白EpCAM,生成复合物:CD63抗体包被磁珠+外泌体+AptEpCAM-T。加入CHA反应序列发夹H1(FAM作为荧光报告基团、BHQ1作为荧光猝灭基团)、H2,通过链置换反应生成具有荧光的复合物H1-H2,检测荧光值高低指示外泌体膜上有无CD63和EpCAM蛋白表达。其检测原理如图 1所示。
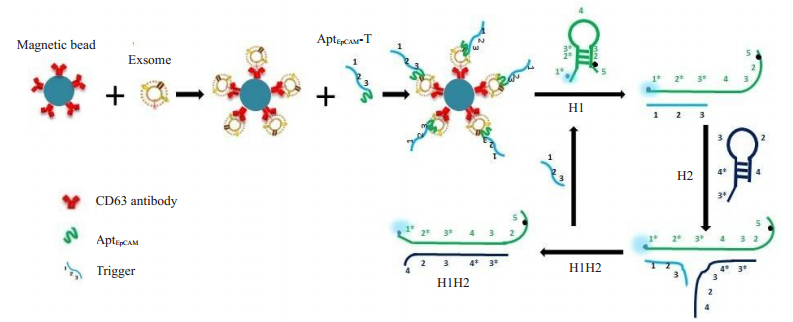
|
图 1 基于磁性分离和CHA信号放大策略的外泌体双膜蛋白共表达检测平台原理图 Fig.1 Schematic illustration of the magnetic and catalytic hairpin assembly-based detection platform for dual membrane proteins on exosomes. |
为了验证基于磁性分离和CHA检测平台的可行性,将5 μL(4.01×1011/mL)外泌体与50 μL包被CD63抗体的磁珠孵育过夜,用0.1% BSA PBS缓冲液洗涤2次(每次洗涤将样品置于磁力架上使其充分沉降,留取沉淀),加入3 μL 5 μmol/L AptEpCAM-T孵育60 min。随后用Tris-HCl洗涤除去游离未结合的AptEpCAM-T,加入54 μL pH 7.4 Tris-HCl、3 μL 5 μmol/L H1、3 μL 5 μmol/L H2共孵育60 min,吸取上清液,检测其荧光信号。
1.2.4.2 CHA检测平台电泳CHA各组分在室内反应30 min,配制12%聚丙烯酰胺凝胶,分别在上样孔中加入Marker、H1、H2、AptEpCAM-T、H1+H2、AptEpCAM-T+H1和AptEpCAM-T+H1+H2,在150 mV条件下迁移30 min,用核酸染液浸泡30 min后曝光观察条带。
1.2.5 CHA试验优化缓冲液类型、酸碱度pH、反应时间和反应温度是CHA实验的重要反应条件。对此,我们设计了一系列试验以观察CHA在不同反应条件下的检测效果,以摸索能达到最佳检测性能的最适反应条件。
1.2.6 检测平台特异性实验在最优反应条件下,我们用本检测平台对不同细胞来源的外泌体膜蛋白CD63和EpCAM进行荧光检测,同时记录乳腺癌细胞外泌体(MDA-MB-231 exo)、人正常乳腺上皮细胞外泌体(MCF-10a exo)的荧光响应值信噪比,本实验重复进行两次,用以评价该检测方法特异性。
2 结果 2.1 TEM、NanoSight、WB鉴定超速离心法提纯细胞上清液中的外泌体基于本课题组之前的研究,本试验采用超速离心法提纯细胞系来源的外泌体,其性能鉴定结果如图 2。TEM图像(图 2A)显示所提取的外泌体具有完整的膜性脂质双分子层的结构,并且直径在100 nm左右,与文献[22-23]报道相符;Nanosight NS300分析样品中的外泌体粒径分布与浓度(图 2B):外泌体的平均粒径为155 nm,与TEM的结果相符,浓度为4.01×109/mL。乳腺癌细胞蛋白及其外泌体蛋白WB结果(图 2C):蛋白TSG101、蛋白CD63在外泌体蛋白和细胞蛋白都有表达;蛋白Calnexin在细胞蛋白有表达而外泌体蛋白无表达。
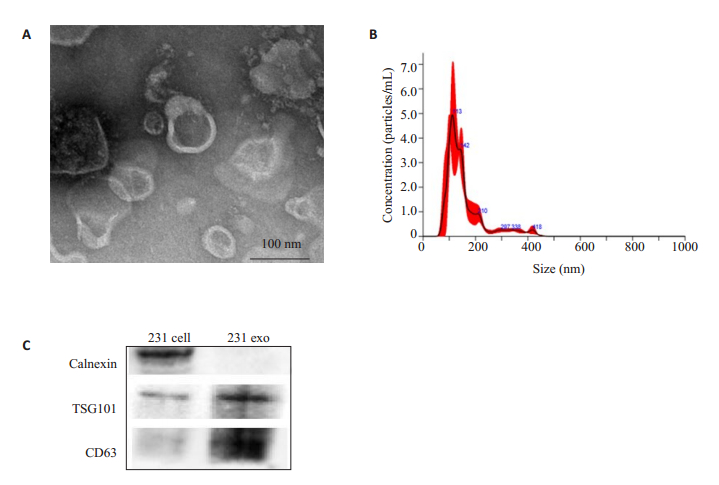
|
图 2 (A)透射电子显微镜,(B)NTA和(C)免疫印迹实验分别表征乳腺癌MDA-MB-231细胞来源外泌体 Fig.2 Characterization of breast cancer MDA-MB-231 cell-derived exosomes by transmission electron microscopy (A), NTA (B) and Western blotting (C). |
如图 3所示,图A、B、C是2D模式,图D、E、F是3D模式,红色通道(图A、D)与绿色通道(图B、E)荧光分别代表CD63抗体-AF647荧光二抗及PKH67染色的外泌体膜,两者共定位良好(图C、F为重叠图),说明MDA-MB-231细胞来源外泌体上有表达CD63蛋白。免疫印迹实验示外泌体CD63蛋白表达明显(图 2C)。
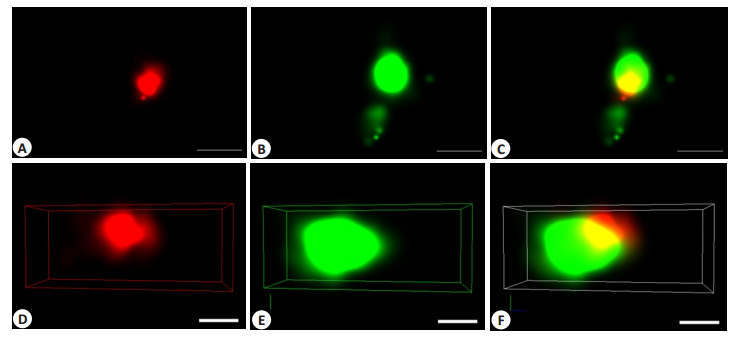
|
图 3 超分辨成像技术对MDA-MB-231细胞外泌体中CD63表征 Fig.3 Characterization of membrane protein CD63 in MDA-MB-231 cell derived exosomes by super-resolution imaging technique (scale bar 200 nm). |
外泌体属于大分子,电泳时在原点(泳道3),泳道4-6是1 μmol/L AptEpCAM-T催发链与不同数量(1.33×109、3.99×109、7.98×109)外泌体反应产物。泳道4 : 1 μmol/L AptEpCAM-T+1 μL外泌体有条带,泳道5:1 μmol/L AptEpCAM-T+3 μL外泌体无条带,说明AptEpCAM序列能够识别并结合外泌体(图 4)。
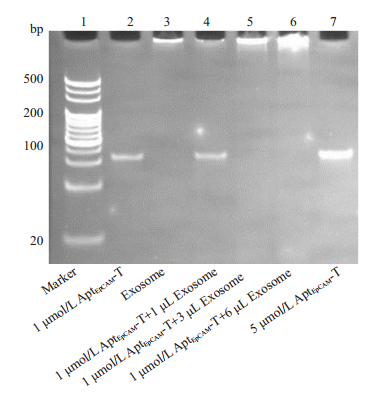
|
图 4 外泌体与AptEpCAM-T催发链反应电泳图 Fig.4 Polyacrylamide gel electrophoresis analysis of the combination between exosome and AptEpCAM. |
不同浓度AptEpCAM-T的CHA荧光检测结果见图 5。随着AptEpCAM-T浓度增加荧光响应值明显增加,与对照组(图 5-a)相比荧光响应值信噪比(S/N)约为7.5倍。
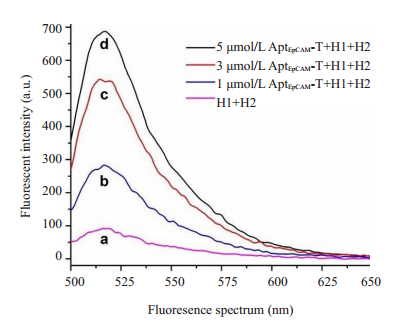
|
图 5 CHA信号放大策略平台可行性验证 Fig.5 Feasibility of catalytic hairpin assembly sequences. Fluorescence spectrum: (a) H1 + H2; (b)1 μmol/L AptEpCAM-T + H1+H2; (c) 3 μmol/L AptEpCAM-T+ H1+H2, (d) 5 μmol/L AptEpCAM-T+ H1+H2. |
CHA各组分及反应电泳结果见图 6:CHA各组分纯度高,发卡结构H1+H2自反应程度低(泳道5),发夹H1、H2在AptEpCAM-T存在的条件下能发生有效的链置换反应,生成新的核酸条带(泳道7)。
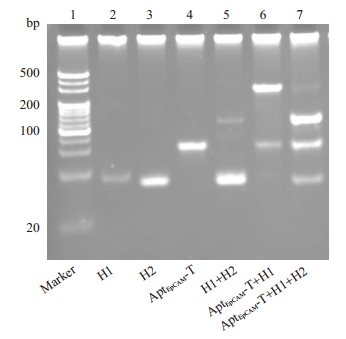
|
图 6 CHA各组分及反应电泳图 Fig.6 Polyacrylamide gel electrophoresis analysis of CHA reaction. |
CHA影响因素优化结果如图 7所示。图 7A:缓冲液Tris-HCl的荧光信号响应值最好;图 7B:缓冲液TrisHCl在pH7.4条件下的荧光信号响应值最佳;图 7C:反应时间为1 h的荧光响应值最高;图 7D:反应温度37 ℃的荧光响应值最好。根据优化结果选取最佳条件进行后续实验。
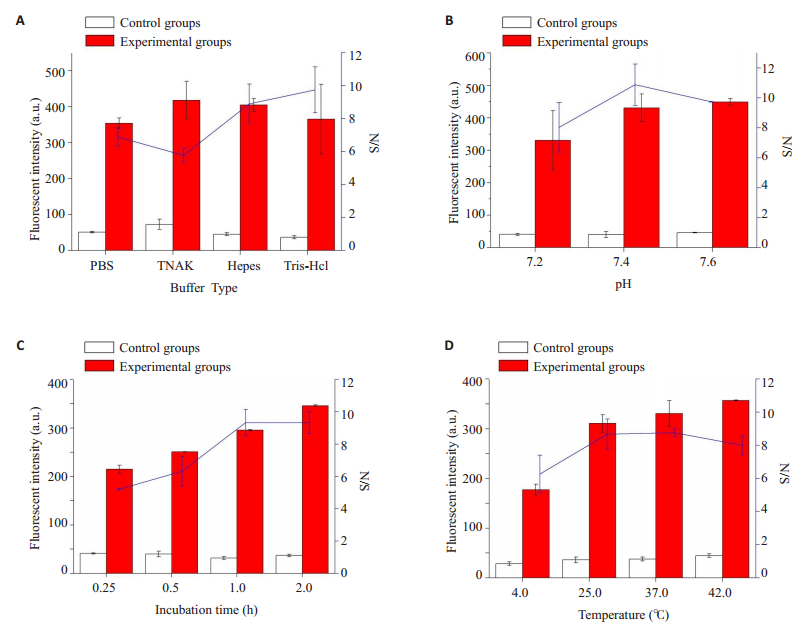
|
图 7 反应缓冲液、反应pH、反应时间和反应温度条件优化图 Fig.7 Optimization of experimental parameters: buffer, pH, temperature and incubation time. |
对两种细胞来源外泌体进行本检测平台特异性验证,试验结果显示:人正常乳腺上皮细胞(MCF-10a exo)荧光检测响应值信噪比:1.10±0.01,乳腺癌细胞外泌体(MDA-MB-231 exo)荧光检测响应值信噪比:2.09±0.08,两组外泌体膜蛋白荧光检测信号有识别度。
3 讨论外泌体富集的方法有:超速离心法(差速离心或蔗糖密度梯度离心)、超滤离心法、磁珠免疫法、微流控技术等.本实验采用的是磁珠免疫法富集外泌体,该方法具有特异性强、纯度较高、不影响外泌体形态结构、操作简便等特点[24-25],适用于外泌体膜蛋白的快速鉴定检测。
外泌体膜蛋白主要有CD63、CD81、Tsg101等,许多学者[26-27]把它们作为外泌体识别的生物标志物。文献[17-19]已证实EpCAM是乳腺癌细胞来源外泌体鉴定和分离的重要分子标志物,其对应的Aptamer可特异性识别肿瘤来源外泌体上高表达的EpCAM分子。由于适配体分子性质稳定且易于修饰,AptEpCAM除了可作为识别元件结合外泌体膜蛋白分子EpCAM之外,还可负载CHA反应的引发链启动下游的核酸自组装反应,进一步放大荧光检测信号。本实验利用CD63抗体包被的特异性磁珠捕获外泌体,并以此构建基于外泌体磁性分离法富集和CHA信号放大策略的外泌体双膜蛋白共表达检测平台,以实现外泌体膜蛋白的定性检测。超分辨显微镜成像[28]可以在三维、多颜色和纳米级分辨率对细胞结构成像,本实验超分辨显微镜成像结果证实了CD63在外泌体上有表达;1 μmol/L AptEpCAM-T催发链与不同数量外泌体常温反应,其产物聚丙烯凝胶电泳实验结果显示:AptEpCAM- T + 1 μL外泌体有条带,AptEpCAM-T+3 μL外泌体无条带,说明随着外泌体量增加,适配体AptEpCAM- T与外泌体完全结合,验证了AptEpCAM-T序列识别外泌体膜蛋白EpCAM;CHA信号放大体系的可行性, 图 6(CHA各组分及反应电泳图)说明在AptEpCAM-T存在的条件下,发夹H1,H2能发生有效的链置换反应,将目标分子转化为荧光检测信号,图 5荧光检测实验证明不同浓度AptEpCAM-T与发夹H1,H2共孵育后显示出不同强度荧光,这些结果符合检测原理预期。
缓冲液类型、pH、反应时间和反应温度是影响CHA反应的主要影响因素,因此我们对本实验涉及的重要反应条件进行优化(具体见图 7)。首先是选择合适的CHA缓冲液:4种缓冲液(PBS、TNAK、Hepes和Tris-HCl)条件下荧光响应值信噪比(S/N)最高的是Tris-HCl,不同的CHA所需的缓冲液是不同的[21, 29, 30],因此需根据后续实验内容选择相应缓冲液。其次对其反应pH值(7.2、7.4、7.6)进行优化,pH为7.4时荧光响应值信噪比(S/N)最高。为寻找最佳检测时间,对不同反应时间(15 min、30 min、1 h、2 h)条件下荧光响应信号进行检测,1 h荧光响应值信噪比(S/N)已达最高,此后荧光响应值信噪比变化不大,这与文献报道[12-14]的最佳检测时间30~120 min相符合。最后,对反应温度(4 ℃、25 ℃、37 ℃、42 ℃)进行优化,37 ℃时荧光响应值信噪比(S/N)最高,说明此检测平台可在恒温条件下进行。根据实验结果分析可得,本方法在Tris-HCl(pH 7.4)缓冲液,37 ℃的条件下反应60 min即可到达荧光响应最大值。
在加入一定浓度的乳腺癌细胞来源外泌体后,该检测平台的荧光响应值明显增加,与空白对照组相比,荧光响应值信噪比(S/N)约为2倍。检测平台特异性试验显示人正常乳腺上皮细胞外泌体(MCF-10a exo)荧光检测响应值信噪比:1.10±0.01,乳腺癌细胞外泌体(MDA-MB-231 exo)荧光检测响应值信噪比:2.09±0.08,说明本方法能够同时检测外泌体上的两种膜蛋白: CD63和EpCAM,并且乳腺癌细胞外泌体与人正常乳腺上皮细胞外泌体的蛋白CD63和蛋白EpCAM表达有区分度。
综上所述,本文构建了一个基于磁性分离和催化发夹组装信号放大策略的外泌体双膜蛋白共表达检测平台。该检测平台可同时检测外泌体膜上表达的两种蛋白:CD63和EpCAM。乳腺癌细胞外泌体与人正常乳腺上皮细胞外泌体膜蛋白CD63和蛋白EpCAM表达有区分度。该方法无需昂贵的大型仪器,采用磁性分离法有效排除游离或杂质蛋白的干扰,提高检测的准确性和特异性;其次,采取催化发夹组装技术将单一的目标蛋白转化为大量可检测荧光信号,提高了检测灵敏度;同时外泌体双蛋白检测的设计提升了检测效率和诊断效能,为具有诊断价值的外泌体膜蛋白的双重检测提供通用平台,也为多靶标膜蛋白检测提供可能性,有望成为肿瘤液体活检早期诊断新方法。
| [1] |
Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the Interna-tional Society for Extracellular Vesicles and update of the MISEV2014 guidelines[J]. J Extracell Vesicles, 2018, 7(1): 1535750. DOI:10.1080/20013078.2018.1535750 |
| [2] |
颜晓慧, 安泰学, 覃思华, 等. 血清外泌体miR-21在肺癌中的表达水平及其诊断效能[J]. 实用医学杂志, 2017, 33(16): 2666-9. DOI:10.3969/j.issn.1006-5725.2017.16.015 |
| [3] |
Alegre E, Zubiri L, Perez-Gracla JL, et al. Circulating melanoma exosomes as diagnostic and prognosis biomarkers[J]. Clin Chim Acta, 2016, 454: 28-32. DOI:10.1016/j.cca.2015.12.031 |
| [4] |
Peinado H, Alečković M, Lavotshkin S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nat Med, 2012, 18(6): 883-891. DOI:10.1038/nm.2753 |
| [5] |
Merchant ML, Rood IM, Deegens JKJ, et al. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery[J]. Nat Rev Nephrol, 2017, 13(12): 731-49. DOI:10.1038/nrneph.2017.148 |
| [6] |
Yang XX, Sun C, Wang L, et al. New insight into isolation, identification techniques and medical applications of exosomes[J]. J Control Release, 2019, 308: 119-29. DOI:10.1016/j.jconrel.2019.07.021 |
| [7] |
Doyle LM, Wang MZ. Overview of extracellular vesicles, their origin, composition, purpose and methods for exosome isolation and analysis[J]. Cells, 2019, 8(7): pii: E727. DOI:10.3390/cells8070727 |
| [8] |
Boriachek K, Islam MN, Möller A, et al. Biological functions and current advances in isolation and detection strategies for exosome nanovesicles[J]. Small, 2017, 1702153. |
| [9] |
Liu C, Zhao J, Tian F, et al. Low-cost thermophoretic profiling of extracellular-vesicle surface proteins for the early detection and classification of cancers[J]. Nat Biomed Eng, 2019, 3(3): 183-93. DOI:10.1038/s41551-018-0343-6 |
| [10] |
Ramirez MI, Amorim MG, Gadelha C, et al. Technical challenges of working with extracellular vesicles[J]. Nanoscale, 2018, 10(3): 881-906. DOI:10.1039/C7NR08360B |
| [11] |
Yu X, He L, Pentok M, et al. An aptamer-based new method for competitive fluorescence detection of exosomes[J]. Nanoscale, 2019, 11(33): 15589-595. DOI:10.1039/C9NR04050A |
| [12] |
韩会霞.等温循环放大检测细胞内活性物质[D].青岛科技大学, 2018: 1-72.
|
| [13] |
Zhang Y, Luo S, Situ B, et al. A novel electrochemical cytosensor for selective and highly sensitive detection of cancer cells using binding-induced dual catalytic hairpin assembly[J]. Biosens Bioelectron, 2018, 102: 568-73. DOI:10.1016/j.bios.2017.12.010 |
| [14] |
Zhang Y, Yan Y, Chen W, et al. A simple electrochemical biosensor for highly sensitive and specific detection of microRNA based on mismatched catalytic hairpin assembly[J]. Biosens Bioelectron, 2015, 68: 343-9. DOI:10.1016/j.bios.2015.01.026 |
| [15] |
Sefah K, Shangguan D, Xiong X, et al. Development of DNA aptamers using Cell-SELEX[J]. Nat Protoc, 2010, 5(6): 1169-85. DOI:10.1038/nprot.2010.66 |
| [16] |
Chen M, Yu Y, Jiang F, et al. Development of Cell-SELEX technology and its application in cancer diagnosis and therapy[J]. Int J Mol Sci, 2016, 17(12): E2079. DOI:10.3390/ijms17122079 |
| [17] |
Yahyazadeh Mashhadi SM, Kazemimanesh M, Arashkia A, et al. Shedding light on the EpCAM: an overview[J]. J Cell Physiol, 2019, 234(8): 12569-80. DOI:10.1002/jcp.28132 |
| [18] |
Zhang H, Wang Z, Zhang Q, et al. TiC MXenes nanosheets catalyzed highly efficient electrogenerated chemiluminescence biosensor for the detection of exosomes[J]. Biosensors Bioelectronics, 2018, 124: 184-90. |
| [19] |
Kwizera EA, O'Connor R, Vinduska V, et al. Molecular detection and analysis of exosomes using surface-enhanced raman scattering gold nanorods and a miniaturized device[J]. Theranostics, 2018, 8(10): 2722-38. DOI:10.7150/thno.21358 |
| [20] |
许乘凤, 杨振林, 花义同, 等. 外泌体在体外对乳腺癌细胞耐药信息传递的作用[J]. 西安交通大学学报:医学版, 2017, 38(2): 193-8, 220. |
| [21] |
黄依瑶, 唐月汀, 覃思华, 等. 血清中外泌体及外泌体RNA提取方法的比较[J]. 中华检验医学杂志, 2016, 39(6): 427-32. DOI:10.3760/cma.j.issn.1009-9158.2016.06.008 |
| [22] |
Shtam T, Naryzhny S, Samsonov R, et al. Plasma exosomes stimulate breast cancer metastasis through surface interactions and activation of FAK signaling[J]. Breast Cancer Res Treat, 2019, 174(1): 129-41. DOI:10.1007/s10549-018-5043-0 |
| [23] |
Huang H, Zheng X, Cai C, et al. Exosomes derived from breast cancer lung metastasis subpopulations promote tumor selfsee-ding[J]. Biochem Biophys Res Commun, 2018, 503(1): 242-8. DOI:10.1016/j.bbrc.2018.06.009 |
| [24] |
Gao ML, He F, Yin BC, et al. A dual signal amplification method for exosome detection based on DNA dendrimer self-assembly[J]. Analyst, 2019, 144(6): 1995-2002. DOI:10.1039/C8AN02383B |
| [25] |
Koliha N, Wiencek Y, Heider U, et al. A novel multiplex bead-based platform highlights the diversity of extracellular vesicles[J]. J Extracell Vesicles, 2016, 5(1): 29975. DOI:10.3402/jev.v5.29975 |
| [26] |
Li X, Wang S, Zhu R, et al. Lung tumor exosomes induce a pro-inflammatory phenotype in mesenchymal stem cells via NFκB-TLR signaling pathway[J]. J Hematol Oncol, 2016, 9(1): 42. |
| [27] |
Pegtel DM, Gould SJ. Exosomes[J]. Annu Rev Biochem, 2019, 88(1): 487-514. DOI:10.1146/annurev-biochem-013118-111902 |
| [28] |
Sigal YM, Zhou R, Zhuang X. Visualizing and discovering cellular structures with super-resolution microscopy[J]. Science, 2018, 361(6405): 880-7. DOI:10.1126/science.aau1044 |
| [29] |
Dai W, Zhang J, Meng X, et al. Catalytic hairpin assembly gel assay for multiple and sensitive microRNA detection[J]. Theranostics, 2018, 8(10): 2646-56. DOI:10.7150/thno.24480 |
| [30] |
Park C, Park H, Lee HJ, et al. Double amplified colorimetric detection of DNA using gold nanoparticles, enzymes and a catalytic hairpin assembly[J]. Mikrochim Acta, 2018, 186(1): 34. |
 2019, Vol. 39
2019, Vol. 39

