肝细胞癌(HCC)是最为常见的恶性肿瘤之一,在全球癌症致死率中排名第3 [1-2]。尽管在过去的几十年里,对其治疗已取得了很大的进展,但大多数患者一旦被确诊为HCC仍会在1年内死亡。因而,HCC瘤细胞侵袭性生长、增殖速度快、易复发的分子机制仍需更为深入的探讨[3-5]。
Musashi1(MSI1)是哺乳动物的果蝇蛋白同源类似物,为神经前体细胞不对称分裂所必需,与细胞自我更新的维持和分化关系密切。最新研究表明,MSI1在包括骨肉瘤[6]、肺癌[7]、食管鳞状细胞癌[8]、胃癌[9]、胶质瘤[10]和女性生殖系统[11-12]等多种类型肿瘤的发生、发展中具有重要作用。MSI1可通过多种信号通路参与调节细胞周期、细胞凋亡、侵袭以及增殖等过程。因而,MSI1是潜在的新型致癌基因之一。已有资料显示,它可通过调节包括MYCN、PTEN、NUMB等基因在内的Notch、mTOR、SMAD及Wnt通路的活化参与肿瘤的扩散以及分化,并最终影响患者的生存率[13-14]。Jones等[15]的研究结果还表明,在胶质瘤细胞的生长及肿瘤的形成过程中,MSI1的作用还与PI3K/AKT信号通路的活化有关。
虽然上述研究成果对MSI1的致癌作用有了初步的探讨,但其对HCC病程进展有何意义目前还未见报道,需要进一步的深入探究。本研究重点关注MSI1对HCC肿瘤细胞生长、细胞周期进展等方面的影响,以期为肝癌的治疗寻找新的干预靶点。
1 资料和方法 1.1 主要试剂HeLa、HepG2和HuH7等细胞购自中国科学院上海细胞库,DMEM培养基(Hyclone),Lipofectamine 2000转染试剂、胎牛血清(Invitrogen),抗MSI1、抗PCNA、抗Cyclin D1、抗β-catenin、抗APC以及抗β-actin一抗(Santa Cruz),pIRES2-EGFP载体(Clontech),碘化丙锭(Propidium iodide, PI)及RNaseA(Sigma)均由相关公司购得。引物由上海生工公司合成,其它试剂均为国产分析纯。
1.2 方法 1.2.1 人体肝癌组织收集2012~2013年间在西安交通大学医学部第二附属医院接受治疗的24例肝癌患者的临床标本。所有患者在标本采集之前均未接受化疗、免疫治疗或放射治疗。该研究获得了西安交通大学医学院伦理审查委员会的批准。
1.2.2 免疫组化4 μm的组织切片经脱蜡、水化,在蒸汽压力锅中用柠檬酸盐缓冲液(2 mmol/L柠檬酸和10 mmol/L pH 6.0的柠檬酸钠)处理并进行抗原修复。室温下用3% H2O2处理后,将切片4 ℃下与抗MSI1一抗温育过夜,随后与二抗室温孵育20 min,使用0.05%的DAB显色,细胞核用苏木精复染。以PBS替代一抗设为阴性对照。染色结果在显微镜下观察,胞质中有棕黄色颗粒者为阳性表达细胞,不着色者为阴性表达细胞。在原发性肝癌组织及相邻非癌组织分别随机选取3个视野并拍摄图片,采用Image J图像分析软件测量每个视野的积分光密度(IOD)和图片面积(Area),计算平均光密度(MD),MD= IOD/Area,取这几个视野MD的平均值为该样本的免疫组化测定结果,以MD表示MSI1蛋白的表达水平。
1.2.3 细胞培养实验用HeLa、HepG2和HuH7等细胞系均培养于含有10%胎牛血清(FBS)及1%青-链霉素的DMEM培养基中。细胞生长于37 ℃,5% CO2的环境中,2~3 d采用胰酶进行消化传代。
1.2.4 蛋白质印迹实验采用添加有蛋白酶抑制剂的裂解液(RIPA)处理肝癌组织或肝癌细胞系,提取总蛋白进行定量。采用聚丙烯酰胺凝胶电泳分离等量蛋白,将其转移到PVDF膜上,5%脱脂牛奶封闭后一抗孵育、4 ℃过夜,二抗孵育后化学发光法显色,β-actin作为内参对照。蛋白质印迹条带密度通过软件Image J分析。
1.2.5 质粒构建以cDNA模板及特异引物通过聚合酶链反应扩增编码MSI1的DNA片段。将扩增后的DNA片段插入到载体-pIRES2-增强型绿色荧光蛋白(EGFP)的多克隆位点中用以生成pIRES2-EGFP-MSI1。
为生成表达MSI1特异性小干扰RNA(siRNA)的质粒,使用在线siRNA设计软件Ambion设计针对MSI1 mRNA的siRNA寡核苷酸,并将其克隆到pSilencer4.1-neo载体中。采用Lipofectamine 2000转染试剂进行转染。将细胞维持在含有10% FBS和1000 μg/mL G418的新鲜培养基中3~4周。提取稳定转染的克隆并进行鉴定。引物信息如下:
pIRES2-EGFP-MSI1 F: 5'-gttgtcgacatggagactgacgcgccccagcc-3';
pIRES2-EGFP-MSI1 R: 5'-gttggatcctcagtggtacccattggtgaag-3';
shMSI1 F: 5'-gatcctgttacatggtgtttcgaattcaagagattcgaaacaccatgtaacatca-3';
shMSI1 R: 5'-gacaatgtaccacaaagcttaagttgagaaagctttgtggtacattgtagttcga-3'。
1.2.6 细胞增殖和活力分析根据标准操作流程,采用MTT法评估细胞活力,每组设6个复孔。将大约1000个细胞接种在96孔板中,细胞干预完成后,每孔加入5 mg/mL的MTT液20 μL,继续孵育4 h后,弃上清液,再加入100 μL的DMSO,室温充分振荡,使紫色结晶充分溶解,测定各孔A490 nm值评估细胞的增殖情况。
1.2.7 细胞周期检测收集细胞(1×106个)并用PBS洗涤,4 ℃条件下75%冰乙醇固定过夜。细胞重悬于含有10 μL PI(50 μg/mL)及10 μL RNaseA(10 μg/mL)的100 μL PBS中,于4 ℃黑暗条件下孵育30 min。细胞周期分布通过美国BD公司的FACSCalibur检测,并采用Flow Jo7.6.1软件进行分析。
1.2.8 qRT-PCR提取细胞总RNA,逆转录为cDNA,qRT-PCR进行扩增。Cyclin D1正向引物:5'-ccatccagtggaggtttgtc-3',反向引物:5'-gtgggacaggtggccttt-3';APC正向引物:5'-cccgatgaacaagtttaccc-3',反向引物:5'-agcagccatctcacctcaaa-3';C-myc正向引物:5'-ggctcctggcaaaaggtca-3',反向引物:5'-ctgcgtagttgtgctgatgt-3';β-actin正向引物:5'- gtgacgttgacatccgtaaa-3',反向引物:5'-taaaacgcagctcagtaaca-3'。聚合酶链反应扩增条件:95 ℃预变性10 s;95 ℃变性5 s,56 ℃退火20 s,72 ℃延伸10 s,共40个循环。β-actin作为内参对照,目的基因相对表达量采用2-△△Ct法进行计算。
1.3 统计处理统计软件采用SPSS 18.0,数据以均数±标准差表示,组间差异使用t检验或单因素ANOVA分析进行比较,P < 0.05认为差异有统计学意义。
2 结果 2.1 过表达MSI1的HepG2细胞及沉默MSI1的Huh7细胞的构建由于现有HCC细胞系的来源与生物学行为存在较大差异,我们首先分析了本实验中所采用的HepG2及Huh7细胞系中MSI1的表达。以宫颈癌细胞系HeLa作为阳性对照,结果显示,不同细胞系中MSI1的含量不同,HepG2细胞中的MSI1表达水平较低,而Huh7细胞中MSI1的表达水平则相对较高(图 1A)。
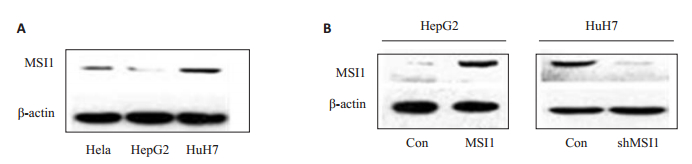
|
图 1 HepG2-MSI1细胞与Huh7-shMSI1细胞的构建与鉴定 Fig.1 Expression of MSI1in Hela, HepG2 and Huh7 cells (A) and in HepG2-MSI1 and Huh7-shMSI1 cells (B) detected by Western blotting. |
为了明确MSI1是否能够调节肝癌细胞的增殖,我们构建了MSI1表达载体并将其稳定转染进HepG2细胞中,同时也设计了专门针对MSI1 mRNA的shRNAs并将其连接到pSilencer4.1-neo线性载体上,从而获得了HepG2-MSI1及Huh7-shMSI1细胞。如图所示,与HepG2-EGFP细胞相比,HepG2-MSI1细胞中MSI1的表达大幅增加,而Huh7-shMSI1细胞系中的MSI1基本被敲除了(图 1B)。
2.2 人体肝癌组织中MSI1蛋白的表达人们已经在包括胶质瘤、乳腺癌和膀胱癌等人体多种癌组织中检测到MSI1的表达。Shu等发现MSI1在小鼠肝脏及人类HCC细胞系中均有表达[8]。但MSI1的表达水平与HCC发生间的关系尚未深入研究。我们采用免疫组化法检测人HCC及其邻近非癌组织中MSI1的表达情况。结果表明,MSI1主要定位于阳性细胞的胞质中,且HCC肿瘤细胞中的MSI1免疫染色信号较强(图 2A)。Western blot结果也表明HCC癌组织中MSI1的表达水平显著高于非癌组织(图 2B)。以上结果均提示作为致癌基因的MSI1其功能可能与HCC肿瘤的进展有关。
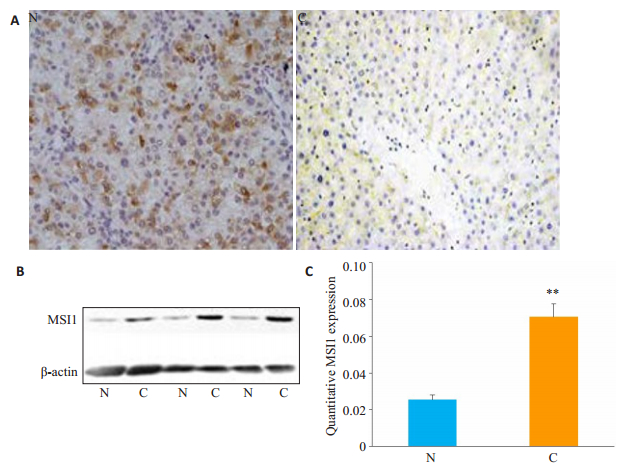
|
图 2 人HCC(C)和相邻非癌组织(N)中MSI1的表达情况 Fig.2 Expression of MSI1 in HCC tissues (C) and adjacent tissues (N) detected by immunohistochemical staining (A, Original magnification: × 100) and Western blotting (B). C: Statistical analysis of MSI1 expression in HCC tissues (C) and adjacent tissues (N). **P < 0.01 vs N. |
随后,我们采用MTT比色法检测MSI1对HCC细胞增殖的影响。过表达MSI1的HepG2-MSI1细胞较作为对照的HepG2-EGFP细胞具有更强的增殖能力,而敲除了MSI1,Huh7-shMSI1细胞较对照细胞的增殖及活力明显受抑(图 3)。
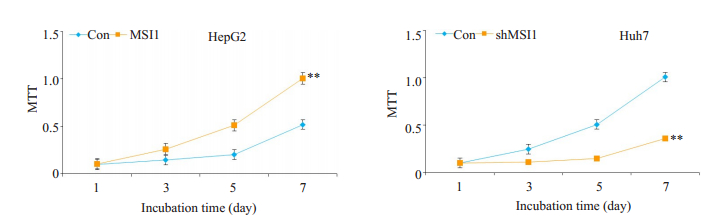
|
图 3 MSI1对HepG2和Huh7细胞增殖及活力的影响 Fig.3 Effect of modulation of MSI1 expression on proliferation and activity of HepG2 and Huh7 cells. **P < 0.01 vs Con. |
为了进一步探讨MSI1调控的HCC细胞增殖能力改变是否与其细胞周期进程的变化相关,我们采用流式分析技术检测了HepG2-MSI1、Huh7-shMSI1及其相应对照细胞内的DNA含量。图 4A、4B显示由于MSI1的过表达,处于G0/G1期的HepG2- MSI1细胞比率从58.42降至40.67%(P < 0.01),而S期细胞比率则从28.51%增加至40.06%(P < 0.01)。同时,因MSI1的敲除,处于G0/G1期的Huh7-shMSI1细胞比率显著增加至62.84%,而S期细胞比例则降至27.69%。
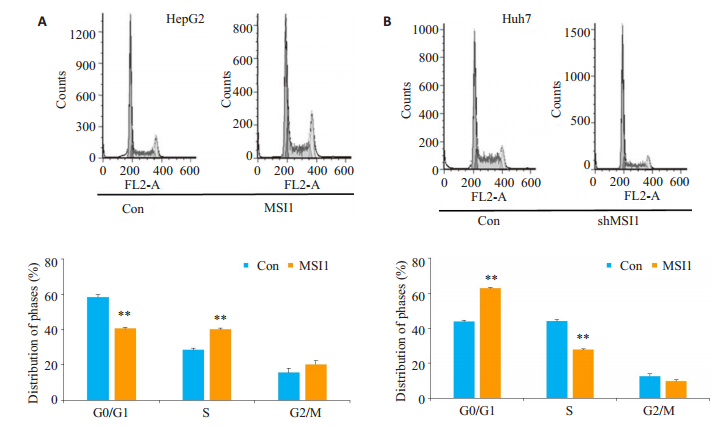
|
图 4 MSI1对HepG2和Huh7细胞周期的调控 Fig.4 Effect of modulation of MSI1 expression on cell cycle distribution in HepG2 and Huh7 cells. **P < 0.01 vs Con. |
我们也采用蛋白印迹技术对细胞增殖相关分子PCNA及Cyclin D1在MSI1促HCC作用中的变化进行了检测。如图 5所示,与对照细胞相比,HepG2-MSI1细胞中PCNA及Cyclin D1的表达显著升高,而Huh7-shMSI1细胞中二者的表达降低非常明显。

|
图 5 MSI1正调控细胞周期相关分子PCNA及Cyclin D1的表达 Fig.5 Effect of modulation of MSI1 expression on the expression of PCNA and cyclin D1 in HepG2 and Huh7 cells. |
为了深入探究MSI1调控肝癌细胞生长和增殖的细胞分子机制,我们进一步分析了MSI1的可能作用靶点。大量文献报道已证实Cyclin D1的表达受到Wnt/β-catenin通路的调控。我们进一步对Wnt/β-catenin通路中的一些经典靶基因的mRNA表达情况进行了检测。在过表达MSI1的HepG2-MSI1细胞中,Wnt通路关键抑制因子APC的mRNA表达水平与对照组细胞相比下调明显(0.51±0.01 vs 1.00±0.02,P < 0.01),与此同时Cyclin D1的表达水平与对照组相比显著升高(3.49±0.06 vs 0.96±0.04),C-myc的变化趋势与Cyclin D1一致。在MSI1敲低的Huh7-shMSI1中,APC的mRNA表达水平与对照组细胞相比则显著增高(2.46±0.04 vs 1.01±0.01),而Cyclin D1与C-Myc的表达水平与对照组相比下调显著,与HepG2-MSI1细胞中的情况相反(图 6A、B)。蛋白水平的检测结果如图 6C所示,与对照细胞相比,HepG2-MSI1细胞中Wnt通路关键分子β-catenin的表达显著增高,而其抑制分子APC的表达却明显降低。Huh7-shMSI1细胞中二者的表达与HepG2-MSI1细胞中的情况相反。
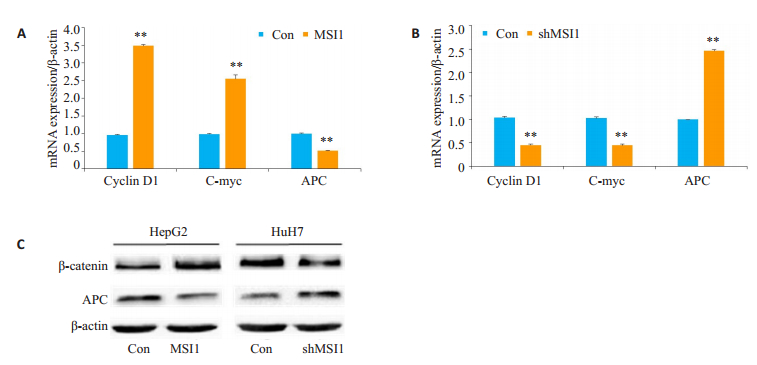
|
图 6 MSI1正调控Wnt/β-catenin细胞信号分子的表达 Fig.6 Effect of modulation of MSI1 expression on the protein expression of APC and β-catenin in HepG2 and Huh7 cells. **P < 0.01 vs Con. |
MSI1是一种对维持干细胞状态具有重要作用的RNA结合蛋白。大量研究表明MSI1主要表达于人类正常的干细胞,包括肠道、造血系统和生殖系统的细胞等[16-19]。最新研究发现MSI1在包括HCC在内的多种恶性肿瘤组织中也有较高表达[20-21],但其在HCC发生发展中的作用还远未探明。
本实验中,我们首先检测人体HCC肿瘤及其邻近非癌组织中MSI1的表达情况。免疫组化及Western Blot实验结果均证实了HCC肿瘤组织中MSI1的高表达,表明MSI1确实可能参与了人体HCC病程的进展(图 1)。随后,我们选择了目前国际上最为常用的两个人源性的HCC细胞系:HepG2及Huh7 [22-24],同时检测了这两种细胞内MSI1的表达情况。结果表明,MSI1在Huh7细胞中的表达水平较高,而在HepG2细胞系中的表达则较低。为了进一步深入观察MSI1对HCC细胞生长和增殖的影响,我们随之采用基因克隆技术在上述两个细胞系中过表达或敲除了MSI1基因。图 2B结果显示实验结果较为满意,我们成功的获得了HepG2过表达而Huh7细胞敲除MSI1的工具细胞。MTT实验结果显示(图 3),HepG2中MSI1的高表达促进了细胞的生长及增殖,而Huh7细胞中MSI1的敲低则显著抑制了细胞的生长及增殖。本结果提示了MSI1在HCC细胞增殖及肿瘤生长过程中的重要作用。
细胞周期测定是检测细胞增殖状况的一项常用技术[25-26],我们随之采用流式细胞仪观察MSI1对上述细胞周期分布的影响。结果显示,MSI1的过表达使处于G0/G1期的HepG2-MSI1细胞比率显著降低,而S期细胞比率大幅增加,差异十分明显(P < 0.05)。而MSI1的敲除,处于G0/G1期的Huh7-shMSI1细胞比率明显增多,而S期的细胞比例则大幅降低(图 4A、B)。细胞停滞于G0/G1期常常表明其向DNA复制加倍的S期及M期转化受阻,最终造成肿瘤细胞生长缓慢和增殖活性降低[27-28]。因此,我们上述的结果显示MSI1对HCC细胞的侵袭性生物学行为及细胞周期的进展有促进作用。
已有资料显示,MSI1可以调节与细胞增殖、细胞周期和肿瘤发生相关的多个基因的表达,其中包括DKK1、APC、β-catenin、C-myc、Cyclin D1和Cyclin D2等。我们随之进一步检测了细胞Cyclin D1以及在细胞增殖启动过程中起重要作用、并与细胞DNA合成关系密切的PCNA蛋白的表达情况。结果表明,当HepG2细胞过表达MSI1时,Cyclin D1和PCNA蛋白的表达均增加明显,而当Huh7细胞中的MSI1敲低时,Cyclin D1和PCNA蛋白的表达则降低显著
已有报道证实包括Ras、src和Wnt在内的多种致癌信号均可诱导Cyclin D1的转录[29]。Wnt信号通路在维持细胞的自我更新及增殖分化等过程中具有非常重要的作用。而在肿瘤的发生过程中,包括Wnt在内的数个重要信号通路通常会被激活。有研究提示MSI1可以调控增殖活性较高细胞中的Wnt通路[30-31]。因而,我们的实验也进一步检测了HCC细胞MSI1的过表达和敲低对Wnt信号通路是否有影响?结果显示,MSI1的过表达可以显著下调Wnt通路抑制因子APC mRNA的表达,而增加细胞Cyclin D1及C-myc mRNA的表达,而Huh7细胞中MSI1的敲低则与上述情况刚好相反。蛋白水平的检测也证实MSI1的过表达可以增加β-catenin同时降低APC蛋白的表达,说明MSI1促进HCC细胞的增殖可能是通过正调控Wnt/β-catenin信号通路实现的。
总之,MSI1不仅可以调控HCC细胞的增殖,还可以调节一系列在细胞增殖过程中重要蛋白的表达,其表达的缺失对HCC细胞的生长具有反向作用。MSI1的这一作用可能与其对HCC细胞中Wnt/β-catenin信号通路的正向调控有关。在未来的研究中,我们尚需对MSI1在HCC肿瘤发生中的作用进行更为深入的研究,从而为未来HCC诊疗方案的优化提供坚实的理论和实验基础。
| [1] |
Clark T, Maximin S, Meier J, et al. Hepatocellular carcinoma: review of epidemiology, screening, imaging diagnosis, response assessment, and treatment[J]. Curr Probl Diagn Radiol, 2015, 44(6): 479-86. DOI:10.1067/j.cpradiol.2015.04.004 |
| [2] |
Zhang RY, Zhang Z, Liu ZK, et al. Adoptive cell transfer therapy for hepatocellular carcinoma[J]. Front Med, 2019, 13(1): 3-11. |
| [3] |
Singh AK, Kumar R, Pandey AK. Hepatocellular carcinoma: causes, mechanism of progression and biomarkers[J]. Curr Chem Genom Transl Med, 2018, 12: 9-26. DOI:10.2174/2213988501812010009 |
| [4] |
Villani R, Vendemiale G, Serviddio G. Molecular mechanisms involved in HCC recurrence after Direct-Acting antiviral therapy[J]. Int J Mol Sci, 2018, 20(1): pii: E49. DOI:10.3390/ijms20010049 |
| [5] |
Roth GS, Decaens T. Liver immunotolerance and hepatocellular carcinoma: Patho-physiological mechanisms and therapeutic perspectives[J]. Eur J Cancer, 2017, 87: 101-12. DOI:10.1016/j.ejca.2017.10.010 |
| [6] |
Niu JB, Zhao XL, Liu QS, et al. Knockdown of MSI1 inhibited the cell proliferation of human osteosarcoma cells by targeting p21 and p27[J]. Oncol Lett, 2017, 14(5): 5271-8. |
| [7] |
Liu L, Qiu F, Chen J, et al. Functional polymorphism in the MSI1 gene promoter confers a decreased risk of lung cancer in Chinese by reducing MSI1 expression[J]. Curr Genomics, 2018, 19(5): 75-383. |
| [8] |
Moghbeli M, Sadrizadeh A, Forghanifard MM, et al. Role of Msi1 and PYGO2 in esophageal squamous cell carcinoma depth of invasion[J]. J Cell Commun Signal, 2016, 10(1): 49-53. DOI:10.1007/s12079-015-0314-6 |
| [9] |
Nikpour P, Emadi-Baygi M, Mohhamad-Hashem F, et al. MSI1 overexpression in diffuse type of gastric cancer[J]. Pathol Res Pract, 2013, 209(1): 10-3. DOI:10.1016/j.prp.2012.09.008 |
| [10] |
Yi C, Li G, Ivanov DN, et al. Luteolin inhibits Musashi1 binding to RNA and disrupts cancer phenotypes in glioblastoma cells[J]. RNA Biol, 2018, 15(11): 1420-32. DOI:10.1080/15476286.2018.1539607 |
| [11] |
Gong PJ, Wang YD, Gao YE, et al. Msi1 promotes tumor progression by epithelial-to-mesenchymal transition in cervical cancer[J]. Hum Pathol, 2017, 65: 53-61. DOI:10.1016/j.humpath.2016.12.026 |
| [12] |
Shi C, Zhang Z. miR-761 inhibits tumor progression by targeting MSI1 in ovarian carcinoma[J]. Tumour Biol, 2016, 37(4): 5437-43. DOI:10.1007/s13277-015-4377-z |
| [13] |
Bish R, Vogel C. RNA binding Protein-Mediated Post-Transcriptional gene regulation in medulloblastoma[J]. Mol Cells, 2014, 37(5): 357-64. DOI:10.14348/molcells.2014.0008 |
| [14] |
Kudinov AE, Karanicolas J, Golemis EA. Musashi RNA-Binding proteins as cancer drivers and novel therapeutic targets[J]. Clin Cancer Res, 2017, 23(9): 2143-53. DOI:10.1158/1078-0432.CCR-16-2728 |
| [15] |
Jones NM, Rowe MR, Shepherd PR. Targeted inhibition of dominant PI3-kinase catalytic isoforms increase expression of stem cell genes in glioblastoma cancer stem cell models[J]. Int J Oncol, 2016, 49(1): 207-16. DOI:10.3892/ijo.2016.3510 |
| [16] |
Kharas MG, Lengner CJ. Stem Cells, Cancer, and MUSASHI in Blood and Guts[J]. Trends Cancer, 2017, 3(5): 347-56. DOI:10.1016/j.trecan.2017.03.007 |
| [17] |
El-Salhy M, Mazzawi T, Umezawa K, et al. Enteroendocrine cells, stem cells and differentiation progenitors in rats with TNBSinduced colitis[J]. Int J Mol Med, 2016, 38(6): 1743-51. DOI:10.3892/ijmm.2016.2787 |
| [18] |
Fan HB, Chen LX, Qu XB, et al. Transplanted miR-219- overexpressing oligodendrocyte precursor cells promoted remyelination and improved functional recovery in a chronic demyelinated model[J]. Sci Rep, 2017, 7: 41407. DOI:10.1038/srep41407 |
| [19] |
Sutherland JM, Siddall N, Hime GR, et al. RNA binding proteins in spermatogenesis: an in depth focus on the Musashi family[J]. Asian J Androl, 2015, 17(4): 529-36. DOI:10.4103/1008-682X.151397 |
| [20] |
He L, Zhou XK, Qu C, et al. Musashi2 predicts poor prognosis and invasion in hepatocellular carcinoma by driving epithelialmesenchymal transition[J]. J Cell Mol Med, 2014, 18(1): 49-58. DOI:10.1111/jcmm.12158 |
| [21] |
Liu NL, Chen TR, Wang XH, et al. Msi1 confers resistance to TRAIL by activating ERK in liver cancer cells[J]. FEBS Lett, 2015, 589(8): 897-903. DOI:10.1016/j.febslet.2015.02.026 |
| [22] |
Zhou XE, Wen Y, Tian Y, et al. Heat shock protein 90 alphaDependent B-Cell-2-Associated transcription factor 1 promotes hepatocellular carcinoma proliferation by regulating MYC ProtoOncogene c-MYC mRNA stability[J]. Hepatology, 2019, 69(4): 1564-81. DOI:10.1002/hep.30172 |
| [23] |
Bidkhori G, Benfeitas R, Klevstig M, et al. Metabolic networkbased stratification of hepatocellular carcinoma reveals three distinct tumor subtypes[J]. Proc Natl Acad Sci USA, 2018, 115(50): E11874-83. DOI:10.1073/pnas.1807305115 |
| [24] |
Roy S, Hooiveld GJ, Seehawer M, et al. microRNA 193a-5p regulates levels of nucleolar- and Spindle-Associated protein 1 to suppress hepatocarcinogenesis[J]. Gastroenterology, 2018, 155(6): 1951. DOI:10.1053/j.gastro.2018.08.032 |
| [25] |
Gao X, Du HJ, Zhang RX, et al. Overexpression of cancer susceptibility candidate 2 inhibited progression of hepatocellular carcinoma cells[J]. J Cell Physiol, 2019, 234(6): 9008-18. DOI:10.1002/jcp.27573 |
| [26] |
Engl T, Rutz J, Maxeiner S, et al. mTOR inhibition reduces growth and adhesion of hepatocellular carcinoma cells in vitro[J]. Mol Med Rep, 2017, 16(5): 7064-71. DOI:10.3892/mmr.2017.7401 |
| [27] |
Kim YW, Jang EJ, Kim CH, et al. Sauchinone exerts anticancer effects by targeting AMPK signaling in hepatocellular carcinoma cells[J]. Chem Biol Interact, 2017, 261: 108-17. DOI:10.1016/j.cbi.2016.11.016 |
| [28] |
Xu XQ, Huang, Xiao XF, et al. Tripartite motif-containing 3 (TRIM3) inhibits tumor growth and metastasis of liver cancer[J]. Chin J Cancer, 2017, 36(9): 407-19. |
| [29] |
Wen B, Sun H, He S, et al. Effects of biejiajian pills on Wnt signal pathway signal molecules β-catenin/TCF4 complex activities and downstream proteins cyclin D1 and MMP-2 in hepatocellular carcinoma cells[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(12): 1758-62. |
| [30] |
Yang SC, Liu Y, Li MY, et al. FOXP3 promotes tumor growth and metastasis by activating Wnt/beta-catenin signaling pathway and EMT in non-small cell lung cancer[J]. Mol Cancer, 2017, 16(1): 124. DOI:10.1186/s12943-017-0700-1 |
| [31] |
Huynh H, Ong R, Goh KY, et al. Sorafenib/MEK inhibitor combination inhibits tumor growth and the Wnt/β-catenin pathway in xenograft models of hepatocellular carcinoma[J]. Int J Oncol, 2019, 54(3): 1123-33. |
 2019, Vol. 39
2019, Vol. 39

