雄激素性脱发(AGA)是中青年男性进展性脱发中最常见的类型[1],发病率约为20%[2]。雄激素性脱发的病程长达数年,许多患者可因此而产生抑郁或焦虑等情感障碍,对患者的生活质量及身心健康都起着负面影响[3]。目前认为遗传及头皮局部双氢睾酮含量增多为主要诱发因素[4-5],但具体的发病机制尚未明确。临床上广泛使用的药物有非那雄胺、度他雄胺[6]、螺内酯[7]和米诺地尔[8],治疗1年后的有效率均在65%以上[9],但由于用药周期长,且存在着一定的副作用,导致患者的依从性较差,临床上整体治愈率不高。
近年来,对于中药在治疗雄激素性脱发方面的研究日益增多[10-11]。凤仙花也称为海娜花,因含多种花色素,着色性强,已被广泛应用于染发剂等化妆品中,而随着对其成分的提取及研究逐渐深入,学者们发现凤仙花在抗过敏、抗菌、止痒及α-还原酶抑制剂等方面显示出特殊的药用价值[12]。研究显示,凤仙花中的萘醌类成分能抑制5a还原酶的活性[12],而双氢睾酮可由睾酮在5a还原酶的作用下转化而来[13],提示凤仙花可能具有降低局部双氢睾酮含量的作用。至今暂未发现凤仙花对雄激素性脱发治疗作用的研究。
然而,由于不同地域的文化差异,散沫花在某些地区也被俗称为海娜花,即出现了凤仙花与散沫花的同名异物现象[14]。这两种植物虽然都具有抗菌抗炎、抗肿瘤、抗氧化等活性[14],但实际上分类于不同科属,从形态上即可鉴别。目前市面上大量流通的植物养发粉大部分注明以海娜花为主要原料,质量参差不齐,难以判断其主要成分为凤仙花抑或散沫花。为了研究凤仙花及散沫花对雄激素性脱发的治疗作用,并对其有效成分进行提取和精炼,本课题组分别比较了凤仙花、散沫花、海娜植物养发粉在促进C57BL/6小鼠雄激素性脱发模型毛发生长中的效果,并对其作用机制进行了初步探讨,以期为临床工作提供动物实验基础,并推动新药的研究。
1 材料和方法 1.1 材料健康雄性SPF级C57BL/6小鼠48只,3~4周龄,体质量16~18 g(中山大学实验动物中心提供,许可证号:SCXK(粤)2016-0029)。丙酸睾酮注射液(1 mL:25 mg,广州白云山明兴制药有限公司),国药准字H44022011;米诺地尔酊(厦门美商医药有限公司),国药准字H20103166;海娜植物养发粉(乌鲁木齐买尔哈巴纳娇海娜化妆品进出口有限公司,卫生许可证:新妆20160010);凤仙花(产地:安徽);散沫花(产地:印度)。
1.2 方法 1.2.1 分组将48只小鼠采用抽签法随机分为6组,分别为实验组(T)、模型组(M)和空白组(K),实验组中又分为凤仙花组(T1)、散沫花组(T2)、海娜组(T3)、米诺地尔酊组(T4),每组8只,并采用剪趾法进行标记。
1.2.2 实验前处理小鼠于温度25 ℃、湿度54%的环境中适应性喂养2周后,用备皮刀剃除各组小鼠背部毛发,面积约2 cm×3 cm,然后按照说明书分别涂抹脱毛膏,去除残留的毛发,并确认当前小鼠毛发生长处于休止期(皮肤呈现粉红色)[15]。
1.2.3 小鼠雄激素性脱发模型的建立[16]及药物治疗将丙酸睾酮注射液(1 mL:25 mg)稀释至0.5 mg/mL。脱毛24 h后,除空白组以外,其余各组小鼠均于背部脱毛区皮下多点注射丙酸睾酮稀释液0.2 mL/只,1次/d,连续注射35 d。用适量蒸馏水分别将凤仙花、散沫花和海娜调配成糊状,在每次注射丙酸睾酮1 h后均匀涂抹于T1、T2、T3组小鼠背部脱毛部位,并用保鲜膜覆盖封包,1次/d,每次封包30 min,连续35 d;T4组外用5%米诺地尔酊,2次/d,每次1 mL,连续35 d;模型组及空白组均外用生理盐水。本实验总周期为7周,实验过程中小鼠正常摄食饮水。
1.2.4 取材及标本处理各组小鼠均于给药35 d后,通过摘眼球取血法取血,离心后留血清于EP管内-80 ℃保存备用。取血结束后,用眼科剪取每只小鼠背部实验区皮肤相同部位皮片,大小约2 cm×3 cm。将取下的皮片平均分为两份,一份置于EP管内-80 ℃保存,用于ELISA检测,另一份行常规石蜡包埋制片。按照ELISA试剂盒说明书检测血清中睾酮(T)、双氢睾酮(DHT)及皮片组织匀浆标本中T、DHT、Ⅱ型5α还原酶的含量。对病理切片行光镜下计数毛囊总数并计算终毛/毳毛比值。
1.2.5 统计学分析使用SPSS20.0软件进行统计分析,计量资料均采用均数±标准差表示;各组间比较采用单因素方差分析,以P < 0.05为有统计学意义。
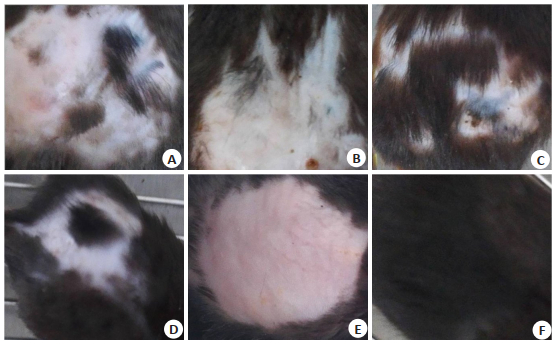
2 结果 2.1 各组小鼠背部脱毛区毛发生长情况外用药物5周后,观察各组小鼠背部脱毛区,局部未见红斑、水肿、水疱、糜烂及渗出等皮肤刺激症状(图 1)。模型组小鼠背部脱毛区皮肤裸露,未见毛发生长;空白组小鼠背部毛发完整浓密,乌黑有光泽;各药物组小鼠背部脱毛区均可见新生毛发,其中海娜组背部毛发生长最明显,且可见部分皮肤变为灰色。散沫花组小鼠背部毛发生长区域最小。
|
图 1 外用药物5周后,各组小鼠背部脱毛区毛发生长情况 Fig.1 Hair growth in the skin lesion area after topical treatment for 5 weeks. A: Impatiens group (T1); B: Lawsonia group (T2); C: Henna group (T3); D: Minoxidil group (T4); E: Model group (M); F: Blank group (K). |
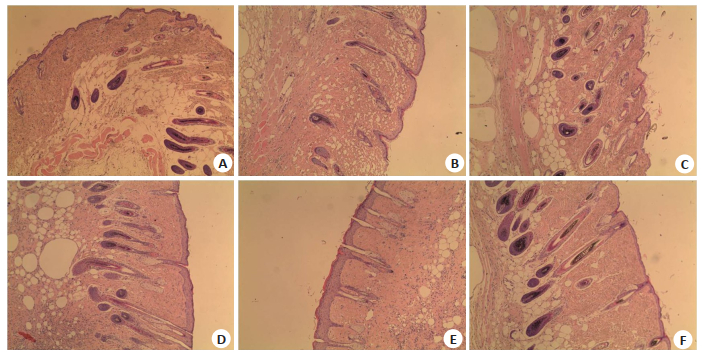
各小鼠实验部位皮肤组织HE切片示:用药35 d后,空白组小鼠的毛囊长度较长,且数量较多;模型组小鼠的毛囊微小化,数量较少,部分毛囊萎缩消失仅可见其附属皮脂腺(图 2)。
|
图 2 外用药物5周后,各组小鼠背部脱毛区皮肤组织病理 Fig.2 Histological examination of the skin lesions after topical treatment for 5 weeks (HE staining, original magnification: ×100). A: Impatiens group (T1); B: Lawsonia group (T2); C: Henna group (T3); D: Minoxidil group (T4); E: Model group (M); F: Blank group (K). |
取毛囊横断面切片于100倍显微镜视野下计数毛囊,每张切片中选择毛囊最多的视野,分别计数总毛囊数、终毛毛囊数和毳毛毛囊数,并计算终毛/毳毛比,对结果进行统计学分析。与模型组相比,各药物组及空白组小鼠皮肤中的总毛囊数及终毛毛囊数量均显著高于模型组,说明这四种药物能增加小鼠毛囊尤其是终毛毛囊的数量,从而有效治疗小鼠雄激素性脱发,但各药物组间无明显差异(P>0.05,表 1)。
| 表 1 各组小鼠背部皮肤毛囊计数 Tab.1 Hair follicle counts in the skin lesions in each group |
给药35 d后,对小鼠进行摘眼球取血,并采用ELISA法对血清中的T及DHT含量进行测定,检测结果以均数±标准差的形式表示(表 2)。由表中数据可以看出,各药物组与模型组血清中雄激素的含量较空白组均明显升高,但各药物组与模型组小鼠之间的血清雄激素含量并无明显差异,提示这三种药物均不能降低雄激素性脱发小鼠模型血清中的雄激素浓度。
| 表 2 ELISA检测各组小鼠T、DHT、Ⅱ型5α还原酶含量 Tab.2 ELISAfor detecting T, DHT, and type Ⅱ 5a-reductase contents in the skin lesion tissue in each group |
取血结束后,用眼科剪取每只小鼠背部实验区皮肤相同部位皮片,并采用ELISA法对皮肤组织匀浆中T及DHT的含量进行测定,检测结果以均数±标准差(SD)的形式表示(表 2)。由表中可见,Ⅱ型5α还原酶的含量在各组中均无明显差异,T1及T3组小鼠皮片中雄激素的含量均明显低于模型组,而T2及T4组与模型组无明显差异,因此我们可以猜测凤仙花和海娜养发粉主要通过降低局部组织中雄激素的含量从而起到促进毛发生长的作用。而在本实验中,散沫花既不能降低血清及皮片中的雄激素含量,也不能通过影响Ⅱ型5α还原酶的含量来发挥治疗作用。
3 讨论雄激素性脱发是一种以前额及顶部头皮毛发进行性减少为特征的疾病,它的发生与头皮局部雄激素含量的升高有着密切的联系[17]。有研究显示,雄激素性脱发患者血浆中雄激素的含量均高于正常成年男性[18],且在雄激素性脱发患者的毛囊中,Ⅱ型5α还原酶的活性异常增强,促进睾酮转变为与雄激素受体有着更高亲和力以及生物效能的双氢睾酮,使毛囊萎缩退化[13, 19-22]。目前最常使用的治疗男性雄激素性脱发的口服药物是非那雄胺,它能够特异性地抑制Ⅱ型5α还原酶的活性,从而起到治疗效果[23],但由于用药后引起的不良反应较多,患者的接受度较低,使得治疗效果受到很大的影响[2, 24]。许多文献表明凤仙花具有多种药理活性,包括抗菌[25]、抗氧化[26]及抗炎镇痛[27]等,而关于其对5α还原酶的抑制作用却鲜有报道。本课题组使用ELISA方法证实了凤仙花并不能降低模型小鼠血清中Ⅱ型5a还原酶的含量,而对其酶活性的影响仍需进一步的研究。米诺地尔是FDA批准的唯一外用药,能够加速毛囊进入生长期,并且使毛囊体积增大,具有明显的生发效果,在临床上广泛应用[28]。因此本实验选用米诺地尔作为阳性对照药物。
C57BL/6小鼠在脱毛后全部毛囊进入同步生长周期,且皮肤的颜色将随着生长周期的变化而呈现由粉到灰再到黑的转变过程,方便在实验过程中随时进行大体上的观察与测量,以便及时调整实验方案,是研究毛发生长周期常用的动物模型[15, 29]。本实验选择了凤仙花、散沫花和海娜植物养发粉作为实验药物,米诺地尔酊作为阳性对照药物,并成功建立了C57BL/6小鼠雄激素性脱发模型,通过观察给药之后小鼠毛发生长情况、毛囊计数以及机体各项雄性激素含量的测定,探究不同药物的生发作用以及可能的机制[30]。
在实验过程中,除空白组外其余各组小鼠均出现了不同程度的好斗、易激惹,考虑可能为造模时局部皮下注射丙酸睾酮引起的小鼠体内雄激素升高造成的。研究结果显示,在用药35 d后,凤仙花、散沫花和海娜植物养发粉均能促进雄激素性脱发小鼠的毛发生长,且海娜植物养发粉的生发效果最好,小鼠背部脱毛区的毛发生长面积最大。从毛囊计数结果来看,各药物组小鼠背部脱毛区皮肤组织中的总毛囊数及终毛毛囊数均大于模型组,差异有统计学意义(P < 0.05),此结果也与各组小鼠的毛发生长情况相一致。除此之外,我们也比较了各组小鼠血清及皮肤组织中的雄激素含量,统计结果表明,凤仙花组和海娜组的小鼠皮肤组织中睾酮及双氢睾酮的含量都显著低于模型组(P < 0.05),而各药物组血清中的雄激素含量均与模型组相当,差异无统计学意义。这可能是由于实验周期较短,药物的使用时间不够长,仅起到了调节局部皮肤雄激素水平的作用,尚未能产生全身性的影响,若延长用药时间,可能将观察到血清中雄激素含量的变化。有研究证明Ⅱ型5α还原酶在雄激素性脱发的发病中起着重要作用[31],但我们的研究结果显示,Ⅱ型5α还原酶的含量在各组小鼠血清中并无明显差异(P>0.05),提示雄激素性脱发的发病可能与Ⅱ型5α还原酶的活性有关,而与其在组织中的含量无关。
综上所述,我们发现凤仙花、散沫花和海娜植物养发粉均能有效促进雄激素性脱发模型小鼠的毛发生长,其中凤仙花和海娜植物养发粉能够降低局部皮肤中的雄激素含量。三种实验药物在促进毛囊生长及向终毛转化的效果上与米诺地尔酊相近,实验过程中未发现明显的毒副作用,有望成为治疗雄激素性脱发的新一代药物。
| [1] |
Lolli F, Pallotti F, Rossi A, et al. Androgenetic alopecia: a review[J]. Endocrine, 2017, 57(1): 9-17. DOI:10.1007/s12020-017-1280-y |
| [2] |
李果, 丁劲松. 雄激素性脱发的机制与西药局部治疗研究进展[J]. 中国医药导报, 2017, 14(5): 43-6. |
| [3] |
俞婉婷, 程伟, 臧洁, 等. 男性雄激素性秃发临床及皮肤镜特征分析[J]. 临床皮肤科杂志, 2018, 47(9): 564-7. |
| [4] |
Michel L, Reygagne P, Benech P, et al. Study of gene expression alteration in male androgenetic alopecia: evidence of predominant molecular signaling pathways[J]. Br J Dermatol, 2017, 177(5): 1322-36. DOI:10.1111/bjd.15577 |
| [5] |
Hammes SR, Levin ER. Impact of estrogens in males and androgens in females[J]. J Clin Invest, 2019, 129(5): 1818-26. DOI:10.1172/JCI125755 |
| [6] |
Arif T, Dorjay K, Adil M, et al. Dutasteride in androgenetic alopecia: an update[J]. Curr Clin Pharmacol, 2017, 12(1): 31-5. |
| [7] |
Shamma RN, Aburahma MH. Follicular delivery of spironolactone via nanostructured lipid carriers for management of alopecia[J]. Int J Nanomedicine, 2014, 9(1): 5449-60. |
| [8] |
Adil A, Godwin M. The effectiveness of treatments for androgenetic alopecia: A systematic review and meta-analysis[J]. J Am Acad Dermatol, 2017, 77(1): 136-41. |
| [9] |
张建中. 中国雄激素性秃发诊疗指南[J]. 临床皮肤科杂志, 2014, 43(3): 182-6. |
| [10] |
唐青涛. 中草药来源的5α-还原酶抑制剂的研究进展[J]. 华西药学杂志, 2016, 31(5): 544-7. |
| [11] |
Zhang B, Zhang RW, Yin XQ, et al. Inhibitory activities of some traditional Chinese herbs against testosterone 5alpha-reductase and effects of Cacumen platycladi on hair re-growth in testosteronetreated mice[J]. J Ethnopharmacol, 2016, 177(177): 1-9. |
| [12] |
万琪. 凤仙花属植物化学成分及药理活性研究进展[J]. 佛山科学技术学院学报:自然科学版, 2014, 32(6): 75-8. |
| [13] |
Dhariwala MY, Ravikumar P. An overview of herbal alternatives in androgenetic alopecia[J]. J Cosmet Dermatol, 2019, 18(4): 966-75. |
| [14] |
刘涵, 高增平, 石钺. 散沫花, 凤仙花的化学成分及其在化妆品中的应用现状[J]. 中国药业, 2014, 23(1): 90-2. |
| [15] |
Lee SY, Lee DJ, Kwon K, et al. Cornu cervi pantotrichum Pharmacopuncture Solution Facilitate Hair Growth in C57BL/6 Mice[J]. J Pharmacopuncture, 2016, 19(2): 122-8. DOI:10.3831/KPI.2016.19.013 |
| [16] |
Shin HS, Park SY, Song HG, et al. The androgenic alopecia protective effects of forsythiaside-a and the molecular regulation in a mouse model[J]. Phytotherapy Research, 2015, 29(6): 870-6. DOI:10.1002/ptr.5324 |
| [17] |
Piraccini BM. Evaluation of hair loss[J]. Curr Probl Dermatol, 2015, 47(47): 10-20. |
| [18] |
Zhang Y, Xu J, Jing J, et al. Serum levels of Androgen-Associated hormones are correlated with curative effect in androgenic alopecia in young men[J]. Med Sci Monit, 2018, 24(24): 7770-7. |
| [19] |
Martinez-Jacobo L, Villarreal-Villarreal CD, Ortiz-López R, et al. Genetic and molecular aspects of androgenetic alopecia[J]. Indian J Dermatol Venereol Leprol, 2018, 84(3): 263-8. |
| [20] |
English RS. A hypothetical pathogenesis model for androgenic alopecia: clarifying the dihydrotestosterone paradox and ratelimiting recovery factors[J]. Med Hypotheses, 2018, 111(111): 73-81. |
| [21] |
安景印, 吕新翔, 卓纳. 雄激素性脱发的发病机制研究进展[J]. 世界最新医学信息文摘, 2018, 18(68): 52-3. |
| [22] |
Yusuf DM, Padmini R. An overview of herbal alternatives in androgenetic alopecia[J]. J Cosmet Dermatol, 2019, 18(4): 966-75. |
| [23] |
Orasan MS, Roman Ⅱ, Coneac A, et al. Hair loss and regeneration performed on animal models[J]. Clujul Med, 2016, 89(3): 327-34. |
| [24] |
Motofei IG, Rowland DL, Georgescu SR, et al. Finasteride adverse effects in subjects with androgenic alopecia: A possible therapeutic approach according to the lateralization process of the brain[J]. J Dermatoll Treat, 2016, 27(6): 495-7. DOI:10.3109/09546634.2016.1161155 |
| [25] |
Sakunphueak A, Panichayupakaranant P. Comparison of antimicrobial activities of naphthoquinones from impatiens balsamina[J]. Nat Prod Res, 2012, 26(12): 1119-24. DOI:10.1080/14786419.2010.551297 |
| [26] |
米尔班古丽·阿卜杜如苏力. 祖丽皮亚·玉努斯. 新疆凤仙花色素抑菌及抗氧化活性研究[J]. 中国食品添加剂, 2015, 9(9): 100-5. DOI:10.3969/j.issn.1006-2513.2015.09.009 |
| [27] |
Imam MZ, Nahar N, Akter S, et al. Antinociceptive activity of methanol extract of flowers of Impatiens balsamina[J]. J Ethnopharmacol, 2012, 142(3): 804-10. DOI:10.1016/j.jep.2012.06.004 |
| [28] |
Barbareschi M. The use of minoxidil in the treatment of male and female androgenetic alopecia: a story of more than 30 years[J]. G Ital Dermatol Venereol, 2018, 153(1): 102-6. |
| [29] |
杨淑霞, 马圣清, 钟志红, 等. C57BL6小鼠毛发周期动物模型的建立[J]. 中华皮肤科杂志, 1999, 4(4): 34-5. |
| [30] |
Noubarani M, Rostamkhani H, Erfan M, et al. Effect of adiantum capillus veneris Linn on an animal model of testosterone-induced hair loss[J]. Iran J Pharm Res, 2014, 13(suppl): 113-8. |
| [31] |
Sawaya ME. Novel agents for the treatment of alopecia[J]. Semin cutan med surg, 1998, 17(4): 276-83. DOI:10.1016/S1085-5629(98)80024-2 |
 2019, Vol. 39
2019, Vol. 39

