2. 南方医科大学第五附属医院急诊科,广东 广州 510900
2. Department of Emergency Medicine, Fifth Affiliated Hospital of Southern Medical University, Guangzhou 510900, China
心源性猝死(SCD)是指急性症状发作后1或24 h内发现由心脏原因引起的死亡[1]。其直接表现形式多为突发性心脏骤停,最常见的病理生理机制为恶性快速室性心律失常,包括心室颤动与室性心动过速。文献报道心脏骤停记录的初始心律多以心室颤动为主[2]。近年来,根据欧美地区的统计报告[3],2015年在全美范围内成年人的院外心脏骤停(OHCA)发生率约为110.8/ 10万每年。即使经过急诊医疗服务救治,OHCA成人患者的出院生存率仍仅为11.4%。
前人[4-5]通过各种动物实验探索对于心脏骤停更好的救治方式。而符合临床条件的心脏骤停动物模型构建是心脏骤停研究的首要条件。目前,心脏骤停模型以电击方式制备室颤性心脏骤停猪模型进行实验较为常见,前人多采用经脉管系统置入导丝到心脏并通电来制备室颤猪模型[6-8]。该类方法操作难度与对实验室设备要求都较高。此外,有一类体外经皮电刺激诱导(TCEI)的致颤方式也被广泛应用[9-11]。其中Burgert等人阐释了此类造模方法[12]:他们使用干电池与22号脊髓穿刺针,制作诱导室颤的工具,通过脊髓穿刺针置于心脏的上下侧,通过干电池给予电流,从而诱导心室颤动。这种方法较为实用简便与高效。但在实际操作上依然有所局限,还需要进一步实验检验与改进。
我们参考Burgert等人总结的造模方法,并创新地改进各种细节,使用较有中国特色的针灸针与具有品种优势的西藏小型猪,拟构建一种更经济,更简便、更安全及高效的心脏骤停猪模型。同时使用Utstein模式标准对此室颤性心脏骤停猪模型进行心肺复苏(CPR),检验其在临床救治中的实际情况。期望通过本次实验所介绍简便而高效的建模方法,以帮助大家在CPR的基础实验研究方面进一步发展。
1 材料和方法 1.1 研究对象西藏小型猪12只,雌雄不拘,月龄5~6月,体质量25~35 kg,由南方医科大学动物实验中心提供。所有西藏小型猪健康情况符合国家普通动物健康标准。实验中动物操作及伦理福利符合南方医科大学南方医院实验动物中心的动物实验管理规定,及《关于善待实验动物的指导性意见》,并通过动物伦理审批,伦理审批号为:NFYY-2016-89。实验在南方医科大学机能实验室进行。
1.2 实验方法 1.2.1 术前准备全部西藏小型猪在术前禁食12 h,不禁水。麻醉后使用7F气管导管插入猪的气道并固定。在右颈外静脉和右颈总动脉处,分别置入静脉导管和动脉导管,并连接相应的压力测量传感器,以获得中心静脉压(CVP)和主动脉收缩压(SBP)及舒张压(DBP)。通过Pclab-530C生物医学信号采集处理系统收集实验动物不同状态下的血流动力学数据及心律。同时连接心电除颤监护仪,监测其各个状态下心律及其变化。
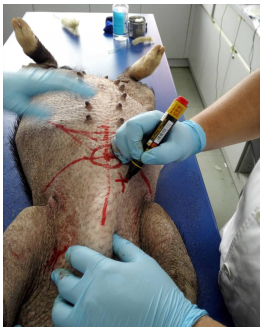
1.2.2 心脏骤停模型制备动物麻醉后标志胸骨右缘第四肋间为针灸针穿刺位(图 1)。当实验动物猪生命体征稳定15 min后,利用经皮电刺激诱导室颤方法制备心脏骤停模型。致颤主要用具:1、3节9V电池;2、带咬钳电线;3、2根针灸针(尺寸:0.3 mm×40.0 mm,1.5寸)。
|
图 1 穿刺点定位标记 Fig.1 Location marker of puncture point. |
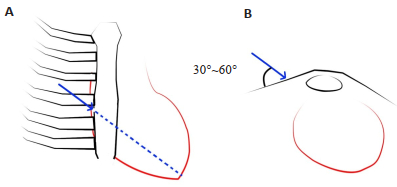
具体诱导室颤方式如下:(1)将1根针灸针(尺寸:0.3 mm×40.0 mm,1.5寸)从已标记的猪胸骨右缘第4肋间隙处进针。在胸部冠状面上的投影里,针灸针的针头指向心尖搏动处。而针身与胸壁平面成30°~60°范围的角度,缓慢插入,深度约为3 cm。针灸针进针角度如图 2;(2)在插入同时,不时作细微角度的来回旋转针柄方便针身插入,同时留意心电图出现的心律改变。当心电节律出现室性早搏改变时,将针灸针向后作0~3 mm调整,当针柄随心脏节律性跳动,而心电图未见持续明显异常心律,则视为右侧针灸针安置完成;(3)另一针灸针插入左侧腋下皮下组织约3 cm,以无损伤重要组织为宜,视为左侧针灸针安置完成;(4)然后将两根带咬钳电线一端分别与两针柄连接,其中右侧针灸针导线的另一端连接串联三节9 V干电池组的负极,注意动作要轻柔,不可改变原针灸针位置与深度;(5)准备通电致颤前,打开计时器,将左侧针灸针导线的另一端持续接触正极,形成回路及直流电刺激。一次电刺激持续时程约为3 s,每次诱导尝试最多可延长至8 s,随即断开电流,观察心律血压及脉搏变化;(6)致颤成功标准为:当尝试通电后,若心电图出现稳定室颤波,且4 min内未能自动转复为窦性心律或室上性心律,则判断为致颤成功;(7)若尝试通电后,心电监护显示心律未出现持续稳定的室颤波,或出现室颤波或其他波形,却在4 min内自动转复为窦性心律或室上性心律,则待动物心律呼吸等基础状态平稳后,再次微调针灸针进针角度及位置再作通电尝试。通电操作最多尝试3次,若仍未能达到致颤成功标准,则判定致颤失败。
|
图 2 针灸针进针角度示意图 Fig.2 Schematic illustration of the puncture angle of the acupuncture needle. A: The direction of the projection of the acupuncture needle points to the cardiac apex on the coronal plane of the chest; B: The acupuncture needle is positioned over the chest wall plane at 30°-60°. |
本实验心脏骤停判定标准[13]如下:(1)心电监护显示心电图波形为心室颤动、无脉性电活动或者心脏停搏;(2)室颤时动脉收缩压下降至60 mmHg以下;(3)血压监测动脉搏动波消失。
本实验致颤操作后,一旦确认符合心脏骤停标准,则进入非干预期。非干预间期时间设置为4 min。
1.2.3 复苏方法心脏骤停4 min后,拔除针灸针,按Utstein模式标准实施常规复苏,即徒手胸外按压+呼吸气囊给氧。按压频率为100~120次/min,按压深度为5~ 6 cm,按压期与放松期时间比例为1:1;简易呼吸气囊通过进气阀连接氧气瓶,气囊前端与猪气管导管相连,以10~12次/min的频率徒手挤压气囊,每次通气量约500 mL。胸外按压2 min后,经耳缘静脉给予第1次肾上腺素1 mg。然后检查脉搏、呼吸和心律,若监测心律为可电击的室颤波,行体外双向波电除颤,初始能量设置从150J开始,逐渐加大,最高为200J。如果未出现自主循环恢复(ROSC),继续行CPR 2 min,然后再次评估猪的自主循环状态。每2 min进行1次评估,每4 min给予1次肾上腺素1 mg,直至实现ROSC,若进行CPR 30 min后仍未实现ROSC,停止复苏,视为复苏失败。
本实验ROSC标准:(1)心电监护显示室上性节律(包括窦性、房性或交界性心律);(2)动脉收缩压>60 mmHg,持续10 min或以上。
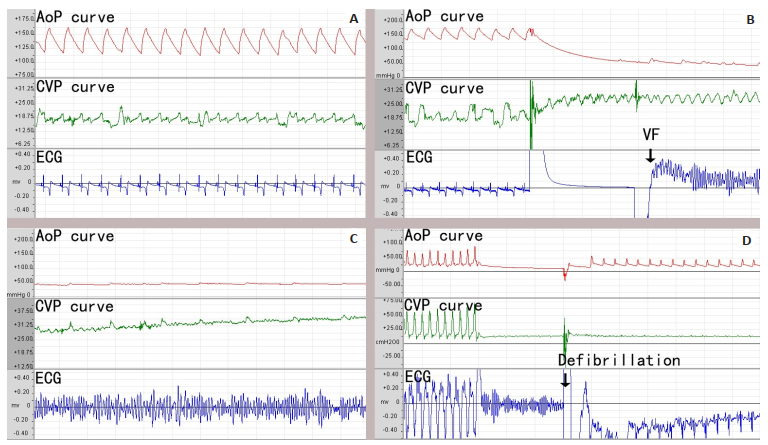
1.2.4 复苏后监护对成功实现ROSC的CA猪于操作台继续予以生命体征和血流动力学监护6 h,期间每隔20 min评估血压、脉搏、心率、呼吸等情况。之后,将猪放置于观察室,记录复苏后生存情况,72 h观察生存情况后处死动物猪。最后对全部实现ROSC的猪进行常规尸检解剖,观察是否存在实验操作所致的胸腹部重要脏器损伤。生物医学信号采集处理系统所示各个阶段变化如图 3。
|
图 3 各个阶段波形变化 Fig.3 ECG and pressure changes at different stages of modeling. A: Baseline; B: Transcutaneous electrical induction; C: Ventricular fibrillation; D: Circulation recovery after resuscitation. AoP curve: Aortic pressure pulse; CVP curve: Central venous pressure pulse. |
使用Pclab-530C生物医学信号采集处理系统收集原始数据,包括SBP、DBP、CVP,计算平均动脉压(MAP)及冠脉灌注压(CPP)。使用IBM SPSS 22.0统计软件进行数据统计,分析其均值及标准差。
2 结果 2.1 造模成功率12只西藏小型猪中,通过经皮电刺激诱导室颤方式,有11只成功致颤,其数据(表 1,2),符合心脏骤停的标准。致颤成功率高达91.67%(11/12)。根据实验时间顺序将成功诱导室颤的西藏小型猪编号为1到11号,并记录实验操作中单次通电时间与尝试次数记录,根据数据计算可知,单次电刺激时间值为3±0 s,尝试次数平均值为1.18±0.39次。
| 表 1 基础状态血流动力学 Tab.1 Baseline hemodynamics of the pigs |
| 表 2 成功致颤后血流动力学 Tab.2 Hemodynamics of the pigs after successfully induction of ventricular fibrillation |
全部成功致颤西藏小型猪经过Utstein模式抢救后,有5只(3、5、6、7、9号)成功达到自主循环恢复,成功率为45.45%(5/11),其血流动力学相关数据被记录(表 3):5只西藏小型猪经CPR后SBP为135.05±20.12 mmHg,均大于60 mmHg,最低值为97.06 mmHg,符合本次实验ROSC标准要求。
| 表 3 自主循环恢复后血流动力学 Tab.3 Heart rate (HR) and hemodynamic parameters after recovery of systemic circulation |
成功复苏的西藏小型猪被送入南方医院动物中心饲养,成功复苏后24及72 h监测其生存情况。其中自主循环恢复后存活时间超过24 h的西藏小型猪有5只(24 h存活率为100%),而其中超过72 h的有4只(72 h存活率为80%)。经72 h观察后,成功复苏的西藏小型猪进行解剖,全部未发现实验操作所致的胸腹部重要脏器的明显损伤。
3 讨论心脏骤停模型有不同的构建方法。冠状动脉闭塞是临床上最接近因缺血性冠心病引起的心源性猝死的造模方法,但需操作人员具备心脏介入技术,同时实验室条件要求也高。而耗时较多,且实验效率较低,成本最高。氯化钾等药物注射方法诱发的心律失常多为心率逐渐下降直至心室停搏的一个过程,而不是心室颤动[14]。窒息性心脏骤停模型主要通过停止氧供造成机体缺氧来构建[15],其最先诱发的是缓慢性心律失常,而之后有一定几率出现室颤。对比室颤性心脏骤停的病理生理学上改变不同,窒息性心脏骤停可带来严重的高碳酸血症及呼吸性酸中毒[16],在代谢功能上也表现出比一般心律失常性心脏骤停更差的结果[17]。钝性创伤主要是通过向心前区做钝性撞击而产生心电生理紊乱,从而诱发室颤的一种方法,但仅仅在模拟心脏震荡损伤机制中应用[18]。而用不同形状及大小的撞击物钝击心脏诱导心脏震荡的成功率也不一致[19]。失血性心脏骤停模型主要以放血方式来降低其血容量,以达到失血性休克状态后出现无脉性电活动(PEA),从而认为达到心脏骤停情况[20]。该模型构建比较依赖PEA的判断,主观性较高。同时这种模型复苏重点更多着重在血容量的恢复,而不是传统的心肺复苏应用。电刺激建模方法中,电流参数相对容易准确调控,该方式诱发的室颤模型最为常见。
在电刺激诱发室颤的建模方式中,大部分是需静脉置管以放置电极导线至心脏,然后通过在脉管系统的电极导线传导电刺激以致颤。前人王彤所构建的电刺激室颤猪模型比较有代表性[21],他的模型是通过左颈内静脉置管,然后放置电极导丝18~22 cm,然后通过调节除颤仪电压到30 V,通过除颤仪连接电极导丝传导电刺激诱导室颤。而本实验建模方式与之有以下较大区别:(1)无需通过脉管系统置管放置导丝;本实验的所有置管皆为监测血流动力学所用,无需放置电极导丝传导电刺激,其减少对脉管系统的实验操作及对动物的伤害;(2)无需用除颤仪等外在仪器提供电刺激;本实验建模利用针灸针及三节9 V干电池所提供的电刺激便可诱导室颤。与王彤的建模方法相比更为简便可行。
本模型使用的实验用西藏小型猪是南方医科大学顾为望教授课题组于2004年从西藏林芝地区引进广州地区,进行驯化及实验动物化培育,2006年获得广东省科技厅颁发的首张实验用小型猪合格证。经几年选育,广州地区饲养的西藏小型猪依旧保存着原产地所具有的理化特性,其中与人类血液生理生化指标尤为相近[22]。前人Burgert的经皮电刺激诱导室颤猪模型实验中,使用的是约克夏猪。研究表明,相对约克夏猪,西藏小型猪在基因稳定性上有优势[23]。
我们建模使用中国传统医学中常见的针灸针。其针头因口径小而锋利,针身富有弹性。与Burgert所用的脊髓穿刺针相比,针灸针有以下优点:(1)穿刺中减少对组织的伤害:因为其比脊髓穿刺针较小的口径,使得在穿刺过程中减少对组织的破坏;(2)便于提示所至部位:针灸针的针身较为柔软,当针尖触及心脏心外膜时,心电监护可以观察到因刺激而引起一过性早搏。同时针柄会受心脏的搏动而规律颤动;(3)更经济:价格比脊髓穿刺针更低。
针灸针穿刺两个地方:(1)胸骨右缘第四肋间隙;(2)左侧腋下。在胸骨右缘的进针点,靠近猪的心脏的右心室处。此电极刺激点与Burgert的方法相比,尖针与心室其距离更近。同时,在左侧腋下的穿刺点避开了膈肌等组织。根据前人的研究[24-26]得知,猪的Purkinje细胞的分布是透壁性的,与人类和犬类不一样,多数分布在心内膜上。所以针灸针只需穿刺到心外膜处,所传导的电刺激便能诱导心室颤动从而导致心脏骤停。
我们实验组探索性尝试所用致颤的通电时间的最低下限,发现许多于3 s之后便可成功进入室颤状态,远远短于非电刺激方法例如窒息所致室颤模型的6~10 min[17, 27-31],与Burgert的方法致颤所需通电时间10 s相近[12]。
本方式造模成功率高达91.67%(11/12),与参考方法的电刺激模型成功率93%(28/30)相接近[12]。而其中成功模型中,经规范抢救处理心脏骤停猪模型的自主循环恢复成功率为45.45%(5/11),与同类经皮电刺激诱导的室颤性心脏骤停模型的ROSC率44.44%(8/18)及57.14%(4/7)相近[9, 13]。
尽管本实验造模方法具有上述优点,但此种方法也有以下不足:(1)无法完全呈现临床病理机制。有临床研究报道证实[32],相较于冠状动脉阻塞致颤法,通过电刺激方式致颤的动物更容易恢复其自主循环。而另一项荟萃分析表示,通过电刺激诱发室颤的动物模型比缺血性致颤的动物模型除颤成功概率更大[33]。而且,TCEI与经静脉系统电刺激致颤模型的自主循环恢复率也有一定差距[7, 32, 34];(2)实验具体操作欠缺更精确数据。例如针灸针尖具体到达的地方,仅通过针尖触碰心外膜而传动的搏动来判断深浅位置,所深入尺寸并无法精确。还需要超声等设备的多次监测,以得到更足够有力的数据。
综上所述,在西藏小型猪上利用针灸针与电池可以成功高效地构建出相对稳定的心脏骤停猪模型,具有经济、安全、简便及高效的优势。但因为缺少更有力而完美的证据,依然有所局限。作为研究人员,在进行心肺复苏实验等研究需要室颤模型时,这个方法是个不错的选择,仍需根据研究设计权衡利弊并进行舍取。
| [1] |
Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American college of cardiology/American heart association task force on clinical practice guidelines and the heart rhythm society[J]. Heart Rhythm, 2018, 15(10): e190-252. DOI:10.1016/j.hrthm.2017.10.035 |
| [2] |
Dagres N, Hindricks G. Sudden cardiac death in acute coronary syndromes[J]. Card Electrophysiol Clin, 2017, 9(4): 725-30. DOI:10.1016/j.ccep.2017.08.009 |
| [3] |
Benjamin EJ, Blaha MJ, Chiuve SE, et al. Heart disease and stroke statistics-2017 update: a report from the American heart association[J]. Circulation, 2017, 135(10): e146-603. |
| [4] |
Yang Z, Tang D, Wu X, et al. A tourniquet assisted cardiopulmonary resuscitation augments myocardial perfusion in a porcine model of cardiac arrest[J]. Resuscitation, 2015, 86: 49-53. DOI:10.1016/j.resuscitation.2014.10.009 |
| [5] |
文才, 李恒, 翟小竹, 等. 长时程电诱发心室纤颤致心搏骤停与心肺复苏家猪模型的建立[J]. 中华危重病急救医学, 2017, 29(6): 536-41. DOI:10.3760/cma.j.issn.2095-4352.2017.06.012 |
| [6] |
Skulec R, Truhlar A, Turek Z, et al. Comparison of cold crystalloid and colloid infusions for induction of therapeutic hypothermia in a porcine model of cardiac arrest[J]. Crit Care, 2013, 17(5): R242. DOI:10.1186/cc13068 |
| [7] |
Xu T, Tang W, Ristagno G, et al. Myocardial performance index following electrically induced or ischemically induced cardiac arrest[J]. Resuscitation, 2008, 76(1): 103-7. DOI:10.1016/j.resuscitation.2007.06.004 |
| [8] |
Wang J, Weil MH, Tang W, et al. A comparison of electrically induced cardiac arrest with cardiac arrest produced by coronary occlusion[J]. Resuscitation, 2007, 72(3): 477-83. DOI:10.1016/j.resuscitation.2006.06.041 |
| [9] |
White NJ, Leong BS, Brueckner J, et al. Coagulopathy during cardiac arrest and resuscitation in a swine model of electrically induced ventricular fibrillation[J]. Resuscitation, 2011, 82(7): 925-31. DOI:10.1016/j.resuscitation.2011.02.034 |
| [10] |
Schwarz B, Mair P, Wagner-Berger H, et al. Neither vasopressin nor amiodarone improve CPR outcome in an animal model of hypothermic cardiac arrest[J]. Acta Anaesthesiol Scand, 2003, 47(9): 1114-8. DOI:10.1034/j.1399-6576.2003.00214.x |
| [11] |
Wenzel V, Lindner KH, Krismer AC, et al. Repeated administration of vasopressin but not epinephrine maintains coronary perfusion pressure after early and late administration during prolonged cardiopulmonary resuscitation in pigs[J]. Circulation, 1999, 99(10): 1379-84. DOI:10.1161/01.CIR.99.10.1379 |
| [12] |
Burgert JM, Johnson AD, Garcia-Blanco JC, et al. An effective and reproducible model of ventricular fibrillation in crossbred Yorkshire swine (susscrofa) for use in physiologic research[J]. Comp Med, 2015, 65(5): 444-7. |
| [13] |
Wong MR, Reggio MJ, Morocho FR, et al. Effects of intraosseous epinephrine in a cardiac arrest swine model[J]. J Surg Res, 2016, 201(2): 327-33. |
| [14] |
Burgert J, Gegel B, Loughren M, et al. Comparison of tibial intraosseous, sternal intraosseous, and intravenous routes of administration on pharmacokinetics of epinephrine during cardiac arrest: a pilot study[J]. AANA J, 2012, 80(4 Suppl): S6-S10. |
| [15] |
Pantazopoulos IN, Xanthos TT, Vlachos I, et al. Use of the impedance threshold device improves survival rate and neurological outcome in a swine model of asphyxial cardiac arrest*[J]. Crit Care Med, 2012, 40(3): 861-8. DOI:10.1097/CCM.0b013e318232d8de |
| [16] |
Grmec S, Lah K, Tusek- Bunc K. Difference in end- tidal CO2 between asphyxia cardiac arrest and ventricular fibrillation/ pulseless ventricular tachycardia cardiac arrest in the prehospital setting[J]. Crit Care, 2003, 7(6): R139-44. DOI:10.1186/cc2369 |
| [17] |
Varvarousis D, Xanthos T, Ferino G, et al. Metabolomics profiling reveals different patterns in an animal model of asphyxial and dysrhythmic cardiac arrest[J]. Sci Rep, 2017, 7(1): 16575. DOI:10.1038/s41598-017-16857-6 |
| [18] |
Link MS, Wang PJ, Pandian NG, et al. An experimental model of sudden death due to low-energy chest-wall impact (commotiocordis)[J]. N Engl J Med, 1998, 338(25): 1805-11. DOI:10.1056/NEJM199806183382504 |
| [19] |
Kalin J, Madias C, Alsheikh-Ali AA, et al. Reduced diameter spheres increases the risk of chest blow-induced ventricular fibrillation (commotiocordis)[J]. Heart Rhythm, 2011, 8(10): 1578-81. DOI:10.1016/j.hrthm.2011.05.009 |
| [20] |
张旻海, 郑汝钢, 菅洪健, 等. 失血性心脏骤停兔模型的构建[J]. 广东医学, 2017(8): 1150-4. DOI:10.3969/j.issn.1001-9448.2017.08.003 |
| [21] |
王彤, 吴海东, 符岳, 等. 电刺激诱发猪心室颤动模型的研究和改进[J]. 岭南急诊医学杂志, 2006(2): 83-5. DOI:10.3969/j.issn.1671-301X.2006.02.002 |
| [22] |
顾为望, 曾昭智, 刘运忠, 等. F1代西藏小型猪早期生长发育特点[J]. 中国实验动物学报, 2006(4): 307-10. DOI:10.3969/j.issn.1005-4847.2006.04.016 |
| [23] |
Ban DM, Zhang B, Wang ZX, et al. Differential gene expression of epigenetic modifying enzymes between Tibet pig and Yorkshire in high and low altitudes[J]. Genet Mol Res, 2015, 14(2): 3274-80. DOI:10.4238/2015.April.13.6 |
| [24] |
Holland RP, Brooks H. . An experimental analysis in the porcine heart[J]. J Clin Invest, 1976, 57(3): 541-50. DOI:10.1172/JCI108309 |
| [25] |
Cheng KA, Dosdall DJ, Li L, et al. Evolution of activation patterns during long-duration ventricular fibrillation in pigs[J]. Am J Physiol Heart Circ Physiol, 2012, 302(4): H992-H1002. DOI:10.1152/ajpheart.00419.2011 |
| [26] |
Sedmera D, Gourdie RG. Why do we have Purkinje fibers deep in our heart?[J]. Physiol Res, 2014, 63(Suppl 1): S9-S18. |
| [27] |
Lopez J, Fernandez SN, Gonzalez R, et al. Comparison between manual and mechanical chest compressions during resuscitation in a pediatric animal model of asphyxial cardiac arrest[J]. PLoS One, 2017, 12(11): e188846. |
| [28] |
Hickey RW, Ferimer H, Alexander HL, et al. Delayed, spontaneous hypothermia reduces neuronal damage after asphyxialcardiac arrest in rats[J]. Crit Care Med, 2000, 28(10): 3511-6. DOI:10.1097/00003246-200010000-00027 |
| [29] |
Fink EL, Alexander H, Marco CD, et al. Experimental model of pediatric asphyxial cardiopulmonary arrest in rats[J]. Pediatr Crit Care Med, 2004, 5(2): 139-44. |
| [30] |
Katz L, Ebmeyer U, Safar P, et al. Outcome model of asphyxial cardiac arrest in rats[J]. J Cereb Blood Flow Metab, 1995, 15(6): 1032-9. DOI:10.1038/jcbfm.1995.129 |
| [31] |
Hickey RW, Akino M, Strausbaugh S, et al. Use of the morris water maze and acoustic startle chamber to evaluate neurologic injury after asphyxial arrest in rats[J]. Pediatr Res, 1996, 39(1): 77-84. DOI:10.1203/00006450-199601000-00011 |
| [32] |
Niemann JT, Rosborough JP, Youngquist S, et al. Is all ventricular fibrillation the same?A comparison of ischemically induced with electrically induced ventricular fibrillation in a porcine cardiac arrest and resuscitation model[J]. Crit Care Med, 2007, 35(5): 1356-61. DOI:10.1097/01.CCM.0000261882.47616.7D |
| [33] |
Kroll MW, Fish RM, Calkins H, et al. Defibrillation success rates for electrically-induced fibrillation: hair of the dog[J]. Conf Proc IEEE Eng Med Biol Soc, 2012, 689-93. |
| [34] |
Zhao H, Li CS, Gong P, et al. Molecular mechanisms of therapeutic hypothermia on neurological function in a swine model of cardiopulmonary resuscitation[J]. Resuscitation, 2012, 83(7): 913-20. DOI:10.1016/j.resuscitation.2012.01.001 |
 2019, Vol. 39
2019, Vol. 39

