2. 南方医科大学器官衰竭防治国家重点实验室,广东 广州 510515;
3. 南方医科大学病理生理学教研室//广东省医学休克微循环重点实验室,广东 广州 510515
2. State Key Laboratory of Organ Failure Research, Southern Medical University, Guangzhou 510515, China;
3. Department of Pathophysiology, Guangdong Provincial Key Laboratory for Shock and Microcirculation Research, Southern Medical University, Guangzhou 510515, China
心血管疾病死亡占据我国城乡居民死亡原因首位[1],而动脉粥样硬化(As)是众多心血管疾病的病理学基础,对As发病机制开展研究,意义深远。目前As发病机制主要涉及高脂学说、内皮损伤应答学说、慢性炎症和平滑肌迁移等学说[2]。以As为代表的众多心血管系统病理学改变,仅仅是代谢综合征(MS)终末表现的冰山一角,而胰岛素抵抗、血脂血糖异常、血压升高等病因才是潜伏于水面以下的巨大冰体[3-4]。特别是近年来,糖尿病/糖耐量异常与As形成的密切关系,已经得到多项临床研究的证实[4-5],降糖药二甲双胍降低糖尿病患者心血管病事件的报道[6-7],更是引发了各个领域学者的关注。但目前为止,Met抑制As形成的机制尚不完全明确。
二甲双胍除了降血糖之外,还有其他重要的生物活性[8]。目前关注较多的是二甲双胍与腺苷酸激活蛋白激酶(AMPK)的关系。在口服剂量下,Met可使AMPK活性增强[8]。AMPK是真核细胞中广泛存在的丝氨酸/苏氨酸蛋白激酶,处于激活态的AMPK发挥多种生物学效应[9],在疾病状态下(如心肌缺血、动脉粥样硬化)其活性较正常生理状态下明显增强,进而加速分解代谢、抑制合成代谢,以降低能量消耗[10]。关于AMPK调控As的研究主要着眼于两方面:从物质代谢角度看,AMPK在As发生过程中对脂质代谢[11]和炎症反应[12]影响重大,MS患者的AMPK活性和表达水平低下,加重As生成[13];从AMPK作用对象来看,它对As各阶段靶细胞的生物学行为起到调控作用,AMPK不仅调控血管内皮细胞的通透性[14],更重要的是,它影响平滑肌细胞的增殖及迁移[15-16],对细胞的迁移运动起着抑制作用。我们的前期研究发现AMPK信号通路的过度激活能够抑制细胞的迁移,因此,本研究假设Met可能通过激活AMPK来抑制血管平滑肌细胞的迁移,进而调控As的形成。
细胞迁移是一个以动态极化,片状伪足形成,前进端胞膜突出等一系列变化为特征的分子生物学过程[17]。细胞骨架是迁移运动的关键结构基础,骨架系统主要分为以肌动蛋白(actin)为亚基的肌动蛋白纤维系统[18]和以微管蛋白(tubulin)为亚基的微管系统[19],两套系统作用不同,前者对单向迁移如异位爬行起关键作用,后者对逆向迁移如有丝分裂起重要作用。二甲双胍对细胞迁移是否起抑制作用,它的作用靶系统是以actin体系为主还是tubulin体系为主,尚未见文献报道。
本研究通过观察小鼠主动脉平滑肌细胞系(MOVAS)对Met刺激的反应及其骨架系统的变化,来解析Met对细胞迁移的作用机制。另外,给予ApoE-/-小鼠注射链脲佐菌素(STZ)造成慢性糖尿病,结合高脂喂养,最终形成As模型,同时具备MS的特点[20]。观察Met治疗对小鼠远期斑块形成的影响,进而为动脉粥样硬化性心脏病治疗提供可能的新方案。
1 材料和方法 1.1 实验动物C57BL/6J遗传背景的ApoE-/-小鼠(B6.129P2- ApoEtm1/Nju)购自广州中医药大学实验动物中心,雄性,清洁级,8周龄,体质量22±2 g,合格证号:[SCXK(粤)2018-0034]。
1.2 试剂及仪器小鼠主动脉血管平滑肌细胞系(MOVAS,ATCC®CRL-2797TM),转染试剂Lipofectamine 2000(Invitrogen),盐酸二甲双胍、Compound C(APExBIO),链脲佐菌素(北京索莱宝);AMPKα抗体、磷酸化AMPKα抗体(苏氨酸172位)、ACC抗体、磷酸化ACC抗体(丝氨酸79位)、CLIP-170抗体、α-SMA、Paxilin抗体均购于Cell Signaling Technology,GAPDH抗体(Millipore),GFP抗体(MBL),α-tubulin抗体(SigmaAldrich);二抗购于Cell Signaling Technology;磷酸化CLIP-170抗体、磷酸化Pdlim5抗体、EGFP-CLIP170质粒、EGFP-Pdlim5质粒由Takashima(Medical School of Osaka University)团队赠送。
1.3 代谢综合征小鼠疾病模型制备及病理取材购入30只ApoE-/-小鼠,普通饲料喂养下,连续5 d腹腔注射链脲佐菌素50 mg/kg,于注射后2周使用血糖仪检测血糖,血糖>300 mg/dl的小鼠被确认为患有糖尿病[21],最终入选22只动物。将22只入选动物随机分为Control组(n=10)和Met组(n=12)。Met组行二甲双胍(300 mg·kg-1·d-1)灌胃干预[21],Control组给予同体积生理盐水灌胃。全部22只小鼠在分组后均予以高脂高胆固醇饲料(蔗糖20%,猪油15%,胆固醇1.2%,胆酸钠0.2%,酪蛋白10%,磷酸氢钙0.6%,石粉0.4%,预混料0.4%,基础饲料52.2%)高脂饮食组(HFD),喂养8周。过量麻醉法处死小鼠,快速分离心脏,在与主动脉根部平行大约1/3个心脏的位置离断出主动脉根部,OCT包埋,冰冻切片机切取10 μm左右的切片,显微镜下见3个瓣膜则留取切片进行α-SMA免疫组织化学染色,部分动物保留整条大动脉行油红O染色。
1.4 细胞培养和质粒转染MOVAS用含10%血清的DMEM培养,置于37 ℃,5% CO2恒温培养箱中,分离细胞至六孔板,8 h后细胞完全贴壁。以Lipofectamine 2000 DNA转染试剂和1 μg具有绿色荧光EGFP的CLIP170质粒或Pdlim5质粒(EGFP-CLIP170/EGFP-Pdlim5)于两个EP管中,按说明书要求混匀及静置后,将混合物加入MOVAS培养皿中,对照组用空载质粒进行转染,8 h后换为普通细胞培养液。之后,分别用Met(1 mmol/L)和Compound C(20 μm,AMPK抑制剂)刺激转染了EGFP-CLIP170或EGFP-Pdlim5质粒或空载质粒的细胞,化合物刺激时间依据文献及预实验摸索,选为2 h。
1.5 MOVAS的划痕实验将MOVAS以5×106 cm-2的密度接种在35 mm细胞培养皿上[18]。接种8 h后,用200 μL的枪头划出一道痕,更换培养基后,向不同的培养皿中分别加入0.5 mmol/L、1 mmol/L Met,设立PBS对照组。通过Zeiss倒置显微成像系统记录8 h内划痕损伤处细胞的迁移情况。
1.6 免疫荧光系统观察细胞骨架变化情况通过免疫荧光成像观察细胞骨架共定位蛋白的变化情况。将MOVAS接种在胶原包被的35 mm细胞培养皿上。待细胞牢固地附着在培养皿上,经洗涤及固定后,在室温下将细胞用0.1% Triton X-100孵育5 min,1% BSA在4 ℃下封闭过夜。12 h后,用一抗(在1% BSA中1:1000,1 h)对样品进行免疫染色。使用种属相匹配的Alexa Fluor 488或Alexa Fluor 568标记的二抗(在1% BSA中1:1000,30 min)。成像之前,将样品与Alexa Fluor 647-缀合的鬼笔环肽在CGS-Sol A中孵育1 h。使用配备冷却电荷耦合装置CoolSNAP-HQ相机(Roper Scientific,Tucson,AZ,USA)记录EGFP,Alexa Fluor 488,Alexa Fluor 546的荧光图像;使用PLAPO× 60的Olympus FV1000-D共聚焦激光扫描显微镜(Olympus Corporation)记录Alexa Fluor 568和Alexa Fluor 647的荧光图像。使用MetaMorph7.1.3.0 software测量黏附斑面积及微管彗星样尾端长度。
1.7 统计学分析使用SPSS 19.0统计学软件进行统计学分析,使用两样本t检验进行组间比较,箱线图表示整体数据,其他图形数据用均数±标准误表示,P < 0.05被认为差异有统计学意义。图片的采集和处理使用Graph Pad Prism5.0、Image Pro Plus6.0及MetaMorph7.1.3.0软件。
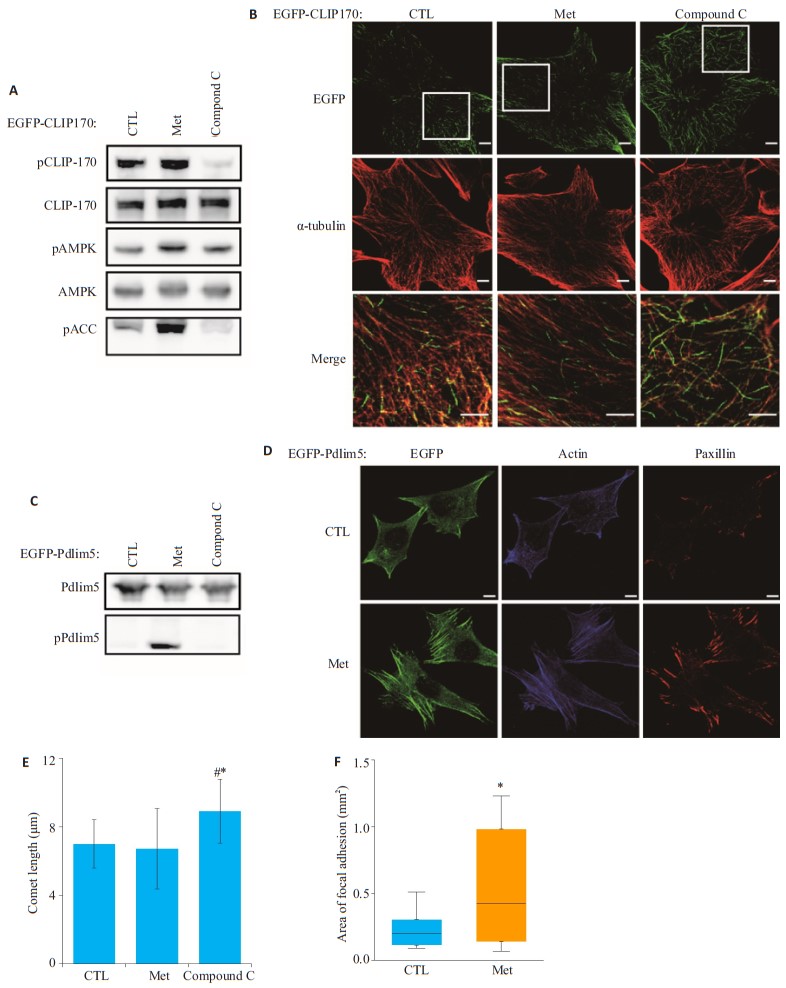
2 结果 2.1 二甲双胍作用于平滑肌细胞的肌动蛋白骨架系统,而非微管骨架系统Met是AMPK的激活剂,而Compound C是AMPK的抑制剂。ACC、CLIP-170、Pdlim5均是AMPK的磷酸化底物[8, 18-19]。将EGFP-CLIP170/EGFP-Pdlim5质粒转染进MOVAS中,与Control组和Compound C组比较,Met刺激MOVAS后pAMPK、pCLIP-170、pPdlim5表达水平明显增加(图 1A、C)。加入Compound C刺激的MOVAS细胞,pCLIP-170、pPdlim5表达水平明显下降(图 1A、C)。
|
图 1 二甲双胍和Compound C刺激后对小鼠平滑肌细胞骨架系统的影响 Fig.1 Effects of metformin and compound C on mouse smooth muscle cytoskeletal system. A: Expressions of pCLIP-170, CLIP-170, pAMPK, AMPK, and pACC detected by Western blotting; B: Changes of microtubule skeleton in the cells in response to metformin or Compound C stimulation; C: Expressions of Pdlim5 and pPdlim5 detected by Western blotting in the cells after metformin or Compound C stimulation; D: Changes of actin skeleton in the cells stimulated by metformin; E: Quantitative analysis of the length of the microtube comet in Fig B (*P < 0.05 vs Control, #P < 0.05 vs Met); F: Quantitative analysis of the area of focal adhesion in Fig D[*P < 0.05 vs Control]. Bar=10 μm |
加入Compound C刺激转染了EGFP-CLIP170质粒的MOVAS,免疫荧光可见微管尾端的EGFP绿色荧光明显延长(图 1B,Compound C组),细胞微管系统的构象受到了影响。而加入Met刺激MOVAS并未引起微管尾端EGFP信号明显改变(图 1B,Met组),Met组细胞的微管形态和长度与Control组无明显差异(图 1E)。
我们将注意力转移到细胞的另一个骨架系统肌动蛋白纤维系统,Pdlim5共定位于细胞肌动蛋白actin上[18],加入Met刺激转染了EGFP-Pdlim5质粒的MOVAS,免疫荧光可见应力纤维上的EGFP绿色荧光明显增强,形状变得粗大,细胞介板的爬行基础结构受到破坏(图 1D,Actin及EGFP染色),Paxilin共定位的黏附斑增多(图 1D、F,Paxilin染色),细胞肌动蛋白actin骨架系统的构象受到了影响。
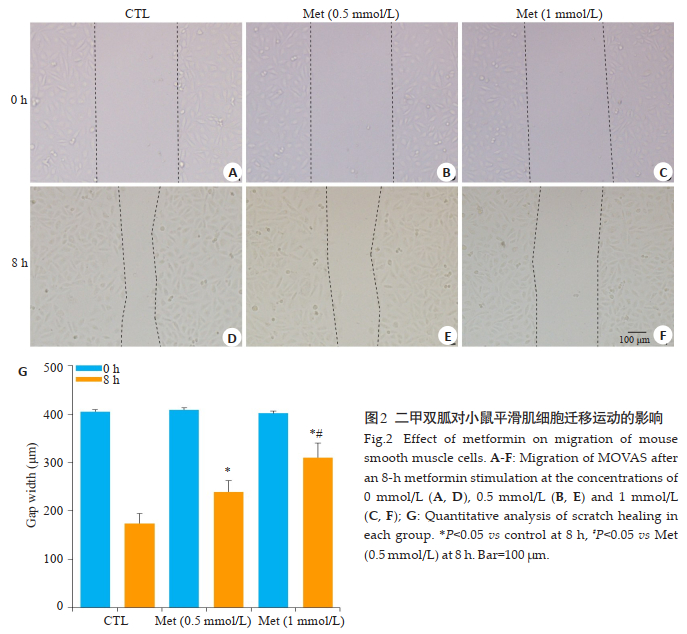
2.2 二甲双胍抑制MOVAS迁移运动为了确认Met是否会影响细胞的迁移运动,我们用200 μL枪头在接种有MOVAS的皿中划出一道痕迹,使用Met分浓度梯度0、0.5、1 mmol/L刺激MOVAS 8 h,观察划痕的愈合。与0 mmol/L(图 2D)的相比较,1 mmol/L(图 2F)、0.5 mmol/L(图 2E)刺激的MOVAS划痕愈合明显减慢,同时,1 mmol/L与0.5 mmol/L两组之间也存在统计学差异(P < 0.05,图 2G)。
|
图 2 二甲双胍对小鼠平滑肌细胞迁移运动的影响 Fig.2 Effect of metformin on migration of mouse smooth muscle cells. A-F: Migration of MOVAS after an 8-h metformin stimulation at the concentrations of 0 mmol/L (A, D), 0.5 mmol/L (B, E) and 1 mmol/L (C, F); G: Quantitative analysis of scratch healing in each group. *P < 0.05 vs control at 8 h, #P < 0.05 vs Met (0.5 mmol/L) at 8 h. Bar=100 μm |
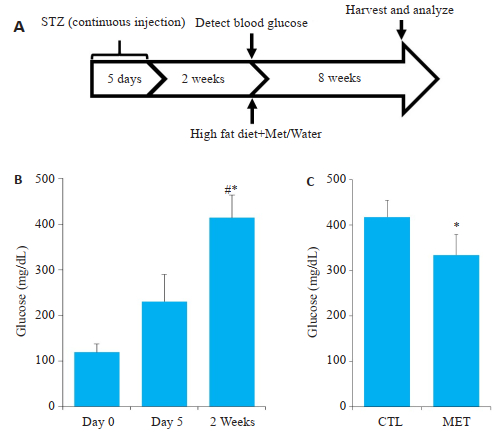
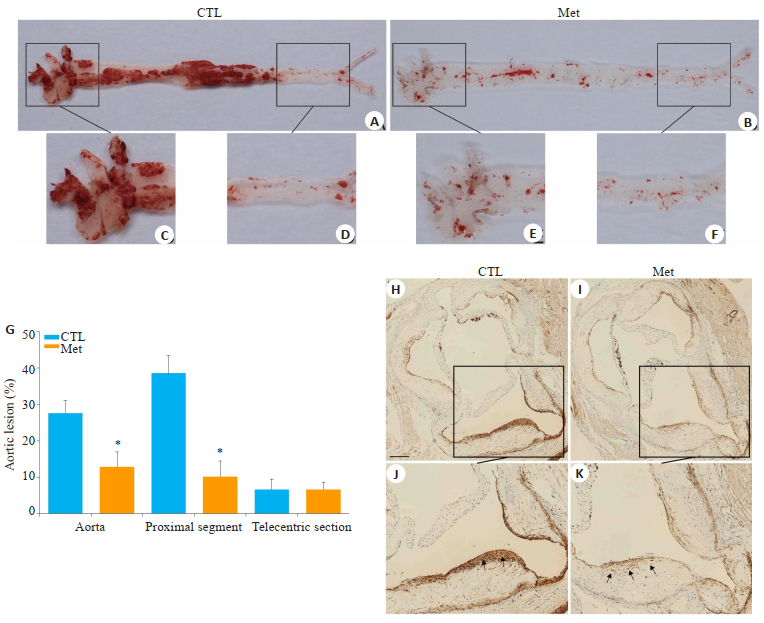
图 3A为构建AS模型的流程图,连续5天腹腔注射STZ后,小鼠血糖均升高,2周后血糖达糖尿病要求值,给予Met治疗8周后,Met治疗组较Control组小鼠血糖明显下降(图 3B)。图 4显示,与Control组对比,Met组油红O沉积明显减少,且仅分布在血管内流速较大的分叉处或瓣膜根部,动脉主干上沉积不明显(图 4B、E);而Control组大量油红O沉积在大动脉的瓣膜口、血管分叉处、以及动脉主干近心端(图 4A、C)。两组动物大动脉远心端脂质沉积均较低(图 4D、F)。α-SMA为平滑肌细胞marker蛋白。生理情况下血管平滑肌细胞主要分布在动脉中膜,图 4显示Control组动物在造模8周后,α-SMA染色信号散在分布于动脉中膜、内膜及形成的斑块内(图 4H、I)。而Met组与Control组比较,脂质斑块面积较少,α-SMA染色信号主要集中于动脉中层(图 4J、K)。
|
图 3 MS/As小鼠模型构建的流程图及模型血糖变化情况 Fig.3 FFlow chart of MS/As mouse model construction and blood glucose changes. A: Flow chart of MS/As mouse model construction; B: Blood glucose of the mice on days 0 and 5 and at 2 weeks after STZ injection, *P < 0.05 vs Day 0, #P < 0.05 vs Day 5; C: Blood glucose in the mice after metformin or saline treatment for 8 weeks. *P < 0.05 vs control. |
|
图 4 小鼠主动脉的脂质沉积及主动脉根部α-SMA的表达情况 Fig.4 Lipid deposition in mouse aorta and expression of α- SMA in the aortic root. A-F: Lipid deposition in control and metformin groups (Oil red O staining). A and D show the full length of the aorta, and B and E show the proximal aortic branches; D and F show the distal part of the aorta; G: Quantitative analysis of lipid staining in the inner wall of the control and metformin groups (*P < 0.05 vs control); H-K: Expression of α-SMA in different groups; J and K are the selected special areas in H and I, respectively. The arrows show migrating smooth muscle cells. Bar=100 μm. |
自20世纪90年代,英国的大规模前瞻性糖尿病临床试验肯定了二甲双胍在减少2型糖尿病患者恶性心血管事件发生率方面的价值[6]。2004年,美国研究人员证实经二甲双胍控制血糖的2型糖尿病患者,较之对照组,能显著降低冠心病引发的心源性猝死[20]。之前关于二甲双胍的研究,只观察到它对肌钙蛋白骨架系统的影响,但并未排除微管系统受影响的可能性。因为有大量的研究证实,Met不仅抑制细胞的定向迁移,还抑制细胞的增殖[22],而微管系统是对细胞的分裂增殖(逆向迁移)起重要作用[23],因此有必要详细检测二甲双胍是否同样影响了微管蛋白的活性和表达。
我们在实验中观察到二甲双胍刺激MOVAS后,pAMPK、pCLIP-170、pACC、pPdlim5表达明显增加;加入Compound C(一种AMPK的抑制剂)后,以上磷酸化酶和底物表达明显下降,这与之前的研究观是一致的[19]。我们继续用显微成像系统观察细胞骨架系统的变化:以EGFP-CLIP170作为微管系统的marker蛋白[19],以EGFP-Pdlim5作为actin系统的marker蛋白[18]。加入Compound C刺激MOVAS,可见EGFP-CLIP170定位的微管尖端延长,这为微管表型变化提供了一个阳性对照;之后加入二甲双胍刺激MOVAS,EGFPCLIP170标记的微管系统并没有明显变化,这说明二甲双胍对tubulin微管系统不起作用。之后,在加入二甲双胍刺激MOVAS时,pPdlim5表达增加,Pdlim5通过α-actinin与actin相连接,是actin骨架系统的重要连接蛋白,二甲双胍作用下,actin骨架系统表现为应力纤维增多,黏附斑增强,细胞的爬行能力下降,这正和我们先前所报导的一致[18]。经过以上观察,本研究首创性明确了一个重要科学问题:二甲双胍对肌钙蛋白骨架系统起作用,但对微管系统并不起作用,虽然很多研究观察到的Met抑制细胞增殖[22, 24-25],但本文的发现直接否定了它改变微管系统这一结构性假设,具体的机制有待于进一步探索和证实。
本文观察到二甲双胍作为一种AMPK的激活剂激活了Pdlim5,扩增激活态的AMPK对细胞迁移的抑制作用是通过磷酸化底物蛋白Pdlim5发挥作用的。值得注意的是,只有在使用二甲双胍这类特异性激活剂的情况下,细胞内的AMPK才会成倍的扩增激活,也只有在超高活性的AMPK作用下,其相对惰性的底物Pdlim5才会被磷酸化,生理浓度的pAMPK是无法磷酸化Pdlim5的,这一点是Pdlim5有别于其他底物的特性之一[18]。也正基于此,它可以作为解释临床糖尿病患者服用二甲双胍后远期心血管冠脉事件降低的可能机制之一。本文并未对AMPK-Pdlim5的下游通路做进一步解析,但据文献报道,Pdlim5的磷酸化,破坏了其与细胞周边的Arhgef6的结合并抑制细胞前缘Rac1的活性,抑制Rac1活性使Arp2/3复合物从细胞前缘脱离,干扰片状伪足的形成[18]。
动脉粥样硬化的形成过程中有多种细胞参与其中[26],其中最主要的是平滑肌细胞,它主要位于动脉的中膜。有研究发现,AS病变中大量的血管平滑肌细胞迁徙到内膜中,迁移到内膜的平滑肌细胞具有明显的促动脉粥样硬化作用[26-28],至于平滑肌细胞迁移行为是如何受到调控的尚不明确。本研究发现,体外使用梯度二甲双胍刺激平滑肌细胞,浓度1 mmol/L可以明显抑制平滑肌细胞的迁移,动物实验也发现,Met喂养的小鼠在8周末主动脉内膜面脂质沉积明显减少,而Control组小鼠主动脉内有更大量的脂质沉积,对照早前我们发表的论文,本研究首先利用动物建立了MS模型,在这样一个兼具血脂异常和血糖异常的模型上给与动物二甲双胍治疗干预,更加符合临床实际情况,也更加直接的观察了二甲双胍对MS小鼠动脉粥样硬化形成的影响。另外,α-SMA是平滑肌细胞表面的特异性marker分子,针对管腔内斑块处α-SMA免疫组化染色显示,Met组动物平滑肌细胞多数位于动脉中膜,而Control组斑块内平滑肌细胞迁移于斑块表面附近,范围包括中膜及部分内膜,这是之前多数关于二甲双胍抑制斑块形成的研究忽视的问题[21, 29]。再生医学领域最新观点认为,平滑肌细胞的迁移运动与其向间充质细胞的转换及斑块稳定性相关,迁移的平滑肌细胞往往是斑块不稳定因素的元凶之一[28],这部分迁移细胞,可能通过向间充质干细胞的转换,最终变成抵抗切应力较弱的纤维细胞,也可能直接吸附脂质成为泡沫细胞,从而成为不稳定斑块的重要成分[30]。二甲双胍抑制了平滑肌细胞的迁移,某种程度上可以降低斑块不稳定性,从而达到减少远期心血管事件的作用。
综上所述,二甲双胍通过调控actin骨架系统,而非tubulin骨架系统,抑制小鼠平滑肌细胞的迁移运动,从而降低代谢综合征小鼠动脉粥样硬化的形成。
| [1] |
Wang W, Hu SS, Kong LZ, et al. Summary of report on cardiovascular diseases in China, 2012[J]. Biomed Environ Sci, 2014, 27(7): 552-8. |
| [2] |
Oliver J, Webb J. Noninvasive assessment of arterial stiffness and risk of atherosclerotic events[J]. Arterioscler Thromb Vasc Biol, 2003, 23(4): 554-66. DOI:10.1161/01.ATV.0000060460.52916.D6 |
| [3] |
Alagona J, Ahmad TA. Cardiovascular disease risk assessment and prevention current guidelines and limitations[J]. Med Clin North Am, 2015, 99(4): 711. DOI:10.1016/j.mcna.2015.02.003 |
| [4] |
Wong ND, Nelson JC, Granston T, et al. Metabolic syndrome, diabetes, and incidence and progression of coronary calcium: the multiethnic study of atherosclerosis study[J]. JACC Cardiovasc Imaging, 2012, 5(4): 358-66. DOI:10.1016/j.jcmg.2011.12.015 |
| [5] |
Mehta NN, Krishnamoorthy P, Martin SS, et al. Usefulness of insulin resistance estimation and the metabolic syndrome in predicting coronary atherosclerosis in type 2 diabetes mellitus[J]. Am J Cardiol, 2011, 107(3): 406-11. DOI:10.1016/j.amjcard.2010.09.035 |
| [6] |
Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes(UKPDS 34). UK prospective diabetes study (UKPDS) group[J]. Lancet, 1998, 352(9131): 854-65. DOI:10.1016/S0140-6736(98)07037-8 |
| [7] |
Ali S, Fonseca V. Overview of metformin: special focus on metformin extended release[J]. Expert Opin Pharmacother, 2012, 13(12): 1797-805. DOI:10.1517/14656566.2012.705829 |
| [8] |
Foretz M, Guigas B, Bertrand L, et al. Metformin: from mechanisms of action to therapies[J]. Cell Metab, 2014, 20(6): 953-66. DOI:10.1016/j.cmet.2014.09.018 |
| [9] |
Steinberg GR, Kemp BE. AMPK in health and disease[J]. Physiol Rev, 2009, 89(3): 1025-78. DOI:10.1152/physrev.00011.2008 |
| [10] |
Carling D, Mayer FV, Sanders MJ, et al. AMP-activated protein kinase: Nature's energy sensor[J]. Nat Chem Biol, 2011, 7(8): 512-8. DOI:10.1038/nchembio.610 |
| [11] |
Li Y, Xu SQ, Mihaylova MM, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metab, 2011, 13(4): 376-88. DOI:10.1016/j.cmet.2011.03.009 |
| [12] |
Boyle JJ, Johns M, Kampfer T, et al. Activating transcription factor 1 directs Mhem atheroprotective macrophages through coordinated Iron handling and foam cell protection[J]. Circ Res, 2012, 110(1): 20-33. DOI:10.1161/CIRCRESAHA.111.247577 |
| [13] |
Zhang BB, Zhou G, Ampk LC. An emerging drug target for diabetes and the metabolic syndrome[J]. Cell Metab, 2009, 9(5): 407-16. DOI:10.1016/j.cmet.2009.03.012 |
| [14] |
Xu J, Zou MH. Molecular insights and therapeutic targets for diabetic endothelial dysfunction[J]. Circulation, 2009, 120(13): 1266-86. DOI:10.1161/CIRCULATIONAHA.108.835223 |
| [15] |
Igata M, Motoshima H, Tsuruzoe K, et al. Adenosine monophosphate-activated protein kinase suppresses vascular smooth muscle cell proliferation through the inhibition of cell cycle progression[J]. Circ Res, 2005, 97(8): 837-44. DOI:10.1161/01.RES.0000185823.73556.06 |
| [16] |
Peyton KJ, Yu YJ, Yates B, et al. Compound C inhibits vascular smooth muscle cell proliferation and migration in an AMP-activated protein kinase-independent fashion[J]. J Pharmacol Exp Ther, 2011, 338(2): 476-84. DOI:10.1124/jpet.111.181784 |
| [17] |
Parsons JT, Horwitz AR, Schwartz M. Cell adhesion: integrating cytoskeletal dynamics and cellular tension[J]. Nat Rev Mol Cell Biol, 2010, 11(9): 633-43. DOI:10.1038/nrm2957 |
| [18] |
Yan Y, Tsukamoto O, Nakano A, et al. Augmented AMPK activity inhibits cell migration by phosphorylating the novel substrate Pdlim5[J]. Nat Commun, 2015, 6(2): 6137. |
| [19] |
Nakano A, Kato H, Watanabe T, et al. AMPK controls the speed of microtubule polymerization and directional cell migration through CLIP-170 phosphorylation[J]. Nat Cell Biol, 2010, 12(6): 583-U139. DOI:10.1038/ncb2060 |
| [20] |
Kao J, Tobis J, Mcclelland RL, et al. Relation of metformin treatment to clinical events in diabetic patients undergoing percutaneous intervention[J]. Am J Cardiol, 2004, 93(11): 1347-50. DOI:10.1016/j.amjcard.2004.02.028 |
| [21] |
Wang QL, Zhang M, Torres G, et al. Metformin suppresses DiabetesAccelerated atherosclerosis via the inhibition of Drp1-Mediated mitochondrial fission[J]. Diabetes, 2017, 66(1): 193-205. DOI:10.2337/db16-0915 |
| [22] |
Hao B, Xiao Y, Song F, et al. Metformin-induced activation of AMPK inhibits the proliferation and migration of human aortic smooth muscle cells through upregulation of p53 and IFI16[J]. Int J Mol Med, 2018, 41(3): 1365-76. |
| [23] |
Coles GL, Baglia LA, Ackerman KG. KIF7 controls the proliferation of cells of the respiratory airway through distinct microtubule dependent mechanisms[J]. PLoS Genet, 2015, 11(10): e1005525. DOI:10.1371/journal.pgen.1005525 |
| [24] |
Han BY, Cui HZ, Kang L, et al. Metformin inhibits thyroid cancer cell growth, migration, and EMT through the mTOR pathway[J]. Tumour Biol, 2015, 36(8): 6295-304. DOI:10.1007/s13277-015-3315-4 |
| [25] |
Mogavero A, Maiorana MV, Zanutto S, et al. Metformin transiently inhibits colorectal cancer cell proliferation as a result of either AMPK activation or increased ROS production[J]. Sci Rep, 2017, 7(1): 15992. DOI:10.1038/s41598-017-16149-z |
| [26] |
LusisAJ. Atherosclerosis[J]. Nature, 2000, 407(6801): 233-41. DOI:10.1038/35025203 |
| [27] |
Falk E. Pathogenesis of atherosclerosis[J]. J Am Coll Cardiol, 2006, 47(8 Suppl): C7-12. |
| [28] |
Owens GK, Kumar MS, Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3): 767-801. DOI:10.1152/physrev.00041.2003 |
| [29] |
Forouzandeh F, Salazar G, Patrushev NA, et al. Metformin beyond diabetes: pleiotropic benefits of metformin in attenuation of atherosclerosis[J]. JAm HeartAssoc, 2014, 3(6): e001202. |
| [30] |
Basatemur GL, Jørgensen HF, Clarke M, et al. Vascular smooth muscle cells in atherosclerosis[J]. Nat Rev Cardiol, 2019, 35(7): 18-9. |
 2019, Vol. 39
2019, Vol. 39

