脓毒症是重症监护病房获得性肌无力(ICUAW)发生的重要原因, 其发病率高达56%~80%[1-4], 主要表现为继发的呼吸肌和四肢肌无力, 深反射减弱或消失等症状[5-6]。ICUAW可增加肺部感染风险, 加重呼吸衰竭, 延长机械通气和住院时间, 是导致危重病人死亡率增高的独立危险因素[7]。
脓毒症导致ICUAW发生发展与多种病理因素有关[8-10]。神经肌肉接头(NMJ)是神经端和肌肉端传递和接受化学信号的特异结构, 而nAChRs高度聚集于终板膜(即NMJ肌细胞侧的突触后膜), 维持着正常的神经肌肉功能[11]。当各种病理因素导致终板膜nAChRs发生质与量的改变即可引起神经肌肉兴奋传导障碍[12], 但其具体的机制目前尚不清楚, 在本项目前期研究中已发现脓毒症可引起骨骼肌终板膜nAChRs分布异常, 密度下降, 可能是导致ICUAW的重要原因[13]。
研究表明在生理情况下, 运动神经末梢释放的聚集蛋白Agrin可使AKT/GSK3β磷酸化, 促进CLASP2与微管蛋白的结合, 从而诱发微管运送nAChRs至终板膜聚集[14-15]。本实验通过脓毒症小鼠血清处理分化成熟的C2C12肌管细胞, 探讨脓毒症对骨骼肌细胞膜上nAChRs聚集的影响, 以及AKT/GSK3β介导的信号通路在其中发挥的作用。
1 材料和方法 1.1 材料 1.1.1 实验对象小鼠源性C2C12肌原细胞购自武汉普诺赛(Procell)生命科技有限公司, 复苏后用含10%胎牛血清的高糖DMEM增殖培养于CO2培养箱中(37℃, 5% CO2), 细胞贴壁生长, 待细胞融合度达95%换含2%马血清的高糖DMEM诱导分化, 5~7 d后可见大量多核肌管细胞。
1.1.2 主要试剂和仪器高糖DMEM、马血清(Hyclone), 胎牛血清(Biological Industries), 重组兔Agrin蛋白(R&D), Alexa Fluor 594-conjugated α-BTX (Invitrogen), CLASP2抗体(Santa cruz), α-Tubulin抗体、SB216763(abcam), p-MAPK/CDK基序抗体(以下简称p-Ab)、AKT、p-AKT、GSK3β、p-GSK3β抗体(CST), CO2培养箱(Thermo Scientific), iX73倒置显微镜(Olympus), 电泳仪、湿转槽(Bio-RAD)。
1.2 方法 1.2.1 小鼠血清制备选择健康雄性C57BL/6小鼠(月龄8~10周, 体质量22~30 g, 成都达硕), 通过盲肠结扎穿孔术(CLP)建模。沿腹正中线开腹后结扎1/2盲肠, 采用21G针头对穿盲肠一次并挤出少许粪便, 最后逐层关腹。假手术小鼠则行开腹探查, 不行盲肠结扎穿孔。建模24 h, 参照文献[16]采用小鼠脓毒症评分法对小鼠评分判断建模是否成功, 于心尖取血, 3000 r/min离心10 min, 取上清液冻存于-80℃备用。
1.2.2 细胞分组与处理待C2C12分化为肌管后, 采用随机数字法将细胞分为4组:Sham组:Agrin预处理30 min后, 加入假手术小鼠血清; Sepsis组:Agrin预处理30 min后, 加入脓毒症小鼠血清; Sepsis+D组:Agrin和DMSO预处理30 min后, 加入脓毒症小鼠血清; Sepsis+ SB组:Agrin和SB216763预处理30 min后, 加入脓毒症小鼠血清。其中, Agrin终浓度为1.5 nmol/L, SB216763终浓度为10 μmol/L, 小鼠血清终浓度为2%, 小鼠血清处理细胞5.5 h。
1.2.3 nAChRs聚集簇的检测用预热的PBS洗涤细胞, 加入含终浓度为5 μg/mL Alexa Fluor 594-conjugated α-BTX的高糖DMEM, 于CO2培养箱(37℃, 5% CO2)中孵育30 min, PBS洗涤10 min, 4%多聚甲醛固定15 min, PBS洗涤多余固定液后于荧光显微镜下拍照, 采用Image Pro Plus软件对荧光的面积和密度进行分析。
1.2.4 Western blottingRIPA裂解细胞提取蛋白, 采用BCA法测定蛋白浓度。经10% SDS-PAGE凝胶电泳后, 将蛋白电转至NC膜, 5%脱脂奶粉封闭1 h, 于4℃孵育一抗过夜:AKT、p-AKT、GSK3β、p-GSK3β抗体稀释比例为1:1000;CLASP2抗体稀释比例为1:100; GAPDH抗体稀释比例为1:5000。PBST洗涤后, 加入相应二抗室温孵育1 h, PBST洗涤后用ECL发光试剂盒发光显影。采用Image J软件分析条带的灰度值, 以目的蛋白条带灰度值与相应内参条带灰度值的比值作为目的蛋白的表达量。
1.2.5 Co-IP细胞提取蛋白后, 各IP实验组加入2 μg CLASP2抗体或者p-Ab, IgG对照组加入2 μg同源IgG, 4℃振荡孵育过夜, 次日加入Protein G/A琼脂糖珠捕捉抗原抗体复合物, 4℃缓慢振荡4 h, 离心后弃上清, 充分洗涤以去除非特异性结合的蛋白质, 经95℃煮沸5 min变性, SDS-PAGE凝胶电泳, 进行Western blotting检测目的蛋白。
1.3 统计学分析所有实验数据至少经过3次独立实验, 以均数±标准差表示。采用SPSS 17.0软件进行数据统计, 多组之间比较采用单因素方差分析, 多组内两两比较采用Bonferroni检验, 两组内两两比较采用两独立样本的t检验, P < 0.05认为差异有统计学意义。
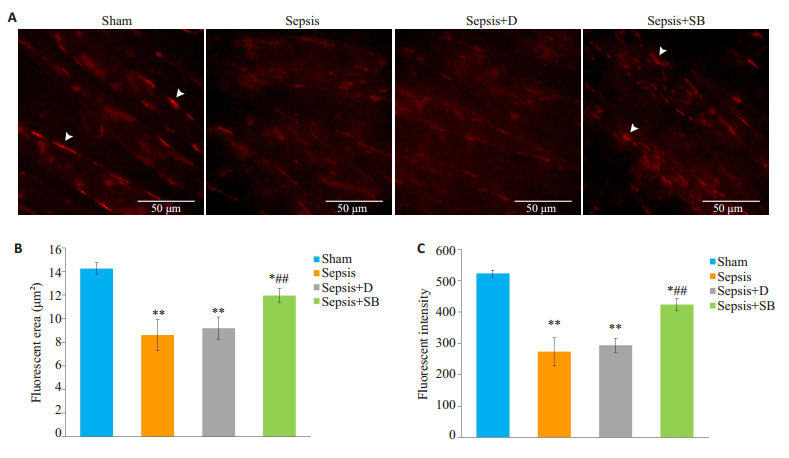
2 结果 2.1 nAChRs聚集簇面积及密度如图 1所示, 与Sham组比较, Sepsis组肌管膜上nAChRs聚集簇的面积、密度均降低, 差异有统计学意义(P < 0.01);与Sepsis+D组相比, Sepsis+SB组肌管膜上nAChRs聚集簇的面积、密度均增加, 差异有统计学意义(P < 0.01)。
|
图 1 各组细胞nAChRs聚集簇面积及密度比较 Fig.1 Comparison of fluorescent area and intensity of nAchRs clusters among the 4 groups (n=4, Mean±SD). A:nAChRs clusters observed using Alexa Fluor 594-conjugated α-BTX (arrows). Scale bars:50 μm; B:Quantitative analysis of the mean area of nAChRs clusters; C:Quantitative analysis of the mean fluorescent intensity of nAChRs clusters. *P < 0.05, **P < 0.01 vs Sham; ##P < 0.01 vs Sepsis+D group. |
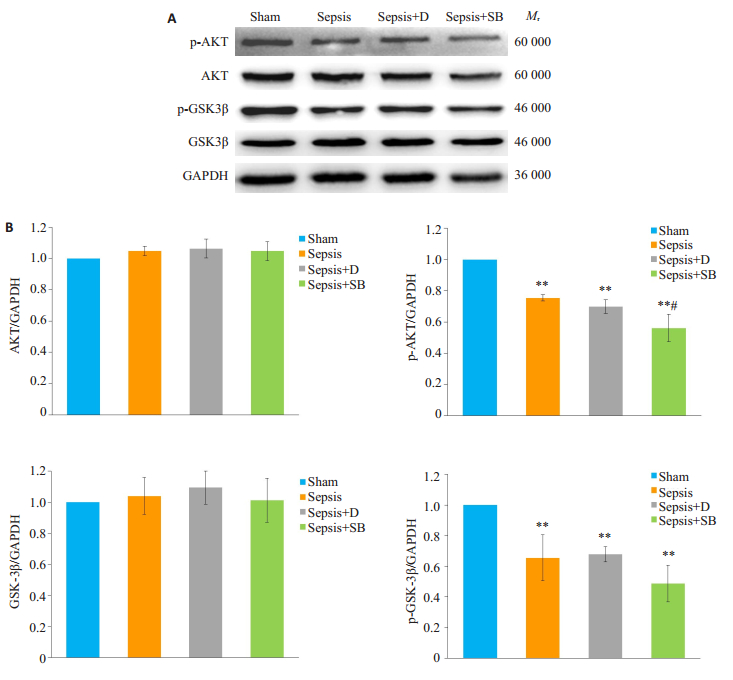
四组细胞AKT、GSK3β、p-AKT、p-GSK3β表达如图 2A所示。图 2B相对定量分析显示, 四组细胞AKT、GSK3β差异无统计学意义(P>0.05)。与Sham组相比, Sepsis组p-AKT、p-GSK3β均降低, 差异有统计学意义(P < 0.01);与Sepsis+D组相比, Sepsis+SB组p-AKT降低, 差异有统计学意义(P < 0.05), p-GSK3β差异无统计学意义(P>0.05)
|
图 2 各组细胞AKT、p-AKT、GSK3β、p-GSK3β表达水平比较 Fig.2 Comparison of expression levels of AKT, p-AKT, GSK3β and p-GSK3β among the groups (n=4, Mean±SD). A: Western blotting for detecting AKT, p-AKT, GSK3β and p-GSK3β expressions; B:Relative quantitative analysis of the expression levels. **P < 0.01 vs Sham group; #P < 0.05 vs Sepsis+D group. |
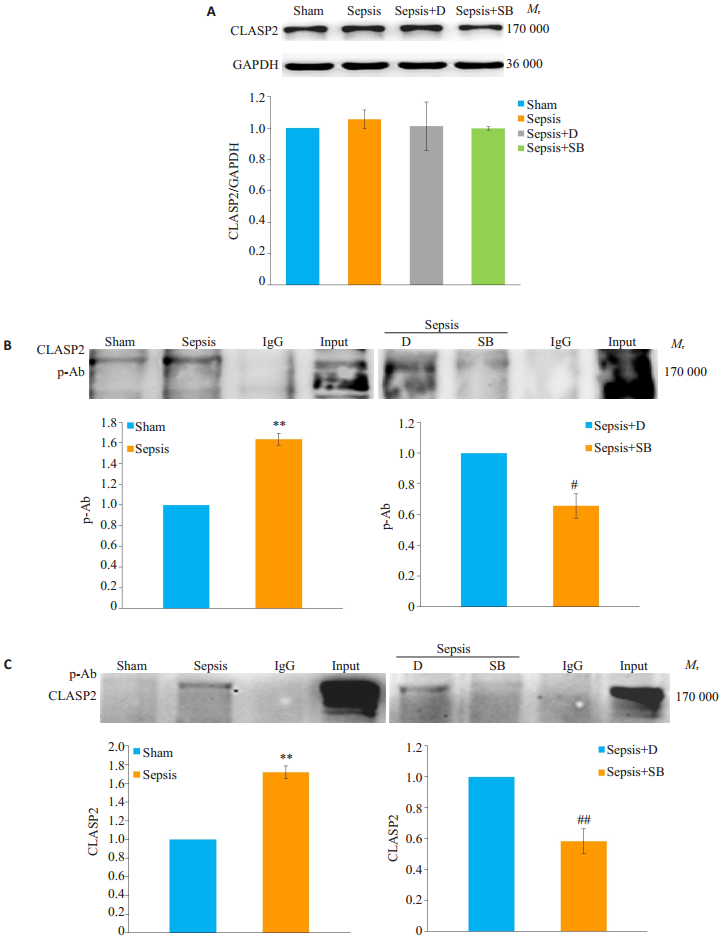
通过Western blotting检测CLASP2总体水平(图 3A), 四组细胞CLASP2差异无统计学意义(P>0.05)。本研究参照文献[17]通过Co-IP双向检测p-CLASP2水平(图 3B, C)。与Sham组相比, Sepsis组p-CLASP2水平升高, 差异有统计学意义(P < 0.01);与Sepsis+D组相比, Sepsis+SB组p-CLASP2水平降低, 差异有统计学意义(P < 0.05)。
|
图 3 各组细胞CLASP2、p-CLASP2水平比较 Fig.3 Comparison of expression levels of CLASP2 and p-CLASP2 among the groups. A:Expressions of CLASP2 detected by Western blotting (n=4, Mean±SD); B:Western blotting of p-Ab in CLASP2 Co-IP product (n=3, Mean±SD); C:Western blotting of CLASP2 in -Ab Co-IP product (n=3, Mean±SD). **P < 0.01 vs Sham group; #P < 0.05, ##P < 0.01 vs Sepsis+D group. |
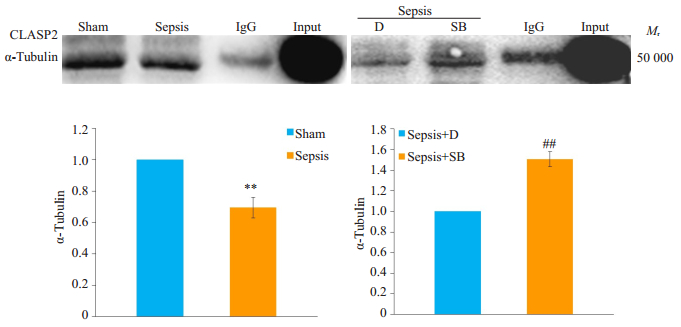
通过Co-IP检测CLASP2与α-Tubulin的结合情况(图 4)。与Sham组相比, Sepsis组CLASP2与α-Tubulin结合减少, 差异有统计学意义(P < 0.01);与Sepsis+D组相比, Sepsis+SB组CLASP2与α-Tubulin结合增加, 差异有统计学意义(P < 0.01)。
|
图 4 Co-IP检测各组细胞CLASP2与α-Tubulin的结合水平 Fig.4 Levels of interaction between CLASP2 and α-tubulin in each group detected by Co-IP assay (n=3, Mean±SD). The bar graph shows the relative Levels of interaction between CLASP2 and α-tubulin. **P < 0.01 vs Sham group; ##P < 0.01 vs Sepsis+D group. |
NMJ是一个可塑的特殊结构, 生理情况下, NMJ突触后膜nAChRs高密度聚集, 以确保快速、稳定和可靠的突触传递[11]。在某些特殊情况下, 如老年[18]、长期吸烟[19]以及去神经支配时[13], 可以观察到骨骼肌终板膜nAChRs的聚集程度下降, 但具体机制并不明确。本研究发现脓毒症也可影响骨骼肌细胞膜nAChRs的聚集, 其机制与Agrin蛋白介导的AKT/GSK3β通路有关。
Agrin蛋白是一种硫酸肝素蛋白聚糖, 可在多种组织中表达, 包括肌肉、大脑以及免疫器官等。在哺乳动物中, 只有神经源性的Agrin才能诱导nAChRs聚集[20-21]。Agrin通过活化磷脂酰肌醇-3-激酶(PI3K)和AKT, 使GSK3β磷酸化而失活, 促进下游分子CLASP2发生去磷酸化, 从而诱导CLASP2与微管的终末端结合, 引导微管向细胞膜聚合稳定, 为nAChRs转运提供通道[11, 15, 22]。有研究报道, 用1~10 nmol/L的神经源性Agrin刺激C2C12肌管, 4~6 h后即可观察到明显的nAChRs聚集簇形成[15, 23]。因此, 本研究采用1.5 nmol/L Agrin处理C2C12肌管诱导nAChRs聚集, 发现在予以相同条件的诱导下, 脓毒症小鼠血清处理后肌管膜上nAChRs聚集明显减少。在对Agrin下游信号分子检测后发现, 经脓毒症小鼠血清处理后肌细胞AKT、GSK3β磷酸化水平均降低, 提示在脓毒症的情况下, Agrin激活AKT/GSK3β磷酸化的效应被抑制, 该过程可能参与nAChRs的聚集异常。
AKT不仅是机体重要的酶, 也是许多信号通路的汇聚点, 调控着机体多方面的功能, 如蛋白合成、细胞凋亡等。研究报道, 在脓毒症期间, 骨骼肌AKT磷酸化被抑制, 蛋白酶体和自噬蛋白水解途径活性增强, 与肌肉萎缩密切相关[24-25]。GSK3β被认为是免疫系统多种成分的调节因子, 激活GSK3β可促进炎症介质的产生, GSK3β抑制剂的使用则可使机体从促炎状态向抗炎状态转换, 有效改善脓毒症老鼠的生存率[26-27]。本研究同样发现脓毒症小鼠血清可抑制肌管AKT的活性, 激活GSK3β, 提示AKT/GSK3β磷酸化下调可能参与脓毒症的多种病理过程。另外, SB216763可明显减轻脓毒症对肌管nAChRs膜上聚集的影响, 证实GSK3β抑制剂在脓毒症中的保护作用。有趣的是, 在予以SB216763处理后, 肌管GSK3β磷酸化水平并未增加, 提示SB216763并不通过增加GSK3β磷酸化水平来抑制GSK3β活性, 与文献报道[28]相一致。另外, 使用GSK3β抑制剂后p-AKT进一步减少, 考虑可能与下游GSK3β失活后形成的负反馈调节有关。
微管作为细胞骨架系统的重要组成成分, 在细胞分裂、蛋白质转运和细胞屏障功能中都发挥着重要的作用。越来越多的证据表明, 脓毒症可使内皮细胞微管稳定性破坏, 导致内皮细胞通透性增加, 促使感染扩散及炎症介质的释放, 加重各脏器功能的损害[29-30]。然而, 脓毒症对骨骼肌微管的影响并不清楚。微管的聚合稳定受内外环境多种因素调节, 如温度、药物、GTP、微管相关蛋白等[31], 大量研究表明, CLASP2是微管解聚和聚合的重要调控因子。CLASP2又称为微管正端追踪蛋白, 其与微管的结合受GSK3β活性的调节。当GSK3β磷酸化处于失活状态时, CLASP2发生去磷酸化与微管相结合, 促使微管聚集并稳定; 当GSK3β去磷酸化而处于激活状态时, 则会诱导CLASP2磷酸化, 使其与微管的结合发生解离, 促使微管解聚, 阻碍nAChRs的转运[14-15]。本研究发现, 予以脓毒症血清处理后, 肌细胞CLASP2磷酸化增加, CLASP2与微管结合减少, GSK3β抑制剂可降低CLASP2磷酸化水平, 增加CLASP2与微管的结合, 明显改善脓毒症小鼠血清对nAChRs聚集的抑制作用。因此本研究结果提示脓毒症可导致骨骼肌微管聚合减少, 影响微管稳定性。
综上所述, 脓毒症抑制AKT/GSK3β磷酸化促使下游信号分子CLASP2与微管蛋白结合减少, 可能是脓毒症导致骨骼肌nAChRs聚集障碍的潜在分子机制。然而, 在本细胞实验中, 无法明确脓毒症是否会影响突触前膜Agrin的分泌, 进而影响nAChRs聚集。本课题组将会在后续实验进行更深入的探究, 以期阐明脓毒症致nAChRs聚集障碍的具体机制。
| [1] |
Latronico N, Bolton CF. Critical illness polyneuropathy and myopathy: a major cause of muscle weakness and paralysis[J]. Lancet Neurol, 2011, 10(10): 931-41. DOI:10.1016/S1474-4422(11)70178-8 |
| [2] |
Price DR, Mikkelsen ME, Umscheid CA, et al. Neuromuscular blocking agents and neuromuscular dysfunction acquired in critical illness: a systematic review and Meta-Analysis[J]. Crit Care Med, 2016, 44(11): 2070-8. DOI:10.1097/CCM.0000000000001839 |
| [3] |
Wang XK, Zhu J, Zhang HL. Critical illness polyneuropathy and myopathy are common neuromuscular complications secondary to sepsis[J]. Neurol Sci, 2013, 34(1): 129-30. |
| [4] |
Garnacho-Montero J, Madrazo-Osuna J, García-Garmendia JL, et al. Critical illness polyneuropathy: risk factors and clinical Consequences. A cohort study in septic patients[J]. Intensive Care Med, 2001, 27(8): 1288-96. DOI:10.1007/s001340101009 |
| [5] |
Schmidt SB, Rollnik JD. Critical illness polyneuropathy (CIP) in neurological early rehabilitation: clinical and neurophysiological features[J]. BMC Neurol, 2016, 16(1): 256. |
| [6] |
Friedrich O, Reid MB, Van den Berghe G, et al. The sick and the weak: neuropathies/myopathies in the critically ill[J]. Physiol Rev, 2015, 95(3): 1025-109. DOI:10.1152/physrev.00028.2014 |
| [7] |
Garnacho-Montero J, Amaya-Villar R, García-Garmendía JL, et al. Effect of critical illness polyneuropathy on the withdrawal from mechanical ventilation and the length of stay in septic patients[J]. Crit Care Med, 2005, 33(2): 349-54. |
| [8] |
Grip J, Jakobsson T, Tardif N, et al. The effect of plasma from septic ICU patients on healthy rat muscle mitochondria[J]. Intensive Care Med Exp, 2016, 4(1): 20. DOI:10.1186/s40635-016-0093-2 |
| [9] |
Koch S, Bierbrauer J, Haas K, et al. Critical illness polyneuropathy in ICU patients is related to reduced motor nerve excitability caused by reduced Sodium permeability[J]. Intensive Care Med Exp, 2016, 4(1): 10. DOI:10.1186/s40635-016-0083-4 |
| [10] |
李天梅, 刘力, 王晓斌. 脓毒症致获得性肌无力相关机制的研究进展[J]. 国际麻醉学与复苏杂志, 2019(5): 471-4. DOI:10.3760/cma.j.issn.1673-4378.2019.05.012 |
| [11] |
Burden SJ, Huijbers MG, Remedio L. Fundamental molecules and mechanisms for forming and maintaining neuromuscular synapses [J]. Int J Mol Sci, 2018, 19(2), pii: E490.
|
| [12] |
Liu L, Min S, Li W, et al. Pharmacodynamic changes with vecuronium in sepsis are associated with expression of α7- and γ- nicotinic acetylcholine receptor in an experimental rat model of neuromyopathy[J]. Br JAnaesth, 2014, 112(1): 159-68. DOI:10.1093/bja/aet253 |
| [13] |
Liu L, Xie F, Wei K, et al. Sepsis induced denervation-like changes at the neuromuscular junction[J]. J Surg Res, 2016, 200(2): 523-32. |
| [14] |
Schmidt N, Basu S, Sladecek S, et al. Agrin regulates CLASP2- mediated capture of microtubules at the neuromuscular junction synaptic membrane[J]. J Cell Biol, 2012, 198(3): 421-37. DOI:10.1083/jcb.201111130 |
| [15] |
Basu S, Sladecek S, Pemble H, et al. Acetylcholine receptor(AChR) clustering is regulated both by glycogen synthase kinase 3β (GSK3β)- dependent phosphorylation and the level of CLIP-associated protein 2(CLASP2) mediating the capture of microtubule plus-ends[J]. J Biol Chem, 2014, 289(44): 30857-67. DOI:10.1074/jbc.M114.589457 |
| [16] |
Shrum B, Anantha RV, Xu SX, et al. A robust scoring system to evaluate sepsis severity in an animal model[J]. BMC Res Notes, 2014, 233. |
| [17] |
Langlais P, Dillon JL, Mengos A, et al. Identification of a role for CLASP2 in insulin action[J]. J Biol Chem, 2012, 287(46): 39245-53. DOI:10.1074/jbc.M112.394148 |
| [18] |
Snyder-Warwick AK, Satoh A, Santosa KB, et al. Hypothalamic Sirt1 protects terminal Schwann cells and neuromuscular junctions from age-related morphological changes[J]. Aging Cell, 2018, 17(4): e12776. DOI:10.1111/acel.12776 |
| [19] |
Kapchinsky S, Vuda M, Miguez K, et al. Smoke-induced neuromuscular junction degeneration precedes the fibre type shift and atrophy in chronic obstructive pulmonary disease[J]. J Physiol, 2018, 596(14): 2865-81. DOI:10.1113/JP275558 |
| [20] |
Ngo ST, Noakes PG, Phillips WD. Neural agrin: a synaptic stabiliser[J]. Int J Biochem Cell Biol, 2007, 39(5): 863-7. DOI:10.1016/j.biocel.2006.10.012 |
| [21] |
Zong Y, Jin R. Structural mechanisms of the agrin-LRP4-MuSK signaling pathway in neuromuscular junction differentiation[J]. Cell Mol Life Sci, 2013, 70(17): 3077-88. DOI:10.1007/s00018-012-1209-9 |
| [22] |
Piguet J, Schreiter C, Segura JM, et al. Acetylcholine receptor organization in membrane domains in muscle cells: evidence for rapsyn-independent and rapsyn-dependent mechanisms[J]. J Biol Chem, 2011, 286(1): 363-9. DOI:10.1074/jbc.M110.139782 |
| [23] |
Ngo ST, Cole RN, Sunn N, et al. Neuregulin-1 potentiates agrininduced acetylcholine receptor clustering through muscle-specific kinase phosphorylation[J]. J Cell Sci, 2012, 125(Pt 6): 1531-43. |
| [24] |
Stana F, Vujovic M, Mayaki D, et al. Differential regulation of the autophagy and proteasome pathways in skeletal muscles in sepsis[J]. Crit Care Med, 2017, 45(9): e971-9. DOI:10.1097/CCM.0000000000002520 |
| [25] |
Wu J, Liu H, Chu T, et al. Neuregulin-1β attenuates sepsis-induced diaphragm atrophy by activating the PI3K/Akt signaling pathway[J]. J Muscle Res Cell Motil, 2019, 40(1): 43-51. DOI:10.1007/s10974-019-09512-2 |
| [26] |
Zhang H, Wang W, Fang H, et al. GSK-3β inhibition attenuates CLPinduced liver injury by reducing inflammation and hepatic cell apoptosis[J]. Mediators Inflamm, 2014, 2014: 629507. |
| [27] |
Beurel E, Michalek SM, Jope RS. Innate and adaptive immune responses regulated by glycogen synthase kinase-3 (GSK3)[J]. Trends Immunol, 2010, 31(1): 24-31. DOI:10.1016/j.it.2009.09.007 |
| [28] |
Evenson AR, Fareed MU, Menconi MJ, et al. GSK-3beta inhibitors reduce protein degradation in muscles from septic rats and in dexamethasone-treated myotubes[J]. Int J Biochem Cell Biol, 2005, 37(10): 2226-38. DOI:10.1016/j.biocel.2005.06.002 |
| [29] |
Mu S, Liu Y, Jiang J, et al. Unfractionated heparin ameliorates pulmonary microvascular endothelial barrier dysfunction via microtubule stabilization in acute lung injury[J]. Respir Res, 2018, 19(1): 220. DOI:10.1186/s12931-018-0925-6 |
| [30] |
Karki P, Ke Y, Tian Y, et al. Staphylococcus aureus-induced endothelial permeability and inflammation are mediated by microtubule destabilization[J]. J Biol Chem, 2019, 294(10): 3369-84. DOI:10.1074/jbc.RA118.004030 |
| [31] |
李凌霏. MAP4在炎症导致肺微血管通透性增高中的作用及机制研究[D].重庆: 第三军医大学, 2015.
|
 2019, Vol. 39
2019, Vol. 39

