2. 南方医科大学顺德医院(佛山市顺德区第一人民 医院)内分泌科,广东 顺德 528300
2. Department of Endocrinology, Shunde Hospital, Southern Medical University (First People's Hospital of Shunde), Shunde 528300, China
近年来, 我国新诊断2型糖尿病患者发病率迅速增加, 平均每年新发病例数约680万~740万。有数据显示, 在我国新诊断的患者中, 超过四分之一的患者在初次诊断时即出现糖化血红蛋白(HbA1c)大于9%的较高血糖[1]。然而由于低治疗率以及药物选择不当, 我国2型糖尿病患者血糖控制达标率仅为39.7%[2]。2018年美国临床内分泌学专家协会(AACE)指南推荐, 对于HbA1c ≥ 9%的初诊患者, 优先考虑胰岛素或三联口服药物治疗[3]。相对胰岛素治疗方案存在便利性差及依从性低的不足, 三联口服降糖方案存在更好的便利性及依从性, 但目前三联用药的具体方案以及其安全性和有效性的相关临床证据仍不足。一项荟萃分析显示临床上三联降糖方案多是二甲双胍+磺脲类(SU)/噻唑烷二酮类(TZDs)再联合其他降糖药物的口服治疗, 但该方案可增加低血糖的风险[4], 且二甲双胍+磺脲类(SU)的治疗方案同时伴有体质量增加的风险, 这些情况在临床实践中应予关注[4-6]。另一方面, 近年来国内外权威指南均对糖尿病的诊治提出了新的治疗策略, 无论是ADA抑或AACE指南对糖尿病患者治疗选择的推荐中, 无不强调将体质量增加风险最小化[3, 7]; 故采取兼备减重等多重获益的降糖方案势在必行。沙格列汀为二肽基肽酶Ⅳ抑制剂(DPP4i), 研究显示:DPP4i在有效降糖的同时[8], 具有低血糖风险低、不增加体质量和不良事件发生率低的特点[9-10]。达格列净是一种钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i), 现有研究显示SGLT2i在强有力降糖的同时, 也有明显的减重效果, 此外, 还兼备降低血压、减少尿蛋白排泄的作用[11-13]。二甲双胍、DPP4抑制剂联合SGLT2抑制剂的三联用药符合新的治疗策略。但目前对于该三联口服降糖模式的报道仍较少, 特别对于初诊断的2型糖尿病患者, 其疗效与安全性仍待进一步探索。因此, 本研究旨在探讨二甲双胍、沙格列汀、达格列净三联口服短期强化降糖方案治疗HbA1c较高的初诊断2型糖尿病患者的降糖疗效、减重效力及安全性, 从而指导临床工作。
1 资料和方法 1.1 对象本研究为多中心、前瞻性、观察性研究, 入选了2018年9月~2019年4月珠江医院内分泌科负责主持的多中心:南方医科大学顺德医院(佛山市顺德区第一人民医院)、清远市人民医院、东莞康华医院内分泌科门诊及住院收治的初诊断2型糖尿病患者58例。入选患者均符合以下纳入标准:(1)新诊断2型糖尿病患者, 2型糖尿病诊断符合1999年WHO糖尿病的诊断标准, 糖化血红蛋白≥ 9%且≤ 12%;(2)年龄:18~65岁; (3)18.5 kg/m2 ≤ BMI ≤ 32 kg/m2; (4)此前未用过其他降糖方案; (5)自愿参加并能坚持每周至少监测血糖1 d, 且3月后返院复查并签署知情同意书。排除1型糖尿病、继发性糖尿病, 排除糖尿病急性并发症、增生性糖尿病视网膜病变; 无严重感染及尿路感染, 无明显肝胆疾病, 无肾功能不全、心功能不全; 无难以控制的高血压, 无贫血史, 无严重胃肠道疾病及手术史; 排除妊娠; 6月内无滥药及酗酒史, 无精神疾病史, 无肿瘤史, 无相关药物及成分过敏史。入组总人数共58例, 其中男性37例, 女性21例, 年龄46.65±8.84岁。
1.2 方法对受试患者进行筛选, 并签署知情同意书后, 根据其纳入顺序为其分配对应的编号, 通过病历号、姓名缩写、中心和研究中的编号识别受试者; 入选患者, 在糖尿病饮食和运动的基础上, 给予二甲双胍(格华止):起始剂量为0.5 g/次, 2次/d, 早晚餐时服用; 达格列净(安达唐):起始剂量为10 mg/次, 1次/d, 早晨服用; 沙格列汀(安立泽):起始剂量为5 mg/次, 1次/d, 早餐前服用; 监测空腹、早餐后2 h及睡前指尖血糖, 每周至少监测1 d; 根据血糖仪检测的血糖情况进行调整, 每2周调整一次, 血糖不达标, 则按"二甲双胍-达格列净-沙格列汀"的顺序依次调整药物至最大剂量, 若血糖仍不达标则建议患者退出研究, 改用其他降糖方案; 若药物增量调整过程出现低血糖, 排除饮食不足和运动过量等影响后, 则按"达格列净-沙格列汀-二甲双胍"的顺序依次降低药物剂量; 若仍有低血糖发生, 则退出实验。研究期间患者自行监测指尖血糖, 每周进行1次电话随访, 每4周进行1次访视。治疗疗程为12周, 治疗过程血糖监测目标为空腹血糖 < 7 mmol/L, 餐后2 h血糖 < 10 mmol/L; 血糖≤ 3.9 mmol/L作为低血糖标准。
检测方法:糖化血红蛋白测定由ARKRAYHA-8180型全自动糖化血红蛋白分析仪检测; 胰岛素、C肽测定由UniCel DxI800全自动化学发光免疫分析仪检测; 血糖、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)、尿素氮(BUN)、肌酐(SCR)、尿酸(UA)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)指标测定由Mindray BS-2000M全自动生化分析仪检测; 指尖血糖采用Nova StatStrip Xpress血糖仪监测。
1.3 观察指标观察治疗前及治疗后患者空腹血糖、餐后2 h血糖、糖化血红蛋白、胰岛素、C肽分泌以及体质量的变化。用稳态模型(HOMA)计算胰岛β细胞功能指数(HOMA-β)及胰岛素抵抗指数(HOMA-IR)。记录治疗过程中患者低血糖发生的次数。
1.4 统计学方法采用SPSS22.0统计软件进行数据录入及统计学分析; 计量资料以均数±标准差和可信区间表示, 对于正态分布的计量资料, 前后比较采用配对样本t检验; 对于非正态分布的计量资料, 前后比较采用Wilcoxon秩和检验; 计数资料统计采用卡方检验; 连续性变量相关性分析采用Pearson相关分析, 等级变量或数据不符合正态分布则采用Spearman相关分析, P < 0.05认为统计学差异具有显著性。
2 结果 2.1 三联口服降糖方案治疗前后药物剂量的情况患者治疗前后药物剂量的情况:起始治疗剂量为二甲双胍(1 g/d)、达格列净(10 mg/d)、沙格列汀(5 mg/d); 终止时剂量为二甲双胍(1~2 g/d)、达格列净(10 mg/d)、沙格列汀(5 mg/d)。
2.2 三联口服降糖方案的疗效、体质量控制及安全性的观察12周治疗后, 所有患者FBG、2 hPBG、HbA1c、HOMA-β、HOMA-IR均较治疗前明显改善, HbA1c平均下降(4.19±1.07)%(P < 0.001, 表 1); 治疗后HbA1c ≤ 6.5% 33例, < 7%且>6.5% 12例, ≥ 7% 9例(表 3)。治疗后体质量及BMI均有下降, 体质量平均下降2.47± 3.38 kg, BMI平均下降0.90+1.18 kg/m2, (P < 0.001, 表 2); 观察治疗前后有5例的患者体质量增加, 5例体质量无变化, 均为BMI < 24 kg/m2的患者(表 3)。有8人发生低血糖症状10次, 发生率为14.81%, 确诊为低血糖症(血糖≤ 3.9 mmol/L)为3人, 发生次数3次, 低血糖发生率5.56%(表 3), 无严重低血糖事件发生; 治疗前后血脂, 包括TC、TG、HDL、LDL, 均有改善(P < 0.01, 表 2), ALT轻度下降(P < 0.01, 表 2), AST、SCR轻度下降, 无统计学意义, BUN、UA轻度升高, 但无统计学意义; eGFR无明显变化; 无泌尿系及生殖系感染发生; 治疗过程部分患者在治疗早期出现疲乏、头晕及胃肠道反应, 如恶心、腹胀, 但反应相对轻微, 经过2周左右治疗后可耐受, 仅2例因胃肠道反应不能耐受而退出实验; 另2例患者因取药途径不便而退出实验; 最后入组人数54例, 男34例, 女20例, 年龄47.15±8.96岁。
| 表 1 治疗前后FBG、2 hPBG、FINS、2 hPINS、F-CP、2 hP-CP、HbA1c以及HOMA-β、HOMA-IR变化 Tab.1 Changes in the observed clinical parameters in the patients after the treatment (Mean±SD, n=54) |
| 表 2 治疗前后体质量、BMI、血脂、肝肾功能、尿酸的变化 Tab.2 Changes of body weight, BMI, blood lipid, liver and kidney function and uric acid after treatment (Mean±SD, n=54) |
| 表 3 HbA1c、WT变化及发生低血糖的比率 Tab.3 Statistics of patients showing changes in HbA1c and body weight and the incidence of hypoglycemia (n=54) |
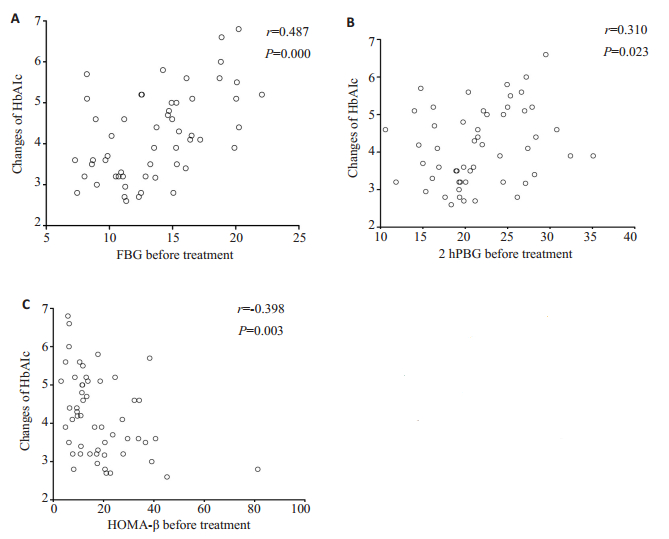
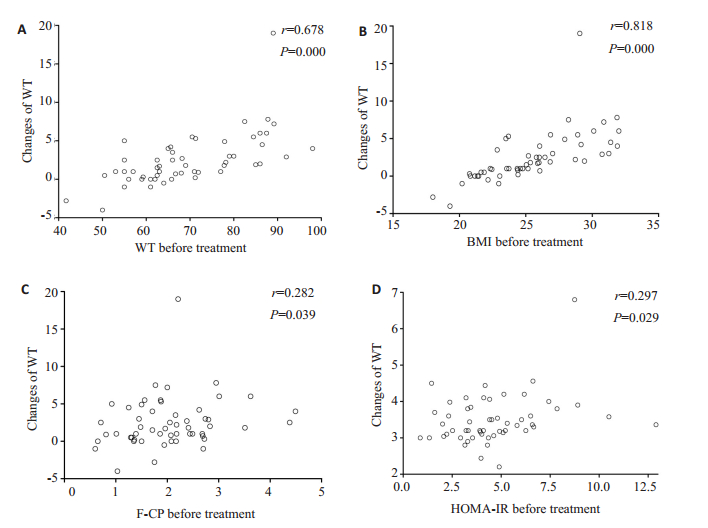
结果显示, 患者糖化血红蛋白下降的程度与治疗前FBG(r=0.487, P=0.000)、2 hPBG(r=0.310, P=0.023)、HOMA-β(r=-0.398, P=0.003)相关(图 1), 与性别、年龄、FINS、2 hPINS、F-CP、2 hP-CP、HOMA-IR无相关关系; 体质量下降的变化程度与患者治疗前基础体质量(r=0.678, P=0.000)、BMI (r=0.818, P=0.000)、F-CP(r= 0.282, P=0.039)、HOMA-IR(r=0.297, P=0.029)相关(图 2), 与性别、年龄、FINS、2 hPINS、2 hP-CP、HOMA-β无相关关系。
|
图 1 糖化血红蛋白变化值的相关性分析 Fig.1 Correlation analysis of HbA1c changes. A:Correlation between changes of HbA1c and FBG before treatment; B: Correlation between changes of HbA1c and 2 hPBG before treatment; C:Correlation between changes of HbA1c and HOMA-β before treatment. |
|
图 2 体质量变化值的相关性分析 Fig.2 Correlation analysis of body weight changes. A:Correlation between changes of WT and WT before treatment; B:Correlation between changes of WT and BMI before treatment; C:Correlation between changes of WT and F-CP before treatment; D:Correlation between changes of WT and HOMA-IR before treatment. |
近年来国内外权威指南均对糖尿病的诊治提出了新的治疗策略, 即采取降糖、减重、降压等方式综合管理糖尿病; 无论是ADA抑或AACE指南对糖尿病患者治疗选择的推荐中, 无不强调将体质量增加风险最小化[3, 7]。此外, 随着体质量指数(BMI)的升高, 2型糖尿病患者并发症和死亡风险也随之升高[15-16]。针对HbA1c ≥ 9%的初诊断2型糖尿病患者, 结合AACE指南推荐, 优先考虑采用胰岛素或三联口服药物治疗[3]。尽管有研究表明胰岛素降糖效果优于口服降糖药物, 但其长期使用导致患者出现低血糖、体质量增加以及胰岛素抵抗等风险, 限制了胰岛素治疗的使用[17-19]; 其次, 皮下注射用药途径的不便也使得部分患者对胰岛素注射存在忧虑[20-22]。故从治疗方案综合获益的角度上, 采用二甲双胍、DPP4抑制剂联合SGLT2抑制剂的三联口服降糖方案, 符合"糖尿病综合管理"的治疗策略。本研究发现, 54例患者在接受三联口服治疗方案后FBG、2 hPBG、HbA1c、HOMA-β、HOMA-IR均较治疗前明显改善。这些患者HbA1c基线水平为10.55%, 在三联口服治疗方案治疗12周后, HbA1c为6.36%, 平均降低约4.19%, 降糖效果明显。此外, 体质量下降幅度为2.47 kg, BMI下降幅度为0.90 kg/m2。相关性分析结果显示, 减重效果与患者基础体质量(r=0.678, P=0.000)、BMI(r=0.818, P= 0.000)、F-CP(r=0.282, P=0.039)、HOMA-IR(r=0.297, P=0.029)相关。观察治疗前后有5例的患者体质量增加, 5例体质量无变化, 均为BMI小于24 kg/m2的患者; 其中有44例体质量下降, 体质量下降比例达81.48%, 有明显的减重优势。同时显示基础体质量及BMI越大的患者体质量下降越明显; 对基础胰岛分泌功能良好, 而且基础胰岛素抵抗明显的患者, 该三联降糖方案减重效果更明显。因此, 基于糖尿病综合管理治疗策略, 对于在治疗过程中需要注意兼顾的降糖及减重效果, 二甲双胍、沙格列汀、达格列净三联口服降糖方案是理想的治疗选择。
根据2017年中国2型糖尿病防治指南推荐的HbA1c控制目标值< 7%, 本研究达标例数有45例, 达标率达到83.33%, 明显高于目前我国2型糖尿病总体的达标率, 降糖效果确切。从降糖机制的角度出发, 此三联口服方案纳括了糖尿病不同的致病机理:二甲双胍可减少肝糖输出, 降低肠道对糖的吸收, 提高脂肪、肌肉外周组织对胰岛素的敏感性[23]; 沙格列汀是二肽基肽酶Ⅳ (DPP4)抑制剂, DPP4抑制剂是基于肠促胰素开发的新型口服降糖药物, 增强胰岛素分泌, 抑制胰高糖素分泌, 还可以延迟胃排空、抑制食欲中枢[24-25]; 达格列净是钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂, SGLT2抑制剂可特异性地抑制肾小管对滤过葡萄糖的重吸收, 增加尿糖的排泄从而降低血糖, 其降糖作用不依赖于胰岛素[26]。该三联口服降糖方案机制互补, 对胰岛素分泌功能的改善可能基于DPP4抑制剂在有效改善血糖控制的同时, 还具有胰岛α/β细胞双调节作用, 对胰岛细胞功能有一定保护作用, 达到有效控制血糖。此外, 相关性结果显示:HbA1c下降的程度与FBG(r=0.487, P=0.000)、2 hPBG(r=0.310, P=0.023)、HOMA-β(r=-0.398, P= 0.003)相关; 结果显示该降糖方案的HbA1c下降的程度与起始治疗的基础血糖正相关, 不因基础血糖的增高而降低达标率, 血糖越高的患者降糖效果越明显, 胰岛β细胞功能指数低的患者HbA1c下降更明显。许多机构对于新诊断2型糖尿病HbA1c水平较高者建议使用胰岛素治疗, 但对于及时使用胰岛素治疗也需考虑实际操作等障碍, 包括对低血糖风险以及体质量增加风险的评估。此三联用药方案对于新诊断2型糖尿病HbA1c水平较高者血糖控制达标率高, 不因基础血糖的增高而降低达标率, 是胰岛素强化治疗较好的替代方案。
本研究在治疗期间有8人发生低血糖症状10次, 发生率为14.81%;确诊为低血糖症(血糖≤ 3.9 mmol/L)为3人, 发生次数3次, 低血糖发生率5.56%。低血糖症状发生率考虑与本研究纳入样本量较小有关, 且发生低血糖症状的原因或与血糖下降过快引起患者不耐受所致, 无严重低血糖发生, 其他不良反应轻, 安全性高。治疗方案对肝功能及肾功能无明显影响。本研究样本量较小, 存在局限性, 但该降糖方案中达格列净、沙格列汀作为新型的口服降糖药物, 已经有多项临床研究对其的有效性及安全性进行了评价。研究显示, SGLT2抑制剂有明显的减重效果; 同时, SGLT2抑制剂能降低血压, 减少尿蛋白排泄, 降低甘油三酯[12-13]。在纳入超过300 000例的里程碑式大型真实世界研究CVD-REAL的结果显示, 使用达格列净等SGLT2抑制剂治疗与降低的糖尿病患者心血管死亡风险有关, 使用达格列净等SGLT2抑制剂的患者全因死亡风险降低51%, 心衰住院风险降低39%[27]。而DPP4抑制剂具有胰岛α/β细胞双调节的特点, 同时有低血糖风险低、不增加体质量和不良事件发生率低的特点[24, 28]。新近研究亦显示, DPP4抑制剂联合二甲双胍能有效减少T2DM患者心血管疾病及全因死亡率[29]。二甲双胍是全球糖尿病治疗的首选用药, 具有良好的单药/联合治疗的疗效和安全性, 以及心血管并发症预防等方面明确的临床证据[23, 30]。同时在对二甲双胍、DPP4抑制剂联合SGLT2抑制剂安全性研究中发现, 与二联用药相比, 采用三联用药的患者中低血糖、肝肾功能损害等不良事件的发生率并没有明显差异[31-32]。
综上所述, 二甲双胍、沙格列汀、达格列净三联口服短期强化降糖方案在新诊断2型糖尿病患者(9% ≤ HbA1c ≤ 12%)中, 不仅有效降糖, 糖化血红蛋白达标率高, 同时兼备减重和低血糖风险小的优势, 并有效改善β细胞胰岛素分泌功能, 适合血糖较高的新诊断2型糖尿病患者临床应用。
| [1] |
中华医学会糖尿病学分会. 新诊断2型糖尿病患者短期胰岛素强化治疗专家共识[J]. 中华医学杂志, 2013, 93(20): 1524-6. DOI:10.3760/cma.j.issn.0376-2491.2013.20.002 |
| [2] |
Xu Y, Wang LM, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-58. |
| [3] |
Garber AJ, Abrahamson MJ, Barzilay JI, et al. Consensus statement by the american association of clinical endocrinologists and american college of endocrinology on the comprehensive type 2 diabetes management algorithm-2018 executive summary[J]. Endocr Pract, 2018, 24(1): 91-120. |
| [4] |
Downes MJ, Bettington EK, Gunton JE, et al. Triple therapy in type 2 diabetes; a systematic review and network meta-analysis[J]. PeerJ, 2015, 3(10): e1461-82. |
| [5] |
Barnett AH, Charbonnel B, Moses RG, et al. Dipeptidyl peptidase-4 inhibitors in triple oral therapy regimens in patients with type 2 diabetes mellitus[J]. Curr Med Res Opin, 2015, 31(10): 1919-31. |
| [6] |
Levin PA. Practical combination therapy based on pathophysiology of type 2 diabetes[J]. Diabetes Metab Syndr Obes, 2016, 9(10): 355-69. |
| [7] |
American Diabetes Association. Standards of medical care in diabetes-2019[J]. Diabetes Care, 2019, 42(Suppl 1): S1-S193. |
| [8] |
Gu WQ, Liang L, Wang SX, et al. Efficacy and safety of saxagliptin monotherapy or added to metformin in Chinese patients with type 2 diabetes mellitus: results from the 24-week, post-marketing sunshine study[J]. Diabetes, 2016, 8(6): 809-15. DOI:10.1111/1753-0407.12360 |
| [9] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版) J][J]. 中国糖尿病杂志, 2014, 10(8): 2-42. |
| [10] |
中华医学会糖尿病学分会. 基于胰高血糖素样肽1降糖药物的临床应用共识[J]. 中华糖尿病杂志, 2014, 6(1): 14-20. DOI:10.3760/cma.j.issn.1674-5809.2014.01.004 |
| [11] |
Kashiwagi A, Maegawa H. Metabolic and hemodynamic effects of sodium-dependent glucose cotransporter 2 inhibitors on cardio-renal protection in the treatment of patients with type 2 diabetes mellitus[J]. J Diabetes Investig, 2017, 8(4): 416-27. DOI:10.1111/jdi.12644 |
| [12] |
Hattersley AT, Thorens B. Type 2 diabetes, SGLT2 inhibitors, and glucose secretion[J]. N Engl J Med, 2015, 373(10): 974-6. DOI:10.1056/NEJMcibr1506573 |
| [13] |
Fernández-Ruiz I. Diabetes: further insights into SGLT2 inhibitors[J]. Nat Rev Cardiol, 2018, 15(1): 2-3. |
| [14] |
全国eGFR课题协作组. MDRD方程在我国慢性肾脏病患者中的改良和评估[J]. 中华肾脏病杂志, 2006, 22(10): 589-95. DOI:10.3760/j.issn:1001-7097.2006.10.002 |
| [15] |
Boles A, Kandimalla R, Reddy PH. Dynamics of diabetes and obesity: Epidemiological perspective[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(5): 1026-36. DOI:10.1016/j.bbadis.2017.01.016 |
| [16] |
Gray N, Picone G, Sloan F, et al. Relation between BMI and diabetes mellitus and Its complications among US older adults[J]. South Med J, 2015, 108(1): 29-36. DOI:10.14423/SMJ.0000000000000214 |
| [17] |
Wallia A, Molitch ME. Insulin therapy for type 2 diabetes mellitus[J]. JAMA, 2014, 311(22): 2315-25. DOI:10.1001/jama.2014.5951 |
| [18] |
Dong S, Lau H, Chavarria C, et al. Effects of periodic intensive insulin therapy: an updated review[J]. Curr Ther Res Clin Exp, 2019, 90(4): 61-7. |
| [19] |
Tandon R, Luxami V, Dosanjh HS, et al. Insulin therapy for diabetes epidemic: a patent review[J]. Curr Drug Deliv, 2018, 15(6): 777-94. DOI:10.2174/1567201815666180228161659 |
| [20] |
Perreault L, Vincent L, Neumiller JJ, et al. Initiation and titration of basal insulin in primary care: barriers and practical solutions[J]. J Am Board Fam Med, 2019, 32(3): 431-47. DOI:10.3122/jabfm.2019.03.180162 |
| [21] |
Kalra S, Ghosal S, Shah P. Consensus on bridges for barriers to insulin therapy[J]. J Assoc Physicians India, 2017, 65(3 Suppl): 23-30. |
| [22] |
Shah S, Sharma SK, Singh P, et al. Consensus evidence-based guidelines for insulin initiation, optimization and continuation in type 2 diabetes mellitus[J]. J Assoc Physicians India, 2014, 62(7 Suppl): 49-54. |
| [23] |
母义明, 纪立农, 宁光, 等. 二甲双胍临床应用专家共识(2016年版)[J]. 药品评价, 2016, 13(19): 5-18. DOI:10.3969/j.issn.1672-2809.2016.19.002 |
| [24] |
Mulvihill EE. Dipeptidyl peptidase inhibitor therapy in type 2 diabetes: Control of the incretin axis and regulation of postprandial glucose and lipid metabolism[J]. Peptides, 2018, 100(11): 158-64. |
| [25] |
杨文英, 李玉珍, 王汝龙. 二肽基肽酶-4抑制剂的药理学特性及其临床应用[J]. 中国药学杂志, 2014, 49(22): 2047-50. |
| [26] |
Esterline RL, Vaag A, Oscarsson J, et al. Mechanisms in endocrinology: SGLT2 inhibitors: clinical benefits by restoration of normal diurnal metabolism?[J]. Eur J Endocrinol, 2018, 178(4): R113-25. DOI:10.1530/EJE-17-0832 |
| [27] |
Kosiborod M, Lam C, Kohsaka S, et al. Cardiovascular events associated with SGLT-2 inhibitors versus other glucose-lowering drugs: the CVD-REAL 2 StudyLower cardiovascular risk associated with SGLT-2i in> 400 000 patients: the CVD-REAL 2 study[J]. J Am Coll Cardiol, 2018, 71(23): 2628-39. |
| [28] |
Del Prato S, Chilton R. Practical strategies for improving outcomes in T2DM: The potential role of pioglitazone and DPP4 inhibitors[J]. Diabetes Obes Metab, 2018, 20(4): 786-99. |
| [29] |
Guo WQ, Li L, Su Q, et al. Effect of dipeptidyl peptidase-4 inhibitors on heart failure: a network Meta-Analysis[J]. Value Health, 2017, 20(10): 1427-30. DOI:10.1016/j.jval.2017.04.010 |
| [30] |
Bridgeman SC, Ellison GC, Melton PE, et al. Epigenetic effects of metformin: From molecular mechanisms to clinical implications[J]. Diabetes Obes Metab, 2018, 20(7): 1553-62. DOI:10.1111/dom.13262 |
| [31] |
Del Prato S, Rosenstock J, Garcia-Sanchez R, et al. Safety and tolerability of dapagliflozin, saxagliptin and metformin in combination: Post-hoc analysis of concomitant add-on versus sequential add-on to metformin and of triple versus dual therapy with metformin[J]. Diabetes Obes Metab, 2018, 20(6): 1542-6. |
| [32] |
Matthaei S, Catrinoiu D, Celiński A, et al. Randomized, DoubleBlind trial of triple therapy with saxagliptin add-on to dapagliflozin plus metformin in patients with type 2 diabetes[J]. Diabetes Care, 2015, 38(11): 2018-24. DOI:10.2337/dc15-0811 |
 2019, Vol. 39
2019, Vol. 39

