2. 南方医科大学南方医院急诊外科,广东 广州 510515
2. Department of Emergency Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
目前疼痛研究及脊髓损伤等相关动物模型研究中,常采用两种方式进行蛛网膜下腔反复给药:重复蛛网膜下腔穿刺以及蛛网膜下腔置管。蛛网膜下腔穿刺是一种很有效的给药途径,但是操作技术较为复杂,不易掌握[1-3]。Yaksh等[4]最早描述了蛛网膜下腔置管术,随后LoPachin等[5]对这种方法经行了改进。这种蛛网膜下腔置管的方法现已成为相关动物模型鞘内给药的主要方法,并被广泛采用[6-9]。然而,两种方法各有其优劣。譬如蛛网膜下腔重复穿刺不易确定其准确的进针位置及深度,而且操作本身可以引起压力诱导性下丘脑-垂体-肾上腺轴的改变[10],不利于研究与应激反应有关的指标。就留置管道而言,存在诸如导管脱离[11-12],神经损伤[13-14],以及较高的局部炎症发生率[15-16]等缺点。
Poon等[17]定义了三条标准以判断蛛网膜下腔给药途径的建立是否成功。首先,动物术后没有明显的运动及感觉功能障碍,没有脑脊液漏、膀胱功能障碍及自伤行为。其次,手术及实验期间动物没有明显的体质量变化。最后,椎管内给药途径建立后给药过程中不会有药物渗漏,药物能准确、足量到达指定的部位。本文即参照上述标准进行研究。
然而,对于腰椎蛛网膜下腔重复穿刺、椎板切除置管以及经皮置管三种给药方式的运用,目前不同的实验室及研究人员尚未统一,也没有相关的文献对之详细评估,不利于相关研究领域文献的综合评价。而且理想的给药方式对于后续实验也至关重要。因此本文将在严格的条件控制下,通过一系列标准实验对三种方法进行比较,找到最佳的给药手段。
1 材料和方法 1.1 建立三种蛛网膜下腔给药途径选择成年雄性SD大鼠(2月龄),动物称质量后计算合适的麻醉剂量[芬太尼(0.005 mg/mL)0.8 mL/kg肌注,咪达唑仑0.4(0.005 mg/mL)mL/kg皮下注射),用1 mL注射器分别取药,固定好大鼠,于尾侧大腿内侧肌肉注射芬太尼,待动物安静后在尾部皮下注射咪达唑仑。(1)重复穿刺:沿L4-L5椎间隙进针,后接20 mL注射器。针刺入硬脊膜后大鼠尾巴会突然摆动或形成“S"形[1]。重复穿刺间隔为1次/d。(2)椎板切除置管:以L4-L5为中心于后背正中切开约2 cm皮肤切口,分离牵开椎旁肌,暴露L4-L5椎板。将L4椎板全部切除,清除黄韧带及硬膜外脂肪组织,暴露蛛网膜及脊髓组织。PE-10管内注满生理盐水,直视下插入2 cm,跟腰椎穿刺一样,此时动物的尾巴或后肢会出现轻微抽动,作为进入的标志。用缝合线在置管周围多点固定,PE-10管末端用火烧灼封闭。将多余的PE-10管盘绕在大鼠的腰部皮下,并确保不打折,防止脱落,1号丝线缝合皮肤[18]。(3)经皮置管:沿L4-L5水平后背正中间切开皮肤,沿L4-L5棘突正中间垂直刺入导针,进入蛛网膜下腔有明确的突破感,并可见尾巴甩动。然后使导针头端向大鼠头端倾斜,用无菌的PE-10管自导针插入,当PE-10管进入蛛网膜下腔时可见尾巴甩动,然后继续向头端插入PE-10管,深入2.0 cm即可,此过程中可见后肢抽动。拔出导针,将PE-10管外端经皮下隧道由颈部皮下引出,用缝合线在插管处和颈部多点固定,热熔封闭PE-10管的末端。将多余的PE-10管盘绕在大鼠的腰部皮下,并确保不打折,1号丝线缝合皮肤[19]。三组大鼠术后均给与5万单位青霉素肌肉注射,持续5 d。
1.2 体质量测定分别于术前及术后第1、2、3、5、7、10、14天称量记录动物体质量。将24只大鼠随机分成4组:空白对照组,重复穿刺组,椎板切除置管组以及经皮置管组,每组6只,每只大鼠称量3次取平均值。
1.3 行为学评估为了比较手术对动物行为的影响,我们于术后第2天开始对实验大鼠的神经生物学行为进行评估。行为学评估主要观察大鼠激惹、痛觉过敏以及僵直发作。激惹通过观察是否有自发发声及烦乱不安的状态来判断;痛觉过敏表现为逃跑反射或者轻刺激大鼠侧面皮肤引起的发声反应。僵直发作的检验方法为:使大鼠的前爪略高于后爪诱发并观察是否出现。其强度由2 min内僵直发作的最长时间来衡量。如果僵直反应明显,则观察从僵直发作开始持续到第一次运动的时间间隔。最后,检验一些与手术本身相关的症状,包括术后病态、脑脊液漏、截瘫、膀胱功能障碍以及自伤行为。术后病态是指术后拒食、毛发凌乱以及少动。如有脑脊液漏,则可以观察到清凉液体从伤口周围及导管旁溢出[20]。后肢及尾巴的感觉运动功能丧失被视为截瘫。膀胱功能障碍主要检测排尿的频率,或者观察有无小便失禁和/或无尿[21]。大鼠自伤行为的评估分为轻、中、重3度[13]。
1.4 Rota-Rod跑步行为学测试分别于术前、术后第1、3、7、14天用Rota-Rod跑步仪(Ugo Basile)测试动物的运动平衡与协调功能(共24只大鼠,每组6只)。将大鼠放于匀速旋转的Rota-Rod跑步仪上,设置为加速旋转模式(10倍速,4~40 r/min)。测定大鼠从放置于跑步仪上开始到失去平衡从跑步仪上掉下的时间(RT),以及实验大鼠在跑步仪上持续5 min的数量(WS)[22-23]。动物术前训练2 d,每天3次,取平均值以获得稳定的基线值。接下来2周内对术后大鼠每天进行3次测试,RT值记录为Mean±SEM,WS值以百分比表示。
1.5 伤害感受性测试Rota-rod运动功能测试后,对24只大鼠(每组6只)行痛敏测试。对大鼠足底进行热照射刺激测试热痛敏[24-26]。通过机械性缩足反射阈值来评价大鼠机械痛敏[27]:用von Frey纤维丝刺激大鼠后肢足底中部,力度以能引起大鼠后肢出现缩足反应为宜。连续3次(其间间隔5 min),分别记录左右后肢机械刺激缩爪阈值(HWML)以及热刺激缩爪潜伏期(HWTL),记录时间分别在手术的第0、1、3、7及14天。最后取3次测量的平均值。
1.6 甩尾试验甩尾试验分别于第0(术前)、1、3、7、14天5个时间点进行,评价穿刺组与置管组的抗痛效应[28]。24只大鼠分为4组,每组6只放置于甩尾试验仪使之先习惯试验环境。一只75瓦的热辐射灯泡固定于距大鼠尾尖5 cm处,记录大鼠尾巴从热刺激到出现甩尾这一过程的时间(即甩尾潜伏期,TFL)。TFL由Ugo Basile甩尾痛觉测试仪(意大利)自动测量,切断值设定为20 s。
1.7 脊髓HE染色为了探究穿刺与长期置管是否引起脊髓背侧局部明显的炎症反应,我们分别于术前(0 d)术后(第1、3、7、14天)取材对腰髓行HE染色。大鼠用戊巴比妥麻醉后(35 mg/kg,静脉注射),取出脊髓,固定于10%福尔马林,然后石蜡包埋。组织切片(层厚4 μm)并行HE染色。选择L4/5部位的脊髓进行染色,每组每个时间点2只大鼠(每个时间点8只大鼠,共40只大鼠),分析大鼠脊髓背侧的炎症反应情况。于10倍显微镜(Olympus BH-2)视野下观察切片。图片由显微镜照相系统获取(TK-C1381EG; Victor Company of Japan Limited, Japan)。脊髓后角炎性细胞核数目的测量由高清晰度彩色病理图文分析系统(HPIAS-1000,华中科技大学)进行分析。
1.8 利多卡因麻痹测试所有的行为学实验结束后,各实验组均注射10 μL 2%利多卡因于蛛网膜下腔,空白对照组注射10 μL生理盐水。通过观察后肢及尾巴的瘫痪(通常几秒内出现,持续至少10 min)来确定腰椎穿刺或导管植入给药是否成功。
1.9 甲苯胺蓝染色实验最后通过穿刺针或PE-10管鞘内注射10 μL 1%甲苯胺蓝。大鼠用戊巴比妥麻醉(35 mg/kg,静脉注射)后处死,并用300 mL生理盐水37°灌流,整块取出脊髓,充分切片并检测对比染色范围。对照组注射10 μL生理盐水。
1.10 数据分析及统计数值变量取均值,手术组及对照组RT、BW、HWTL、HWML及TFL值的比较用重复测量方差分析,并行Dunnett's检验。WS间的差异用log-rank检验。不同组别脊髓背角炎症反应的差异用单因素方差分析,并行Student-Newman-Keuls multiple-range检验。P < 0.05被认为差异有统计学意义,实验过程中采取观察者盲法。
2 结果 2.1 体质量测定如图 1所示,与正常对照组相比,椎板切除置管组大鼠在术后第1~7天体质量明显下降,其中术后第3天体质量最轻(P=0.02,双向方差分析)。重复穿刺组及经皮置管组术后能够保持正常的摄食及饮水,体质量较为稳定。两组动物第1周内虽有轻度的体质量下降,但与正常对照组相比差异无显著性。
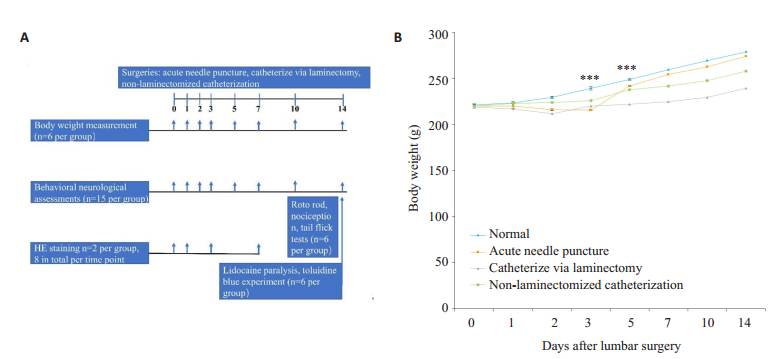
|
图 1 术后两周内大鼠体质量变化 Fig.1 Body weight within 2 weeks. A: Diagram of the experimental protocol; B: Body weight changes of the rats within 2 weeks after acute needle puncture, catheterization via laminectomy and catheterization without laminectomy. ***P < 0.05 vs Control |
如表 1所示,重复穿刺组及椎板切除置管组可引起明显的激惹、痛觉过敏及僵直发作。而经皮置管组不引起任何的异常行为,除了个别动物出现轻度激惹。表 2所示,经皮置管组死亡率只有6.7%(1/15),且只有13.3%(2/15)术后出现迟缓性轻瘫。仅观察到6.7%(1/ 15)的大鼠出现脑脊液漏,未发现膀胱功能障碍及自残行为。该组模型成功率达到73.3%(11/15),而重复穿刺组及椎板切除置管组分别只有26.7%及46.7%。
| 表 1 术后行为学异常发生情况 Tab.1 Postoperative behavioral abnormalities of the rats in the 3 groups |
| 表 2 术后相关并发症 Tab.2 Comparisons of postoperative neurological complications after the surgeries |
术前3组动物Rota-Rod运动功能测试结果没有差异。与经皮置管组相比,重复穿刺组及椎板切除置管组在术后7 d内(第1、3、7天)RT时间明显缩短(P < 0.01,双向方差分析)。与正常组相比虽然经皮置管组RT时间有轻度下降,但差异并无统计学意义(图 2)。
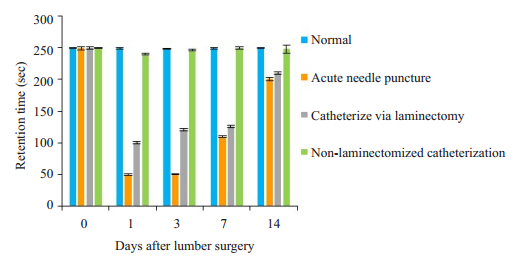
|
图 2 24只大鼠术后2周内RT值变化 Fig.2 Changes in endurance on the rotating rod of 24 rats within 2 weeks after the surgeries |
痛敏测试结果如图 3,对照组及经皮置管组术前及术后的热缩足潜伏期(HWTL)值非常接近,分别从8.3±0.9 s至9.0±0.6 s,8.4±0.9 s至9.1±1.4 s,两组之间没有差异。但重复穿刺组的HWTL从8.5±1.3 s降至4.7± 0.4 s,椎板切除置管组组从8.9±1.2 s降至3.7±0.5 s。在术后第1、3、7、14天该差异有显著性(P < 0.01,双向方差分析)。
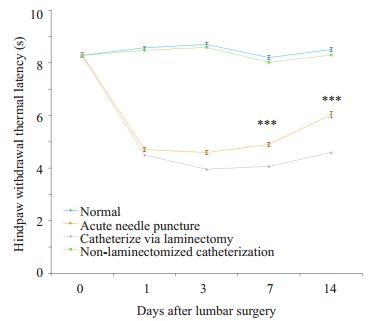
|
图 3 24只大鼠术前及术后第1、3、7、14天伤害性感受反射 Fig.3 Changes in rat hindpaw sensation at 1, 3, 7, and 14 days after the surgeries. ***P < 0.05 vs Control |
如图 4所示,重复穿刺组及椎板切除置管组脊髓背侧可见明显的炎症反应。术后7 d内多形核白细胞明显增加,而经皮置管组在术后不同时间段并没有发生剧烈的炎症反应,且与对照组相比,局部白细胞数目没有明显的增加。
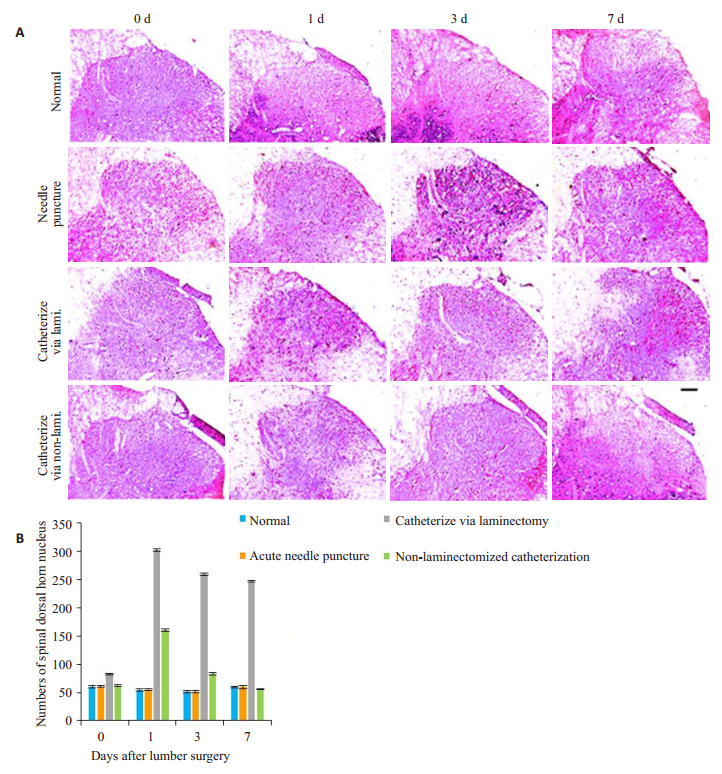
|
图 4 24只大鼠术前、术后第1、3、7天脊髓背侧HE染色(A)及各组炎性细胞计数(B) Fig.4 HE staining of L4/5 spinal cord sections (4 µm; A) and inflammatory cell counts (B) at 0, 1, 3 and 7 days after the surgeries. Scale bar=100 µm |
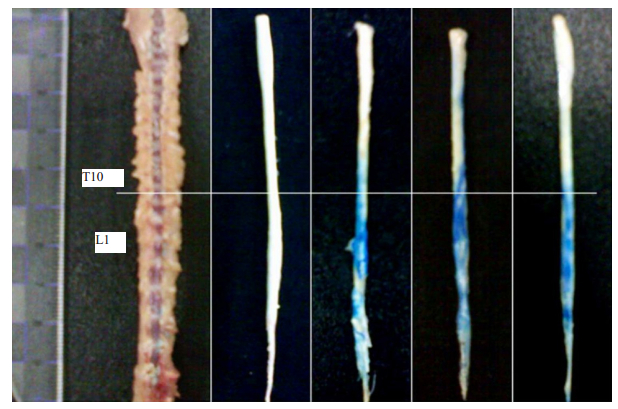
通过腰椎穿刺、椎板切除置管及经皮置管注入20 μL 1%甲苯胺蓝来判断脊髓受染的分布情况。注入的染料显示其染色蔓延至T10水平及骶尾部(图 5)。置管组腰髓组织的染色分布明显优于穿刺组。
|
图 5 经给药途径注入甲苯胺蓝后染料分布 Fig.5 Distribution of the dye after intrathecal TB injection via needle puncture, laminectomized catheterization and catheterization without laminectomy |
本文中我们比较了目前广泛采用的大鼠蛛网膜下腔三种给药操作方式,并根据文献报道[9]采用一系列标准测试来进行全面系统的评价。椎板切除置管,由于在直视下将导管送入蛛网膜下腔,能达到较高的给药精度,早期有不少文献采用此方法。但该方法由于造成额外损伤较大,影响后续实验,故逐渐应用减少。本文将其加入,以更详细的量化指标对三种方法进行评估,以供相关研究者参考。主要的观察指标包括体质量变化,神经功能,运动协调功能,伤害感受性反射,甩尾试验,局部炎症反应,给药精度(利多卡因麻痹测试以及腰髓染色试验)等。
实验结果表明,与椎板切除置管以及重复穿刺相比,经皮置管具有更高的成功率,并且能减少相应的并发症。最为明显的是,它能够大大降低大鼠的死亡率以及与给药途径相关的神经功能损害。三种给药方式之所以有这些差异,笔者认为有以下一些因素。首先,重复蛛网膜下腔穿刺给药在技术上有一定的困难,由于动物的个体差异,穿刺针的进针方向与深度常有变化。并且因为针管容易折弯,更增加了操作难度。其次,就椎板切除置管而言,由于椎板切除后使脊柱不稳定,暴露的脊髓于术后更容易受到额外损伤,并且具有较大的手术创伤。另外,椎板切除引起出血感染以及瘢痕形成,容易引起导管堵塞[29],影响后续给药。相比而言,经皮置管是一种微创的方式,避免了重复穿刺以及椎板切除带来的创伤,减少了对后续实验的干扰,给药途径稳定。
我们于术后两周内观察并比较了三组动物热痛敏及机械痛敏阈值的变化情况。经皮置管组除了第一天表现出轻度的痛觉过敏,其余时间对热痛及机械痛敏刺激均表现出良好的稳定性。重复腰椎穿刺常常引起压力诱导性激素水平变化,这会明显干扰与应激反应有关指标的研究。实验发现,重复穿刺及椎板切除置管组脊髓背侧在一周内有较高的炎症反应发生率,而经皮置管组未发现明显的炎症反应。有研究表明,注射器针管以及鞘内导管均会引起明显的炎症反应[30],但我们的实验结果并不支持这一结论。差异可能来源于选择观察炎症反应的时机不一样。但是,亦有文献报道植入导管可有效减少局部炎症反应[21],与我们的结论一致。
还有一种方法可以帮助我们判断是优先选择穿刺还是置管,即利多卡因运动麻痹实验。运动麻痹一般发生在给药15 s之内,20~30 min恢复[24],它可以协助我们确定药物是否已注入蛛网膜下腔,判断给药的精确性。注射2%利多卡因可引起大鼠后肢及尾巴不同程度的麻痹,就麻醉效率而言,除了腰椎穿刺组,置管组大鼠均具有较好的麻醉效果。重复穿刺组之所以麻醉效率较低,与其穿刺定位不准、药物部分注入椎管外有关。而且经皮置管组动物较另外两组的术后恢复也更快。另外一种广泛采用的方法是经给药通道注射甲苯胺蓝染料,之后处死动物,通过观察染料在脊髓表面的分布来定位穿刺针及导管的位置。注射染料后,只有定位准确的导管或穿刺针才能够得到精确的染色区域,并且所有的染料都进入椎管[30]。我们发现两种方法的实验结果是一致的。Xu等[30]发现于T13-L1水平注射20 μL染液可完全进入椎管内及马尾神经周围区域。本实验结果表明,虽然精确的穿刺及置管均可以将药物注入所需的部位,但是蛛网膜下腔重复穿刺较置管更容易造成额外的损伤,这也解释了前述感觉及运动实验结果的差异。
综上所述,本文所涉及的大鼠腰椎蛛网膜下腔3种给药方式各有其优劣。重复穿刺及经椎板切除置管在操作技术上具有较大难度,不易掌握。而经皮置管则不需要精确的穿刺技能,手术也更为容易,并且具有更低的术后死亡率,对运动及感觉功能的影响也更小,炎症反应也更轻微。因此我们认为经皮置管进行大鼠蛛网膜下腔重复给药的方法具有很高的实用性及可靠性,值得推广。
| [1] |
Mestre C, Pélissier T, Fialip J, et al. A method to perform direct transcutaneous intrathecal injection in rats[J]. J Pharmacol Toxicol Methods, 1994, 32(4): 197-200. DOI:10.1016/1056-8719(94)90087-6 |
| [2] |
Hou Y, Wang L, Gao J, et al. A modified procedure for lumbar intrathecal catheterization in rats[J]. Neurol Res, 2016, 38(8): 725-32. DOI:10.1080/01616412.2016.1196870 |
| [3] |
Mazur C, Fitzsimmons B, Kamme F, et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat[J]. J Neurosci Methods, 2017, 280: 36-46. DOI:10.1016/j.jneumeth.2017.02.001 |
| [4] |
Yaksh TL, Rudy TA. Chronic catheterization of the spinal subarachnoid space[J]. Physiol Behav, 1976, 17(6): 1031-6. DOI:10.1016/0031-9384(76)90029-9 |
| [5] |
Lopachin RM, Rudy TA, Yaksh TL. An improved method for chronic catheterization of the rat spinal subarachnoid space[J]. Physiol Behav, 1981, 27(3): 559-61. DOI:10.1016/0031-9384(81)90350-4 |
| [6] |
Størkson RV, Kjørsvik A, Tjølsen A, et al. Lumbar catheterization of the spinal subarachnoid space in the rat[J]. J Neurosci Methods, 1996, 65(2): 167-72. DOI:10.1016/0165-0270(95)00164-6 |
| [7] |
Lv J, Li Z, She S, et al. Effects of intrathecal injection of rapamycin on pain threshold and spinal cord glial activation in rats with neuropathic pain[J]. Neurol Res, 2015, 37(8): 739-43. DOI:10.1179/1743132815Y.0000000052 |
| [8] |
Thomas AA, Detilleux J, Sandersen CF, et al. Minimally invasive technique for intrathecal administration of morphine in rats: practicality and antinociceptive properties[J]. Lab Anim, 2017, 51(5): 479-89. DOI:10.1177/0023677216682771 |
| [9] |
Lee JY, Kim SW, Kim SP, et al. A rat model of chronic syringomyelia induced by epidural compression of the lumbar spinal cord[J]. J Neurosurg Spine, 2017, 27(4): 458-67. DOI:10.3171/2016.9.SPINE16188 |
| [10] |
Tsigos C, Chrousos GP. Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress[J]. J Psychosom Res, 2002, 53(4): 865-71. DOI:10.1016/S0022-3999(02)00429-4 |
| [11] |
Asato F, Butler M, Blomberg H, et al. Distribution of intrathecal catheter positions in rat[J]. Acta Anaesthesiol Scand, 2001, 45(5): 608-11. DOI:10.1034/j.1399-6576.2001.045005608.x |
| [12] |
Erdivanli B, Altun M, Sezen OK, et al. Anti-nociceptive, analgesic and pathohistological effects of intrathecal dexmedetomidine and bupivacaine in rats[J]. Braz J Anesthesiol (Elsevier), 2013, 63(2): 183-7. DOI:10.1016/S0034-7094(13)70212-5 |
| [13] |
Gonzalez-Darder JM. Gomez-Cardenas E, Gil-Salu J L.microsurgical catheterization of the intrathecal space in the rat for chronic infusion of drugs[J]. Rev Esp Anestesiol Reanim, 1989, 36(3): 153-6. |
| [14] |
Kopach O, Krotov V, Voitenko N. Atlanto-occipital catheterization of young rats for long-term drug delivery into the lumbar subarachnoid space combined with in vivo testing and electrophysiology in situ[J]. J Neurosci Methods, 2017, 290: 125-32. DOI:10.1016/j.jneumeth.2017.08.001 |
| [15] |
Jones LL, Tuszynski MH. Chronic intrathecal infusions after spinal cord injury cause scarring and compression[J]. Microsc Res Tech, 2001, 54(5): 317-24. DOI:10.1002/jemt.1144 |
| [16] |
Yan L, Li X, Wang J, et al. Immunomodulatory effectiveness of tacrolimus in preventing epidural scar adhesion after laminectomy in rat model[J]. Eur J Pharmacol, 2013, 699(1/3): 194-9. |
| [17] |
Poon YY, Chang AY, Ko SF, et al. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat[J]. Anesth Analg, 2005, 101(1): 155-60. |
| [18] |
Hinton JL, Warejcka DJ, Mei Y, et al. Inhibition of epidural scar formation after lumbar laminectomy in the rat[J]. Spine (Phila Pa 1976), 1995, 20(5): 564-70. DOI:10.1097/00007632-199503010-00011 |
| [19] |
Sakura S, Hashimoto K, Bollen AW, et al. Intrathecal catheterization in the rat. Improved technique for morphologic analysis of druginduced injury[J]. Anesthesiology, 1996, 85(5): 1184-9. DOI:10.1097/00000542-199611000-00028 |
| [20] |
Ozisik PA, Inci S, Soylemezoglu F, et al. Comparative dural closure techniques: a safety study in rats[J]. Surg Neurol, 2006, 65(1): 42-7. DOI:10.1016/j.surneu.2005.04.047 |
| [21] |
Gevaert T, Ost D, De Ridder D. Comparison study of autonomous activity in bladders from normal and paraplegic rats[J]. Neurourol Urodyn, 2006, 25(4): 368-78. DOI:10.1002/nau.20206 |
| [22] |
Kitamura Y, Yanagisawa D, Inden M, et al. Recovery of focal brain ischemia-induced behavioral dysfunction by intracerebroventricular injection of microglia[J]. J Pharmacol Sci, 2005, 97(2): 289-93. DOI:10.1254/jphs.SC0040129 |
| [23] |
Yanagisawa D, Kitamura Y, Inden M, et al. DJ-1 protects against neurodegeneration caused by focal cerebral ischemia and reperfusion in rats[J]. J Cereb Blood Flow Metab, 2008, 28(3): 563-78. DOI:10.1038/sj.jcbfm.9600553 |
| [24] |
Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J]. Pain, 1988, 32(1): 77-88. |
| [25] |
Ma Z, Li Y, Zhang YP, et al. Thermal nociception using a modified Hargreaves method in primates and humans[J]. Funct Neurol, 2015, 30(4): 229-36. |
| [26] |
Zhang S, Yang XN, Zang T, et al. Astroglial MicroRNA-219-5p in the ventral tegmental area regulates nociception in rats[J]. Anesthesiology, 2017, 127(3): 548-64. DOI:10.1097/ALN.0000000000001720 |
| [27] |
Pitcher GM, Ritchie J, Henry JL. Paw withdrawal threshold in the von Frey hair test is influenced by the surface on which the rat stands[J]. J Neurosci Methods, 1999, 87(2): 185-93. DOI:10.1016/S0165-0270(99)00004-7 |
| [28] |
Cecchi M, Capriles N, Watson SJ, et al. Differential responses to morphine-induced analgesia in the tail-flick test[J]. Behav Brain Res, 2008, 194(2): 146-51. DOI:10.1016/j.bbr.2008.06.034 |
| [29] |
Yaksh TL, Provencher JC, Rathbun ML, et al. Pharmacokinetics and efficacy of epidurally delivered sustained-release encapsulated morphine in dogs[J]. Anesthesiology, 1999, 90(5): 1402-12. DOI:10.1097/00000542-199905000-00025 |
| [30] |
Xu JJ, Walla BC, Diaz MF, et al. Intermittent lumbar puncture in rats: a novel method for the experimental study of opioid tolerance[J]. Anesth Analg, 2006, 103(3): 714-20. DOI:10.1213/01.ane.0000226100.46866.ea |
 2019, Vol. 39
2019, Vol. 39

