创伤失血性休克患者病情进展较急,一直以来都是急诊外科和创伤外科重点关注的急危重症,也是引起患者死亡的重要原因。近年来,随着创伤失血性休克研究的不断深入和发展,其导致的死亡率已有所下降,但发病率仍在上升[1]。据世界卫生组织(WHO)的数据统计,创伤导致全球死亡人数约580万/年,到2020年,将超过800万。研究统计发现全球死于失血性休克的患者每年约190万[2]。通过对创伤失血性休克患者死亡原因的调查,我们发现早期未有效控制失血而继发一系列炎症反应是引起其高死亡率的主要原因[3]。目前,国内外研究创伤失血性休克的主要热点集中在如何早期控制失血、限制性液体复苏、改善微循环[4]及抑制炎症过度释放[5],阻断全身炎症反应综合征发展至多器官衰竭(MOF),以降低患者死亡率[6]。然而,真正关注于创伤失血性休克限制性液体复苏及其信号通路减轻炎症级联反应的文章目前还未见报道。
醋酸钠林格液的渗透压与血浆等渗,含有的钠、钾、氯等离子与血浆中的浓度接近,可在有效扩容的基础上,维持水电解质平衡,减轻组织损伤,提高生存率[7-8],是液体复苏的“第一线”晶体液[9]。我们团队的早期研究也已证实使用醋酸钠林格液行限制性液体复苏的效果优于乳酸钠林格液、生理盐水等。尿胰蛋白酶抑制剂乌司他丁具有平衡炎症、调节免疫[10-11]、改善微循环及组织灌注的作用[12-13]。现已广泛应用于烧伤、胰腺炎、脓毒症休克等疾病引起的炎症反应,以减少多脏器功能障碍的发生发展。本研究在限制性液体复苏的基础上联用乌司他丁,希望能在改善微循环灌注的同时,进一步抑制炎症介质过度释放,以提高对创伤性失血性休克的救治水平,并初步探索乌司他丁的作用机制。
miR-146是一种内源性单链非编码小分子RNA,通过特异性作用于靶标,调控下游基因和蛋白的表达,参与机体信号通路和炎症介质调节,其中miR-146a是目前研究最为前沿和广泛的小分子RNA之一。Zheng等[14]研究发现:miR-146a可通过下调TLR4/TRAF6/NF-kB信号通路,减少兔小肠缺血再灌注损伤。Nunns等[15]研究发现,肺组织是失血性休克发生后最易受损的器官,也是表现最明显的器官之一。因此针对miR-146a/ TLR4/NF-κB信号通路研究乌司他丁对创伤失血性休克大鼠肺炎性介质的作用是可行的。
本实验中,我们成功建立了创伤失血性休克大鼠模型,通过限制性液体复苏联合乌司他丁干预,观察休克大鼠及其在实施干预措施后的信号通路及炎症介质变化,并探讨其可能机制,以便为休克患者的肺组织损伤寻求更多更有效的针对性治疗措施。
1 材料和方法 1.1 实验动物选取健康SD大鼠72只,SPF级,雌雄不限,体质量240±20 g,年龄7~9周(上海杰思捷实验动物有限公司提供),在室温24±1 ℃,湿度(40%~60%)和12 h光照(7 am~7 pm)/黑暗周期循环的受控条件下将实验动物饲养7 d,然后进行实验。给大鼠提供颗粒状大鼠食物,随意饮水。失血性休克模型于上午7:00建立。所有实验操作均按照“医学实验动物护理和使用指南”进行,并经中国安徽省蚌埠市蚌埠医学院实验动物管理及伦理委员会批准。
1.2 实验设备及试剂Medlab-u/2cs生物信号采集处理系统(美易);台式高速冷冻离心机和核酸浓度测定仪(Thermo Fisher);实时定量荧光PCR仪(ABI);微型高速离心机(sybr Green);全功能化学发光及荧光生物图像分析系统(复日);乌司他丁(天普);醋酸钠林格液(康源);TRIzol Reagent(Invitrogen);所有其他化学品均为试剂级。
1.3 动物分组与模型建立采用随机数字表法选取大鼠进行实验,分为休克不复苏组(SR,n=24),醋酸钠林格液组(AR,n=24),乌司他丁组(UR,n=24)。失血性休克模型的术前准备:大鼠称重后,用戊巴比妥钠(50 mg/1 kg)腹腔注射联合异氟醚吸入麻醉大鼠,麻醉成功后将大鼠仰卧位固定于手术台上,给予大鼠双侧腹股沟区备皮、消毒、铺巾,切开两侧腹股沟处皮肤,钝性游离出股动脉、股静脉后,分别予以置管、固定,注射少许2.5%的枸橼酸钠葡萄糖注射液,确保实验期间管腔通畅。右侧股动脉置管连接于Medlab-u/2cs生物信号采集处理系统(使用前予以调零及换能器定标),用以持续监测平均动脉压(MAP)(测压系统中的冲洗液为2.5%的枸橼酸钠葡萄糖注射液),右侧股静脉用于休克后的液体复苏,左侧股动脉用于放血诱导休克,左侧股静脉连接微量泵。整个手术期间室温维持在25 ℃,手术器械均已提前高温灭菌。
休克及复苏模型的建立:置管成功后,静置大鼠20 min适应。用2 mL注射器(内含橼酸钠溶液0.2 mL)从股动脉以2 mL/3 min速度缓慢放血,直到血压达30~ 40 mmHg,这一过程大概需要20 min。通过缓慢、间断、少量放血或回输自体血维持MAP在30~40 mmHg之间60 min后,SR组不予液体复苏,分别观察1、4、6 h(若动物死亡则动物死亡即刻)后取大鼠肺组织。而AR组、UR组分别采用醋酸钠林格液、乌司他丁联合醋酸钠林格液进行限制性复苏(30 min完成),其中前者在左侧股静脉推注2 mL生理盐水(5 min内),后者在左侧股静脉静推乌司他丁100 000 U/kg(2 mL生理盐水稀释,5 min内),两者右侧股静脉均输注醋酸钠林格液(以复苏液体量:失血量=3:1,30 min内)。复苏成功后分别观察1、4、6 h后取大鼠肺组织。在整个实验过程中,为弥补手术区域及呼吸道液体丢失,使用微量泵通过左侧股静脉泵入生理盐水5 mL/(kg·h)。
1.4 实验方法及观察指标利用实时荧光定量PCR检测肺组织中miR-146a、TNF-α、IL-1、IL-4、IL-6、IL-10的mRNA含量,应用Western blot检测肺组织TLR4、MyD88、IκB-α、p-IκB-α、NF-κB p65、IRAK4、p-IRAK4(Thr342)、p-IRAK4(Thr345、Ser346)及TRAF6的蛋白表达水平。在光镜下对3组肺组织进行组织形态学观察。
1.5 肺组织中TNF-α、IL-1、IL-4、IL-6及IL-10的mRNA表达水平获取肺组织标本后,按Trizol法分离提取总RNA,根据反转录试剂盒(Invitrogen)说明书将RNA逆转录成cDNA后,行qPCR扩增。GAPDH作为扩增引物:F:5' CCT CTA TGC CAA CAC AGT 3',R:5' AGC CAC CAA TCCA CAC AG 3';TNF-α:F:5' GAC TCT GAC CCC CAT TAC TCT 3',R:5' TGT TTC TGA GCA TCG TAG TTG T 3';IL-1:F:5' GGG CTA ACT AAG GGA TAA GAC AA 3',R:5' CCA CTG AGG TAG GAA AGA TGT AG 3';IL-4:F:5' ACC CTG TTC TGC TTT CTC ATA 3',R:5' TTT TCT GTG ACC TGG TTC AA 3';IL-6:F:5' CAC CCA CAA CAG ACC AGT A 3',R:5' GAA GCA TCC ATC ATT TCT TT 3';IL-10:F:5' GAC AAC ATA CTG CTG ACA GAT TC 3',R:5' GCT GTA TCC AGA GGG TCT TC 3';miR-146a:F:5' GGG GGG TGA GAA CTG AAT 3',R:5' TCG TAT CCA GTG CGT GTC 3'。按照95 ℃ 1 min预变性,95 ℃ 15 s变性,60 ℃ 30 s延伸,循环40次;绘制溶解曲线(95 ℃ 15 s—60 ℃ 1 min—95 ℃ 15 s)。反应结束后,读取Ct值并计算mRNA的表达量。
1.6 肺组织中TLR4、MyD88、IκB-α、p-IκB-α、NF-κB p65、IRAK4、p-IRAK4(Thr342)、p-IRAK4(Thr345、Ser346)、TRAF6的蛋白表达取冻存的肺组织约100 mg,用PBS冲洗两次,置于匀浆管壶腹部后剪碎,加入1 mL RIPA裂解液,置于冰上研磨。抽提肺组织蛋白,在4 ℃离心机中以12 000 r/min离心10 min后,取上清液,根据BCA蛋白质定量试剂盒对蛋白质进行定量分析,检测蛋白浓度。采用10%分离胶和4%的浓缩胶行SDS-PAGE凝胶电泳,电泳后采用湿式转膜法转至PVDF膜。将5%脱脂奶粉封闭液置于摇床上封闭2 h,加入对应的一抗,4 ℃摇床孵育过夜后,用TBST洗涤膜3次,加入相应的二抗,室温孵育1 h后,再用TBST洗涤膜3次。通过增强的化学发光法(ECL)在暗室进行曝光、显影及定影获得胶片,并用FluorChem灰度分析软件进行分析。目的蛋白与β-actin的灰度比值即为蛋白相对表达量。
1.7 肺组织病理学检查肺组织经4%多聚甲醛溶液固定、石蜡包埋、切片后HE染色,在光镜下观察肺组织病理学变化。
1.8 统计学方法采用SPSS 23.0统计软件对所得数据进行分析处理,结果以均数±标准差表示,在不同时间点进行多组间与组内重复测量多因素方差分析。P < 0.05表示差异具有统计学意义。
2 结果 2.1 肺组织miR-146a mRNA、TNF-α mRNA、IL-1mRNA、IL-4mRNA、IL-6mRNA、IL-10 mRNA的表达在T0至T2期,3组大鼠肺组织中,UR组的miR-146a和抑炎因子(IL-4、IL-10)的表达明显高于AR组和SR组(P < 0.05),而促炎因子(TNF-α、IL-1、IL-6)的表达明显低于另外两组(P < 0.05,表 1)。
| 表 1 3组肺组织中miR-146a mRNA、TNF-α mRNA、IL-1 mRNA、IL-4 mRNA、IL-6 mRNA、IL-10 mRNA的表达水平 Tab.1 Expression levels of miR-146a, TNF-α, IL-1, IL-4, IL-6, and IL-10 mRNAs in the lung tissues of the 3 groups (Mean±SD, n=24) |
Western blot结果显示,在UR组中,TLR4、MyD88、p-IκB-α、NF-κB p65、IRAK4及TRAF6的蛋白表达量在6 h内,随着时间的延长,相比SR组明显降低(P < 0.01),且较AR组有显著优势(P < 0.05)。在6 h内,相比SR组,IκB-α、p-IRAK4(Thr342)及p-IRAK4(Thr345、Ser346)的蛋白表达量在UR组中明显升高(P < 0.01),且较AR组的表达升高(P < 0.05,图A~I)。
2.3 肺组织病理学改变在光镜下观察:SR组1 h时可见肺泡腔内红细胞及炎性细胞渗出,毛细血管扩张充血,肺间质水肿,间隔稍增宽,组织内炎性细胞浸润;4 h时见肺泡壁增厚,结构紊乱,肺间隔增宽,炎性细胞呈点灶状聚集浸润;6 h时见较多肺泡断裂、萎陷不张,大量炎性细胞呈片状滞留于肺间质,微血管内可见透明血栓形成。休克后使用醋酸钠林格液复苏,肺泡结构在相应时段均较SR组稍有改善,1 h时,AR组肺泡壁稍增厚,肺泡结构尚完整,肺间质水肿、渗出,可见炎性细胞浸润;4 h时,肺组织间隔略增宽,肺泡周围可见炎性细胞浸润;6 h时,肺泡腔清晰,周围可见散在炎性细胞渗出、浸润。UR组复苏休克较SR组有明显改善,1 h时肺泡腔尚清晰,肺泡壁略增厚,肺泡内红细胞及炎症细胞渗出较SR组降低,炎症细胞浸润也有所改善;4 h时,肺泡炎症有明显改善,但可见毛细血管扩张、充血,肺泡内可见红细胞;6 h时,肺泡腔结构清晰,肺泡壁薄,但腔内仍可见少许红细胞渗出(图 1)。
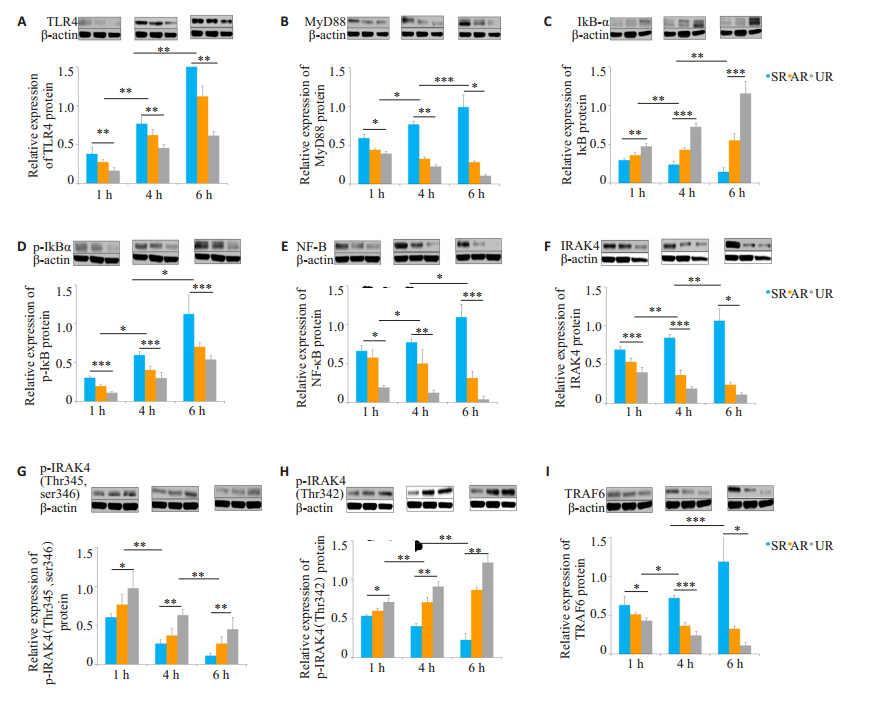
|
图 1 在不同时间点,各组大鼠肺组织中蛋白的表达和定量分析 Fig.1 Protein expression and quantitative analysis in the lung tissues of rats in each group at different time points A: TLR4; B: MyD88; C: IκB; D: p-IκB; E: NF-κB; F: IRAK4; G: p-IRAK4 (Thr345, ser346); H: p-IRAK4 (Thr342); I: TRAF6. *P < 0.01, **P < 0.01, ***P < 0.01. |
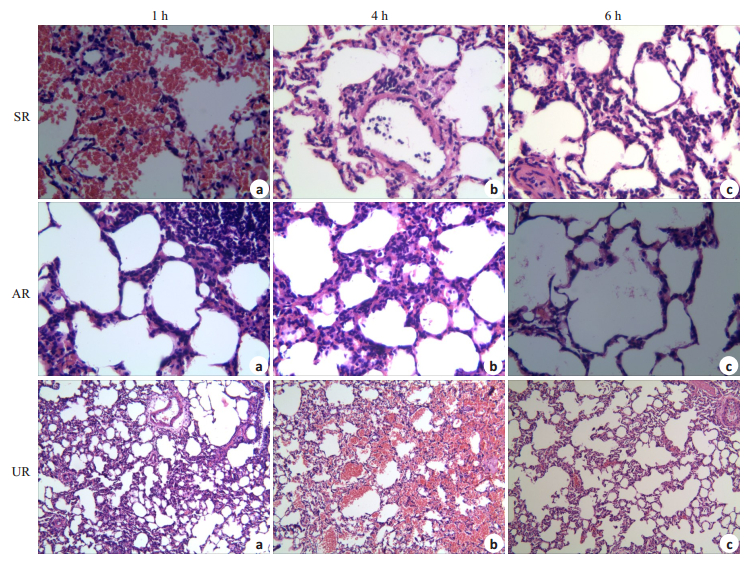
|
图 2 光镜下肺组织的病理学改变 Fig.2 Pathological examination of the pulmonary tissues under light microscope at 1 h (a), 4 h (b), and 6 h (c) after shock onset |
创伤失血性休克的实质是创伤导致机体大量失血而引起有效循环血量减少、组织灌注不足及微循环功能障碍的同时激活体内诸如中性粒细胞、单核/巨噬细胞等释放出大量以白细胞介素和肿瘤坏死因子(TNF-α)为主的炎症介质,引发炎症级联反应,导致全身炎症反应(SIRS),如不及时处理,可进一步发展为全身多器官功能障碍(MODS)[16-17],乃至死亡。因此,失血性休克救治的理想效果在于改善组织灌注的同时调节体内的炎症水平,避免组织器官发展至不可逆性损伤,改善患者预后,降低病死率[18]。本实验中,通过限制性液体复苏联用乌司他丁恰好符合失血性休克的救治理念。此外,肺组织病理结果也显示了休克组的肺组织损伤明显,醋酸钠林格液组较休克组减轻,乌司他丁组的肺组织炎性浸润最轻。
炎症介质在创伤应激、微循环障碍的发生发展中承担着重要的作用。在创伤失血性休克发生时,机体会释放出大量诸如IL-1、IL-6、TNF-α等促炎因子,其中尤以肺组织促炎因子聚集表现最为明显[19]。IL-4和IL-10属于抑炎因子,增强其表达可抑制促炎因子的产生[20-21],平衡炎症,以保护肺组织。Wang等[22]研究胰腺炎时,发现乌司他丁可降低TNF-a、IL-6、IL-8的释放,促进IL-10释放。研究表明乌司他丁在胰腺炎、脓毒症休克等疾病的治疗中,具有减轻炎症反应,保护肺组织的作用[23-24]。然而,乌司他丁对创伤失血性休克炎症因子方面的研究明显不足,尤其缺乏在时间轴上观察炎症因子的变化。本实验的表一中数据可以明显观察到随时间延长(6 h内),休克组肺组织中的促炎因子IL-1、IL-6及TNF-α的mRNA表达水平逐渐升高,抑炎因子IL-4和IL-10的mRNA表达水平降低。醋酸钠林格液组促炎因子的表达水平较休克组减少,抑炎因子升高。乌司他丁组的促炎因子的表达水平最低,抑炎因子的表达水平最高。实验结果表明乌司他丁能在限制性液体复苏的基础上进行性降低促炎因子的释放,增强抑炎因子的表达,减轻肺组织的炎性损伤。
目前的临床和实验研究表明,MiR-146a一方面可抑制靶标IRAK-1和TRAF-6的表达,降低促炎因子IL- 1、IL-6、TNF-α的释放,保护肺组织[25],另一方面可减轻创伤引起的炎症性疼痛[26]。在缺血再灌注损伤时,机体代偿性提高miR-146a的表达,抑制其靶标IRAK-1的表达,降低p-IκB和NF-κB的表达,减少促炎因子IL-1、IL-6、TNF-α的释放,提示miR-146a是机体缺血再灌注损伤治疗的潜在靶点[27]。miR- 146a的直接靶标是IL- 6mRNA,且过表达的miR-146a可降低IL-6的表达[28]。抑炎因子IL-10可诱导miR-146a表达[29],促炎因子IL-1和IL-6受IRAK4调节,TNF-α主要依赖于TLR4的活化[30-31],活化后的TNF-α可诱导降解NF-κB抑制剂(IκB),增强NF-κB的转录活性,正反馈刺激机体促炎因子“瀑布样”释放,而MyD88是TLR4的衔接蛋白,主要用于促炎信号转导[32]。TRAK6缺乏,可导致MyD88降解增强[33]。IRAK4可被IL-1R和Toll样受体磷酸化,有趣的是,即使IRAK4激酶活性被完全抑制,也不抑制IL-1诱导的IL-6产生和NF-κB活化,但当IRAK4缺乏时,上述反应会完全消失[34]。创伤失血性休克能促使炎症介质的释放多由于触发机体信号通路引起,且这些信号通路与炎症介质相互影响,但具体联系尚不明确。本实验数据已显示了乌司他丁组中miR-146a的mRNA表达水平明显高于醋酸钠林格液组和休克组,IκB、p-IRAK4(Thr342)及p-IRAK4(Thr345、ser346)的蛋白表达水平也较两组显著升高,但p-IκB、IRAK-4及TRAF6的蛋白表达水平较两组降低。在炎症因子的研究基础上,提示了乌司他丁可能通过影响miR-146a的mRNA表达,作用于特异性靶标IRAK-4及TRAF6,调控下游炎症因子的基因表达,减轻肺组织损伤。
TLR4/MyD88/NF-kB信号通路是介导炎症释放的最重要信号通路之一[35]。Huang等[36]研究中发现TLR4可通过激活MyD88/NF-κB信号通路,释放大量IL-1、IL-6、TNF-α等促炎因子而加重肺组织损伤,相反,当使用抗TLR4 mAb时,促炎因子释放量减少,肺组织损伤也会减轻。MyD88作为TLR4的关键衔接蛋白,现在已经成为肺部炎症性疾病治疗的重要靶点[37]。据报道当缺血发生时,MyD88的表达上调,可增加促炎因子的释放;若阻遏MyD88的表达,可增加抑炎因子如IL-4、IL-10的释放[38]。NF-κB常以p50/p65两个亚基组成的异二聚体形式存在,且p65具有最强的转录活性,现已被证实是机体介导炎症反应的枢纽,在急性肺损伤中起关键作用[39]。本实验中,我们观察到TLR4、MyD88和NF-κB p65在乌司他丁组的组织中蛋白表达水平较休克组于醋酸钠林格液组明显减低,提示乌司他丁可能通过抑制TLR4/NF-κB信号通路减轻休克大鼠肺组织损伤。
综上所述,一方面,我们推测乌司他丁可能通过提高miR-146a的表达,特异性作用于靶标IRAK-4和TRAF6,使IκB磷酸化降低,进而抑制TLR4/NF-κB信号通路的活化,减少促炎因子的产生,增加抑炎因子的释放,从而逆转炎症介质表达失衡,减轻创伤失血性休克大鼠肺的炎性损伤。此实验结果证实了乌司他丁可明显减轻创伤失血性休克大鼠肺的炎性损伤,为临床上应用乌司他丁治疗创伤失血性休克提供重要的理论依据;另一方面,miR-146a相关信号通路的机制研究结果为临床治疗提供了新的靶点,为创伤失血性休克的治疗提供了一个新的思路,为以后靶向治疗及精准医学的发展提供了一个新的契机。但考虑miR-146a参与调控基因表达和信号通路的机制十分复杂,当前的研究尚处于初步阶段,仍需深入研究以更好的明确其作用机制。
| [1] |
Divo MJ, Martinez CH. Ageing and the epidemiology of multimorbidity[J]. Eur Respir J, 2014, 44(4): 1055-68. DOI:10.1183/09031936.00059814 |
| [2] |
Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the global burden of disease study 2010[J]. Lancet, 2012, 380(9859): 2095-128. DOI:10.1016/S0140-6736(12)61728-0 |
| [3] |
Fox EE, Holcomb JB, Wade CE, et al. Earlier endpoints are required for hemorrhagic shock trials among severely injured patients[J]. Shock, 2017, 47(5): 567-73. DOI:10.1097/SHK.0000000000000788 |
| [4] |
Hutchings SD, Naumann DN, Hopkins P, et al. Microcirculatory impairment is associated with multiple organ dysfunction following traumatic hemorrhagic shock: the Microshock study[J]. Crit Care Med, 2018, 46(9): E889-96. DOI:10.1097/CCM.0000000000003275 |
| [5] |
Lord JM, Midwinter MJ, Chen YF, et al. The systemic immune response to trauma: an overview of pathophysiology and treatment[J]. Lancet, 2014, 384(9952): 1455-65. DOI:10.1016/S0140-6736(14)60687-5 |
| [6] |
Cannon JW. Hemorrhagic shock[J]. N Engl J Med, 2018, 378(4): 370-81. DOI:10.1056/NEJMra1705649 |
| [7] |
Mccague A, Dermendjieva M, Hutchinson R, et al. Sodium acetate infusion in critically ill trauma patients for hyperchloremic acidosis[J]. Scand J Trauma Resusc Emerg Med, 2011, 19(1): 24-35. DOI:10.1186/1757-7241-19-24 |
| [8] |
Rohrig R, Wegewitz C, Lendemans S, et al. Superiority of acetate compared with lactate in a rodent model of severe hemorrhagic shock[J]. J Surg Res, 2014, 186(1): 338-45. DOI:10.1016/j.jss.2013.09.005 |
| [9] |
Kusza K, Mielniczuk M, Krokowicz LA, et al. Ringer's lactate solution enhances the inflammatory response during fluid resuscitation of experimentally induced haemorrhagic shock in rats[J]. Arch Med Sci, 2018, 14(3): 655-70. DOI:10.5114/aoms.2017.69771 |
| [10] |
Feng Z, Shi Q, Fan Y, et al. Ulinastatin and/or thymosin α1 for severe sepsis: a systematic review and meta- analysis[J]. J Trauma Acute Care Surg, 2016, 80(2): 335-40. DOI:10.1097/TA.0000000000000909 |
| [11] |
Liu WS, Pang GZ, Wang SY, et al. Protective effect of ulinastatin on severe pulmonary infection under immunosuppression and its molecular mechanism[J]. Exp Ther Med, 2017, 14(4): 3583-8. DOI:10.3892/etm.2017.4993 |
| [12] |
Li XF, Su LK, Zhang XJ, et al. Ulinastatin downregulates TLR4 and NF- kB expression and protects mouse brains against ischemia/ reperfusion injury[J]. Neurol Res, 2017, 39(4): 367-73. DOI:10.1080/01616412.2017.1286541 |
| [13] |
Li XF, Zhang XJ, Zhang C, et al. Ulinastatin protects brain against cerebral ischemia/reperfusion injury through inhibiting MMP-9 and alleviating loss of ZO- 1 and occludin proteins in mice[J]. Exp Neurol, 2018, 302(3): 68-74. |
| [14] |
Zheng Y, Liu S. miR-146a protects small intestine against ischemia/ reperfusion injury by down- regulating TLR4/TRAF6/NF- κB pathway[J]. J Cell Physiol, 2018, 233(3): 2476-88. DOI:10.1002/jcp.26124 |
| [15] |
Nunns GR, Stringham JR, Gamboni F, et al. Trauma and hemorrhagic shock activate molecular association of 5- lipoxygenase and 5- lipoxygenase-activating protein in lung tissue[J]. J Surg Res, 2018, 229(1): 262-70. |
| [16] |
Almahmoud KW, Namas RA, Abdul- Malak OM, et al. Impact of injury severity on dynamic inflammation networks following blunt trauma[J]. Shock, 2014, 41(2): 75-6. |
| [17] |
Langgartner D, Wachter U, Hartmann CA, et al. Effects of psychosocial stress on subsequent hemorrhagic shock and resuscitation in male mice[J]. Shock, 2019, 51(6): 725-30. DOI:10.1097/SHK.0000000000001204 |
| [18] |
Khetarpal R. Fluid management in patients with trauma:restrictive versus liberal approach[J]. J Anaesthesiol Clin Pharmacol, 2015, 31(3): 308-16. DOI:10.4103/0970-9185.161664 |
| [19] |
Wu XW, Schwacha MG, Dubick MA, et al. Trauma-related acute lung injury develops rapidly irrespective of resuscitation strategy in the rat[J]. Shock, 2016, 46(3, 1): 108-14. |
| [20] |
Ip W, Hoshi N, Shouval DS, et al. Anti-inflammatory effect of IL- 10 mediated by metabolic reprogramming of macrophages[J]. Science, 2017, 356(6337): 513-9. DOI:10.1126/science.aal3535 |
| [21] |
Zlotnik A, Mosmann TR. Pillars article:IL- 10 inhibits cytokine production by activated macrophages[J]. J Immunol, 2016, 197(5): 1539-46. |
| [22] |
Wang G, Liu Y, Zhou SF, et al. Effect of somatostatin, ulinastatin and gabexate on the treatment of severe acute pancreatitis[J]. Am J Med Sci, 2016, 351(5): 506-12. DOI:10.1016/j.amjms.2016.03.013 |
| [23] |
Jiang W, Yu XY, Sun TW, et al. ADJunctive ulinastatin in sepsis treatment in China (ADJUST study): study protocol for a randomized controlled trial[J]. Trials, 2018, 19(1): 133-45. DOI:10.1186/s13063-018-2513-y |
| [24] |
周耿标, 徐秋林, 刘亚楠, 等. 乌司他丁对重症中暑小鼠急性肺损伤的保护作用[J]. 南方医科大学学报, 2015, 35(9): 1277-82. DOI:10.3969/j.issn.1673-4254.2015.09.012 |
| [25] |
Zeng Z, Gong HH, Li Y, et al. Upregulation of miR- 146a contributes to the suppression of inflammatory responses in LPSinduced acute lung injury[J]. Exp Lung Res, 2013, 39(7): 275-82. DOI:10.3109/01902148.2013.808285 |
| [26] |
Sun W, Ma M, Yu H. Inhibition of lncRNA X inactivate- specific transcript ameliorates inflammatory pain by suppressing satellite glial cell activation and inflammation by acting as a sponge ofmiR- 146a to inhibit Na 1.7[J]. J Cell Biochem, 2018, 119(12): 9888-98. DOI:10.1002/jcb.27310 |
| [27] |
Chu B, Zhou YD, Zhai H, et al. The role of microRNA-146a in regulating the expression of IRAK1 in cerebral ischemia-reperfusion injury[J]. Can J Physiol Pharmacol, 2018, 96(6): 611-7. DOI:10.1139/cjpp-2017-0586 |
| [28] |
Wu W, Li Y. Lung injury caused by paraquat poisoning results in increased interleukin-6 and decreased microRNA-146a levels[J]. Exp Ther Med, 2018, 16(1): 406-12. |
| [29] |
Monk CE, Hutvagner G, Arthur JS. Regulation of miRNA transcription in macrophages in response to Candida albicans[J]. PLoS One, 2010, 5(10): e13669-80. DOI:10.1371/journal.pone.0013669 |
| [30] |
Lv YN, Ou-yang AJ, Fu LS. MicroRNA-27a negatively modulates the inflammatory response in lipopolysaccharide-stimulated microglia by targeting TLR4 and IRAK4[J]. Cell Mol Neurobiol, 2017, 37(2): 195-210. |
| [31] |
De S, Karim F, Kiessu E, et al. Mechanism of dysfunction of human variants of the IRAK4 kinase and a role for its kinase activity in interleukin-1 receptor signaling[J]. J Biol Chem, 2018, 293(39): 15208-20. DOI:10.1074/jbc.RA118.003831 |
| [32] |
Jorge L, Cervantes. MyD88 in mycobacterium tuberculosis infection[J]. Med Microbiol Immunol, 2017, 206(3): 187-93. DOI:10.1007/s00430-017-0495-0 |
| [33] |
Into T, Horie T, Inomata M, et al. Basal autophagy prevents autoactivation or enhancement of inflammatory signals by targeting monomeric MyD88[J]. Sci Rep, 2017, 7(1): 1009-20. DOI:10.1038/s41598-017-01246-w |
| [34] |
Cushing L, Stochaj W, Siegel M, et al. Interleukin 1/toll-like receptor-induced autophosphorylation activates interleukin 1 receptor-associated kinase 4 and controls cytokine induction in a cell type-specific manner[J]. J Biol Chem, 2014, 289(15): 10865-75. DOI:10.1074/jbc.M113.544809 |
| [35] |
Gorina R, Font-Nieves M, Márquez-Kisinousky L, et al. Astrocyte TLR4 activation induces a proinflammatory environment through the interplay between MyD88-dependent NFκB signaling, MAPK, and Jak1/Stat1 pathways[J]. Glia, 2011, 59(2): 242-55. DOI:10.1002/glia.21094 |
| [36] |
Huang C, Pan L, Lin F, et al. Monoclonal antibody against Toll-like receptor 4 attenuates ventilator-induced lung injury in rats by inhibiting MyD88- and NF-κB-dependent signaling[J]. Int J Mol Med, 2017, 39(3): 693-700. DOI:10.3892/ijmm.2017.2873 |
| [37] |
Di Padova F, Quesniaux VF, Ryffel B. MyD88 as a therapeutic target for inflammatory lung diseases[J]. Expert Opin Ther Targets, 2018, 22(5): 401-8. DOI:10.1080/14728222.2018.1464139 |
| [38] |
Zhao Y, Zhang L. RIPK3/MLKL-Mediated neuronal necroptosis modulates the M1/M2 polarization of microglia/macrophages in the ischemic cortex[J]. Cerebral Cortex, 2018, 28(7): 2622-35. DOI:10.1093/cercor/bhy089 |
| [39] |
Cao C, Yin CF, Shou ST, et al. Ulinastatin protects against LPSinduced acute lung injury by attenuating TLR4/NF-κB pathway activation and reducing inflammatory mediators[J]. Shock, 2018, 50(5): 595-605. DOI:10.1097/SHK.0000000000001104 |
 2019, Vol. 39
2019, Vol. 39

