2. 安徽省多糖药物工程技术研究中心,安徽 芜湖 241002;
3. 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002
2. Anhui Provincial Engineering Research Center for Polysaccharide Drugs, Wuhu 241002, China;
3. Anhui Provincial Key Laboratory of Active Biological Macro-molecules, Wuhu 241002, China
前期课题组从黑根霉发酵液中分离纯化得到的黑根霉胞外多糖(EPS),具有多种生物活性,在一定浓度范围内可以抑制肿瘤细胞增殖、转移和诱导其细胞凋亡,但量效实验结果显示黑根霉EPS抗癌有效浓度较高[1-4]。目前,针对黑根霉EPS的研究主要在发酵、纯化、抗肿瘤活性及其作用机制几个方面,但EPS的不同批次生物活性有差异,成为黑根霉EPS抗肿瘤活性研究的瓶颈。黑根霉EPS化学修饰和构效关系研究有助于指导黑根霉EPS发酵、分离纯化和抗肿瘤活性研究,但未见相关文献报道。多糖的生物活性主要与其分子结构密切相关,包括相对分子质量、单糖组成、主链和支链的结构、溶解度和溶液中构象等[5-6]。化学修饰尤其是硫酸化修饰可以改变多糖分子结构特征从而提高多糖的生物活性,现已成为开发高活性多糖衍生物的主要方法之一[7-8],多糖的糖羟基被硫酸基团取代后不仅可提高多糖的溶解度,而且可使其糖链的局部形成螺旋结构,从而提高多糖的生物活性[7],如多糖经硫酸化修饰后,具有更好的抗肿瘤[9-10]、抗炎[11]、抗病毒[12-13]、抗凝血[14]等多种生物学活性[15-18]。因此,开展EPS化学修饰研究初步探讨黑根霉EPS抗肿瘤活性的构效关系对EPS的开发具有重要意义。
本研究以黑根霉EPS为实验材料,制备黑根霉EPS硫酸酯(SEPS),并检测硫酸酯化修饰对黑根霉EPS抗肿瘤活性的影响,初步探讨黑根霉EPS硫酸酯制备工艺及构效关系,指导黑根霉EPS发酵、分离纯化和抗肿瘤活性研究,为黑根霉EPS抗肿瘤药物开发提供资料。
1 材料和方法 1.1 主要试剂与仪器氯磺酸、吡啶、N, N-二甲基甲酰胺、氢氧化钠、氯化钡和明胶均为分析纯;超纯水。RPMI 1640培养基(Gibco);胎牛血清(HyClone);青霉素、链霉素(AMRESCO);人结肠癌HCT 116细胞(中科院上海生命科学研究院细胞库);电子分析天平(梅特勒-托利多);752紫外分光光度计(精科);AXTG16G台式高速离心机(赵迪);RE- 3000A旋转蒸发器(亚荣)。细胞培养板、培养瓶(Costar);CO2气体培养箱(SHEL Lab);倒置荧光显微镜(Olympus);多功能酶标仪(BIO-RAD);傅里叶变换光谱分析仪(THORLABS)。
黑根霉由山东大学生命科学学院生化实验室从土传病害严重的植物根际土壤中分离纯化,并由中国微生物菌种保藏管理委员会普通微生物中心鉴定和保藏;EPS由课题组前期从黑根霉发酵液中分离纯化获得[19-20]。
1.2 SEPS的制备SEPS的制备采用氯磺酸—吡啶法[21]。
1.2.1 硫酸酯化试剂的制备将预冷的无水吡啶置于冰盐浴中带有冷凝管和搅拌装置的三颈瓶中,在搅拌状态下缓慢滴1:1体积的氯磺酸,反应温度控制在4 ℃,反应40 min后得到淡黄色的酯化试剂。
1.2.2 酯化反应称取6份EPS,每组3份,0.5 g/份,分别用20 mL N, N-二甲基甲酰胺充分分散;各组分别按1:1和2:1加入硫酸酯化试剂,在80 ℃下搅拌反应2 h;反应完后立即冰浴,用4.0 mol/L NaOH调pH至中性,并转入装有冰水的烧杯中,加入3倍体积的无水乙醇,4 ℃静置过夜,充分析出沉淀;离心弃上清,无水乙醇洗涤3次,沉淀加少量的水溶解后装入透析袋,去离子水透析3 d;浓缩、冷冻干燥得到硫酸酯化黑根霉胞外多糖,记作SEPS。
1.2.3 黑根霉SEPS硫酸基含量的测定与取代度计算取透析3 d后的SEPS溶液,旋转蒸发仪浓缩至5.00 mL,采用氯化钡比浊法[22]测定其硫酸基含量。取代度计算公式:DS=(1.62×S%)/(32-1.02×S%),S为SEPS中硫酸基的百分含量。统计分析不同配料比对SEPS取代度的影响。
1.2.4 黑根霉SEPS的红外光谱分析称取黑根霉EPS和SEPS各约1 mg与约200 mg干燥的KBr粉末混匀,置玛瑙研钵中充分研磨使其混匀,压片机压成均匀透明、无明显颗粒的片。用同法制成只有KBr的供试片作为空白背景,用Varian3100 FT-IR红外光谱仪测定样品4000 cm-1~400 cm-1的红外光谱。
1.3 黑根霉SEPS抑制HCT 116细胞增殖活性分析采用CCK-8法[23],检测SEPS抑制HCT 116细胞增殖的作用。将处于对数生长期的各组细胞用胰酶消化后轻轻吹打下来,制成2×104/mL的细胞悬液,接种于96孔板内,100 μL/孔。培养24 h后,更换新鲜的培养液,然后进行药物干预,每个浓度设6个复孔,37 ℃、5% CO2培养。细胞培养48 h后,取出培养板,每孔加入20 μL CCK-8溶液,培养箱中孵育1 h,终止培养,自动酶标仪检测测定A450 nm。
1.4 黑根霉SEPS体外诱导HCT 116细胞凋亡活性分析SEPS对HCT 116细胞凋亡的影响采用Annexin V-FITC/PI双染法[24]染色,流式细胞术进行检测。取对数生长期的各组细胞,调整浓度为5×105/mL,接种于6孔板内,孵育24 h。次日按分组进行药物干预,处理48 h后收获细胞。取5~10万细胞,加入195 µLAnnexin V-FITC结合液,然后加入5 µL Annexin V-FITC,室温避光孵育20 min,1000 g离心5 min,弃上清,加入190 µL Annexin V-FITC结合液轻轻重悬细胞,加入10 µL碘化丙啶染色液,随即上机检测。选择FL1通道检测Annexin V-FITC,选择FL2通道检测碘化丙啶(PI),使用FlowJo软件分析数据。
2 结果 2.1 配料比对黑根霉SEPS取代度的影响黑根霉SEPS的硫酸基含量测定标准曲线回归方程:y=5.1717x+0.0299,R2=0.9916,线性关系良好,取代度计算公式:DS=(1.62×S%)/(32-1.02×S%)。黑根霉EPS的硫酸酯化反应分组、配料比和取代度测定结果见表 1。单因素方差分析结果显示,EPS取代度和酯化剂用量有关,增加酯化剂配料比可以提高产物取代度(P < 0.05,表 2)。
| 表 1 配料比对黑根霉SEPS取代度的影响 Tab.1 Effect of the composition ratio on the substitution degree of SEPS from Rhizopus nigricans |
| 表 2 配料比对黑根霉SEPS取代度的影响的单因素方差分析 Tab.2 One-way ANOVA for analyzing the effect of the composition ratio on the substitution degree of SEPS from Rhizopus nigricans |
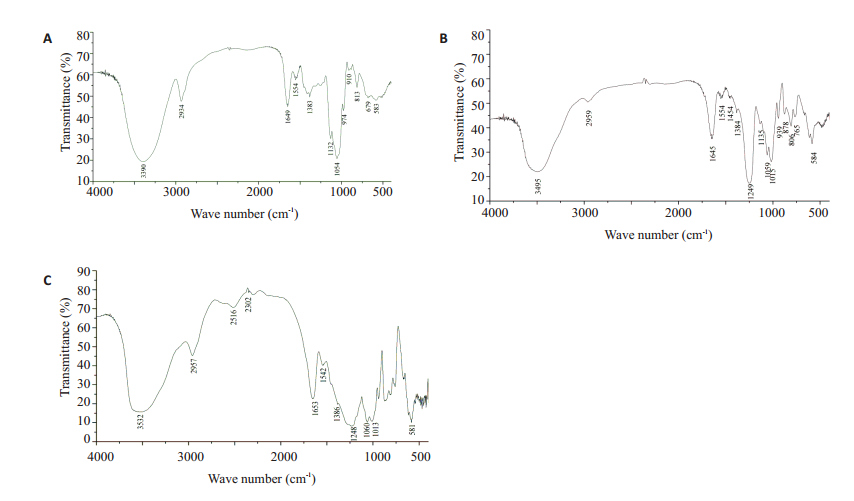
将两组SEPS按预设配料比分别混合,分别记作SEPS-1和SEPS-2,比较SEPS-1、SEPS-2与EPS的红外光谱(图 1)。EPS(图 1A)在3390 cm-1处的宽峰是O-H的伸缩振动,2934 cm-1处的吸收峰是C-H的伸缩振动,1649 cm-1处的吸收峰为乙酰氨基的C=O伸缩振动,1383 cm-1处的吸收峰为C-H的弯曲振动,这些均为多糖的特征峰,1150 cm-1处的吸收峰是C-O伸缩振动,1050 cm-1处的吸收峰是O-H变角振动。SEPS-1(图 1B)和SEPS-2(图 1C)除了具有多糖的特征吸收峰外,还明显增加了1个特征吸收峰:1249 cm-1附近的吸收峰为-OSO3—的S=O伸缩振动,是硫酸酯的特征吸收峰,显示硫酸基已与黑根霉胞外多糖结合形成硫酸酯。
|
图 1 黑根霉EPS(A)、SEPS-1(B)和SEPS-2(C)的红外光谱 Fig.1 Infrared spectra of EPS (A), SEPS-1(B) and SEPS-2(C) of Rhizopus nigricans. |
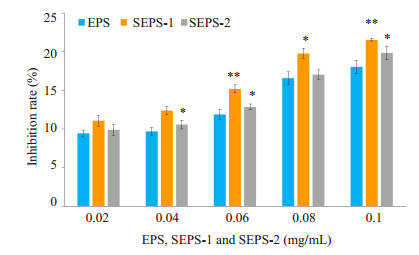
结果显示,EPS、SEPS-1和SEPS-2分别处理48 h后,SEPS-1和SEPS-2表现出较强的抑制HCT 116细胞增殖活性,且抑制率高于EPS(图 2)。在0.02~0.10 mg/L各浓度梯度范围内,SEPS-1对HCT 116细胞增殖的抑制率明显高于EPS,差异有统计学意义(P < 0.05);在0.04、0.06、0.10 mg/mL浓度梯度水平时,SEPS- 2对HCT 116细胞增殖的抑制率高于EPS,差异有统计学意义(P < 0.05);SEPS-1和SEPS-2在0.04~0.08 mg/L各浓度梯度水平对HCT 116细胞增殖的抑制率差异有统计学意义(P < 0.05)。
|
图 2 黑根霉EPS、SEPS-1和SEPS-2抑制HCT 116肿瘤细胞增殖柱状图 Fig.2 Bar graph showing inhibitory effects of EPS, SEPS-1 and SEPS-2 of Rhizopus nigricans on HCT 116 cells. *P < 0.05, **P < 0.01 vs EPS. |
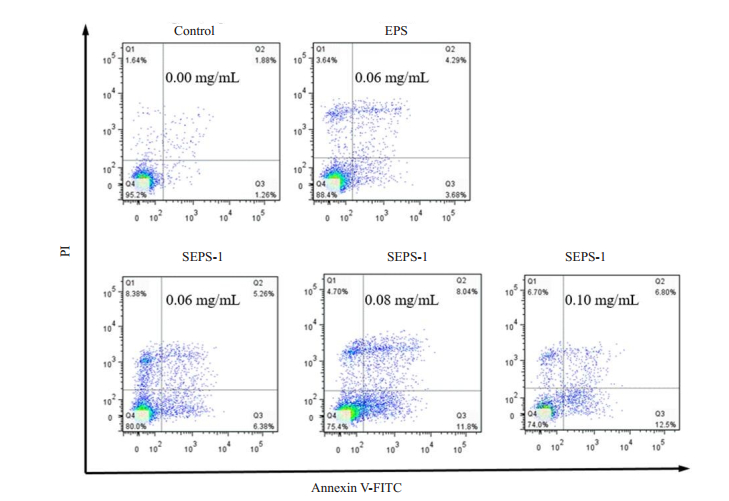
结合黑根霉SEPS抑制HCT 116细胞增殖活性检测结果,采用Annexin V-FITC/PI双染法分析SEPS-1对HCT 116细胞凋亡影响,结果显示(图 3),SEPS-1(0.06、0.08、0.10 mg/mL)和EPS(0.06 mg/mL)处理HCT 116细胞48 h后,未用药物处理空白对照组细胞凋亡率为1.26%,晚期凋亡和坏死细胞率为1.88%;EPS组细胞凋亡率为3.68%,晚期凋亡和坏死细胞率为4.29%。随着SEPS-1浓度的增加,发生早期凋亡的细胞与坏死细胞相应增加,并且呈现剂量依赖性。0.06、0.08、0.10 mg/mL处理组细胞早期凋亡率分别为6.38%、11.8%与12.5%,晚期凋亡和坏死细胞率分别为5.26%、8.04%、6.80%。
|
图 3 Annexin V-FITC/PI双染法检测黑根霉EPS、SEPS-1诱导HCT 116细胞凋亡 Fig.3 Apoptosis induced by EPS and SEPS-1 from Rhizopus nigricans in HCT 116 cells. The cells were treated with 0.00, 0.06, 0.08, and 0.10 mg/mL of SEPS-1 and 0.06 mg/mL of EPS for 48 h and detected by flow cytometry with annexin V-FITC and PI staining. |
天然多糖改性采用较多的是化学修饰法[25],通过在多糖分子链上引入或脱掉一些基团,使其分子结构发生改变,得到具有多种特殊性能的衍生物。由于多糖结构中含有大量的羟基,可以对其进行酯化、氧化、甲基化等处理。硫酸酯化修饰是天然多糖常用的修饰改性方法,硫酸基的引入改变了多糖的理化性质和立体构象,构象的变化是生物活性变化的决定性因素[6]。本研究首次采用氯磺酸-吡啶法对黑根霉EPS进行化学修饰制备黑根霉SEPS,分析硫酸酯化修饰对黑根霉EPS抗肿瘤活性的影响。实验结果表明,酯化剂配料比对黑根霉SEPS取代度有直接影响,增加酯化剂配料比可以提高产物取代度,与研究报道的酯化剂对取代度的影响相关研究结果基本一致[26],可指导后续黑根霉EPS硫酸酯化和规模化制备等相关研究。细胞增殖实验结果显示,与EPS组相比,具有不同取代度的SEPS-2(1.18%)和SEPS-1(0.98%)均可明显抑制HCT 116细胞的增殖,在0.02~0.10 mg/L各浓度梯度范围内,SEPS-1对HCT 116细胞增殖的抑制率明显高于EPS;实验中取代度较低的SEPS-1较取代度较高的SEPS-2抑制效应更明显,这一结果和多糖硫酸酯化相关研究中取代度与活性正相关的结论相悖[27-28],而与部分研究结果[29-30]相似,并非取代度越大活性越强,其原因可能是因随机修饰中较高的取代度致使天然多糖构象改变而活性减弱,此外,较高的酯化剂配料比致使多糖部分水解,从而导致多糖活性损失。黑根霉EPS硫酸酯化修饰的取代度和活性的关系还有待在后续实验过程中进一步论证;随着EPS、SEPS-1、SEPS-2浓度的增加,抑制HCT 116细胞的增殖活性呈现剂量依赖性,与黑根霉EPS抗肿瘤活性研究相关报道一致[19]。EPS、SEPS-1诱导HCT 116细胞凋亡实验表明,在0.06、0.08、0.10 mg/mL浓度梯度水平SEPS-1诱导HCT 116细胞凋亡活性较EPS强,随着SEPS-1浓度的增加,发生早期凋亡的细胞与坏死细胞相应增加,并且呈现剂量依赖性。
因此,黑根霉EPS抗肿瘤活性可以通过硫酸酯化修饰而提高,但取代度高低与抗肿瘤活性高低并非正相关;酯化剂配料比可影响黑根霉SEPS取代度,但较高的酯化剂配料比也可能导致黑根霉SEPS活性的降低。针对该问题,在今后的研究中获得适宜取代度的黑根霉EPS硫酸酯衍生物,进一步对修饰产物进行深入分析,揭示其构效关系及其相关作用机制,可指导黑根霉EPS发酵、分离纯化和抗肿瘤活性研究,进而为黑根霉EPS抗肿瘤药物开发提供资料。
| [1] |
Wei Z, Chen G, Zhang P, et al. Rhizopus nigricans polysaccharide activated macrophages and suppressed tumor growth in CT26 tumor-bearing mice[J]. Carbohydr Polym, 2018, 198(2): 302-12. |
| [2] |
Yu Y, Shen M, Song Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: a review[J]. Carbohydr Polym, 2018, 183(1): 91-101. |
| [3] |
Yu Z, Sun Q, Liu J, et al. Polysaccharide from rhizopus nigricans inhibits the invasion and metastasis of colorectal cancer[J]. Biomed Pharmacoth, 2018, 103(5): 738-45. |
| [4] |
Yu Z, Kong M, Zhang P, et al. Immune-enhancing activity of extracellular polysaccharides isolated from rhizopus nigricans[J]. Carbohydr Polym, 2016, 148(3): 318-25. |
| [5] |
Yang JH, Du YM, Huang RH, et al. Chemical modification and antitumour activity of Chinese lacquer polysaccharide from lac tree Rhus vernicifera[J]. Carbohydr Polym, 2005, 59(1): 101-7. DOI:10.1016/j.carbpol.2004.09.004 |
| [6] |
Xu Y, Wu YJ, Sun PL, et al. Chemically modified polysaccharides: synthesis, characterization, structure activity relationships of action[J]. Int J Biol Macromol, 2019, 132(12): 970-7. |
| [7] |
Feng YL, Li WQ, Wu XE, et al. Rapid and efficient microwaveassisted sulfate modification of lentinan and its antioxidant and antiproliferative activities in vitro[J]. Carbohydr Polym, 2010, 82(3): 605-12. DOI:10.1016/j.carbpol.2010.05.025 |
| [8] |
Pawar H, Kamat SR, Choudhary PD. An overview of natural polysaccharides as biological macromolecules: their chemical modifications and pharmaceutical applications[J]. Biol Med, 2015, 7(1): 224-32. |
| [9] |
Wang J, Bao A, Meng X, et al. An efficient approach to prepare sulfated polysaccharide and evaluation of anti-tumor activities in vitro[J]. Carbohydr Polym, 2018, 184(4): 366-75. |
| [10] |
Wang J, Bao A, Wang Q, et al. Sulfation can enhance antitumor activities of artemisia sphaerocephala polysaccharide in vitro and vivo[J]. Int J Biol Macromol, 2018, 107(Pt A): 502-11. |
| [11] |
Zhang K, Liu Y, Zhao X, et al. Anti-inflammatory properties of GLPss58, a sulfated polysaccharide from ganoderma lucidum[J]. Int J Biol Macromol, 2018, 107(Pt A): 486-93. |
| [12] |
Huheihel M, Ishanu V, Tal J, et al. Activity of porphyridium sp. polysaccharide against herpes simplex viruses in vitro and in vivo[J]. J Biochem Biophys Methods, 2002, 50(2/3): 189-200. |
| [13] |
Talarico LB, Zibetti RG, Faria PC, et al. Anti-herpes simplex virus activity of sulfated galactans from the red seaweeds gymnogongrus griffithsiae and cryptonemia crenulata[J]. Int J Biol Macromol, 2004, 34(1/2): 63-71. |
| [14] |
Liang L, Ao L, Ma T, et al. Sulfated modification and anticoagulant activity of pumpkin (cucurbita pepo, lady godiva) polysaccharide[J]. Int J Biol Macromol, 2018, 106(7): 447-55. |
| [15] |
Geresh S, Mamontov A, Weinstein J. Sulfation of extracellular polysaccharides of red microalgae: preparation, characterization and properties[J]. J Biochem Biophys Methods, 2002, 50(2/3): 179-87. |
| [16] |
Bao H, Choi WS, You S. Effect of sulfated modification on the molecular characteristics and biological activities of polysaccharides from hypsizigus marmoreus[J]. Biosci Biotechnol Biochem, 2010, 74(7): 1408-14. DOI:10.1271/bbb.100076 |
| [17] |
李晓萌, 汲晨锋, 季宇彬. 硫酸化海藻多糖及其生物活性研究[J]. 哈尔滨商业大学学报:自然科学版, 2017, 33(1): 11-4. |
| [18] |
宋见喜, 任婷, 王贺, 等. 高山红景天多糖的硫酸化修饰及DPPH自由基清除活性研究[J]. 中草药, 2017, 48(24): 5125-9. DOI:10.7501/j.issn.0253-2670.2017.24.011 |
| [19] |
Yu W, Chen G, Zhang P, et al. Purification, partial characterization and antitumor effect of an exopolysaccharide from rhizopus nigricans[J]. Int J Biol Macromol, 2016, 82(10): 299-307. |
| [20] |
秦国正, 琚勇, 张明芮, 等. 响应面法优化黑根霉胞外多糖脱蛋白工艺研究[J]. 天然产物研究与开发, 2017, 29(10): 1773-8, 1784. |
| [21] |
Gracher AH, Santana AG, Cipriani TR. A procoagulant chemically sulfated mannan[J]. Carbohydr Polym, 2016, 136(2): 177-86. |
| [22] |
丛建波, 王长振, 李妍, 等. 褐藻硫酸多糖硫酸基含量测定—硫酸钡比浊法研究[J]. 解放军药学学报, 2003, 19(3): 181-3. DOI:10.3969/j.issn.1008-9926.2003.03.008 |
| [23] |
高丕尧, 龙军先, 甘嘉亮, 等. CCK-8法与Alamar blue法对RKO细胞株增殖活力测试条件的对比分析[J]. 华西药学杂志, 2015, 30(1): 38-41. |
| [24] |
Henry CM, Hollville E, Martin SJ. Measuring apoptosis by microscopy and flow cytometry[J]. Methods, 2013, 61(2): 90-7. DOI:10.1016/j.ymeth.2013.01.008 |
| [25] |
Kim GY, Park HS, Nam BH, et al. Purification and characterization of acidic proteo-heteroglycan from the fruiting body of phellinus linteus (Berk. & M.A. Curtis) teng[J]. Bioresour Technol, 2003, 89(1): 81-7. DOI:10.1016/S0960-8524(02)00273-0 |
| [26] |
郭金英, 朱蓓茹, 任国艳, 等. 发菜胞外多糖硫酸化条件的优化及红外光谱分析[J]. 食品科学, 2016, 37(24): 61-7. DOI:10.7506/spkx1002-6630-201624009 |
| [27] |
郭晓强, 何钢, 刘嵬, 等. 硫酸酯化银耳多糖的制备及抗氧化性活性研究[J]. 天然产物研究与开发, 2013, 25(6): 747-51. DOI:10.3969/j.issn.1001-6880.2013.06.005 |
| [28] |
Wang JL, Guo HY, Zhang J, et al. Sulfated modification, characterization and structure-antioxidant relationships of artemisia sphaerocephala polysaccharides[J]. Carbohydr Polym, 2010, 81(4): 897-905. DOI:10.1016/j.carbpol.2010.04.002 |
| [29] |
Zhang Y, Lu X, Zhang Y, et al. Sulfated modification and immunomodulatory activity of water-soluble polysaccharides derived from fresh Chinese persimmon fruit[J]. Int J Biol Macromol, 2010, 46(1): 67-71. DOI:10.1016/j.ijbiomac.2009.10.007 |
| [30] |
王文侠, 王龙艳, 宋春丽, 等. 豆渣多糖硫酸酯化工艺条件优化及其抗氧化活性[J]. 食品与发酵工业, 2013, 39(1): 103-7. |
 2019, Vol. 39
2019, Vol. 39

