2. 重庆医科大学附属儿童医院肝胆外科,重庆 400014
2. Department of Hepatobiliary Surgery, Children's Hospital Affiliated to Chongqing Medical University, Chongqing 400016, China
新生儿坏死性小肠结肠炎(NEC)是新生儿时期常见且较为严重的胃肠道急症之一,有较高的发病率和病死率[1]。NEC病情重,进展快,其确切机制尚未完全阐明[2]。目前研究发现早产、人工喂养、肠道菌群异常定植等与NEC的发生有着密切关系[3]。
近年来应用益生菌防治NEC的研究虽然取得了较多进展[4],但其作用机理尚未完全阐明[5-6]。罗伊氏乳杆菌(L. reuteri)最初是由母乳分离而来[7],在国际上普遍运用,Hoang等[8]发现其可通过减少炎症反应减轻NEC肠道损伤,另外,有研究表明L. reuteri可通过减少氧化应激减轻急性胃肠道氧化损伤[9-10]。但L. reuteri对NEC肠道氧化应激水平的调节作用尚不清楚。我们在此基础上推测其对NEC肠道炎症损伤的保护作用可能与减少肠道氧化应激有关。本研究采用NEC新生小鼠模型,予以L. reuteri DSM17938菌株干预,并检测各组肠组织病理改变,炎症因子表达水平以及氧化损伤指标,探讨L. reuteri DSM17938对NEC肠道氧化应激水平的调控作用。由于国内临床治疗存在地区差异,且尚未搜集到国内其对NEC作用的报道,因此阐明L. reuteri影响NEC作用机制对国内临床菌群选择提供参考,进而推动国内中西部地区该菌株对NEC防治的应用具有重要意义。
1 材料和方法 1.1 实验动物与试剂96只IVC清洁级新生10 d的C57BL/6J新生小鼠,体质量3.79~4.07 g(重庆医科大学动物中心)。雅培婴幼儿奶粉(雅培),贝克幼犬奶粉(贝克),组织RNA提取试剂盒(Qiagen),反转录试剂盒(TaKaRa),ELISA检测试剂盒(欣博盛),超氧化物歧化酶(SOD)测定试剂盒(南京建成)、丙二醛(MDA)测定试剂盒(南京建成),还原性谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)检测试剂盒(碧云天),酶标仪(Biotek),蛋白酶抑制剂混合物(凯基生物),L. reuteri DSM17938菌株(百纳),CFX96 Real-time PCR仪(BioRad)。
1.2 方法 1.2.1 动物模型的制备按随机数字表法分为3组(n=32):对照组、给予PBS的NEC模型组(NEC组)、给予L. reuteri DSM17938干预的NEC模型组(NEC+L. reuteri组)。对照组:与母鼠同笼喂养,不予其他处理;NEC组:采用缺氧、冷刺激、人工喂养建立NEC模型[11],新生小鼠于生后第10天开始与母鼠分开,放于保育箱内。采用鼠乳代用品人工喂养[12],经口插入PICC管行灌胃喂养。每次灌胃奶量为0.03~0.05 mL/g,每隔4 h喂养1次,共5次。灌胃时间:08:00、12:00、16:00、20:00、24:00。将小鼠放入自制的缺氧箱内,向缺氧箱充入氮气(N2),控制N2流量为12 L/min;缺氧1 min 30 s后关闭氮气阀门并将取出小鼠。6 min后将新生小鼠置于4 ℃冰箱中冷刺激10 min。缺氧、冷刺激分别于每日10:00、18:00、22:00各进行1次,每天进行3次,连续3 d[13]。NEC+L. reuteri组:新生小鼠每天早上9点予以1次L. reuteri DSM17938灌胃,余处理同NEC。建模前后称量小鼠体质量,第13天处死,取标本。
1.2.2 L. reuteri培养将已活化的L. reuteri DSM17938菌株接种于MRS液体培养基中,于37 ℃厌氧培养箱中静置培养24 h。1500 r/min下离心15 min,用PBS调整菌体浓度[1×107 CFU/mL],按照(每日106 CFU/g)的剂量添加[14]。
1.2.3 小鼠一般状况及体质量变化观察并记录各组新生小鼠有无吐奶,腹胀、腹泻及粪便性状,活动及精神状态是否良好等情况。并记录建模前后小鼠体质量变化情况。
1.2.4 小鼠肠道组织大体形态及病理学形态观察小鼠于建模后处死,取回肠末端近回盲部肠组织。肉眼观察有无肠腔积气、串珠样改变、出血、坏死等NEC样病变。取回盲部肠组织2~3 cm固定于4%多聚甲醛溶液中,通过石蜡包埋、切片、苏木素-伊红染色、封片,于光学显微镜下观察肠道组织病理学变化并拍照。参照NEC肠道损伤评分的标准,采用双盲法进行肠组织病理评分[15],评分≥2分确定为NEC建模成功。每个肠组织标本观察3个视野,取其平均值。
1.2.5 实时荧光定量PCR检测肠组织中IL-1β、TNF-α mRNA水平取出冻存肠组织,提取肠组织总RNA,测定每个样本RNA浓度,并按照逆转录试剂盒操作步骤将RNA逆转录为cDNA,然后以cDNA为模板,在Bio-Rad CFX90 Real time PCR仪上进行IL-1β、TNF-α扩增。RT-PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火5 s、65 ℃延伸5 s,共39个循环。以GAPDH为内参照,采用2–ΔΔCt(ΔCt=目的基因Ct值-内参Ct值)进行目的基因相对表达量分析计算。引物序列(表 1)。
| 表 1 RT-PCR引物序列 Tab.1 Sequences of the primers used for RT-PCR |
取出冻存的回盲部肠组织,按照80 mg组织加入400 μL组织裂解液的比例加入裂解液,同时按比例加入蛋白酶抑制剂,匀浆,4 ℃、12 000 g离心10 min,取上清液,严格按照TNF-α、IL-1β试剂盒说明书操作。
1.2.7 比色法检测肠组织中SOD活力及抑制率、MDA含量取出冻存的取肠道样本0.3 g按比例加入PBS匀浆。组织匀浆液按4000 r/min,4℃离心10 min,取上清液检测。各指标的测定均按生化试剂盒说明书要求进行操作。SOD于37 ℃孵育20 min,450 nm处酶标仪测量。MDA于95 ℃水浴40 min,流水冷却后,4000 r/min,离心10 min。取上清,于532 nm处酶标仪测量。
1.2.8 比色法测定肠组织中GSH、GSSG、GSSG/GSH取0.3 g组织加入匀浆液匀浆,组织匀浆液按4 ℃,10 000 g离心10 min,严格按照生化试剂盒说明书进行操作,于412 nm处酶标仪测量,并按说明书计算出GSH、GSSG、GSSG/GSH。
1.3 统计学方法采用SPSS 24.0统计软件进行分析,正态分布计量资料以均数±标准差表示,符合正态分布且方差齐的计量资料3组间比较采用单因素方差分析。非正态分布计量资料以中位数(四分位间距)表示,方差不齐采用Kruskal-Wallis进行非参数检验,检验水准α=0.05。
2 结果 2.1 小鼠一般情况及体质量变化3组小鼠在建模前,体质量差异无统计学意义(P > 0.05)。对照组一般情况较好,进食、排便正常,第13天体质量为4.19±0.34 g,明显增加。NEC组一般情况较差,出现吐奶、腹胀、腹泻、活动减少、喂养困难等。取标本时,NEC + L. reuteri组与NEC组体质量均减少,NEC+L. reuteri组体质量下降较NEC组少(P < 0.05);而两组生存率(63.6% vs 66.7%)差异无统计学意义(P > 0.05)。
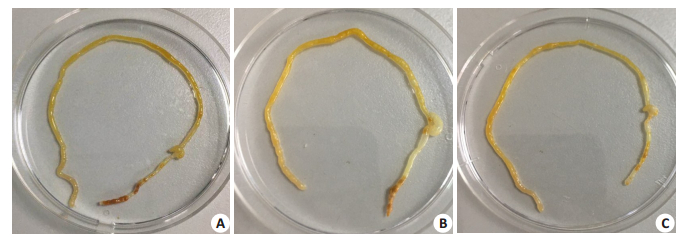
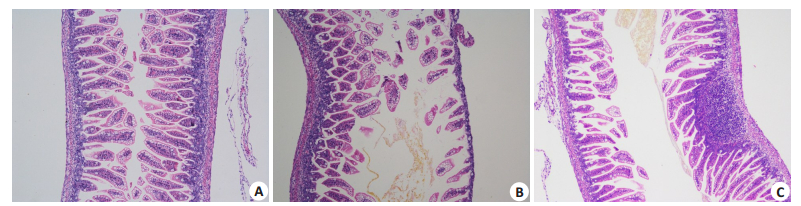
2.2 肠组织大体形态、病理学形态及评分肉眼观察可见,对照组肠组织弹性佳,色泽鲜嫩,无出血、积气、充血等表现(图 1A)。NEC组肠管胀气明显,肠管扩张,肠壁变薄,呈串珠样改变(图 1B)。NEC+L. reuteri组肠道组织弹性尚可,肠腔可见轻度积气,有轻微串珠样改变(图 1C)。光学显微镜下可见:对照组组小鼠回盲部肠组织结构清晰,肠上皮连续,绒毛高耸,黏膜层、黏膜下层及固有层均未见断裂分离或充血水肿,肌层较厚(图 2A);NEC组肠组织完整性丧失,肠上皮出现断裂,部分出现坏死、脱落或消失,肌层变薄、断裂(图 2B);而予以L. reuteri干预的NEC组小鼠回盲部肠组织结构较清晰,肠上皮完整性尚可,偶有断裂,绒毛轻中度水肿,腺体结构稍紊乱,肌层稍变薄,但未见明显断裂(图 2C)。NEC+L. reuteri组[1.33(1.25~1.75)]肠组织损伤评分,明显低于NEC组[2.67(2.33~3.33)](P < 0.05)。
|
图 1 3组新生小鼠肠道大体形态 Fig.1 Gross morphology of intestinal tissue of the neonatal mice in the 3 groups. A: Control group; B: NEC group; C: NEC+ L. reuteri group. |
|
图 2 3组新生小鼠肠道病理形态比较HE Fig.2 Pathomorphology of the intestinal tissue of the neonatal mice in the 3 groups (HE staining, original magnification: ×100). A: Control group; B: NEC group; C: NEC+L. reuteri group. |
与对照组相比,NEC组炎症因子TNF-α、IL-1β mRNA表达显著增加(P < 0.05);与NEC组相比,予以L. reuteri干预组TNF-α、IL-1β mRNA表达降低(P < 0.05,表 2)。
| 表 2 添加罗伊氏乳杆菌对小鼠炎症因子的影响 Tab.2 Effects of Lactobacillus reuteri on inflammatory cytokines in the intestinal tissues in the mice |
ELISA结果与PCR结果一致,与对照组相比,NEC组炎症因子TNF-α、IL-1β蛋白表达显著增加(P < 0.05);与NEC组相比,NEC+L. reuteri组TNF-α、IL-1β蛋白表达降低(P < 0.05,表 2)。
2.5 L. reuteri DSM17938干预的NEC小鼠氧化应激水平与抗氧化能力与对照组相比,NEC组MDA、GSSG、GSSG/GSH增加,SOD活力及抑制率、GSH降低(P < 0.05);与NEC组相比,NEC+L. reuteri组SOD活力及抑制率、GSH含量增加,MDA、GSSG、GSSG/GSH降低(P < 0.05,表 3)。
| 表 3 添加罗伊氏乳杆菌对小鼠抗氧化性能的影响 Tab.3 Effect of Lactobacillus reuteri on antioxidant capacity of the mice |
NEC是严重威胁着早产儿的生命健康的胃肠道疾病之一[16],其发病机制尚不清楚。目前研究认为血流灌注失衡、肠道菌群异常定植、感染等都是NEC的发病危险因素[17-18]。虽然迄今为止尚不清楚何种因素起主导作用,但炎症因子参与NEC肠道损伤这一理论已逐渐被认可[19]。本实验结果显示,与对照组相比,NEC组炎症因子TNF-α、IL-1β表达增加,表明炎症因子TNF-α、IL-1β在NEC的发生中过程中起着重要用。另外研究发现,TNF-α通过激活炎症级联反应,促进自身以及其他炎症因子的释放,诱导肠黏膜损伤[20]。IL-1β也可通过募集、激活免疫细胞,导致炎症介质释放,放大局部及全身炎症反应[21]。以上研究提示炎症因子TNF-α、IL-1β可通过放大炎症反应引起肠黏膜损伤,导致新生儿NEC的发生。本研究结果还显示L. reuteri DSM17938干预能降低NEC肠道炎症因子TNF-α、IL-1β的表达。Karadag等[22]发现在NEC中炎症因子升高主要是由于肠道氧化应激引起的。Li等[23]发现肠道菌群异常定植诱导肠道氧化应激升高,进一步损伤肠道黏膜屏障,导致细菌易位,激活免疫系统,引发NEC肠道炎症反应。表明氧化应激可能是引起NEC肠道炎症反应的重要调节因素。
早产儿肠道黏膜屏障功能不成熟,容易发生肠道缺氧、缺血、菌群异常定植等,并产生大量的氧自由基[24],激活肠道氧化应激,导致蛋白质、DNA以及细胞膜过氧化,过量的自由基可以介导产生大量的MDA,造成组织细胞损伤[25]。肠道氧化应激可以通过测定MDA含量来进行评价[26]。Özdemir等[27]研究发现MDA含量在肠道缺血再灌注损伤中无明显增加。本研究结果显示,与对照组相比,NEC组肠道MDA含量明显增加;予以L. reuteri干预后肠道MDA含量降低。提示NEC肠道氧化应激损伤增加,L. reuteri可能通过减少氧化应激保护NEC肠道损伤,这与杨家军等[9]发现L.reuteri可通过减少氧化应激减轻急性肠道损伤结果一致。
机体抗氧化系统的第一道防线负责抑制过量氧自由基的生成和脂质过氧化,细胞对氧化应激的防御是通过SOD、GSH等介导的[28],SOD、GSH可中和氧自由基从而抵抗氧化应激。SOD可将体内的氧自由基转化为过氧化氢[29],GSH中和自由基发生氧化反应转变为GSSG,GSSG/GSH被认为是检测氧化损伤的可靠指标[30]。本实验结果显示,与对照组比,NEC组GSSG、GSSG/GSH显著升高,SOD活力和抑制率、GSH降低;与NEC组相比,添加L. reuteri DSM17938可降低GSSG、GSSG/GSH比值,提高肠道SOD活力及抑制率、GSH含量。提示L. reuteri DSM17938菌株能够通过增加机体的抗氧化能力,在一定程度上减轻肠道氧化损伤,这与Yang等[31]给昆明鼠喂养益生菌提高其抗氧化能力的报道一致。研究发现粪菌移植可以调节肠道微生态,减少肠道氧化应激从而减轻NEC肠道炎症反应[23]。且Oliveira等[10]研究表明L.reuteri对肠道氧化应激损伤具有潜在调节作用。因此,我们推测在NEC中,L. reuteri DSM17938菌株可能通过减少肠道脂质过氧化物的产生、增加其抗氧化能力,减轻肠道黏膜损伤,从而降低NEC肠道炎症反应。
综上所述,本研究表明L. reuteri DSM17938菌株可能通过减少肠道氧化应激、增加其抗氧化能力,从而减轻肠道炎症反应,保护NEC肠道损伤。进一步提示在国内临床针对肠道氧化损伤较重的NEC患儿治疗中,可考虑增加该菌株使用。但是在复杂的肠道微生态中,L.reuteri通过调节氧化应激作用炎症反应的具体分子信号通路仍需进一步探索。
| [1] |
Eaton S, Rees CM, Hall NJ. Current research on the epidemiology, pathogenesis, and management of necrotizing enterocolitis[J]. Neonatology, 2017, 111(4): 423-30. DOI:10.1159/000458462 |
| [2] |
Kim CS, Claud EC. Necrotizing Enterocolitis Pathophysiology: How Microbiome Data Alter Our Understanding[J]. Clin Perinatol, 2019, 46(1): 29-38. DOI:10.1016/j.clp.2018.10.003 |
| [3] |
Christian VJ, Polzin E, Welak S. Nutrition Management of Necrotizing Enterocolitis[J]. Nutr Clin Pract, 2018, 33(4): 476-82. DOI:10.1002/ncp.10115 |
| [4] |
Niño DF, Sodhi CP, Hackam DJ. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(10): 590-600. DOI:10.1038/nrgastro.2016.119 |
| [5] |
Fleming P, Hall NJ, Eaton S. Probiotics and necrotizing enterocolitis[J]. Pediatr Surg Int, 2015, 31(12): 1111-8. DOI:10.1007/s00383-015-3790-0 |
| [6] |
Chen CC, Walker WA. Probiotics and the mechanism of necrotizing enterocolitis[J]. Semin Pediatr Surg, 2013, 22(2): 94-100. DOI:10.1053/j.sempedsurg.2013.01.006 |
| [7] |
Liu YY, Tran DQ, Fatheree NY, et al. Lactobacillus reuteri DSM 17938 differentially modulates effector memory T cells and Foxp3 (+) regulatory T cells in a mouse model of necrotizing enterocolitis[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 307(2): G177-86. DOI:10.1152/ajpgi.00038.2014 |
| [8] |
Hoang TK, He BK, Wang T, et al. Protective effect of Lactobacillus reuteri DSM 17938 against experimental necrotizing enterocolitis is mediated by Toll-like receptor 2[J]. Am J Physiol Gastrointest Liver Physiol, 2018, 315(2): G231-40. DOI:10.1152/ajpgi.00084.2017 |
| [9] |
杨家军, 钱坤, 李庆岗, 等. 罗伊氏乳杆菌抑制致病性大肠杆菌感染效果的研究[J]. 中国畜牧兽医, 2017, 44(8): 2431-6. |
| [10] |
Oliveira AP, Souza LK, Araujo TS, et al. Lactobacillus reuteri DSM 17938 Protects against Gastric Damage Induced by Ethanol Administration in Mice: Role of TRPV1/Substance P Axis[J]. Nutrients, 2019, 11(1): Pii: E208. DOI:10.3390/nu11010208 |
| [11] |
杨凯蒂, 贺雨, 曾本华, 等. 新生儿坏死性小肠结肠炎动物模型研究进展[J]. 中国实验动物学报, 2017, 25(6): 689-92. DOI:10.3969/j.issn.1005-4847.2017.06.019 |
| [12] |
Quintanilla HD, Liu Y, Fatheree NY, et al. Oral administration of surfactant protein-a reduces pathology in an experimental model of necrotizing enterocolitis[J]. J Pediatr Gastroenterol Nutr, 2015, 60(5): 613-20. DOI:10.1097/MPG.0000000000000678 |
| [13] |
胡坤, 余加林, 艾青, 等. 鼠诺如病毒在新生小鼠坏死性小肠结肠炎模型中的保护作用[J]. 第三军医大学学报, 2018, 40(10): 898-903. |
| [14] |
Liu YY, Fatheree NY, Mangalat N, et al. Lactobacillus reuteri strains reduce incidence and severity of experimental necrotizing enterocolitis via modulation of TLR4 and NF-κB signaling in the intestine[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(6): G608-17. DOI:10.1152/ajpgi.00266.2011 |
| [15] |
Feng Z, Zhou H, Ma S, et al. FTY720 attenuates intestinal injury and suppresses inflammation in experimental necrotizing enterocolitis via modulating CXCL5/CXCR2 axis[J]. Biochem. Biophys Res Commun, 2018, 505(4): 1032-7. DOI:10.1016/j.bbrc.2018.10.013 |
| [16] |
Neu J, Pammi M. Pathogenesis of NEC: Impact of an altered intestinal microbiome[J]. Semin Perinatol, 2017, 41(1): 29-35. DOI:10.1053/j.semperi.2016.09.015 |
| [17] |
Neu J, Modi N, Caplan M. Necrotizing enterocolitis comes in different forms: Historical perspectives and defining the disease[J]. Semin Fetal Neonatal Med, 2018, 23(6): 370-3. DOI:10.1016/j.siny.2018.07.004 |
| [18] |
Hackam D, Caplan M. Necrotizing enterocolitis: Pathophysiology from a historical context[J]. Semin Pediatr Surg, 2018, 27(1): 11-8. DOI:10.1053/j.sempedsurg.2017.11.003 |
| [19] |
Hunter CJ, De Plaen IG. Inflammatory signaling in NEC: Role of NF-κB, cytokines and other inflammatory mediators[J]. Pathophysiology, 2014, 21(1): 55-65. DOI:10.1016/j.pathophys.2013.11.010 |
| [20] |
Tayman C, Aydemir S, Yakut I, et al. TNF-α Blockade Efficiently Reduced Severe Intestinal Damage in Necrotizing Enterocolitis[J]. J Invest Surg, 2016, 29(4): 209-17. DOI:10.3109/08941939.2015.1127449 |
| [21] |
Wijendran V, Brenna JT, Wang DH, et al. Long-chain polyunsaturated fatty acids attenuate the IL-1β-induced proinflammatory response in human fetal intestinal epithelial cells[J]. Pediatr Res, 2015, 78(6): 626-33. DOI:10.1038/pr.2015.154 |
| [22] |
Karadag A, Ozdemir R, Kurt A, et al. Protective effects of dexpanthenol in an experimental model of necrotizing enterocolitis[J]. J Pediatr Surg, 2015, 50(7): 1119-24. DOI:10.1016/j.jpedsurg.2014.10.053 |
| [23] |
Li XM, Li XW, Shang QJ, et al. Fecal microbiota transplantation (FMT) could reverse the severity of experimental necrotizing enterocolitis (NEC) via oxidative stress modulation[J]. Free Radic Biol and Med, 2017, 108: 32-43. DOI:10.1016/j.freeradbiomed.2017.03.011 |
| [24] |
Cai Z, Liu J, Bian H, et al. Astragaloside Ⅳ ameliorates necrotizing enterocolitis by attenuating oxidative stress and suppressing inflammation via the vitamin D3-upregulated protein 1/NF-κB signaling pathway[J]. Exp Ther Med, 2016, 12(4): 2702-8. DOI:10.3892/etm.2016.3629 |
| [25] |
Yazıcı S, Ozcan CU, Hismiogullari AA, et al. Protective effects of quercetin on necrotizing enterocolitis in a neonatal rat model[J]. Am J Perinatol, 2018, 35(5): 434-40. DOI:10.1055/s-0037-1608660 |
| [26] |
Tsikas D, Rothmann S, Schneider JY, et al. Development, validation and biomedical applications of stable-isotope dilution GC-MS and GC-MS/MS techniques for circulating malondialdehyde (MDA) after pentafluorobenzyl bromide derivatization: MDA as a biomarker of oxidative stress and its relation to 15(S)-8-iso-prostaglandin F2α and nitric oxide (NO)[J]. J Chromatogr. B Analyt Technol Biomed Life Sci, 2016, 1019: 95-111. DOI:10.1016/j.jchromb.2015.10.009 |
| [27] |
Özdemir ÖM, Ergin H, Yenisey Ç, et al. Protective effects of clarithromycin in rats with hypoxia/reoxygenation-induced intestinal injury[J]. J Ped Surg, 2010, 45(11): 2169-74. DOI:10.1016/j.jpedsurg.2010.06.024 |
| [28] |
Cakir U, Tayman C, Serkant U, et al. Ginger (zingiber officinale roscoe) for the treatment and prevention of necrotizing enterocolitis[J]. J Ethnopharmacol, 2018, 225: 297-308. DOI:10.1016/j.jep.2018.07.009 |
| [29] |
Gangull G, Mukherjee U, Sonawane A. Peroxisomes and oxidative stress: their implications in the modulation of cellular immunity during mycobacterial infection[J]. Front Microbiol, 2019, 7(10): 1121. |
| [30] |
Lee SG, Yim J, Lim Y, et al. Validation of a liquid chromatography tandem mass spectrometry method to measure oxidized and reduced forms of glutathione in whole blood and verification in a mouse model as an indicator of oxidative stress[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1019(SI): 45-50. |
| [31] |
Yang J, Huang KH, Qin SY, et al. Antibacteial action of seleniumernriched probiotics against pathogenic Escherichia coli[J]. Dig Dis Sci, 2009, 54(2): 246-54. DOI:10.1007/s10620-008-0361-4 |
 2019, Vol. 39
2019, Vol. 39

