2. 南方医科大学南方医院卫生经济管理科,广东 广州 510515
2. Department of Economic Management, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
2015年2月,美国总统奥巴马宣布了“精确医学计划”。对此,FDA(2015)在有关文件中特别强调了探讨患者对治疗方法反应的异质性对于药物研发的重要性[1]。那么,亚组识别,即识别出对特定治疗手段有较好疗效的亚组人群,并证明这种获益对患者是客观存在的,是实现精准医学中个体化治疗的重要手段[2-5]。
目前,国内外对于亚组识别的研究较多[6-10],但是大多数是针对定量或者分类变量的结局。而临床试验中最常见的结局变量是达到某个终点事件所经历的时间(以下称之为生存数据),此类数据常出现右删失现象。目前涉及生存数据亚组识别的相关文献尚较少。其中,Wu等[11]学者扩展了Shen等[9]的方法,建立了一个logistic-Cox回归模型。但是,这个模型与Shen等的方法同样有较为严格的参数假设。此外,有学者拟合了带有交互项的单变量Cox模型,但其没有解释检验水准校正的问题[12]。近年来,高维的生物、医学数据大量出现。对于高维的小样本(HDLSS)数据,Cox模型不够稳定;而且,Cox模型的等比例风险假定有时是不成立的。而加速失效时间(AFT)模型已被证实适用于高删失和高维数据(例如,癌症生存数据、微阵列数据)[13],可以作为Cox模型的替代模型。此外,考虑到协变量之间的相关性问题,有学者提出了基于Elastic Net的惩罚AFT模型[14]。但Elastic Net和其他的惩罚模型(如:lasso、岭回归)有一个共同的缺点:不能确保变量选择的一致性和系数估计的渐近正态性,即不具有Oracle性质[15]。针对这个问题,学者提出了Adaptive Elastic Net [16]。目前Adaptive Elastic Net在AFT模型中的应用仅局限于协变量筛选,本研究改进常规应用中的模型,将其应用于生存数据的亚组识别,是本研究的创新之处。
1 生存数据亚组识别的分析策略Berry曾对亚组定义如下:基于少量协变量(亚组相关协变量)所确定的、将所有患者划分为互斥的子数据集或亚组人群[17]。基于协变量的亚组识别可分成3部分:亚组相关协变量筛选、亚组选择和临床效用性评价[18]。其中,所筛选出来的亚组相关协变量用于建立分类器,以识别其中的获益亚组,从而优化治疗的选择。
1.1 亚组相关协变量筛选 1.1.1 单变量AFT模型假设临床试验中,包含一个对照组和一个试验组,且患者中存在两个亚组:获益亚组(g+)和非获益亚组(g-)。令n表示样本量;TR为组别指示变量(TR=0,对照组;TR=1,治疗组);xij为第i个患者的第j个协变量;xij· TRi为第i个患者的第j个协变量与组别变量的交互项;Yi表示观察结局。
用以确定第j个协变量xj是否与治疗结局有关的传统统计方法:建立单变量模型,同时纳入协变量xij和治疗变量TRi的主效应,以及它们的交互效应。本研究中,拟合了单变量AFT模型:
| $ Y_{i}=\alpha_{j}+\beta_{1 j} x_{i j}+\beta_{2 j} T R_{i}+\beta_{3 j} x_{i j} \cdot T R_{i}+\varepsilon_{i j} $ | (1) |
其中,Yi为对数生存时间log(ti);εij是服从极值分布的随机误差;β3j是交互项的回归系数,代表着获益亚组g+与非获益亚组g-之间的治疗效应差异,如果交互项有统计学意义,则xij为亚组相关协变量。
由于样本量估计主要是针对主效应来计算的,因此同时纳入协变量xj与治疗变量TR的主效应时,评估交互作用的效能往往较差。因此,学者Freidlin和Simon [19]提出了剔除协变量xij主效应的方法。本研究所对应的模型为:
| $ Y_{i}=\alpha_{j}+\beta_{2 j} T R_{i}+\beta_{3 j} x_{i j} \cdot T R_{i}+\varepsilon_{i j} $ | (2) |
不管是公式(1)还是公式(2),每次都是仅在模型中纳入一个协变量。当对每个变量都进行检验时,就涉及到多重检验的问题。通过控制错误发现率(FDR),可以实现多重校正,Benjamini-Hochberg算法是控制FDR的一种方法[20]。
记U={x1, x2, …, xk
}为预先指定的错误发现率q= 0.05时,交互项系数具有统计学意义的所有协变量中的子集,那么每个患者的预测得分为
该模型基于正则化加权最小二乘法[21],即正则化SWLS(Stute's Weighted Least Squares)算法。对于典型的AFT模型而言,SWLS的目标函数为:
| $ \begin{array}{l}{\arg \min } \\ {(\alpha, \beta)}\end{array}\left[\frac{1}{2} \sum\nolimits_{i}^{n} \omega_{i}\left(Y_{i}-\alpha-X_{(i)}^{T} \beta\right)^{2}\right] $ | (3) |
其中,Yi是第i个患者的对数生存时间,X是协变量矩阵,α是常数项,β是未知的p×1的回归系数矩阵,ωi是Kaplan-Meier权重。
令u和u分别代表非删失和删失的数据,则非删失和删失的例数分别记为nu和nu,删失数据中的自变量和应变量分别为Xu和Yu,删失个体的未观察到的真正失效时间为Tu。右删失时,Yu < log (Tu),即Yu < α + Xuβ,这个加入上式的SWLS目标函数中,作为一个删失约束,则有
| $ L(\alpha, \beta)=\frac{1}{2}\left(Y_{u}-\alpha-X_{u} \beta\right)^{T} \omega_{u}\left(Y_{u}-\alpha-X_{u} \beta\right)+\frac{\lambda_{0}}{2 n} \zeta^{T} \zeta\\ 且Y_{\bar{u}} \leq \alpha+X_{\bar{u}} \beta+\zeta $ | (4) |
其中ζ是一个非负值矩阵,代表着偏离删失约束的严重程度;λ0是一个正值,是对偏离删失约束的惩罚。
引入Adaptive Elastic Net正则化法,即加入适应性权重ω,则得到以下的目标函数:
| $ \begin{array}{l}{\underset{\beta, \zeta}{\arg \min } \frac{1}{2}\left(Y_{u}-\alpha-X_{u} \beta\right)^{T} \omega_{u}\left(Y_{u}-\alpha-X_{u} \beta\right)} \\ \quad \quad + {\lambda _2}{\beta ^T}\beta + {\lambda _0}{\zeta ^T}\zeta \\ 且\sum\nolimits_{j=1}^{p} \hat{\omega}_{j}\left|\beta_{j}\right| \leq \lambda_{1}和Y_{\bar{u}} \leq \alpha+X_{\bar{u}} \beta+\zeta \end{array} $ | (5) |
以上为一般生存数据的变量选择所采用的适应性正则化模型,当生存数据存在亚组人群时,本研究在模型中纳入协变量与组别变量的交互项,则得到以下的惩罚AFT模型:
| $\begin{array}{l}{Y_{i}=\alpha+X_{(i)}^{T} \beta+e_{i}=\alpha+\sum\nolimits_{j} \beta_{1 j} x_{i j}+\beta_{2} T R_{i}+} \\ {\sum\nolimits_{j} \beta_{3 j}\left(x_{i j} \cdot T R_{i}\right)+e_{i}}\end{array} $ | (6) |
若在上式中剔除协变量xj主效应,则得到:
| $ Y_{i}=\alpha+\beta_{2} T R_{i}+\sum\nolimits_{j} \beta_{3 j}\left(x_{i j} \cdot T R_{i}\right)+e_{i} $ | (7) |
对于基于Adaptive Elastic Net的惩罚AFT模型,是否剔除了协变量xj主效应后的变量选择效果更好,有待模拟验证。记
基于全部患者的预测得分l(x),建立分类器,寻找l(x)的截断点,以选择能从特定治疗中获益的亚组人群。
这里采用Hinkley等[22]学者提出的change-point算法,以得到截断点[23]。记l={l(1), l(2), ..., l(n)}为已知的有序预测得分,当存在一个整数τ∈ (1, n - 1),使得{l(1), l(2), ..., l(τ)}和{l(τ+1), l(τ+2), ..., l(n)}两个子集出现的概率之和最大,那么l(τ)则为截断点。这样的截断点是通过使得下面的对数似然函数最大化而得到的:
| $M L(\tau)=\log p\left(l_{(1):(\tau)} | \hat{\theta}_{1}\right)+\log p\left(l_{(\tau+1):(n)} | \hat{\theta}_{2}\right) $ | (8) |
其中,p(.)是概率密度函数,
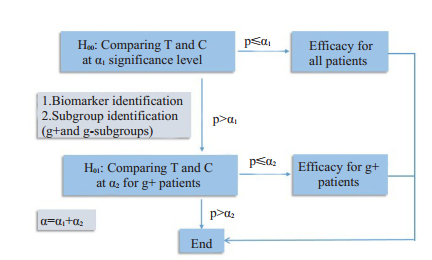
亚组分析中,评价治疗效果的统计检验可以通过多重假设检验来进行[18]。第1个原假设H00:基于所有患者,试验组和对照组间没有治疗效应差异;第2个原假设H01:基于g+,试验组和对照组间没有治疗效应差异;第3个原假设H02:基于g-,试验组和对照组间没有治疗效应差异。一般情况下,研究者并不关心g-的治疗效应。二阶段适应性设计往往被用以评估治疗对亚组人群的有效性[24-25]。其分成两个阶段。第1阶段,按预先设定的检验水准α1,基于全部患者,比较试验组和对照组的治疗效应;如果第1阶段中的检验显示有统计学差异,则终止,结论是治疗对所有患者都有效;否则继续第2阶段,按预先设定的检验水准α2,基于获益亚组人群g+,比较试验组和对照组的治疗效应;如果第2阶段的检验有统计学意义,则认为治疗仅对g+有效。这里的检验水准α=α1+α2(α一般取值为0.05)。
2 模拟研究 2.1 亚组选择的有效性评价本研究考虑p个协变量,并将其分成两个区块:前k个协变量作为亚组相关协变量,在g+和g-中,分别来自于N(μ1, σ12)和N(μ2, σ22)分布;其余的协变量来自于N(μ2, σ22)分布。其中,μ1, μ2, σ1, 和σ2的取值分别为6,8,0.5和0.25。令n表示样本量,通过以下AFT模型模拟产生生存时间:
| $Y_{i}=\alpha+\beta_{2} T R_{i}+\sum\nolimits_{j=1}^{k} \beta_{3 j} x_{i j} \cdot T R_{i}+\sigma \varepsilon_{i}, i=1, \cdots, n $ | (9) |
其中,截距α,取值为2;εi是服从极值分布的随机误差;σ是度量参数,其取值为1。令S为亚组指示变量(S=0,g+;S=1,g-),uS·TR表示4个亚组的平均对数生存时间,即uS·TR = E(Yi|S·TR)。我们的模拟考虑的是治疗仅对获益亚组人群g+有效的情形,而对照组中的g+、g-、治疗组中的g-疗效相同(u00 =
u10 =
u01 < u11),此情形下
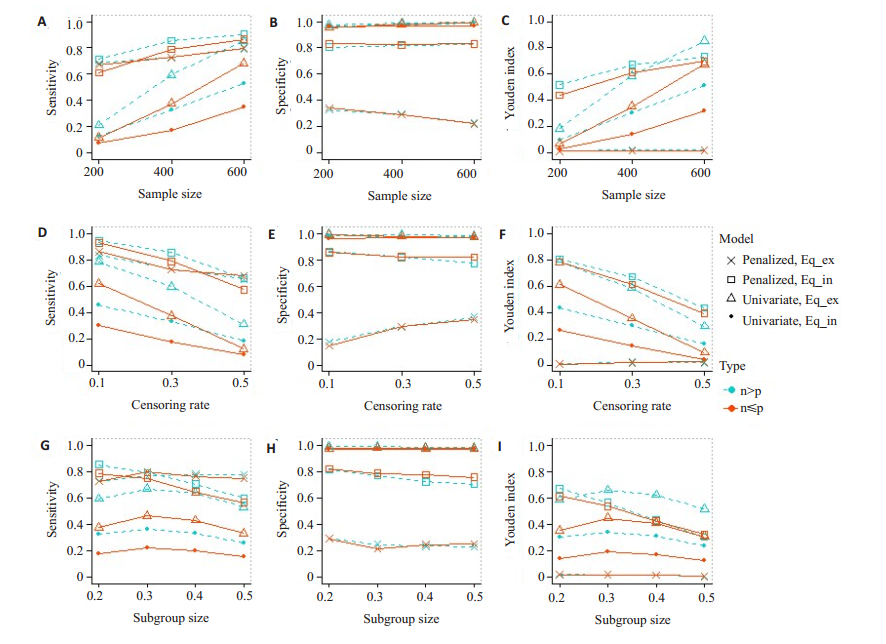
记是否包含协变量主效应的公式分别为Eq_in、Eq_ex,这里考虑4种亚组相关协变量筛选模型:分别基于Eq_in、Eq_ex的单变量模型和惩罚模型。考虑两种数据类型:样本量不超过协变量个数(n≤p)、样本量远大于协变量个数(n > p)。亚组相关协变量筛选和亚组选择采用10层交叉验证。为了研究所提出的分析策略是否受样本量、删失比例、亚组比例的影响,本研究产生了不同的数据集,各个数据集中两组的受试者数量相同,并通过1000次模拟数据计算灵敏度、特异度和Youden指数,来评价亚组选择的有效性;此处的灵敏度指所筛选的获益亚组g+中真获益个体占比,特异度指所筛选的非获益亚组g-中的非获益个体占比;结果如图 2所示。其中,n≤p时取p=600,n > p时取p=100,亚组相关协变量个数k均为10。
|
图 1 二阶段适应性设计 Fig.1 Flow chart of the two-stage adaptive design. |
|
图 2 不同情形下亚组选择的有效性评价结果 Fig.2 Validity evaluation of subgroup selection in different scenarios. "Penalized, Eq_ex" represents the penalized model excluding the main effect, "Univariate, Eq_in" represents the univariate model including the main effect, and so forth. n > p represents the situation where the sample size largely exceeds the number of covariates, and n≤p represents the situation where the sample size does not exceed the number of covariates. A-C: The censoring rate is 30% and the subgroup proportion is 20%; D-F: The sample size is 400 and the subgroup proportion is 20%; G-I: The sample size is 400 and the Diff is 10% (Diff=censoring rate-subgroup proportion). |
结果显示,随着样本量的增加(图 2A~C),四种模型的灵敏度都呈现上升的趋势,惩罚模型的灵敏度明显高于单变量模型(10%~50%),特别是样本量n较小、n≤ p的情况下。随着删失率的增加(图 2D~F),各个模型的灵敏度都呈现下降的趋势,但单变量模型的下降幅度更大;而且惩罚模型的灵敏度比单变量模型的高10%~ 35%,特别是删失率较高、以及n≤p的情况下。随着亚组比例的增加(图 2G~I),基于Eq_in的惩罚模型的灵敏度呈下降趋势,其他模型则是现上升后下降;惩罚模型的灵敏度明显高于单变量模型,特别是亚组比例较小、以及n≤p的情况下。这3种情形中,模型间特异度的差异情况相似;基于Eq_ex的惩罚模型的特异度较差,其他模型的特异度高达80%以上且呈现平稳的状态,但各单变量模型的特异度比基于Eq_in的惩罚模型高12%~17%。
总的来说,基于Eq_ex的单变量模型和基于Eq_in的惩罚模型的效果较好;在样本量较小、删失率较高、亚组比例较小以及n≤p的情况下,基于Eq_in的惩罚模型相对有优势;而其他情况下,则是基于Eq_ex的单变量模型更优。
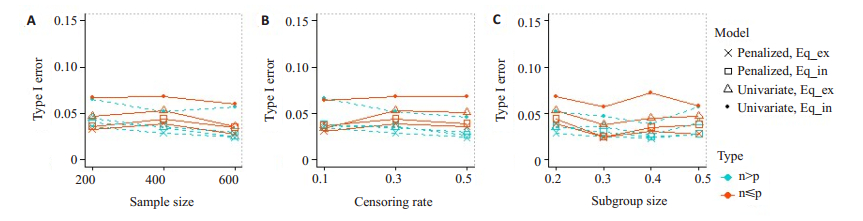
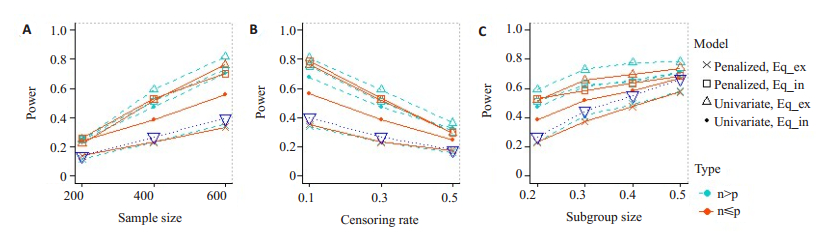
2.2 获益亚组的治疗效果评价如上所述,本研究采用二阶段适应性设计来提高检测治疗效果的能力,其中α1=0.03、α2=0.02 [12]。当不存在亚组(不存在交互效应)时,适应性设计的第1阶段中若出现基于所有患者的组间疗效比较的p≤α1,或者第2阶段中基于所识别的获益亚组的组间疗效比较的p≤α2,则为犯Ⅰ类错误;当存在亚组(存在交互效应)时,适应性设计中,两个阶段的组间疗效比较结果p分别大于检验水准α1、α2,则为犯Ⅱ类错误。不同情形下模型在适应性设计中的Ⅰ类错误、检验效能分别如图 3、4所示。
|
图 3 不同情形下亚组识别的Ⅰ类错误 Fig.3 Type Ⅰ error of subgroup identification in different scenarios. A: The censoring rate is 30% and the subgroup proportion is 20%; B: The sample size is 400 and the subgroup proportion is 20%; C: The sample size is 400 and the Diff is 10% (Diff=censoring ratesubgroup proportion). |
|
图 4 不同情形下亚组识别的的检验效能 Fig.4 Power of subgroup identification in different scenarios. The dotted line with inverted triangle (reference line) represents the powers of conventional design. A: The censoring rate is 30% and the subgroup proportion is 20%; B: The sample size is 400 and the subgroup proportion is 20%; C: The sample size is 400 and the Diff is 10% (Diff=censoring rate-subgroup proportion). |
由图 3可知,在各种数据中,除了基于Eq_in的单变量模型以外,其他模型的Ⅰ类错误都能控制在0.05左右。
由图 4可知,在适应性设计中,各种情形下,除了基于Eq_ex的惩罚模型以外,其他模型的检验效能都要高于传统设计的检验效能(蓝色参考线)。其中,基于Eq_ex的单变量模型,以及基于Eq_in的惩罚模型的检验效能最高。随着样本量增加,各个模型的检验效能呈上升的趋势;随着删失率增加,各个模型的检验效能呈下降趋势;随着亚组比例上升,各个模型的检验效能呈上升的趋势;n≤p时,基于Eq_in的惩罚模型与基于Eq_ex的单变量模型的检验效能较接近;n > p时,基于Eq_ex的单变量模型占优。
3 实例验证将本研究所提出的分析策略应用在肺癌数据(GSE14814)中(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse14814)。该数据包含133名非小细胞肺癌患者的22215个基因表达测量信息,其中对照组(OBS)有62名患者,辅助化疗组(ACT)有71名患者,删失率为62.4%。分别用基于Eq_ex的单变量模型(Univariate, Eq_ex),以及基于Eq_in的惩罚模型(Penalized, Eq_in),结合留一法交叉验证(LOOCV)对该数据进行亚组分析。
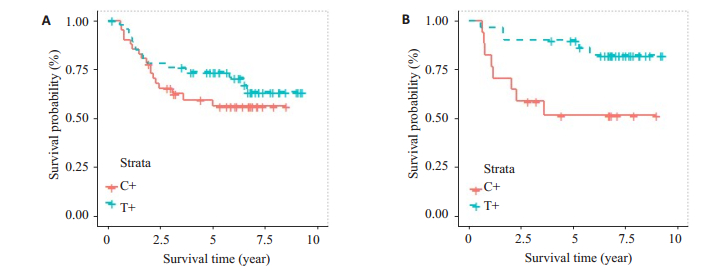
结果如表 1所示,其中第3~8行是每组或每个亚组的中位生存时间(样本量)。第1~2行是二阶段适应性设计分析结果,其中第1行是第1阶段中全部患者的组间比较结果(检验水准α1=0.03),第2行是第2阶段中潜在的获益亚组的组间比较结果(检验水准α2=0.02)。第1阶段的结果显示,尚无法认为辅助化疗对所有患者有效(P=0.376);因此,进行第2阶段分析,结果显示基于Eq_ex的单变量模型所识别的潜在获益亚组g+中的两组间比较差异无统计学意义(P=0.187);而基于Eq_in的惩罚模型结果显示接近于有统计学差异(P=0.023 ≈ α2,图 5,右图)。这两个模型所识别的获益亚组例数以及占比分别为41+47=88(66.17%)、17+30=47(35.34%)。
| 表 1 肺癌数据GSE14814的亚组识别结果 Tab.1 Subgroup identification of lung cancer data GSE14814 |
|
图 5 基于Eq_ex的单变量模型(A)、基于Eq_in的惩罚模型(B)识别的亚组生存曲线图 Fig.5 Survival cures for subgroups identified by the univariate model excluding the main effect (A) and the penalized model including the main effect (B). T + : Responders in treatment group; C + : Responders in control group. |
生存数据是临床试验中最常见的资料类型,亚组识别是精准医学的重要手段,如何对这类数据中所存在的获益亚组进行可靠的个体甄别是一个亟待解决的问题。Chen等[12]学者基于单变量Cox模型进行亚组识别,但该研究仅考察了模型在亚组比例为0.2、0.5时的性能;其模型在不同的样本量、删失率等情形下以及在高维小样本数据中的性能是未知的;而且,该研究没有解释亚组相关协变量筛选中检验水准校正的问题。因此,本研究扩展了Chen等[12]学者的研究,分别将单变量AFT模型和基于Adaptive Elastic Net的惩罚AFT模型,进行亚组识别;通过Monte Carlo方法模拟n > p、n≤p数据,和不同情形下(样本量、删失比例、亚组比例)的数据以及通过实例对所提出的分析策略进行了考核。结果显示,不含协变量主效应的单变量模型、含主效应的惩罚模型的亚组识别能力更好。在样本量较小、删失率较高、亚组比例较小以及样本量不超过协变量个数的情况下,含主效应的惩罚模型在亚组选择上相对有优势;而其他情况下,则是不含主效应的单变量模型更优。相比于传统设计,二阶段适应性设计更适用于潜在获益亚组的疗效评价。本研究基于AFT模型,其不需要满足等比例风险假定;单变量AFT模型中,我们应用Benjamini-Hochberg算法控制错误发现率(FDR)而不是简单的多重校正方法。
另外,二阶段适应性设计的检验效能不仅与模型识别获益亚组的能力有关,还与两个阶段的检验水准设定有关。模拟研究显示,适应性设计中,在预先设定的检验水准下(α1=0.03,α2=0.02),灵敏度高的模型在适应性设计中的检验效能并未显示出优势,这可能与两个阶段检验水准的设定有关。此外,实例分析中,含协变量主效应的惩罚模型,在适应性设计第2阶段中的P值为0.023,略大于所设定的检验水准α2=0.02,但是亚组生存曲线图(图 5)显示所识别的获益亚组疗效有明显改善。这可能与该例样本量(n=133)或者检验水准的设定有关。如何结合实际,合理地设定两个阶段的检验水准有待进一步研究。
此外,虽然建立一个能正确识别亚组的模型或分析策略是必不可少的,但是在亚组识别之前,探测出数据中是否存在亚组也是一个非常重要的问题,这样可以降低由于把同质患者分成不同的亚组所造成的Ⅰ类错误。本研究采用了McLachlan[26]提出的似然比检验(LRT)来检测抽样患者的异质性,但模拟结果显示,不管事先是否进行似然比检验,二阶段适应设计中,含协变量主效应的惩罚模型、不含主效应的单变量模型的Ⅰ类错误都能控制在0.05左右,因此正文部分没有展现这部分结果。
本研究仅对定量协变量进行了研究,后续将对该亚组识别方法应用于含分类协变量情形进行研究;此外,考虑到生存数据中患者的获益会存在两种情况,第一种是患者仅是生存时间延长了,最终仍会发生结局事件;第二种是患者治愈了,最终不会发生结局事件[27-30]。本研究仅考虑了第一种情况,后续拟将本研究所提出的分析策略拓展到潜在的亚组人群为治愈亚组情形。
| [1] |
Ruberg SJ, Shen L. Personalized medicine: four perspectives of tailored medicine[J]. Stat Biopharm Res, 2015, 7(3): 214-29. DOI:10.1080/19466315.2015.1059354 |
| [2] |
Brookes ST, Whitely E, Egger M, et al. Subgroup analyses in randomized trials: risks of subgroup-specific analyses; power and sample size for the interaction test[J]. J Clin Epidemiol, 2004, 57(3): 229-36. DOI:10.1016/j.jclinepi.2003.08.009 |
| [3] |
Foster JC, Taylor JM, Ruberg SJ. Subgroup identification from randomized clinical trial data[J]. Stat Med, 2011, 30(24): 2867-80. DOI:10.1002/sim.4322 |
| [4] |
Huber C, Benda N, Friede T. A comparison of subgroup identification methods in clinical drug development: Simulation study and regulatory considerations[J]. Pharm Stat, 2019, 18(5): 600-26. DOI:10.1002/pst.1951 |
| [5] |
Lipkovich I, Dmitrienko A, Denne J, et al. Subgroup identification based on differential effect search--a recursive partitioning method for establishing response to treatment in patient subpopulations[J]. Stat Med, 2011, 30(21): 2601-21. |
| [6] |
Cai T, Tian L, Wong PH, et al. Analysis of randomized comparative clinical trial data for personalized treatment selections[J]. Biostatistics, 2011, 12(2): 270-82. DOI:10.1093/biostatistics/kxq060 |
| [7] |
Zhao L, Tian L, Cai T, et al. Effectively selecting a target population for a future comparative study[J]. J Am Stat Assoc, 2013, 108(52): 527-39. |
| [8] |
Song X, Pepe MS. Evaluating markers for selecting a patient's treatment[J]. Biometrics, 2004, 60(4): 874-83. DOI:10.1111/j.0006-341X.2004.00242.x |
| [9] |
Shen J, He XM. Inference for subgroup analysis with a structured Logistic-Normal mixture model[J]. J Am Stat Assoc, 2015, 110(59): 303-12. |
| [10] |
Bonetti M, Gelber RD. Patterns of treatment effects in subsets of patients in clinical trials[J]. Biostatistics, 2004, 5(3): 465-81. DOI:10.1093/biostatistics/kxh002 |
| [11] |
Wu RF, Zheng M, Yu W. Subgroup analysis with Time-to-Event data under a Logistic-Cox mixture model[J]. Scandinavian J Stat, 2016, 43(3): 863-78. DOI:10.1111/sjos.12213 |
| [12] |
Chen YC, Lee UJ, Tsai CA, et al. Development of predictive signatures for treatment selection in precision medicine with survival outcomes[J]. Pharm Stat, 2018, 17(2): 105-16. |
| [13] |
Khan MHR, Bhadra A, Howlader T. Stability selection for lasso, ridge and elastic net implemented with AFT models[J]. Stat Appl Genet Mol Biol, 2019, 18(5): 125-6. |
| [14] |
Engler D, Li Y. Survival analysis with high-dimensional covariates: an application in microarray studies[J]. Stat Appl Genet Mol Biol, 2009, 8(1): Article 14. |
| [15] |
黄登香. Elastic Net方法在几类模型变量选择中的应用[D].南宁: 广西大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10593-1014370195.htm
|
| [16] |
Zou H, Zhang HH. On the adaptive elastic-net with a diverging number of parameters[J]. Ann Stat, 2009, 37(4): 1733-51. DOI:10.1214/08-AOS625 |
| [17] |
Berry DA. Subgroup analyses[J]. Biometrics, 1991, 46(4): 1227-30. |
| [18] |
Chen JJ, Lu TP, Chen YC, et al. Predictive biomarkers for treatment selection: statistical considerations[J]. Biomark Med, 2015, 9(11): 1121-35. DOI:10.2217/bmm.15.84 |
| [19] |
Freidlin B, Simon R. Adaptive signature design: an adaptive clinical trial design for generating and prospectively testing a gene expression signature for sensitive patients[J]. Clin Cancer Res, 2005, 11(21): 7872-8. DOI:10.1158/1078-0432.CCR-05-0605 |
| [20] |
Benjamini Y, Hochberg Y. Controlling the false discovery rate:a practical and powerful approach to multiple testing[J]. J Roy Stat Soc. Series B (methodological), 1995, 57(1): 289-300. DOI:10.1111/j.2517-6161.1995.tb02031.x |
| [21] |
Khan MH, Shaw J. Variable selection for survival data with a class of adaptive elastic net techniques[J]. Stat Comput, 2016, 26(3): 725-41. DOI:10.1007/s11222-015-9555-8 |
| [22] |
Hinkley DV, Hinkley EA. Inference about the change-point in a sequence of binomial variables[J]. Biometrika, 1970, 57(3): 477-88. DOI:10.1093/biomet/57.3.477 |
| [23] |
Killick R, Eckley IA. Changepoint: an R package for changepoint analysis[J]. J Stat Softw, 2014, 58(3): 1-19. |
| [24] |
Wang SJ, Hung HM, O'neill RT. Adaptive patient enrichment designs in therapeutic trials[J]. Biom J, 2009, 51(2): 358-74. DOI:10.1002/bimj.200900003 |
| [25] |
Jiang W, Freidlin B, Simon R. Biomarker-adaptive threshold design: a procedure for evaluating treatment with possible biomarker-defined subset effect[J]. J Natl Cancer Inst, 2007, 99(13): 1036-43. DOI:10.1093/jnci/djm022 |
| [26] |
Mclachlan GJ, Rathnayake S. On the number of components in a Gaussian mixture model[J]. Wiley Interdiscip Rev Data Min Knowl Discov, 2014, 4(5): 341-55. DOI:10.1002/widm.1135 |
| [27] |
Boag JW. Maximum likelihood estimates of the proportion of patients cured by cancer therapy[J]. J R Stat Soc Series B Stat Methodol, 1949, 11(1): 15-53. |
| [28] |
Maetani S, Gamel JW. Parametric cure model versus proportional hazards model in survival analysis of breast cancer and other malignancies[J]. Adv Breast Cancer Res, 2013, 2(4): 119-25. DOI:10.4236/abcr.2013.24020 |
| [29] |
Othus M, Barlogie B, Leblanc ML, et al. Cure models as a useful statistical tool for analyzing survival[J]. Clin Cancer Res, 2012, 18(14): 3731-6. DOI:10.1158/1078-0432.CCR-11-2859 |
| [30] |
Zhang Y, Shao Y. Concordance measure and discriminatory accuracy in transformation cure models[J]. Biostatistics, 2018, 19(1): 14-26. DOI:10.1093/biostatistics/kxx016 |
 2019, Vol. 39
2019, Vol. 39

