2. 湖南中医药大学 医学院,湖南 长沙 410208
2. School of Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
动脉粥样硬化(AS)所引起的心脑血管疾病是目前严重危害人类身体健康的主要疾病之一,也是多种心脑血管疾病发生的病理基础,其对心脑血管的损害及伤害可累及到身体的各个器官[1]。血管平滑肌细胞(VSMCs)作为动脉粥样硬化斑块中主要的细胞成分,在动脉粥样硬化等病理状态下,VSMCs出现异常增殖,导致血管内膜的增厚与管腔狭窄[2]。目前,病毒载体基因治疗在减少和/或预防再狭窄和内膜增生中取得了重要的进展。有研究证实,慢病毒和腺病毒介导的基因转移在术后血管再狭窄和严重肢体缺血(CLI)患者中具有对症状改善的潜力[3-5]。因此,慢病毒是极有前景的基因治疗载体,有可能会成为临床上治疗AS的一种重要手段。
Fas死亡结构域相关蛋白(Daxx)是一种高度保守的核蛋白,广泛分布于核质、核仁、胞浆、异染色质和早幼粒细胞白血病蛋白核体(PML-NBs)等亚细胞区域,在细胞凋亡和转录调控中发挥重要作用[6-7]。本课题组前期研究发现,Daxx能抑制VSMCs凋亡[8],但对其增殖的作用却未见文献报道。因此,本实验拟通过构建Daxx基因的慢病毒载体表达质粒,探讨Daxx对VSMCs异常增殖的影响,为动脉粥样硬化的药物研究提供了靶点。
1 材料和方法 1.1 材料病毒载体四质粒包装系统(pCDH-CMV-MCSEF1-copEGFP、pLP1、pLP2、pLP/VSVG)为宁夏医科大学检验学院徐广贤教授惠赠;VSMCs、293T细胞(中南大学湘雅细胞库);LB营养琼脂,LB肉汤(高科园海博);无内毒素质粒提取试剂盒、E.coli DH5α菌株(天根生化);脂质体Lipofectamine 2000(Invitrogen);XbaⅠ和SalⅠ限制性内切酶(TaKaRa);Daxx(sc-7152)、p-AKT、β-actin、GAPDH抗体、辣根过氧化物酶标记的山羊抗兔IgG和山羊抗兔IgG抗体(proteintech);DMEM、胎牛血清等细胞培养试剂(Hyclone);化学发光仪(Tanon);蛋白印迹系统(Bio-RAD);倒置荧光显微镜(Olympus)。
1.2 方法 1.2.1 实验分组观察Daxx在AngⅡ介导的VSMCs增殖中表达情况,根据1 μmol/L AngⅡ孵育时间不同,将实验分组为:①0 h组;②3 h组;③6 h组;④12 h组;⑤ 24 h组。确定AngⅡ对Daxx蛋白表达具有抑制作用,并选择24 h进行后续实验,接下来将实验分为4组:①无血清培养基孵育pCDH-EGFP病毒液感染的vector细胞组;②1 μmol/L AngⅡ孵育pCDH-EGFP病毒液感染的Vector组;③无血清培养基孵育pCDH-DaxxEGFP病毒液感染的过表达Daxx组;④1 μmol/L AngⅡ孵育pCDH-Daxx-EGFP病毒液感染的过表达Daxx组。
1.2.2 重组Daxx基因慢病毒载体的构建从NCBI基因库中获取Daxx基因的mRNA序列,采用PAS(PCRbased AccurateSynthesis)的方法合成基因Daxx,使用双酶切(XbaⅠ和SalⅠ)对目的基因片段酶切产生特异接口,再利用T4连接酶将酶切片段连接pCDH-CMVMCS-EF1-copEGFP载体相应位点,获得重组质粒pCDH-Daxx-EGFP。
1.2.3 慢病毒颗粒的包装及滴度测定细胞以2×105/孔接种于6孔板中,达到80%融合率时用制备的重组质粒pCDH-Daxx-EGFP与pLP1、pLP2、pLP/VSVG在转染试剂LipofectamineTM2000下共转染293T细胞。培养6 h后,更换10% FBS培养基。转染24 h后收集病毒上清液(含慢病毒),0.45 μm的滤器过滤,密封,4 ℃保存。如果长时间保存,则分装后放于-80 ℃冻存。
1.2.4 重组慢病毒(pCDH-Daxx-EGFP)感染VSMCs试验VSMCs以含10%胎牛血清的DMEM培养基培养。转染前1 d,将VSMCs以1×105/孔的密度接种于24孔板。经37 ℃,5% CO2孵箱培养24 h后,将含VSMCs表达重组慢病毒的溶液冰上融解,用培养液稀释病毒液,并加入终浓度为8 μg/mL的聚凝胺Polybrene,轻轻混匀后加入到细胞中。培养箱中孵育6 h后,换上新鲜的培养基继续置孵箱培养。24 h后将细胞置倒置荧光显微镜下观察,根据转染细胞能发出绿色荧光的特点判断转染是否成功。
1.2.5 MTT法检测细胞活力细胞以5000/孔接种于96孔板中,每孔设6个复孔,待细胞融合度达到60%~80%时,然后用AngⅡ处理细胞24 h。处理结束后,加入100μL 0.5 mg/mL的MTT溶液孵育4 h后,弃上清,加入150 μL DMSO溶解紫色结晶沉淀,测吸光度A450 nm。
1.2.6 流式细胞术检测细胞周期细胞以5×105/孔接种于6孔板中,待细胞融合度达到60%~80%时,然后用AngⅡ处理细胞24 h后,按如下步骤收集细胞:将处理后的细胞用胰酶消化后收集于1.5 mL EP管中,1000 r/min离心3 min,弃上清收集细胞,然后轻轻震荡并悬浮细胞后加入预冷的PBS洗1遍,4 ℃,1500 r/min离心5 min。震荡离心管使细胞悬浮,边震荡逐滴加入1 mL预冷的75%乙醇,于-20 ℃固定细胞过夜后,4 ℃ 2000 r/min,离心5 min后去上清。PBS洗涤细胞2次,加入50 μL RNase和50 μL PI,37 ℃染色30 min,避光保存于4 ℃。流式细胞仪检测细胞周期变化。
1.2.7 划痕法检测细胞迁移率细胞以5×105/孔接种于6孔板中,待细胞融合度达到60%~80%后,用无菌枪头垂直横线划“1”字形划痕,用PBS洗3次,加入AngⅡ处理细胞24 h后放入培养箱中继续培养,按0、24 h取样,拍照。每组任取5个点视野,利用Image J读出迁移率。
1.2.8 Western blot法检测蛋白表达取各组实验处理后细胞,用预冷的PBS洗3次,加入RIPA裂解液和PMSF的混合液100 μL(100:1)置于冰上裂解30 min,收集蛋白,4 ℃,13 000 r/min离心15 min,收集上清。样品100 ℃煮沸10 min,使其变性。配制8%~10%聚丙烯酰胺凝胶,进行电泳分离(浓缩胶80 V,分离胶120 V),0.22 μm PVDF膜200 mA湿转120 min,5%脱脂牛奶慢摇封闭1 h,加入一抗Daxx(1:1000),p-Akt(1:1000)和β-actin(1:1000),4 ℃孵育过夜,TBST洗4次,每次15 min,按1:8000的比例加入稀释的辣根过氧化物酶标记的山羊抗兔二抗室温孵育1 h,然后用TBST洗膜4次,每次15 min,用化学发光显影法进行显影。
1.3 统计分析所有数据均用均数±标准差表示。采用SPSS 17.0统计软件进行数据处理,采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 重组质粒pCDH-Daxx-EGFP的鉴定 2.2.1 测序结果pCDH-CMV-MCS-EF1-copEGFP质粒中插入的Daxx基因序列与要求合成序列完全一致,目的基因的插入方向正确。将测序结果与设计的预期序列进行比对,测序结果部分与预期序列完全一致。
2.2.2 重组质粒pCDH-Daxx-EGFP酶切电泳结果构建的pCDH-Daxx-EGFP表达载体经XbaⅠ和SalⅠ双酶切后,用1%琼脂糖凝胶电泳可见约2000 bp大小的条带与约7000 bp大小的条带,分别与前述含有目标基因Daxx的设计序列(2193 bp)和质粒pCDH-CMV-MCSEF1-copEGFP(7384 bp)大小相仿(图 1)。
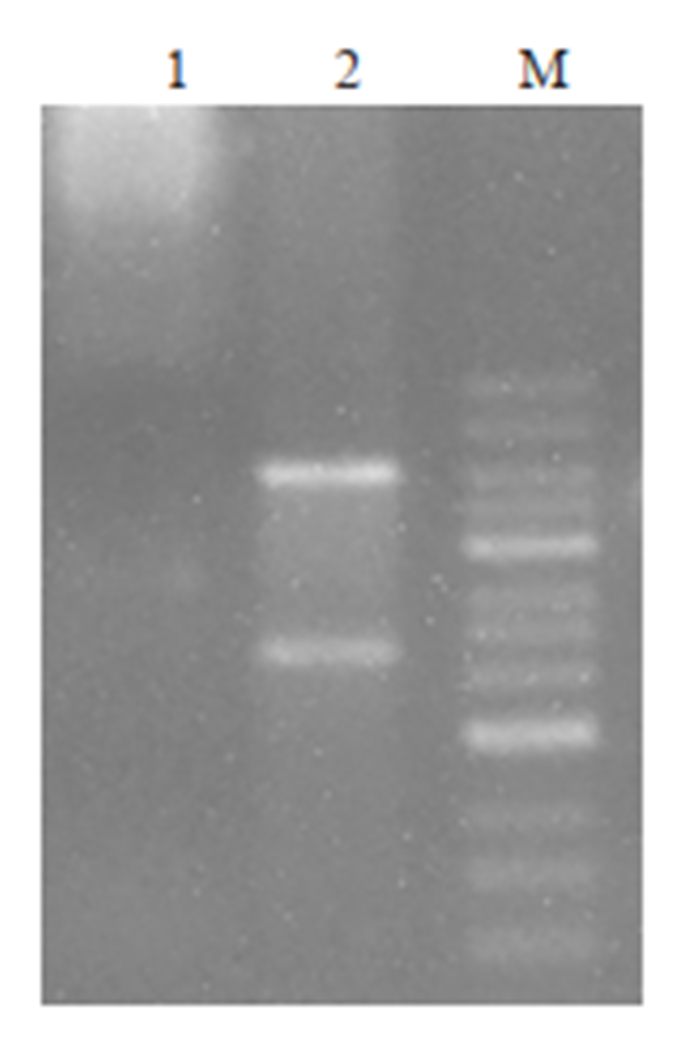
|
图 1 pCDH-Daxx-EGFP重组质粒酶切图 Fig.1 Digestion map of pCDH-Daxx-EGFP recombinant plasmid. M: Marker; Lane 1: Plasmid before digestion; Lane 2: Plasmid after digestion. |
构建的重组质粒pCDH-Daxx-EGFP与包装质粒共转染293T细胞后观察到绿色荧光表达,表明293T细胞成功地包装制备了重组慢病毒。VSMCs用慢病毒感染后用荧光显微镜观察发现80%以上的VSMCs表达绿色荧光蛋白,经传代培养后仍有很强绿色荧光蛋白表达,提示目的基因整合成功(图 2)。
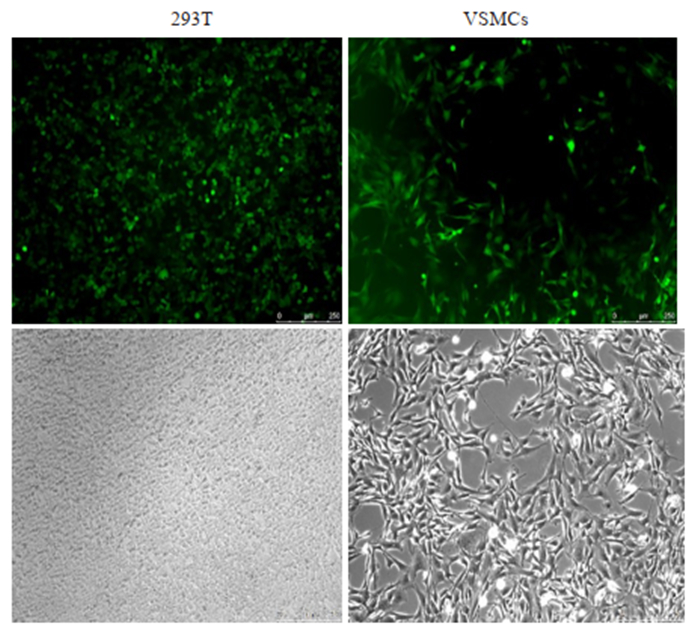
|
图 2 慢病毒表达载体和包装质粒共转染293T细胞系产生慢病毒与慢病毒感染VSMCs表达情况 Fig.2 Co-transfection of 293T cells with the recombinant lentiviral vector and packaging plasmid and VSMCs infected with the recombinant lentivirus (Original magnification: ×100). |
与空白对照组和空载组比较,转染组Daxx蛋白表达水平均明显升高,具有统计学意义(P < 0.05,图 3)。
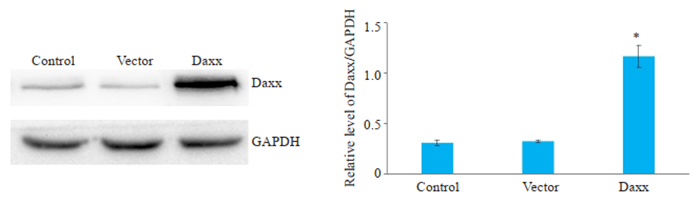
|
图 3 Western blot法检测Daxx蛋白的表达 Fig.3 Expression of Daxx protein detected by Western blotting (n=3, Mean±SD). *P < 0.05 vs Vector. |
1 μmol/LAngⅡ分别刺激VSMCs 0、3、6、12、24 h后,Daxx蛋白的表达随着干预时间的增加而下调,在24 h时Daxx蛋白表达下调明显(P < 0.05,图 4),故选择24 h进行后续实验。
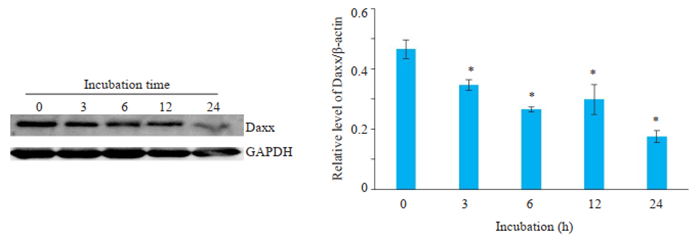
|
图 4 Western blot法观察用AngⅡ孵育不同时间Daxx蛋白表达的变化 Fig.4 Western blotting for detecting the changes of Daxx protein expression at different time points during incubation with AngⅡ (n=3, Mean±SD). *P < 0.05 vs 0 h. |
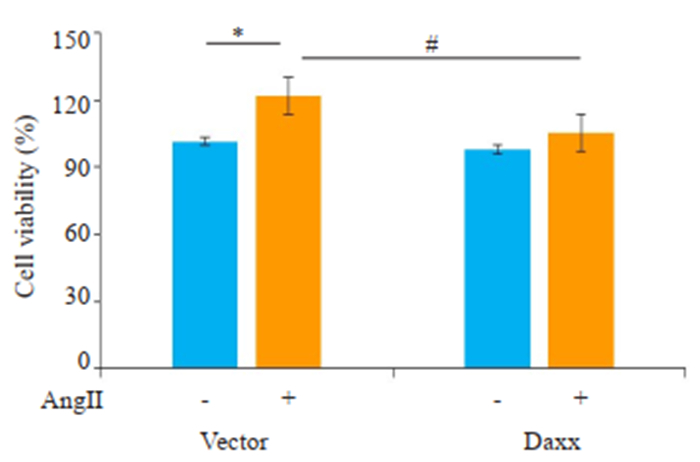
AngⅡ孵育Vector组和转染Daxx组细胞24 h后,Vector组细胞增殖(25±2.50)%(P < 0.05,图 5),而转染Daxx组细胞仅增殖(8.40±1.90)%。表明Daxx可以抑制AngⅡ诱导的VSMCs增殖。
|
图 5 MTT检测Daxx对于VSMCs活力的影响 Fig.5 Effect of Daxx overexpression on VSMC viability assessed by MTT assay (n=3, Mean±SD). *P < 0.05 vs Vector, #P < 0.05 vs Vector+AngⅡ. |
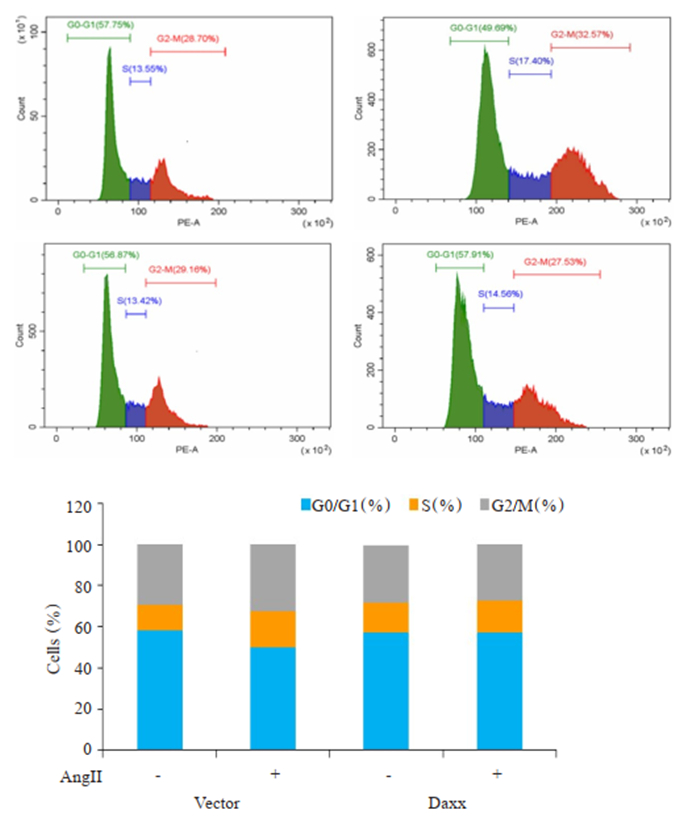
结果图 6显示,AngⅡ孵育Vector组和转染Daxx组细胞24 h后,Vector组细胞G0/G1期比例由(57.75± 0.36)%降低至(49.69±0.32)%(P < 0.05),而转染Daxx组细胞G0/G1期比例由(56.87±0.22)%升高至(57.91± 0.19)%,没有明显改变(P>0.05)。表明Daxx主要是通过阻滞细胞G0/G1期向S期的合成,进而影响细胞增殖过程的。
|
图 6 Daxx对于VSMCs增殖的周期影响 Fig.6 Effect of Daxx overexpression on cell cycle distribution of VSMCs (n=3, Mean±SD). |
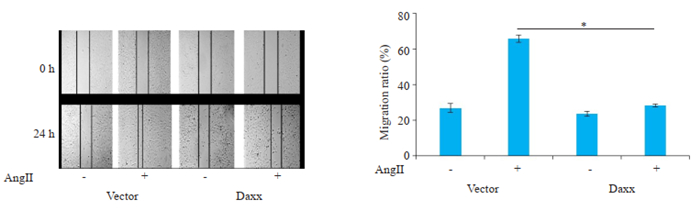
AngⅡ分别孵育Vector组和转染Daxx组细胞24 h后,Vector组细胞的迁移率明显增加(P < 0.05),而转染Daxx组细胞的迁移率较Vector组明显降低(P < 0.05,图 7)。表明Daxx可以降低AngⅡ诱导的VSMCs的迁移率。
|
图 7 Daxx对AngⅡ诱导的VSMCs迁移影响 Fig.7 Effect of Daxx overexpression on AngⅡ-induced migration in the VSMCs (n=3, Mean±SD). *P < 0.05. |
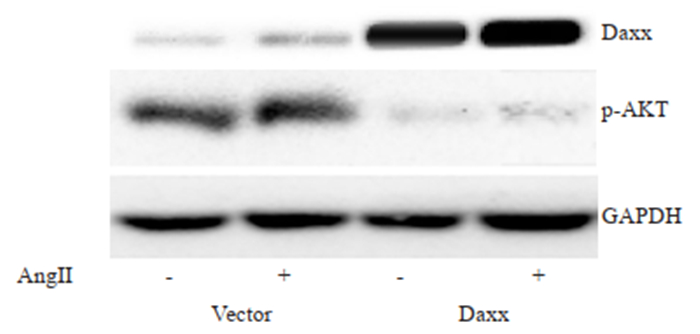
AngⅡ孵育Vector组和转染Daxx组细胞24 h后,Vector组细胞中Daxx蛋白表达明显降低,而p-AKT蛋白表达明显升高(P < 0.05)。转染Daxx组细胞中Daxx蛋白表达较Vector组明显升高,而p-AKT蛋白表达明显降低(P < 0.05,图 8)。
|
图 8 Daxx对VSMCs中p-Akt蛋白表达的影响 Fig.8 Effects of Daxx overexpression on the expression of p-Akt in AngⅡ-treated VSMCs (n=3, Mean±SD). |
近年来,慢病毒为载体的基因治疗研究发展非常迅速。从第1代慢病毒载体系统发展至第3代慢病毒载体系统。慢病毒载体系统由于其宿主范围广、转染效率高、可感染非分裂细胞、免疫反应小和可整合进宿主基因组长期表达等[9]优点,使得慢病毒载体成为一种能实现外源基因的高效导入及应用于疾病的基因治疗等的有效工具,具有良好应用前景[10]。本实验选用含有增强型绿色荧光蛋白基因(EGFP)的第3代慢病毒四质粒载体系统,通过去除野生型病毒基因组中的致病基因而大大提高了其生物安全性,而且该系统因含有标记基因EGFP,可以标识转移质粒的转染效率。鉴于以上优点,本实验进行了过表达Daxx大鼠VSMCs的构建,最终得到转染Daxx重组慢病毒的VSMCs株。利用Western boltting法对转染Daxx重组慢病毒的VSMCs株中Daxx的表达情况从蛋白质水平水平进行了分析,结果证实转染Daxx重组慢病毒的VSMCs株中Daxx的蛋白表达水平均有显著升高,证实成功构建了过表达Daxx的VSMCs。
AngⅡ已被确定为关键的血管活性肽,在心肌病[11],冠状动脉疾病[12],AS[13]和血管损伤[14]等血管疾病的发病机制中具有重要作用。研究已证实AngⅡ能诱导VSMCs表型转化[15-16],内皮细胞功能障碍[17-19],血管炎症[20-21]等。最近,越来越多的研究调查表明,AngⅡ还可以通过受体介导的信号传导参与心血管疾病,随后通过刺激VSMCs激活多种细胞内信号通路,包括磷脂酰肌醇3-激酶(PI3K)/Akt[22]、丝裂原活化蛋白激酶(MAPK)[23]和JAK/STAT3[24]等,促进VSMCs的增殖和迁移。本实验我们应用AngⅡ干预VSMCs,研究发现随着AngⅡ孵育时间延长,VSMCs中Daxx的蛋白表达逐渐下调,在24 h时Daxx蛋白表达下调明显,故选择24 h进行后续实验。为研究Daxx对VSMCs增殖作用,采用MTT法观察过表达Daxx对AngⅡ诱导的VSMCs细胞活力的影响。结果显示,AngⅡ孵育的Vector组细胞增殖明显,而转染Daxx组细胞在AngⅡ刺激前后无明显增殖。经流式细胞术检测发现,AngⅡ孵育Vector组细胞的G0/G1期比例明显减低,而转染Daxx组细胞在Ang Ⅱ刺激前后G0/G1期比例没有明显改变,表明Daxx可能通过抑制G0/G1期向S期转换从而抑制VSMC增殖。
PI3K/Akt途径是AS形成过程中参与VSMCs增殖和迁移的必需细胞内信号传导途径[25]。目前研究表明,PI3K/Akt信号通路的激活与VSMCs功能有关,包括细胞迁移[26],增殖[27],钙化[28]和细胞凋亡[29]。正常情况下,Akt在细胞中处于去磷酸化状态,只有被激活成活化的Akt(即磷酸化的Akt,P-Akt)才会与底物蛋白发生作用,调控下游的多种信号种分子,进而促进细胞的增殖和迁移[30]。因此,通过抑制Akt活化,可以很大程度上抗心血管疾病的作用。可见,Daxx与Akt有着密切关联。本实验结果显示,转染Daxx重组慢病毒的VSMCs株和Vector细胞株分别给予AngⅡ刺激后,高表达Daxx组细胞活性明显降低,说明Daxx能抑制VSMCs增殖;Daxx可以通过使S期细胞数量减少,进而抑制VSMCs增殖;转染Daxx组中p-Akt蛋白表达明显下调,提示Daxx抑制VSMCs的增殖与迁移,可能与p-Akt蛋白表达有关。
综上所述,本实验结果表明Daxx能显著抑制VSMCs增殖与迁移,其主要机制可能与p-Akt蛋白表达有关。结合本次研究结果,更进一步证实Daxx参与血管再狭窄及其他心血管疾病,但其作用机制还需要更进一步在动物体内研究,为将来的临床治疗提供一定的理论依据。
| [1] |
Lu H, Daugherty A. Recent Highlights of ATVB Atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2015, 35(3): 485-91. DOI:10.1161/ATVBAHA.115.305380 |
| [2] |
Chistiakov DA, Orekhov AN, Bobryshev YV. Vascular smooth muscle cell in atherosclerosis[J]. Acta Physiologica, 2015, 214(1): 33-50. DOI:10.1111/apha.12466 |
| [3] |
Han XJ, Chen M, Hong T, et al. Lentivirus-mediated RNAi knockdown of the gap junction protein, Cx43, attenuates the development of vascular restenosis following balloon injury[J]. Int J Mol Med, 2015, 35(4): 885-92. DOI:10.3892/ijmm.2015.2078 |
| [4] |
Hedman M, Muona K, Hedman A, et al. Eight-year safety followup of coronary artery disease patients after local intracoronary VEGF gene transfer[J]. Gene Ther, 2009, 16(5): 629-34. DOI:10.1038/gt.2009.4 |
| [5] |
Lebas B, Galley J, Renaud-Gabardos E, et al. Therapeutic benefits and adverse effects of combined proangiogenic gene therapy in mouse critical leg ischemia[J]. Ann Vasc Surg, 2017, 40: 252-61. DOI:10.1016/j.avsg.2016.08.027 |
| [6] |
Xiong G, Li L, Sun S, et al. Subcellular localization of DAXX influence ox-LDL induced apoptosis in macrophages[J]. Mol Biol Rep, 2014, 41(11): 7183-90. DOI:10.1007/s11033-014-3601-z |
| [7] |
Tang SY, Wan YP, Wu YM. Death domain associated protein (Daxx), a multi-functional protein[J]. Cell Mol Biol Lett, 2015, 20(5): 788-797. DOI:10.1515/cmble-2015-0048 |
| [8] |
刘锦红.过表达Daxx对Chol: MβCD诱导血管平滑肌细胞凋亡的作用研究[D].南华大学, 2013.
|
| [9] |
孟凡荣, 陈琛, 万海粟. 慢病毒载体及其研究进展[J]. 中国肺癌杂志, 2014, 17(12): 870-6. DOI:10.3779/j.issn.1009-3419.2014.12.09 |
| [10] |
Wilson RC, Gilbert LA. The promise and challenge of in vivo delivery for genome therapeutics[J]. ACS Chem Biol, 2018, 13(2): 376-82. DOI:10.1021/acschembio.7b00680 |
| [11] |
Ma H, Kong J, Wang YL, et al. Angiotensin-converting enzyme 2 overexpression protects against doxorubicin-induced cardiomyopathy by multiple mechanisms in rats[J]. Oncotarget, 2017, 8(15): 24548-563. DOI:10.18632/oncotarget.15595 |
| [12] |
Sen A, Shin-Ichiro M, Yuhei S, et al. Depressor and anti-inflammatory effects of angiotensin Ⅱ receptor blockers in metabolic and/or hypertensive patients with coronary artery disease: a randomized, prospective study (DIAMOND Study)[J]. J Clin Med Res, 2016, 8(10): 743-8. DOI:10.14740/jocmr2675w |
| [13] |
Yano H, Hibi K, Nozawa N, et al. Effects of valsartan, an angiotensin Ⅱ receptor blocker, on coronary atherosclerosis in patients with acute myocardial infarction who receive an angiotensin-converting enzyme inhibitor[J]. Circ J, 2012, 76(6): 1442-51. DOI:10.1253/circj.CJ-11-1102 |
| [14] |
Seara FAC, Barbosa RAQ, de Oliveira DF, et al. Administration of anabolic steroid during adolescence induces long-term cardiac hypertrophy and increases susceptibility to ischemia/reperfusion injury in adult Wistar rats[J]. J Steroid Biochem Mol Biol, 2017, 171: 34-42. DOI:10.1016/j.jsbmb.2017.01.012 |
| [15] |
Ren XS, Tong Y, Ling L, et al. NLRP3 gene deletion attenuates angiotensin Ⅱ-Induced phenotypic transformation of vascular smooth muscle cells and vascular remodeling[J]. Cell Physiol Biochem, 2017, 44(6): 2269-80. DOI:10.1159/000486061 |
| [16] |
Savoia C, Burger D, Nishigaki N, et al. Angiotensin Ⅱ and the vascular phenotype in hypertension[J]. Expert Rev Mol Med, 2011, 13: e11. DOI:10.1017/S1462399411001815 |
| [17] |
Abbas M, Jesel L, Auger C, et al. Endothelial microparticles from acute coronary syndrome patients induce premature coronary artery endothelial cell aging and thrombogenicity: role of the Ang Ⅱ/AT1 receptor/NADPH oxidase-mediated activation of MAPKs and PI3-Kinase pathways[J]. Circulation, 2017, 135(3): 280-296. DOI:10.1161/CIRCULATIONAHA.116.017513 |
| [18] |
Xiao X, Zhang C, Ma X, et al. Angiotensin-(1-7) counteracts angiotensin Ⅱ-induced dysfunction in cerebral endothelial cells via modulating Nox2/ROS and PI3K/NO pathways[J]. Exp Cell Res, 2015, 336(1): 58-65. DOI:10.1016/j.yexcr.2015.06.010 |
| [19] |
Boegehold MA, Drenjancevic I, Lombard JH. Salt, Angiotensin Ⅱ, superoxide, and endothelial function[J]. Compr Physiol, 2016, 6(1): 215-54. DOI:10.1002/cphy.c150008 |
| [20] |
Ruiz-Ortega M, Lorenzo O, Suzuki Y, et al. Proinflammatory actions of angiotensins[J]. Curr Opin Nephrol Hypertens, 2001, 10(3): 321-9. DOI:10.1097/00041552-200105000-00005 |
| [21] |
Jia D, He Y, Zhu Q, et al. RAGE-mediated extracellular matrix proteins accumulation exacerbates HySu-induced pulmonary hypertension[J]. Cardiovasc Res, 2017, 113(6): 586-97. DOI:10.1093/cvr/cvx051 |
| [22] |
Dugourd, Ceéline, Gervais M, et al. Akt is a major downstream target of PI3-Kinase involved in Angiotensin Ⅱ-Induced proliferation[J]. Hypertension, 2003, 41(4): 882-90. DOI:10.1161/01.HYP.0000060821.62417.35 |
| [23] |
Shen YJ, Zhu XX, Yang X, et al. Cardamonin inhibits angiotensin Ⅱ-induced vascular smooth muscle cell proliferation and migration by downregulating p38 MAPK, Akt, and ERK phosphorylation[J]. J Nat Med, 2014, 68(3): 623-9. DOI:10.1007/s11418-014-0825-0 |
| [24] |
Ben P, Hu M, Wu H, et al. L-Theanine down-regulates the JAK/STAT3 pathway to attenuate the proliferation and migration of vascular smooth muscle cells induced by angiotensin Ⅱ[J]. Biol Pharm Bull, 2018, 41(11): 1678-84. DOI:10.1248/bpb.b18-00387 |
| [25] |
Cavalot F, Russo I, Vaccheris C, et al. Leptin and vascular smooth muscle cells[J]. Curr Pharm Des, 2014, 20(4): 625-34. DOI:10.2174/13816128113199990022 |
| [26] |
Lee GL, Wu JY, Yeh CC, et al. TLR4 induces CREB-mediated IL-6 production via upregulation of F-spondin to promote vascular smooth muscle cell migration[J]. Biochem Biophys Res Commun, 2016, 473(4): 1205-10. DOI:10.1016/j.bbrc.2016.04.040 |
| [27] |
Li XG, Wang YB. SRPK1 gene silencing promotes vascular smooth muscle cell proliferation and vascular remodeling via inhibition of the PI3K/Akt signaling pathway in a rat model of intracranial aneurysms[J]. CNS Neurosci Ther, 2019, 25(2): 233-44. DOI:10.1111/cns.13043 |
| [28] |
Arvind P, Smeeta S, Hyde GD, et al. FTI-277 inhibits smooth muscle cell calcification by up-regulating PI3K/Akt signaling and inhibiting apoptosis[J]. PLoS One, 2018, 13(4): e0196232. DOI:10.1371/journal.pone.0196232 |
| [29] |
Wang S, Cheng Z, Chen X. Promotion of PTEN on apoptosis through PI3K/Akt signal in vascular smooth muscle cells of mice model of coronary heart disease[J]. J Cell Biochem, 2019, 120(9): 14636-44. DOI:10.1002/jcb.28725 |
| [30] |
Wei F, Zhang Y, Geng L, et al. mTOR inhibition induces EGFR feedback activation in association with its resistance to human pancreatic cancer[J]. Int J Mol sci, 2015, 16(2): 3267-82. DOI:10.3390/ijms16023267 |
 2019, Vol. 39
2019, Vol. 39

