鼻咽癌是我国南方发病率较高的头颈部恶性肿瘤,具有发病原因复杂及诊断不易等特点。研究显示,中国目前的鼻咽癌发病率和死亡率仍处于世界较高水平[1-3]。鼻咽癌作为临床较为常见的肿瘤,其治疗一般首选放射疗法,但这种疗法仅限于早期原位癌,且5年生存率较低[4]。联合放化疗可明显提高早期鼻咽癌患者的治愈率,然而化疗过程中出现的耐药制约了这种联合疗法的应用,导致现有的放化疗方案满足不了当前临床需要。因此,寻找新型有效的抗鼻咽癌药物变得尤为重要。
糖酵解抑制剂3-溴丙酮酸(3-BrPA)具有良好的广谱抗肿瘤作用[5-6],获得国内外广泛研究,有望成为理想的抗肿瘤新药。3-BrPA对肿瘤细胞(包括鼻咽癌)的增殖抑制作用明显并能增加肿瘤细胞对化疗药物的敏感性[7-9],但其抗肿瘤作用机制并不十分明确。
miRNAs在肿瘤细胞中异常表达,是一类参与人肿瘤发生、发展的单链小分子RNA[10]。部分miRNAs的表达水平可影响肿瘤细胞对化疗药物的敏感性[11],调控miRNAs在肿瘤细胞内的表达水平可有效增强某些化疗药物或化学物质的抗肿瘤作用,如灵芝孢子油通过下调miR-21促进人肺腺癌SPC-A1细胞凋亡[12],二甲双胍通过下调miR-23b-5p抑制胰腺癌细胞生长[13],姜黄素通过下调miR-186*促进人肺腺癌A549/DDP细胞凋亡[14]等。研究发现[15],在肿瘤的发生、发展中,异常表达的miRNAs起着非常重要的作用。以往的研究表明miR- 205-5p在鼻咽癌细胞中高表达,下调miR-205-5p在鼻咽癌细胞中的表达水平可以抑制细胞增殖作用[16],3- BrPA亦具备广谱抗肿瘤作用,但尚未见miR-205-5p在3-BrPA诱导鼻咽癌细胞凋亡中的作用的报道,能否通过下调miR-205-5p的表达水平增强3-BrPA对鼻咽癌细胞的凋亡诱导作用值得研究。因此,本实验选用鼻咽癌CNE2Z细胞[17]作为研究对象,探讨miR-205-5p在3- BrPA诱导鼻咽癌CNE2Z细胞凋亡中的作用,以期为鼻咽癌的治疗提供参考。
1 材料和方法 1.1 试剂RPMI 1640培养基(HyClone);胰蛋白酶(Gibco);胎牛血清(四季青);线粒体膜电位检测试剂盒(JC-1)、青霉素-链霉素溶液(碧云天生物技术有限公司);LipofectamineTM2000(Invitrogen);二甲基亚砜(DMSO)(Amresco);3-BrPA(Sigma);Annexin Ⅴ-FITC/PI双染试剂盒(贝博);Mcl-1、Bcl-2、Bax、Bak抗体(Proteintech);山羊抗兔IgG(Abcam)。miR-205-5p(吉玛)(序列见表 1)。
| 表 1 miR-205-5p的序列 Tab.1 Sequences of miR-205-5p mimic and inhibitor for cell transfection experiment |
鼻咽癌细胞株CNE2Z购自北京北纳创联生物技术研究院,由蚌埠医学院科研中心冻存。
1.3 方法 1.3.1 细胞培养、转染将CNE2Z细胞置于含10%胎牛血清的RPMI 1640培养液内,培养于37 ℃、5% CO2、饱和湿度的培养箱中。实验分为对照组(control)、转染组(转染miR-205-5p-mimic或miR-205-5p-inhibitor)、3-BrPA组(80 μmol/L 3-BrPA)、合用组(转染miR-205-5p-mimic或miR-205-5p-inhibitor后合用3-BrPA)。按LipofectamineTM2000说明书操作,将miR-205-5p-mimic/ inhibitor转染到CNE2Z细胞,12 h后更换含血清培养基,加药组在转染后加入80 μmol/L 3-BrPA处理细胞。
1.3.2 MTT法检测细胞抑制率取对数生长期未经转染的CNE2Z细胞,以每孔7×103细胞接种于96孔板,经转染换液,分别培养24、48、72 h后,加入15 μL 20 μg/mL MTT溶液,继续培养4 h,吸去培养液,每孔加入150 μL DMSO,用酶标仪在490 nm处测定吸光度值(A490 nm)。计算细胞抑制率。
1.3.3 Annexin Ⅴ-FITC/PI双染检测细胞凋亡取对数生长期未经转染的CNE2Z细胞,以每孔1×105细胞接种于12孔板,经转染换液,继续培养24 h。收集细胞,1000 r/min离心8 min,弃上清液,加入PBS洗1次,弃上清,按照试剂说明书将PI和Annexin Ⅴ-FITC加入细胞中孵育20 min,1 h内用流式细胞仪检测细胞的凋亡情况。
1.3.4 线粒体膜电位检测取对数生长期未经转染的CNE2Z细胞,以每孔1.5×105细胞接种于6孔板,经转染换液,继续培养24 h,吸除培养液,PBS洗涤细胞2次,按照JC-1检测试剂盒进行操作。30 min内用荧光显微镜观察拍照。
1.3.5 DAPI荧光染色取对数生长期未经转染的CNE2Z细胞,以每孔1.5×105细胞接种于6孔板,经转染换液,继续培养24 h,吸除培养液,PBS洗涤细胞2次,4%多聚甲醛室温固定20 min,每孔加0.5 mL DAPI染色液,避光孵育5 min,弃上清,PBS洗涤2次,加2 mL PBS。用荧光显微镜观察拍照。
1.3.6 Western blot检测蛋白表达取对数生长期未经转染的CNE2Z细胞,以每孔2×105细胞接种于6孔板,经转染换液,继续培养24 h。收集细胞,冰上裂解30 min,4 ℃、12 000 r/min离心30 min,提取细胞总蛋白,BCA蛋白定量法(参照试剂盒说明书操作)测定各组蛋白浓度,加入SDS-PAGE蛋白上样缓冲液,100 ℃煮沸5 min。每组取60 μg蛋白,10% SDS-PAGE电泳(70 V,30 min;100 V,100 min);转膜(200 mA,2~3 h)至PVDF膜;5%脱脂牛奶室温封闭4 h(或4 ℃过夜);一抗室温孵育4 h(或4 ℃过夜);TPBS洗涤3次,10 min/次;二抗室温孵育2 h;TPBS洗涤3次,10 min/次;ECL发光试剂盒发光,凝胶成像系统获取图像。
1.3.7 统计学方法实验数据以均数±标准差表示,使用SPSS 22.0软件用单因素方差分析和q检验对数据进行统计学分析,以P < 0.05表示差异有统计学意义。
2 结果 2.1 3-BrPA对CNE2Z细胞的增殖抑制作用不同浓度3-BrPA(20、40、80、160、320 μmol/L)处理CNE2Z细胞后,采用MTT法观察3-BrPA对CNE2Z细胞的增殖抑制作用。结果显示,3-BrPA能明显抑制CNE2Z细胞的体外增殖活性(图 1),与对照组比较,差异有统计学意义(P < 0.01)。
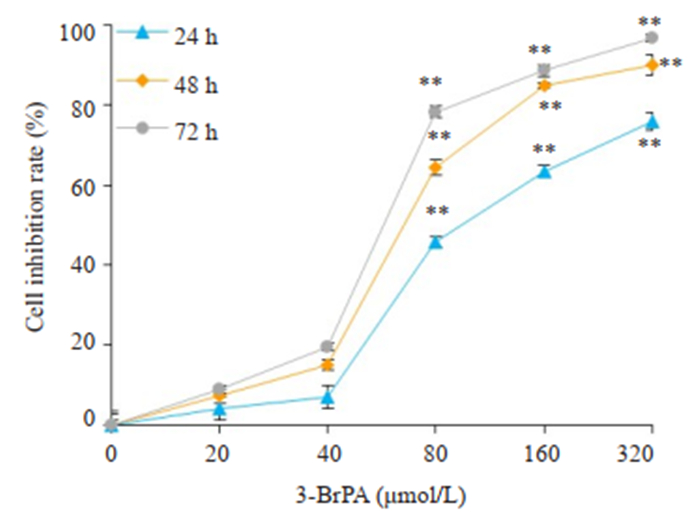
|
图 1 3-BrPA对CNE2Z细胞增殖抑制作用 Fig.1 Inhibitory effect of 3-BrPA on proliferation of CNE2Z cells. **P < 0.01 vs control group. |
分别使用miR-205-5p-mimic和miR-205-5p-inhibitor转染CNE2Z细胞24、48、72 h后,MTT法检测细胞抑制率。结果显示,miR-205-5p-inhibitor能抑制CNE2Z细胞的体外增殖活性,而miR-205-5p-mimic能相对促进CNE2Z细胞的体外增殖活性,且用80 μmol/L 3-BrPA处理转染miR-205-5p-mimic后的CNE2Z细胞,24、48、72 h的抑制率分别为(27.7 ± 1.04)%、(34.8 ± 2.10)%、(44.3±1.57)%(图 2);而用80 μmol/L 3-BrPA处理转染miR-205-5p-inhibitor后的CNE2Z细胞,24、48、72 h的抑制率分别为(80.5±0.94)%、(87.9±0.50)%、(93.8± 1.16)%(图 3)。
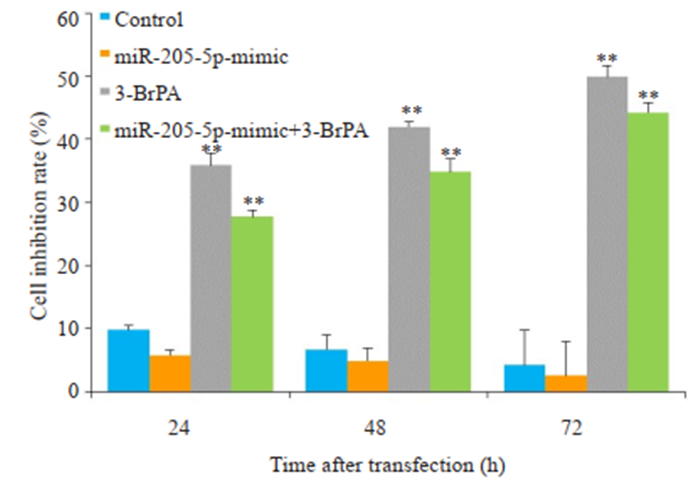
|
图 2 上调miR-205-5p的表达水平增强3-BrPA对CNE2Z细胞的增殖作用 Fig.2 Up-regulation of miR-205-5p enhances the pro-proliferative effects of 3-BrPA in CNE2Z cells. **P < 0.01 vs control group. |
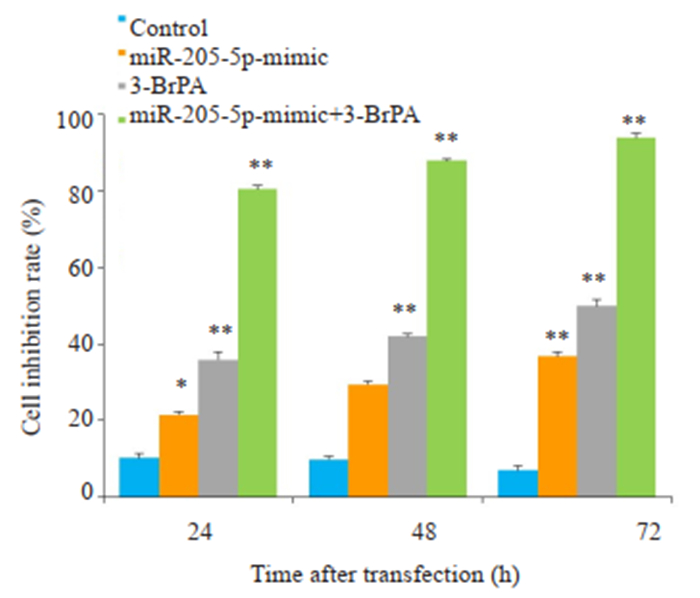
|
图 3 下调miR-205-5p的表达水平增强3-BrPA对CNE2Z细胞的增殖抑制作用 Fig.3 Down-regulation of miR-205-5p enhances the inhibitory effect of 3-BrPA on CNE2Z cell proliferation. **P < 0.01 vs control group. *P < 0.05 vs control group. |
采用线粒体膜电位检测试剂盒(JC-1)观察细胞早期凋亡,荧光显微镜拍照,以JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的指标,结果显示3-BrPA处理转染miR-205-5p-inhibitor的细胞24 h后与control组相比,红色荧光向绿色荧光转变明显(图 4)。
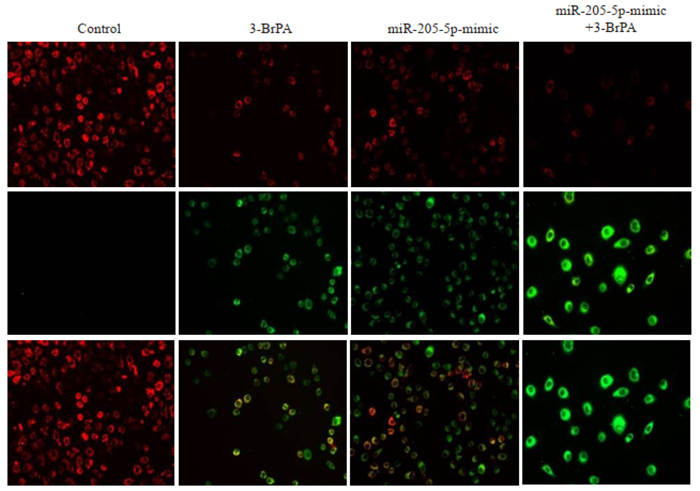
|
图 4 下调miR-205-5p的表达水平对3-BrPA诱导的CNE2Z细胞线粒体膜电位的影响 Fig.4 Effects of down-regulating miR-205-5p on mitochondrial membrane potential in 3-BrPA-treated CNE2Z cells (Original magnification: ×200). |
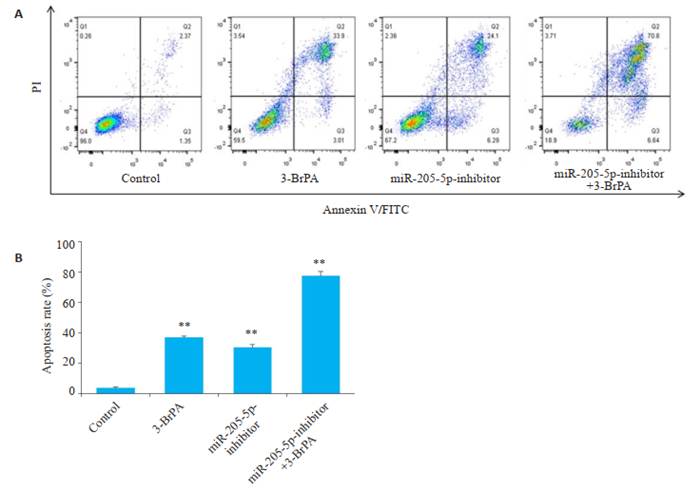
3-BrPA作用转染miR-205-5p-inhibitor的CNE2Z细胞24 h后,收集细胞,流式细胞术检测细胞凋亡情况。结果显示,3-BrPA组的凋亡率为(36.91±1.02)%,转染miR-205-5p-inhibitor组的凋亡率为(30.39±1.81)%,转染miR-205-5p-inhibitor后3-BrPA组的凋亡率为(77.44±2.93)%(图 5A),明显高于单独处理组的凋亡率,与control组比较,差异有统计学意义(P < 0.01,图 5B)。
|
图 5 下调miR-205-5p的表达水平对3-BrPA诱导的CNE2Z细胞凋亡的影响 Fig.5 Effects of down-regulating miR-205-5p on 3-BrPA-induced apoptosis in CNE2Z cells. **P < 0.01 vs control group. |
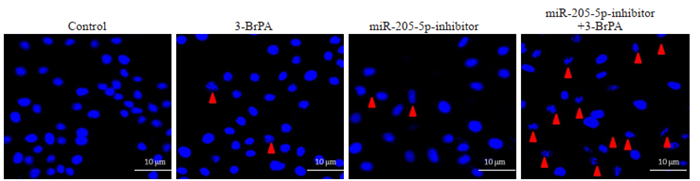
采用DAPI染色法观察细胞核形态的变化,检测细胞晚期凋亡情况,结果显示,3-BrPA处理转染miR-205- 5p-inhibitor的细胞24 h后与control组相比,核碎裂及核固缩明显增多(图 6)。
|
图 6 下调miR-205-5p的表达水平对3-BrPA诱导的CNE2Z细胞细胞核的影响 Fig.6 Effects of down-regulating miR-205-5p on 3-BrPA-induced nuclear changes in CNE2Z cells. |
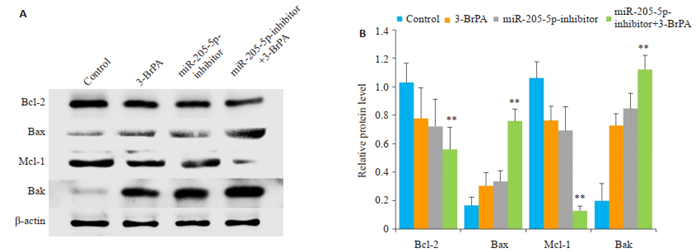
3-BrPA作用转染miR-205-5p-inhibitor的CNE2Z细胞,Western blot检测Mcl-1、Bcl-2、Bak、Bax蛋白的表达,结果显示,抑凋亡蛋白Mcl-1和Bcl-2蛋白表达下调,而促凋亡蛋白Bax和Bak蛋白表达上调(图 7)。
|
图 7 下调miR-205-5p的表达水平对3-BrPA诱导的CNE2Z细胞凋亡相关蛋白的影响 Fig.7 Effects of down-regulating miR-205-5p on apoptosis-related proteins in 3-BrPA-treated CNE2Z cells. **P < 0.01 vs control group. |
肿瘤的形成和生长取决于与正常组织明显不同的各种生物代谢过程[18-20],能量代谢异常是肿瘤的典型特征之一[21-22]。3-BrPA是一种糖酵解抑制剂,可有效抑制多种肿瘤细胞的生长[23-25],它不仅可以靶向糖酵解过程,还可以抑制肿瘤细胞中的线粒体氧化磷酸化[26-28]。本研究MTT结果表明,不同浓度3-BrPA能明显抑制CNE2Z细胞的体外增殖活性,且随着3-BrPA浓度的增加和作用时间的延长而增强。
miRNAs是一类内源性单链非编码小分子RNA,长18~25核苷酸,能够通过在互补杂交时直接靶向编码转录因子来调节基因表达,发挥调节肿瘤细胞增殖、凋亡、转移、侵袭及耐药等方面的重要作用[10-11]。miR-205- 5p作为一种功能性miRNA,近年来受到研究人员的广泛关注。研究表明,miR-205-5p可作为癌基因或抑癌基因在肿瘤发生、发展中发挥重要作用[29-31],不同类型的肿瘤细胞中miR-205-5p的作用亦不同,在乳腺癌[32]和皮肤鳞癌[33]等肿瘤细胞中,miR-205-5p作为抑癌基因表达下调,在肺癌[34]、子宫内膜癌[35]等肿瘤细胞中以癌基因方式参与肿瘤的发生和发展,且miR-205-5p在鼻咽癌组织中的表达水平高于鼻咽正常组织[36-38],有文献研究miR-205-5p在鼻咽癌细胞中增殖、侵袭和迁移的作用机制[16, 39],然而,尚未有文献报道下调miR-205-5p的表达水平是否能增强3-BrPA对鼻咽癌细胞的凋亡诱导作用。因此,本实验下调CNE2Z细胞中miR-205-5p的表达水平,结果发现CNE2Z细胞出现增殖抑制现象,提示miR-205-5p在鼻咽癌中可能以促进细胞增殖的方式发挥作用;在转染miR-205-5p-inhibitor后,3-BrPA处理CNE2Z细胞,发现3-BrPA对CNE2Z细胞的凋亡诱导作用进一步增强,表明下调miR-205-5p在细胞内的表达水平可明显增强3-BrPA诱导CNE2Z细胞的凋亡作用。
Mcl-1是抑凋亡蛋白Bcl-2家族的成员之一,与Bcl-2在结构和功能上相似,能保护线粒体膜的完整性,在多种肿瘤细胞(包括鼻咽癌)的凋亡中有着重要作用,Mcl-1已被证明是调节细胞凋亡的重要分子之一[40]。而Bak和Bax在细胞凋亡途径中主要通过调控各种凋亡诱导因子来发挥作用。本实验结果表明,转染miR- 205-5p-inhibitor后联合3-BrPA作用,相对单独处理组,Bcl-2和Mcl-1蛋白表达水平明显下调,而Bax和Bak蛋白表达水平明显上调,提示下调miR-205-5p可以增强3-BrPA诱导CNE2Z细胞的凋亡诱导作用,其机制可能与调节凋亡相关蛋白的表达有关。
综上所述,本研究结果表明3-BrPA能诱导CNE2Z细胞凋亡,下调CNE2Z细胞中miR-205-5p表达水平后能明显增强3-BrPA诱导的细胞凋亡,其机制可能与下调Mcl-1和Bcl-2蛋白表达,上调Bak和Bax蛋白的表达有关。
| [1] |
Tang LL, Chen WQ, Xue WQ, et al. Global trends in incidence and mortality of nasopharyngeal carcinoma[J]. Cancer Lett, 2016, 374(1): 22-30. |
| [2] |
Tsao SW, Yip YL, Tsang CM, et al. Etiological factors of nasopharyngeal carcinoma[J]. Oral Oncol, 2014, 50(5): 330-8. DOI:10.1016/j.oraloncology.2014.02.006 |
| [3] |
Wei KR, Zheng RS, Zhang SW, et al. Nasopharyngeal carcinoma incidence and mortality in China, 2013[J]. Chin J Cancer, 2017, 36(1): 90. DOI:10.1186/s40880-017-0257-9 |
| [4] |
Lee CC, Huang TT, Lee MS, et al. Clinical application of tumor volume in advanced nasopharyngeal carcinoma to predict outcome[J]. Radiat Oncol, 2010, 5(1): 20. DOI:10.1186/1748-717X-5-20 |
| [5] |
Szczuka I, Gamian A, Terlecki G. 3-Bromopyruvate as a potential pharmaceutical in the light of experimental data[J]. Postepy Hig Med Dosw, 2017, 71: 988-96. |
| [6] |
Fan TJ, Sun GH, Sun XD, et al. Tumor energy metabolism and potential of 3-Bromopyruvate as an inhibitor of aerobic glycolysis: implications in tumor treatment[J]. Cancers (Basel), 2019, 11(3): E317-7. DOI:10.3390/cancers11030317 |
| [7] |
李其响, 张配, 刘芳, 等. 单羧酸转运蛋白1增强乳腺癌细胞对3-溴丙酮酸的敏感性[J]. 南方医科大学学报, 2017, 37(5): 588-93. |
| [8] |
赵素容, 张媛媛, 吴成柱, 等. 3-溴丙酮酸增强肝癌细胞对顺铂敏感性的作用[J]. 南方医科大学学报, 2014, 34(1): 25-30. |
| [9] |
Yoo JJ, Yu SJ, Na JR, et al. Hexokinase-Ⅱ inhibition synergistically augments the anti-tumor efficacy of sorafenib in hepatocellular carcinoma[J]. Int J Mol Sci, 2019, 20(6): 1292. DOI:10.3390/ijms20061292 |
| [10] |
Esquela-Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-69. DOI:10.1038/nrc1840 |
| [11] |
Khan SH. Genome-Editing technologies: concept, Pros, and Cons of various Genome-Editing techniques and bioethical concerns for clinical application[J]. Mol Ther Nucleic Acids, 2019, 16: 326-34. DOI:10.1016/j.omtn.2019.02.027 |
| [12] |
赵光锋, 郭葳, 赵晓寅, 等. 灵芝孢子油通过下调miR-21促进人肺腺癌SPC-Al细胞凋亡[J]. 中国中药杂志, 2011, 36(9): 1231-4. |
| [13] |
刘亚萍.二甲双胍通过下调miR-23b-5p靶向激活STK4抑制胰腺癌细胞生长的作用机制[D].上海: 第二军医大学, 2017: 67.
|
| [14] |
唐妮, 张艰, 杜永平. 姜黄素通过下调miR-186*促进人肺腺癌细胞A549/DDP凋亡[J]. 中国肺癌杂志, 2010, 13(4): 301-6. DOI:10.3779/j.issn.1009-3419.2010.04.06 |
| [15] |
Jothimani G, Sriramulu S, Chabria Y, et al. A review on theragnostic applications of microRNAs and long Non-Coding RNAs in colorectal cancer[J]. Curr Top Med Chem, 2018, 18(30): 2614-29. |
| [16] |
李斐斐.微小RNA 205-5p参与鼻咽癌作用机制的初步研究[D].青岛: 青岛大学, 2017: 62.
|
| [17] |
唐泽立, 陈小毅, 陈燕. 鼻咽癌细胞系CNE1和CNE2Z中EBV-LMP 1的表达[J]. 现代肿瘤医学, 2008, 16(4): 525-6. DOI:10.3969/j.issn.1672-4992.2008.04.007 |
| [18] |
Devorkin L, Pavey N, Carleton G, et al. Autophagy regulation of metabolism is required for CD8(+) T cell anti-tumor immunity[J]. Cell Rep, 2019, 27(2): 502-13. DOI:10.1016/j.celrep.2019.03.037 |
| [19] |
Jagust P, De Luxan-Delgado B, Parejo-Alonso B, et al. MetabolismBased therapeutic strategies targeting cancer stem cells[J]. Front Pharmacol, 2019, 10(203): 1-26. |
| [20] |
Martinez-Outschoorn UE, Pestell RG, Howell A, et al. Energy transfer in "parasitic" cancer metabolism: mitochondria are the powerhouse and Achilles'heel of tumor cells[J]. Cell Cycle, 2011, 10(24): 4208-16. DOI:10.4161/cc.10.24.18487 |
| [21] |
Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even warburg did not anticipate[J]. Cancer Cell, 2012, 21(3): 297-308. DOI:10.1016/j.ccr.2012.02.014 |
| [22] |
Liu YY, Fang SS, Sun QS, et al. Anthelmintic drug ivermectin inhibits angiogenesis, growth and survival of glioblastoma through inducing mitochondrial dysfunction and oxidative stress[J]. Biochem Biophys Res Commun, 2016, 480(3): 415-21. DOI:10.1016/j.bbrc.2016.10.064 |
| [23] |
Ishiguro Y, Kobayashi M, Ideno M, et al. Valproate sensitizes human glioblastoma cells to 3-bromopyruvate-induced cytotoxicity[J]. Int J Pharm, 2018, 551(1-2): 97-102. DOI:10.1016/j.ijpharm.2018.08.039 |
| [24] |
Chen Y, Wei L, Zhang X, et al. 3-Bromopyruvate sensitizes human breast cancer cells to TRAILinduced apoptosis via the phosphorylated AMPKmediated upregulation of Dr5[J]. Oncol Rep, 2018, 40(5): 2435-44. DOI:10.3892/or.2018.6644 |
| [25] |
Zou XE, Zhang MX, Sun YM, et al. Inhibitory effects of 3-bromopyruvate in human nasopharyngeal carcinoma cells[J]. Oncol Rep, 2015, 34(4): 1895-904. DOI:10.3892/or.2015.4147 |
| [26] |
Pulaski L, Jatczak-Pawlik I, Sobalska-Kwapis M, et al. 3-Bromopyruvate induces expression of antioxidant genes[J]. Free Radic Res, 2019, 53(2): 170-8. DOI:10.1080/10715762.2018.1541176 |
| [27] |
Lis P, Dylag M, Niedzwiecka K, et al. The HK2 dependent Warburg Effect"and mitochondrial oxidative phosphorylation in cancer: targets for effective therapy with 3-bromopyruvate[J]. Molecule, 2016, 21(12): 1730. DOI:10.3390/molecules21121730 |
| [28] |
Tran Q, Lee H, Park J, et al. Targeting cancer metabolism-revisiting the Warburg effects[J]. Toxicol. Res, 2016, 32(3): 177-93. DOI:10.5487/TR.2016.32.3.177 |
| [29] |
Cao WF, Zhao YG, Wang L, et al. Circ0001429 regulates progression of bladder cancer through binding miR-205-5p and promoting VEGFA expression[J]. Cancer Biomark, 2019, 25(1): 101-13. DOI:10.3233/CBM-182380 |
| [30] |
Qi J, Liu YF, Hu KS, et al. MicroRNA-205-5p regulates extracellular matrix production in hyperplastic scars by targeting Smad2[J]. Exp Ther Med, 2019, 17(3): 2284-90. |
| [31] |
Tao W, Sun WM, Zhu HL, et al. miR-205-5p suppresses pulmonary vascular smooth muscle cell proliferation by targeting MICAL2-mediated Erk1/2 signaling[J]. Microvasc Res, 2019, 124: 43-50. DOI:10.1016/j.mvr.2019.03.001 |
| [32] |
张海鸽. MicroRNA-205通过调节AMOT的表达抑制乳腺癌的增殖与侵袭[D].郑州: 郑州大学, 2016: 108.
|
| [33] |
周晓宇. miR-205-5p在人皮肤鳞癌SCC12细胞中的表达, 作用及其机制研究[D].大连: 大连医科大学, 2018: 44.
|
| [34] |
Zeng Y, Zhu J, Shen D, et al. MicroRNA-205 targets SMAD4 in non-small cell lung cancer and promotes lung cancer cell growth in vitro and in vivo[J]. Oncotarget, 2017, 8(19): 30817-29. DOI:10.18632/oncotarget.10339 |
| [35] |
Ma YJ, Ha CF, Bai ZM, et al. Overexpression of microRNA-205 predicts lymph node metastasis and indicates an unfavorable prognosis in endometrial cancer[J]. Oncol Lett, 2016, 12(6): 4403-10. DOI:10.3892/ol.2016.5262 |
| [36] |
Tang JF, Yu ZH, Liu T, et al. Five miRNAs as novel diagnostic biomarker candidates for primary nasopharyngeal carcinoma[J]. Asian Pac J Cancer Prev, 2014, 15(18): 7575-81. DOI:10.7314/APJCP.2014.15.18.7575 |
| [37] |
Liu ML, Zhu KR, Qian XM, et al. Identification of miRNA/mRNANegative regulation pairs in nasopharyngeal carcinoma[J]. Med Sci Monit, 2016, 22: 2215-34. DOI:10.12659/MSM.896047 |
| [38] |
Wang F, Lu J, Peng XH, et al. Integrated analysis of microRNA regulatory network in nasopharyngeal carcinoma with deep sequencing[J]. J Exp Clin Cancer Res, 2016, 35(1): 17. DOI:10.1186/s13046-016-0292-4 |
| [39] |
苗玉, 贺荟静, 李斐斐, 等. miR-205-5p对鼻咽癌细胞系增殖, 迁移和侵袭的影响及其机制[J]. 青岛大学学报:医学版, 2018, 54(3): 257-62. |
| [40] |
Weng JR, Bai LY, Chiu SJ, et al. Divaricoside exerts antitumor effects, in part, by modulating Mcl-1 in human oral squamous cell carcinoma cells[J]. Comput Struct Biotechnol J, 2019, 17(1): 151-9. |
 2019, Vol. 39
2019, Vol. 39

