2. 皖南医学院 细胞电生理研究室,安徽 芜湖 241002;
3. 皖南医学院 启明星小组,安徽 芜湖 241002
2. Cell Electrophysiology Laboratory, Wannan Medical College, Wuhu 241002, China;
3. Rising-Star Group, Wannan Medical College, Wuhu 241002, China
口腔颌面部疼痛是涉及口腔咀嚼肌功能紊乱及慢性头颈疼痛的一大类疾病,包括颞下颌关节病(TMD)、非继发性头痛、面颈部局限性肌痛及肌痉挛等,其中以TMD最为常见,而咀嚼肌疼痛也是TMD的主要症状之一[1-2]。在下颌运动过程中,可以影响上下颌正常咬合咀嚼的牙齿接触,称咬合干扰。咬合干扰在咀嚼运动过程中不但无功能意义,反而增加了不必要的肌功能负担,引起咀嚼肌异常的肌电活动甚至脑电活动的改变,是TMD的主要因素之一[3-4]。临床上常见很多患者咀嚼肌疼痛与金属冠修复、正畸治疗和咬合重建等口腔疾病治疗产生的咬合干扰密切相关[5-7]。研究表明,长期咬合干扰能诱发大鼠咀嚼肌慢性机械痛敏,且与咬合干扰的程度有关[8]。愈燕芳等[9]研究表明咬合干扰引起的咬合创伤可引起脑干和颈髓中枢神经元的敏化,是咬合创伤致咀嚼肌疼痛的中枢机制之一。Cao等[10]通过动物实验认为三叉神经脊束核特异性伤害感受神经元参与此过程的中枢敏化。在咬合干扰引起颌面部疼痛的机制方面,目前基本局限在分别对咀嚼肌、脑干或颈髓中枢神经元的痛敏变化研究,技术上主要以形态学等为主[11-12],而采用电生理方法检测痛觉传入通路的研究,目前尚未见相关报道。基于传导痛觉的三叉神经感觉纤维进入中枢后,主要与三叉神经脊束核尾侧亚核(SPVC)相联系的结构基础[13],故本研究通过建立刺激大鼠三叉神经节(TG)、记录SPVC生物电活动和外周生理指标的技术,以观察咬合干扰对三叉神经痛觉传入通路、SPVC神经元兴奋性的影响。
1 材料和方法 1.1 实验动物选择体质量250~280 g的清洁级成年雄性Wistar大鼠20只,由扬州大学比较医学中心提供,许可证号SCXK(苏)2012-0004,随机均分为对照组和模型组,每组10只。
1.2 仪器和药品大鼠脑立体定位仪(瑞沃德68000系列),动物恒温系统(上海奥尔科特生物科技有限公司),口腔打磨机H2L2401084,手术显微镜,双层铜网电生理屏蔽罩,充气防震台,PowerLab 8/30多通道生理信号采集系统及其Chart Pro分析软件(PowerLab System, AD Instruments, Australia),生物电放大器,玻璃微电极和金属参考电极、刺激电极其它常规哺乳动物手术器械,3.6%的水合氯醛,20%乌拉坦,3%双氧水,75%酒精,口腔裂钻、von Frey尼龙毛(Von Frey hairs测痛仪,North Coast Medical, Inc.CA, USA)。
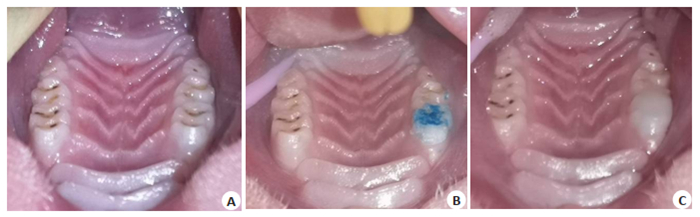
1.3 咬合干扰模型制备参照Cao[3]、俞燕芳等[9]造模方法,本实验进行了相关改良:大鼠磨牙牙合面粘接树脂,可以避免金属冠对大鼠邻牙的挤压以及磨牙开髓及封金属砷失活剂等造成的额外刺激干扰。具体步骤是取模型组大鼠用3.6%的水合氯醛麻醉(用量1 mL/100 g),用医用棉签蘸水清洁右上第一磨牙并吹干;用格鲁玛酸蚀剂酸蚀20 s,冲洗吹干,保持牙面干燥;在酸蚀面涂配套液体粘接剂,光照20 s固化;最后在牙齿的牙合面及颊腭侧,为了增强树脂的牢固性,树脂延伸到磨牙颊侧、腭侧和近中(注意避免产生悬突),涂格鲁玛流动树脂,树脂高出牙合面约0.5~ 1 mm,光照20 s固化。用棉签轻触粘结树脂,树脂须稳固不脱落(图 1)。造模之日起持续观察30 d,造模后第1 d开始每隔1 d检查1次树脂是否稳固(如果脱落,立即重新粘接树脂),同时用von Frey尼龙毛测试咀嚼肌压痛进行鉴定,观察结束进行相关电生理实验。
|
图 1 模型鼠右上第一磨牙咬合干扰口内照片 Fig.1 Photographs of occlusal interference on the right maxillary first molar in the model group. A: Cleaning and drying; B: Acid etching; C: Resin curing. |
在大鼠清醒状态下,参考陈霜等[14]方法测试大鼠单侧咬肌机械刺激反应阈值,用von Frey尼龙毛测试咀嚼肌压痛(咬肌的检测点为眼耳连线中点后下1 cm),每一型号von Frey尼龙毛刺激5次。动物出现缩头、避开、抬腿、发出声音等行为被视为有痛觉反应。根据尼龙毛粗细和动物痛觉反应次数,确定痛敏分值,痛敏分值越高表明肌肉对机械压痛越敏感。痛敏分值评分根据von Frey尼龙毛型号调整为:以100 g von Frey尼龙毛有反应的记1分,60 g反应1~2次记2分,60 g反应3次记3分,60 g反应4~5次记4分,26 g有反应记5分。
1.5 三叉神经节(TG)电刺激和三叉神经脊束核尾侧亚核(SPVC)细胞外记录 1.5.1 麻醉取大鼠给予20%乌拉坦以1.5 g/kg剂量腹腔注射麻醉,直至夹捏刺激无明显反应。麻醉稳定后,将大鼠俯卧位固定于脑立体定位仪上,下面垫保温毯,温度设置为37 ℃,然后放置于双层铜网电生理屏蔽罩内的防震台上。
1.5.2 多项外周生理指标同步记录[15]将体温换能器探头置于大鼠肛门内,进行体温信号采集。大鼠右前肢腕关节上部的大腿皮下插入白色针式电极,左后肢踝关节上部的大腿皮下插入黒式针式电极,右后肢绿色针式电极接地,记录标准肢体Ⅱ导联心电图。将黄棕两根针式电极插入大鼠右侧腋中线第9肋下缘肋间外肌肉,记录呼吸肌肌电图。
1.5.3 定位三叉神经节(TG)和三叉神经脊束核尾侧亚核(SPVC)[15-17]调节耳杆使其左右对称,上下移动门齿杆使大鼠颅骨位于同一平面,固定大鼠头部。切开大鼠头皮,用3%双氧水反复擦拭直至暴露颅骨前囟、人字缝和矢状缝。调节前囟和人字缝至同一水平面。定位三叉神经节:前囱后3.2 mm,矢状缝右侧2.5 mm处,用装有口腔裂钻的口腔打磨机钻一直径为2 mm窗孔,然后将刺激电极穿过该孔插入三叉神经节(硬脑膜下深度为9.5 mm)。定位三叉神经脊束核尾侧亚核(SPVC):前囟后(AP)-12.6~-14.0 mm;右旁开(R)1.9~2.1 mm;硬膜表面以下(DV) 6~7.7 mm。术后持续麻醉。
1.5.4 SPVC放电记录及TG电刺激先记录30 min的SPVC基础放电频率。调试好刺激电极,单脉冲刺激参数为脉冲(0.1 ms,0.2 ms),刺激强度(0.5 mA,1 mA,2 mA,4 mA,8 mA),刺激间隔1 min;串刺激参数为脉冲0.2 ms,强度1 mA,频率为100 Hz,刺激持续30 s。观察SPVC的诱发放电反应及其幅值,以及放电频率和生理指标的改变。
1.5.5 信号采集参数设置[15]记录电极所引导的信号经放大器放大后,接入PowerLab多导生理信号采集与处理系统,运用Chart 5软件进行采集、存盘,采样频率4 kHz,体温为低通10 Hz,心电为低通200 Hz、高通10 Hz,呼吸肌肌电为低通200 Hz、高通0.1 Hz,数字滤波为100 Hz,SPVC记录参数设置:低通2 kHz、高通100 Hz。
1.5.6 刺激和记录位点鉴定实验结束,大鼠断头取脑于4%甲醛溶液内固定后,进行冠状面切片,观察针道位置与图谱TG、SPVC的位置进行比对,进行记录位点鉴定。刺激位点、记录位点正确的样本纳入统计分析。
1.6 统计学分析结果均以均数±标准差表示,用SPSS 18.0软件进行统计学分析,两组数据之间比较用独立样本t检验,刺激前后数据比较用配对t检验分析,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
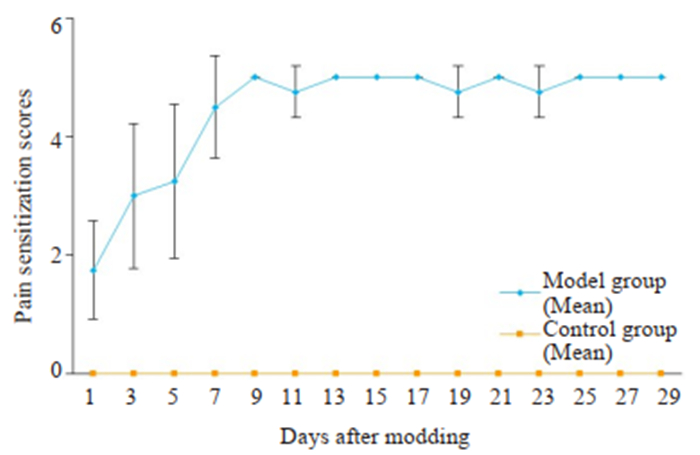
2 结果 2.1 咀嚼肌痛觉敏化检测用von Frey尼龙毛测试两组大鼠咀嚼肌压痛,模型组大鼠自造模后第1天起咬肌即出现痛敏分值升高,约7 d后达到高峰(图 2),并在以后的咬合干扰观察期间痛敏分值维持高水平。观察期间模型鼠右上第1磨牙颊、腭侧及近中牙龈较对侧同名牙以及邻牙稍红肿,右上第1磨牙颊腭向有些松动,垂直向以及近远中向未见明显松动。
|
图 2 模型组(Model group)大鼠的咬肌痛敏评分 Fig.2 Pain sensitization scores of the masseter in the model group (Mean±SD, n=10). |
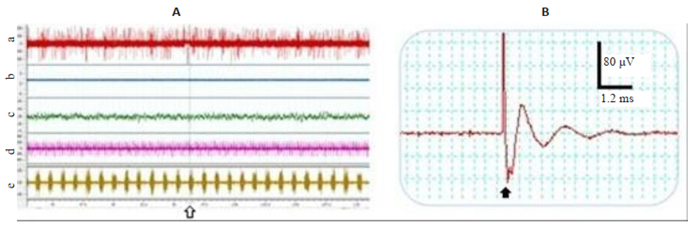
图 3A示例了典型的大鼠三叉神经脊束核尾侧亚核(SPVC)细胞外生物电活动和体温、心电图、呼吸肌肌电图等电生理实验同步记录结果。表明本研究电生理实验相关指标能得到有效、稳定的记录和TG电刺激实验观察(图 3B)。
|
图 3 大鼠SPVC细胞外生物电活动和生理指标同步记录(A)及三叉神经节刺激(↑)诱发的反应(B) Fig.3 Simultaneous recordings of electrical activities from the SPVC and the physiological functions. In A: a: SPVC(μV); b: TG stimulation (hollow arrow); c: Temperature(℃); d: ECG(μV); e: EMG(mV); In B: ↑indicates stimulus artifact of the TG. |
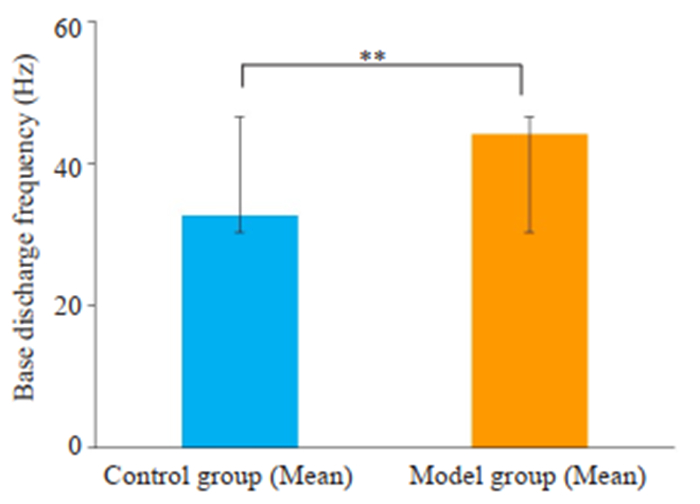
通过放电频率直方图方法分析两组大鼠基础记录30 min的SPVC放电频率平均值,显示对照组大鼠的自发放电频率为32.68±7.28 Hz,而模型组大鼠的自发放电频率升高为44.11±9.08 Hz(图 4,n=10,P < 0.01)。
|
图 4 两组大鼠三叉神经脊束核尾侧亚核(SPVC)的基础自发放电频率比较 Fig.4 Comparison of spontaneous discharge frequencies between the two groups (Mean±SD, n=10). **P < 0.01. |
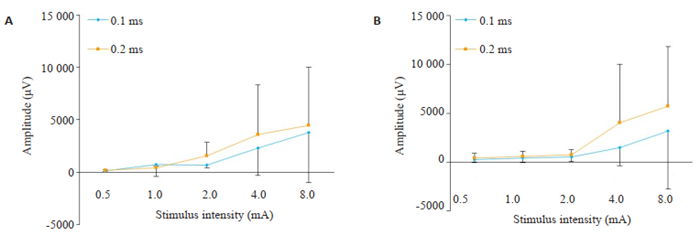
在TG给予不同强度(0.5 mA,1 mA,2 mA,4 mA,8 mA)的单脉冲电刺激(波宽0.1 ms和0.2 ms),两组大鼠均可在SPVC诱发放电性反应,其放电反应的幅值呈现刺激强度依赖性特征(图 5)。
|
图 5 TG电刺激在SPVC诱发反应的刺激强度依赖性 Fig.5 Stimulus intensity-dependent changes of the response amplitude of SPVC evoked by TG stimulation for 0.1 and 0.2 ms in the two groups (Mean±SD, n=10). A: Control group; B: Model group. P < 0.05 in curves 0.1 ms and 0.2 ms of control group, while in curve 0.2 ms of model group. |
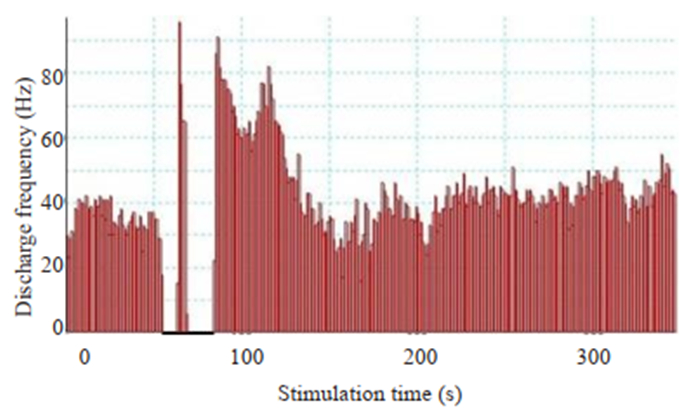
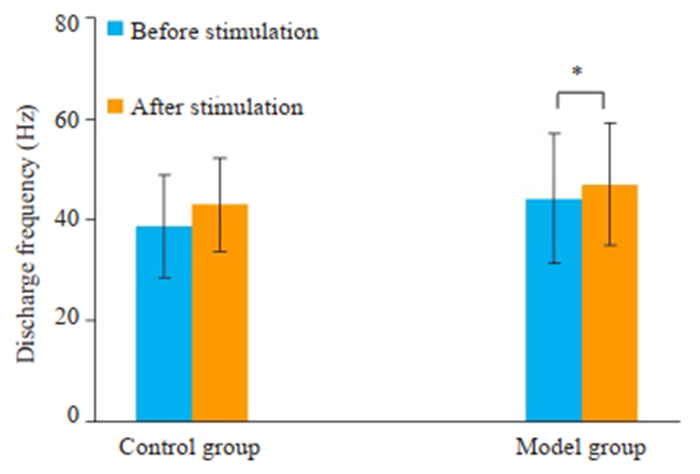
给予两组大鼠TG高频串刺激(0.2 ms,1 mA,30 s,100 Hz),显示大鼠SPVC的放电频率有一过性升高,对照组大鼠的典型放电频率直方图例示于图 6。模型组大鼠刺激后放电频率较刺激前升高(P < 0.05,图 7),而对照组大鼠的刺激前后比较差异没有统计学意义。
|
图 6 对照组大鼠TG高频串刺激(0.2 ms, 1 mA, 30 s, 100 Hz)对SPVC放电频率的影响 Fig.6 Discharge frequency histogram of SPVC after a train stimulation of the TG (0.2 ms, 1 mA, 30 s, 100 Hz). Bin=1 s. |
|
图 7 TG高频串刺激(0.2 ms, 1 mA, 30 s, 100 Hz)后对照组和模型组大鼠SPVC放电频率的比较 Fig.7 Comparison of discharge frequency in the SPVC after a train stimulation of the TG (0.2 ms, 1 mA, 30 s, 100 Hz) between control and model groups (Mean±SD, n=10). *P < 0.05. |
目前认为[18-20]传导口面部痛觉信息的初级传入纤维主要终止在三叉神经脊束核尾侧亚核的浅层,因而三叉神经脊束核尾侧亚核及邻近部位被认为是口面痛初级传入的门户。本实验在大鼠三叉神经节,给予不同强度的单脉冲刺激,并进行三叉神经脊束核尾侧亚核(SPVC)生物电活动和外周生理指标同步记录技术,是对三叉神经痛觉传入通路及其与中枢联系的电生理监测方法。实验结果表明在TG给予不同强度的单脉冲电刺激,可以激活三叉神经痛觉传入通路,并诱发SPVC的神经元产生放电性反应,并呈现反应幅值对刺激强度依赖性,可见本检测方法可以有效激活TG的痛觉传入通路,并评估SPVC神经元兴奋性变化。
3.2 咬合干扰对三叉神经脊束核尾侧亚核(SPVC)的影响Riise等[21]很早就对11名正常牙合年轻志愿者研究发现咬合干扰1 h后咀嚼肌即出现肌电活动增强,48 h达到高峰,干扰去除1周后才能恢复正常。然而,咬合干扰所致咀嚼肌不适与三叉神经脊束核尾侧亚核的关系至今未有定论。本实验将流动树脂粘固于大鼠右侧上颌第一磨牙咬合面形成咬合干扰,咀嚼肌痛觉敏化检测提示咬合干扰可以引起大鼠双侧咀嚼肌广泛、持续的痛觉敏化,且两者存在因果关系。
通过放电频率直方图方法分析两组大鼠麻醉状态下基础放电显示,长期咬合干扰可影响三叉神经脊束核尾侧亚核神经元的功能活动,表现为SPVC神经元兴奋性升高。本实验给予两组大鼠TG高频串刺激,模型组大鼠刺激后SPVC放电频率较刺激前升高,差异有统计学意义,提示咬合干扰可以提高SPVC神经元对痛觉传入的反应性。
至于三叉神经痛觉传入通路的敏感性变化,可以是传入神经本身的兴奋性升高或SPVC神经元兴奋性升高所致,也可以是传入神经与SPVC神经元间突触传递的增强导致。具体机制尚需要进一步研究来阐明。
3.3 咬合干扰引起三叉神经脊束核尾侧亚核(SPVC)的中枢敏化中枢敏化[22]是一种神经元活动依赖性可塑性的变化,其特点是上扬现象和长时程增强效应(LTP),长期咬合干扰,可能产生“记忆效应”,涉及三叉神经周围支痛觉纤维对痛觉传入冲动产生易化作用。研究表明,疼痛可能导致患者产生相关记忆,类似的疼痛会使患者产生易化作用[23-25]。海马是学习记忆及空间定位活动等高级神经活动的重要部位[26-27]。已有学者提出咀嚼运动能够影响认知功能,其运动控制有海马的参与[28]。Ding等[29-30]发现大鼠海马损毁后,大鼠对对咬合干扰引起的咬肌痛觉记忆降低。咬合干扰刺激时间越长[14, 31],有可能也涉及LTP效应,及产生持久的疼痛记忆。本实验咬合干扰持续时间达30 d,通过von Frey尼龙毛刺激大鼠咬肌皮肤可知大鼠咀嚼肌痛觉敏感的易化作用非常明显。这些结果提示咬合干扰所致的咀嚼肌疼痛可能涉及产生LTP效应,易化疼痛的发作。表明咬合干扰不仅可能提高SPVC神经元对三叉神经痛觉传入的敏感性,也可升高SPVC神经元的兴奋性,提示SPVC出现了中枢的可塑性变化,可能是中枢敏化的机制之一。
综上所述,大鼠三叉神经痛觉传入通路的活动可用电刺激TG记录SPVC生物电活动的方法进行检测,咬合干扰可能提高该通路的敏感性和SPVC神经元的兴奋性,导致通路的神经可塑性变化。本研究提示:咬合干扰可致患者口颌面疼痛,临床在进行牙体治疗、义齿修复及正畸等治疗时,尽量避免产生咬合干扰,一旦产生要尽早去除,因为一旦转变为慢性则可能引起中枢变化,即便消除干扰也无法逆转已经产生的疼痛。
| [1] |
Latysheva NV, Filatova EG, Osipova VV. Temporomandibular disorder as the most prevalent cause of facial pain: current evidenc[J]. Zh Nevrol Psikhiatr Im S S Korsakova, 2017, 117(10): 106-13. DOI:10.17116/jnevro2017117101106-113 |
| [2] |
Brogan K, Lockington D, Ramaesh K. Temporomandibular disorder: an important cause of temporal headache in patients unlikely to have giant cell arteritis[J]. Semin Ophthalmol, 2019, 34(2): 80-4. DOI:10.1080/08820538.2019.1578383 |
| [3] |
Cao Y, Xie QF, Li K, et al. Experimental occlusal interference induces long-term masticatory muscle hyperalgesia in rats[J]. Pain, 2009, 144(3): 287-93. |
| [4] |
Figueroba SR, Desjardins MP, Ferreira LE, et al. The influence of altered occlusion on pro-inflammatory cytokine levels in the TMJ synovial tissues of rats[J]. Arch Oral Biol, 2014, 59(11): 1164-71. DOI:10.1016/j.archoralbio.2014.07.003 |
| [5] |
Coêlho TG, Caracas HC. Perception of the relationship between TMD and orthodontic treatment among orthodontists[J]. Dental Press J Orthod,, 2015, 20(1): 45-51. DOI:10.1590/2176-9451.20.1.045-051.oar |
| [6] |
Abdalla HB, Clemente-Napimoga JT, Hashizume CA, et al. Metallic crown-induced occlusal trauma as a protocol to evaluate inflammatory response in temporomandibular joint and periodontal tissues of rats[J]. Clin Oral Investig, 2019, 23(4): 1905-12. DOI:10.1007/s00784-018-2639-z |
| [7] |
Mitrirattanakul S, Jariyasakulroj S. Dental treatment as perceived etiology of temporomandibular disorders[J]. Cranio, 2018, 26(7): 1-6. DOI:10.1016/S1073-8746(95)80053-0 |
| [8] |
刘存瑞, 徐啸翔, 曹烨, 等. 咬合干扰时间因素对大鼠咀嚼肌机械痛觉敏感的影响[J]. 北京大学学报:医学版, 2016, 48(1): 51-6. |
| [9] |
俞燕芳, 谷志远, 傅开元. 咬合创伤致咀嚼肌疼痛的中枢机制研究[J]. 华西口腔医学杂志, 2007, 25(6): 588-90. DOI:10.3321/j.issn:1000-1182.2007.06.019 |
| [10] |
Cao Y, Li K, Fu KY, et al. Central sensitization and MAPKs are involved in occlusal interference-induced facial pain in rats[J]. J Pain, 2013, 14(8): 793-807. DOI:10.1016/j.jpain.2013.02.005 |
| [11] |
Sun SZ, Qi D, Yang YY, et al. Association of occlusal interferenceinduced masseter muscle hyperalgesia and P2X3 receptors in the trigeminal subnucleus caudalis and midbrain periaqueductal gray[J]. Neuroreport, 2016, 27(4): 277-83. DOI:10.1097/WNR.0000000000000533 |
| [12] |
刘存瑞, 曹烨, 徐啸翔, 等. 咬合干扰对大鼠三叉神经脊束核内胶质细胞的影响[J]. 口腔疾病防治, 2018, 26(12): 766-72. DOI:10.12016/j.issn.2096-1456.2018.12.003 |
| [13] |
李云庆, 高田昌彦, 水野. 大鼠三叉神经节细胞向三叉神经脊束核各亚核的分枝投射[J]. 神经解剖学杂志, 1994, 10(4): 299-303. |
| [14] |
陈霜, 王美青, 刘晓东, 等. 急、慢性咬合干扰致雌性大鼠咀嚼肌痛觉敏感的研究[J]. 口腔医学研究, 2008, 24(3): 248-51. |
| [15] |
刘伟, 汪伟伟, 黄军, 等. 大鼠脑内双核团电活动与多项生理指标的同步记录技术[J]. 皖南医学院学报, 2013, 32(5): 423-9. DOI:10.3969/j.issn.1002-0217.2013.05.028 |
| [16] |
Paxinos G, Watson C. The rat brain in stereotaxic coordinates[M]. 6th ed. [S. l. ]: academic press, 2008.
|
| [17] |
张文斌, 熊抗辉, 王百忍, 等. 大鼠三叉神经节神经元向三叉神经脊束核尾侧亚核和孤束核的分支投射[J]. 解剖学报, 1998(3): 20-3. |
| [18] |
Sessle BJ. Neural mechanisms and pathways in craniofacial pain[J]. Can J Neurol Sci, 1999, 26(s3): S7-11. |
| [19] |
董研, 刘洪臣, 王新木, 等. 咬合创伤对三叉神经脊束核敏化作用的研究[J]. 中华口腔医学杂志, 2004, 39(5): 70-2. |
| [20] |
Dasilva AF, Becerra L, Makris N, et al. Somatotopic activation in the human trigeminal pain pathway[J]. J Neurosci, 2002, 22(18): 8183-92. DOI:10.1523/JNEUROSCI.22-18-08183.2002 |
| [21] |
Riise C, Sheikholeslam A. The influence of experimental interfeting occlusal contacts on the postural activity of the anterior temporal and masseter muscles in young adults[J]. J Oral Rehabil, 1982, 9(5): 419-25. DOI:10.1111/j.1365-2842.1982.tb01031.x |
| [22] |
Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity[J]. J Pain, 2009, 10(9): 895-926. DOI:10.1016/j.jpain.2009.06.012 |
| [23] |
Kuffler DP. Coping with Phantom Limb Pain[J]. Mol Neurobiol, 2018, 55(1): 70-84. |
| [24] |
Noel M, Chambers CT, Mcgrath PJ, et al. The influence of children's pain memories on subsequent pain experience[J]. Pain, 2012, 153(8): 1563-72. DOI:10.1016/j.pain.2012.02.020 |
| [25] |
Althaus A, Hinrichs-Rocker A, Chapman R, et al. Development of a risk index for the prediction of chronic post-surgical pain[J]. Eur J Pain, 2012, 16(6): 901-10. DOI:10.1002/j.1532-2149.2011.00090.x |
| [26] |
Okada K, Okaichi H. Functional cooperation between the hippocampal subregions and the medial septum in unreinforced and reinforced spatial memory tasks[J]. Behav Brain Res, 2010, 209(2): 295-304. DOI:10.1016/j.bbr.2010.02.007 |
| [27] |
Reyes-Castro LA, Padilla-Gomez E, Parga-Martinez NJ, et al. Hippocampal mechanisms in impaired spatial learning and memory in male offspring of rats fed a low-protein isocaloric diet in pregnancy and/or lactation[J]. Hippocampus, 2017, 28(1): 18-30. DOI:10.1002/hipo.22798 |
| [28] |
Ono Y, Yamamoto T, Kubo KY, et al. Occlusion and brain function: mastication as a prevention of cognitive dysfunction[J]. J Oral Rehabil, 2010, 37(8): 624-40. DOI:10.1038/sj.bdj.2010.649 |
| [29] |
Ding TT, Xu XX, Cao Y, et al. Inflammatory pain memory facilitates occlusal interference-induced masticatory muscle hyperalgesia in rats[J]. Eur J Pain, 2016, 20(3): 353-64. DOI:10.1002/ejp.730 |
| [30] |
Aidil-Carvalho MF, Carmo A, Ribeiro J. Mismatch novelty exploration training enhances hippocampal synaptic plasticity: A tool for cognitive stimulation?[J]. Neurobiol Learn Mem, 2017, 145(11): 240-50. DOI:10.1016/j.nlm.2017.09.004 |
| [31] |
莫思怡, 徐啸翔, 曹烨, 等. 重复咬合干扰对大鼠咬肌痛觉敏感的易化作用[J]. 口腔医学研究, 2018, 34(3): 266-9. |
 2019, Vol. 39
2019, Vol. 39

