2. 南方医科大学 第一临床医学院2015级临床医学,广东 广州 510515
2. First Clinical Medical College, Southern Medical University, Guangzhou 510515, China
中枢性尿崩症是神经外科常见并发症[1-4],创伤、肿瘤和手术等因素损伤到垂体柄、下丘脑和垂体等鞍区结构均可导致抗利尿激素(AVP)分泌失调,诱发中枢性尿崩的症状。部分患者在损伤远期中枢性尿崩的症状得到缓解[5],但目前无相关研究探讨其缓解机制,本研究通过垂体柄损毁模型模拟了临床垂体柄损伤导致的中枢性尿崩症[6-7],并初步探讨了AVP分泌功能恢复的潜在机制。
Ⅲ型β微管蛋白(Tuj1),作为神经元的一种特异微管蛋白,与轴突生长、囊泡运输密切相关[8-10],可评价细胞骨架的修复情况、轴突再生的能力以及对囊泡的运输能力。双皮质素(DCX)是一种微管相关蛋白(MAP家族),其与包括Tuj1在内的微管蛋白结合可引起结构域连接的微妙变化,使细胞骨架状态发生改变[11-12],这种变化与细胞的迁移、细胞骨架的变化、轴突的再生等密切相关[13-15]。同时,DCX和Tuj1与驱动蛋白的结合[9, 16-19]可进一步促进轴突和囊泡运输功能的修复,此过程通常受到JNK/c-Jun信号通路的调控。JNK/c-Jun作为经典损伤、修复调控相关通路,被广泛报道可参与调控轴突损伤后神经元再生与凋亡[20-21],既可通过促进DCX的表达来保护神经元[22],同时也可激活caspase蛋白家族以启动细胞凋亡程序[23]。在垂体柄损伤后,JNK/c-Jun是否能调控DCX与caspase蛋白家族的平衡以实现组织结构的修复、神经内分泌功能的重建尚未有相关报道。
垂体柄损毁致AVP神经元轴突受损后,如何恢复损伤的细胞骨架及对AVP的运输能力,对改善AVP神经元功能,重建神经内分泌稳态起着重要作用。在本研究中,我们探究了损伤后不同时间点DCX表达情况,并初步探讨了其调控机制及意义,能够为中枢性尿崩症的治疗寻找潜在的靶点。
1 材料和方法 1.1 材料和仪器AVP抗体(Millipore,小鼠抗大鼠抗体);DCX抗体(CST,兔抗大鼠抗体);Tuj1抗体(Abcam,兔抗大鼠抗体);p-JNK抗体(Proteintech,兔抗大鼠抗体);c-Jun抗体(CST,兔抗大鼠抗体);p-c-Jun抗体(CST,兔抗大鼠抗体);caspase3抗体(Proteintech,小鼠抗大鼠抗体);立体定向仪;牙科钻;小动物麻醉系统(瑞沃德);异氟烷;电损仪(UGO);3D打印损毁针(头端:宽2.5 mm,厚1 mm)。
1.2 实验动物32只雄性SD大鼠[南方医科大学动物实验中心提供,SPF级,许可证号:SCXK (粤) 2016-0041,体质量180~250 g,平均体质量220 g。大鼠自由进食进水,环境温度22±1 ℃,昼夜12 h,术后代谢笼中单笼喂养,记录饮水量、尿量和尿比重。本实验通过南方医科大学南方医院伦理委员会批准。
1.3 实验方法 1.3.1 实验动物分组32只雄性SD大鼠随机分组,正常组7只、垂体柄损毁后1 d组4只、垂体柄损毁后3 d组7只、垂体柄损毁后7 d组7只、垂体柄损毁后14 d组7只。假手术组和垂体柄损毁组每组随机取4只用于形态学实验,假手术组和垂体柄损毁后各时间点(3、7和14 d)每组3只提取组织蛋白用于分子生物学实验。
1.3.2 动物模型将大鼠的头部固定于立体定向仪上,基于我们前期研究[7, 24],参考Paxinos & Watson大鼠鼠脑图谱,找到垂体柄的坐标。以前囟为原点,沿矢状轴后移3.8 mm,用牙科钻钻开颅骨,用3D打印针垂直扎至颅底,至刚好无法继续下压为止,以0.5 mA的电流通过阳极损毁40 s,损毁完后拔针,压迫止血,缝合。假手术组从颅顶与损毁组相同的位置进针,进针深度8 mm,不给电流,停留40 s后拔出,压迫止血缝合。
1.3.3 免疫荧光将大鼠深度麻醉,生理盐水灌注,4%多聚甲醛滴注固定,取脑后用4%多聚甲醛固定24 h。修取脑块,分别用15%和30%的蔗糖溶液脱水至沉底。将脑块于-20 ℃包埋至OCT中,冰冻切片机(莱卡)切取脑片。将脑片用PBS漂洗,37 ℃山羊血清封闭1 h,4 ℃一抗孵育过夜,PBST漂洗,二抗37 ℃避光孵育1 h,PBST漂洗,DAPI染核5 min,PBS漂洗,贴片,并用防粹灭剂封片。所用一抗有AVP,DCX,caspase3和Tuj1,二抗激发光波长为488 nm和594 nm。倒置共聚焦显微镜(奥林巴斯)成像拍照。
1.3.4 Western blot将大鼠深度麻醉后,断颈,快速取脑,切取双侧视上核(SON),RIPA裂解组织细胞,研磨成匀浆。以12 000 r/min的转速离心15 min,取上清,用BCA法测量蛋白浓度,100 ℃煮沸变性5 min。经10% SDS-PAGE凝胶后,将蛋白电转至PVDF膜,5% BSA封闭1 h,切取条带,于4 ℃孵育一抗过夜,PBST洗涤,室温孵育二抗1 h,PBST洗涤,用化学发光法曝光。测取灰度值,用目的蛋白与内参的比值进行统计。
1.3.5 免疫组化将大鼠深度麻醉,生理盐水灌注,4%多聚甲醛滴注固定,取脑后用4%多聚甲醛固定24 h。修取脑块,70%~100%梯度酒精脱水24 h,切片,60 ℃烤片,100%~80%酒精复水。PBS漂洗,枸橼酸钠抗原修复,PBS漂洗,双氧水去过氧化物酶。一抗小鼠抗大鼠AVP抗体孵育过夜,PBS漂洗,二抗山羊抗小鼠抗体常温孵育30 min,PBS漂洗,DAB显色,苏木素复染,60 ℃烘片,树脂封片。正置显微镜(奥林巴斯)成像拍照。
1.3.6 统计运用SPSS进行数据分析,行为学结果用均数±标准差表示,各种比值用均数±标准差表示,两两比较采用t检验,P < 0.05表示差异有统计学意义。
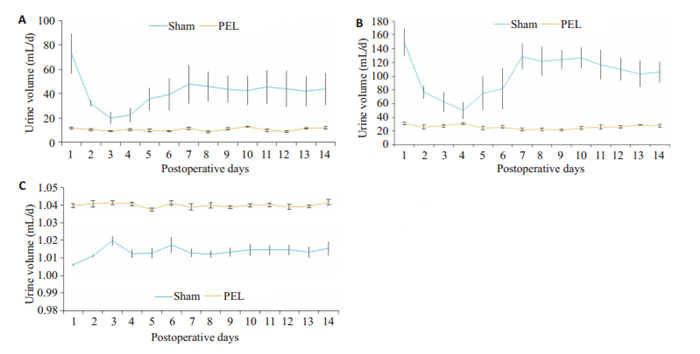
2 结果 2.1 垂体柄损毁术后大鼠出现明显的三相性尿崩与假手术组相比,垂体柄损毁组表现出明显的尿崩症状,尿量、尿比重和饮水量表现出典型的三相性,损毁后1~2 d定义为第一相,3~5 d定义为第二相,6 d后的阶段定义为第三相。第1天大鼠表现为多尿(73 ± 40 mL/24 h),低比重尿(1.006±0.001)和多饮(149±49 mL/24 h)。第3天时进入少尿期,表现少尿(20±12 mL/24 h),尿比重(1.020±0.007)升高,少饮(62±34 mL/24 h)。接近7 d时,大鼠再次进入尿崩状态,表现为多尿(47±39 mL/24 h),尿比重(1.013±0.006)下降,多饮(129±46 mL/24 h)。到14 d时,大鼠并未表现出明显的恢复趋势。术后第一相的尿崩症状比第三相的尿崩症状严重(图 1)。
|
图 1 垂体柄损毁后三相性尿崩症 Fig.1 A triphasic pattern of central diabetes insipidus after PEL in the rats. A-C: Time course of daily urine volume (DUV), daily water consumption (DWC), and urine specific gravity (USG) within 14 days after pituitary stalk (PEL) (n=7). Values are expressed as Mean±SE. |
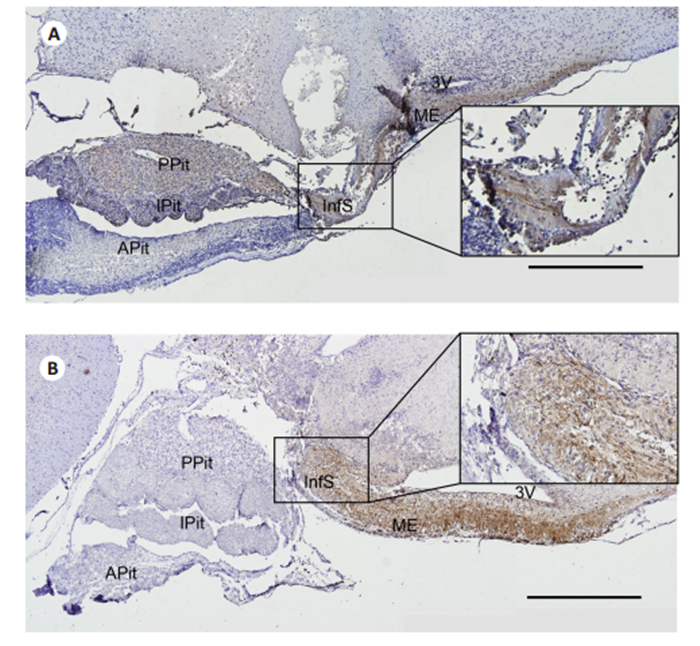
为探究垂体柄损伤后机体的病理变化,我们对在垂体至正中隆起层面的矢状切片进行了AVP免疫组化染色。损毁早期垂体柄周围AVP神经纤维完全离断(图 2A),在损毁端可见AVP神经纤维变得不连续,神经纤维间出现大量空洞,而远期(28 d)AVP神经纤维明显增粗,在损毁端AVP神经纤维垂直径明显增宽,漏斗部与垂体后叶之间出现一个神经叶样结构(图 2B)。在损毁早期,垂体后叶仍残存大量的AVP,而损毁远期垂体后叶明显萎缩。
|
图 2 术后正中隆起和垂体柄处AVP神经纤维的矢状切片免疫组化提示轴突再生 Fig.2 Immunohistochemistry of AVP-positive fibers in the sagittal section through the rat median eminence and pituitary stalk after PEL showing evidence of the regeneration of axons. A: Early stage after PEL; B: The long term 28 d stage after PEL. Scale bars: 500 μm. 3V, Third ventricle; APit, anterior lobe of pituitary; InfS, infundibular stem; IPit, intermediate lobe of pituitary; ME, median eminence; PPit, posterior lobe of pituitary. |
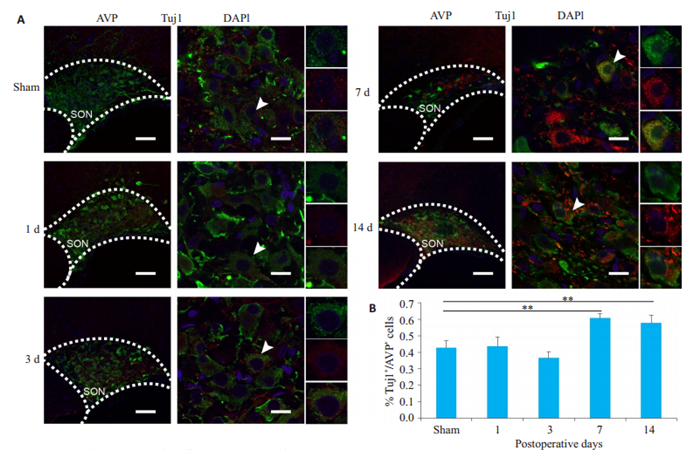
由于垂体柄损毁后第1天、第3天和第7天分别为第一相、第二相和第三相的关键时间转折点,我们选用垂体柄损毁后第1天、第3天、第7天和第14天分别评估第一相、第二相、第三相早期和第三相中期的变化情况。AVP与Tuj1免疫荧光共染显示,在损毁后1 d和3 d,AVP神经元中Tuj1阳性率分别为([43.70±2.76) %]、([36.55±1.88) %],与假手术组([42.82±2.02) %]相比无明显差异。而在损毁后7 d时,Tuj1阳性率([60.70± 1.29) %]明显升高,损毁后14 d的Tuj1阳性率([57.70± 2.42) %]与第7天相近,无明显继续升高的趋势,结果提示在损毁后第7天神经元骨架修复现象达到高峰并逐渐趋于稳定(图 3)。
|
图 3 垂体柄损毁远期出现神经元骨架修复现象 Fig.3 Cytoskeleton repair after PEL. A: Immunofluorescent staining for Tuj1(red) and AVP(green) in each group in the supraoptic nucleus (SON) (n= 4); B: Quantitative analysis of Tuj1 expression in AVP neurons. Scale bars: 100 μm for low magnification image, 15 μm for high magnification image. *P < 0.05, **P < 0.01 vs sham group. |
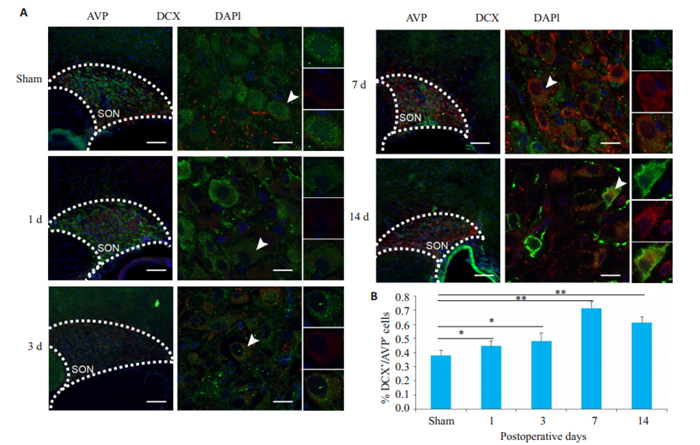
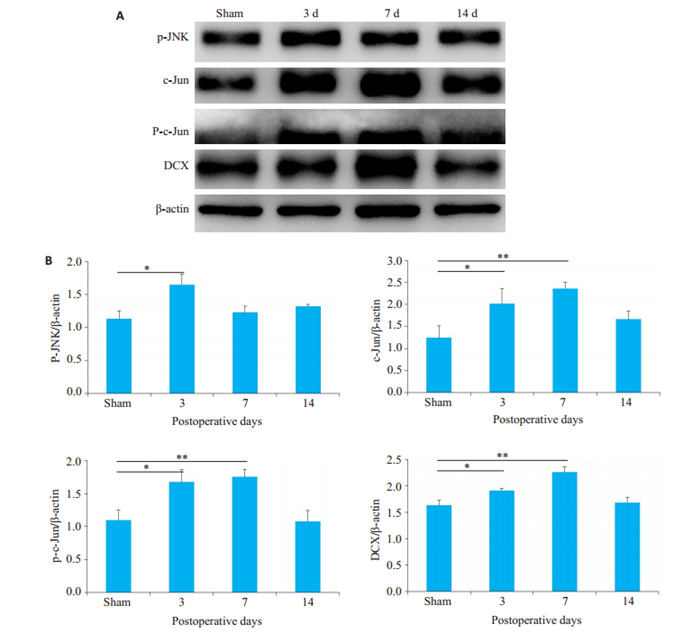
为探讨第三相尿崩症中细胞骨架修复的可能的调控机制,我们通过免疫荧光染色检测了包括DCX在内的相关蛋白的表达情况。免疫荧光结果显示,AVP神经元中DCX的阳性率发生了不同程度的变化。与假手术组([37.93±1.83) %]相比,垂体柄损毁后第1天([44.67± 1.79) %]和第3天([48.09±2.96) %] AVP神经元DCX的阳性率轻度增高,损毁后第7天([71.34±2.18) %] AVP神经元中DCX的阳性率达到峰值,损毁后第14天时AVP神经元中DCX的阳性率([61.08±2.15) %]继续处于高水平,与假手术组相比均有统计学差异(P < 0.05,图 4)。为进一步探讨神经元骨架修复的相关调控机制,通过Western blot检测神经元损伤后修复的经典调控通路JNK/c-Jun相关关键蛋白在垂体柄损毁后不同时间点的表达情况。与假手术组相比,损毁后3 d,p-JNK、c-Jun、p-c-Jun表达明显上调,DCX的表达轻度升高,而在损毁后第7天,p-JNK表达水平恢复到与假手术组无明显差异(P>0.05),c-Jun、p-c-Jun表达进一步升高,DCX表达大幅升高。损毁后第14天,各组蛋白表达均下调至与假手术组蛋白表达水平相近(图 5)。
|
图 4 垂体柄损毁后DCX阳性率逐渐升高 Fig.4 Expression of DCX in AVP neuron gradually increased after PEL.A: Immunofluorescent staining for DCX(red) and AVP (green) in the supraoptic nucleus (SON) in each group (n=4); B: Quantitative analysis of DCX expression in AVP neurons. Scale bars: 100 μm for low magnification image, 15 μm for high magnification image. *P < 0.05, **P < 0.01 vs sham group. |
|
图 5 垂体柄损毁后不同时期神经元骨架修复特征性蛋白表达水平 Fig.5 Detection of the expression levels of several representative protein markers of neuronal cytoskeleton repair at different time points after PEL. A: Western blotting for p-JNK, c-Jun, p-c-Jun and DCX proteins (n=3); B: Quantitative analysis of the expression levels. *P < 0.05, **P < 0.01 vs sham group. |
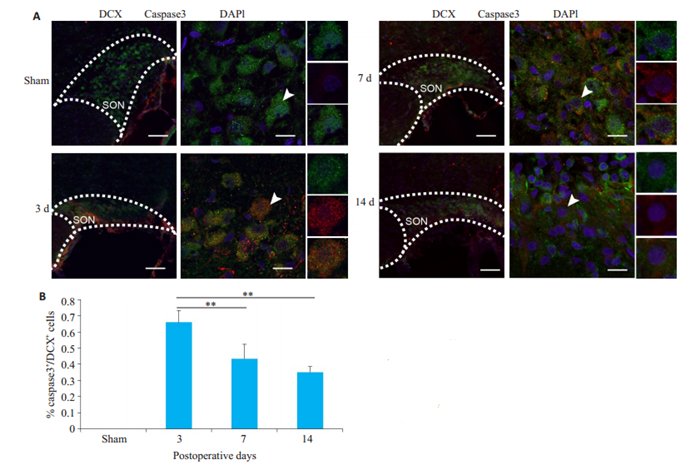
前述结果,我们证实神经元骨架修复现象主要存在于垂体柄损毁远期阶段,为了探究在损伤急性期,何种机制抑制了神经元骨架修复,如损伤急性改变,包括凋亡、坏死等。我们通过免疫荧光探讨了凋亡关键性蛋白caspase3与DCX共表达情况,以阐述损伤后凋亡与修复的关系。在假手术组中,caspase3不表达。在损毁后3 d,caspase3+DCX+双阳性细胞比例最高,然后逐渐减少。在损毁后第14天,仅部分DCX+caspase3-单阳性神经元得以存活。损毁后第3、7、14天caspase3+ DCX+双阳性细胞占DCX阳性细胞的具体比例分别为:(66.03±3.58) %,(43.42±4.45) %,(35.11±1.73) % (图 6)。
|
图 6 垂体柄损毁后capase3阳性神经元逐渐减少AVP神经元凋亡与修复的关系 Fig.6 Relationship between neuronal apoptosis and repair after PEL. A: Immunofluorescence for DCX(green) and caspase3(red) in the SON (n=4); B: Quantitative analysis of caspase3 expression in DCX-positive neurons. Scale bars: 100 μm for low magnification image, 15 μm for high magnification image. **P < 0.01 vs 3 d group. |
AVP主要由下丘脑中视上核和室旁核中的AVP神经元合成[25],在胚胎发育过程中,由漏斗部和拉特克囊的相互延伸,AVP神经元的轴突逐渐长入垂体后叶,鞍膈便成了颅内和垂体窝的重要界限[26-27]。鞍膈以上,伸长细胞在正中隆起建立了下丘脑与垂体门脉系统之间的血-下丘脑屏障[28-30],于正中隆起分泌的激素受到伸长细胞的限制。鞍膈以下,垂体细胞影响了轴突末端与血管的连接,调节血管的通透性[31],垂体后叶素可直接释放至外周[27-29]。完整的下丘脑垂体后叶轴在AVP合成、运输和释放中至关重要[27-29]。从核团的AVP神经元胞体到垂体后叶的任何位置被损毁,AVP将无法直接释放至外周,进而导致机体水-电解质平衡紊乱。在本研究中,垂体柄损毁后,大鼠表现出了典型的三相性尿崩。第一相时,AVP不能通过垂体柄运输至垂体后叶,致使AVP无法直接释放入血,出现严重的尿崩现象。第二相时,大鼠进入少尿期,可能与AVP神经元可以通过树突和胞体对AVP的胞吐直接释放至颅内,经脑脊液循环入血相关[32],也有可能来源于垂体后叶残存的AVP。第三相时,尿崩症状不如第一相严重,可见此期比第一相有更多AVP释放入血,可能是某些代偿机制渐渐稳定了AVP的分泌,如AVP神经元对AVP合成增加、胞体和树突通过胞吐释放AVP的能力增强、某些肽类营养作用修复轴突功能等[18, 32]。
DCX在神经元轴突损伤后神经元骨架的变化中起着相当重要的作用,对Tuj1+神经元轴突修复有明显作用[10, 19],同时DCX还与中枢神经系统其它类型神经元的形变、迁移及轴突再生密切相关[8, 12-15]。在本研究中,垂体柄损毁后7 d,AVP神经元中的DCX和Tuj1阳性率明显增高,行为学也明显改变,可能与恢复细胞骨架结构和轴突运输功能相关[11, 19]。然而,在损毁后3 d DCX和Tuj1的阳性率与损毁后1 d没有明显的区别,提示第一相和第二相尿崩程度的差异不受轴突运输能力的影响,这也可能是导致第一相严重尿崩和第二相少尿的原因。假手术组结果显示,DCX在正常的AVP神经元中也存在表达,而目前大多数观点认为DCX大多在未成熟的神经元中表达[14-15]。在关于DCX超微结构的报道中[8],DCX与神经元驱动蛋白3关系密切,在神经元囊泡运输中具有重要作用,AVP神经元中丰富的细胞骨架具有强大的运输能力,DCX在正常AVP神经元中的表达可能与这种运输能力密切相关。
作为JNK相关通路的下游蛋白[22],垂体柄损毁后,DCX的表达变化可能受到JNK信号通路调控。在关于感觉和运动相关神经元轴突损伤的研究中表明[20, 33-34],JNK与轴突损伤密切相关,传递损伤的Ca2+激活了JNK的磷酸化,通过JNK/c-Jun通路将损伤信号传入核内,但JNK激活后会导致受损神经元走向不同的结局,包括轴突再生,轴突退行性变和细胞死亡[20-23, 34-35]。垂体柄损毁后,p-JNK只在3 d时高表达,c-Jun和p-c-Jun表达明显上调,提示此时可能是诱导AVP神经元坏死、凋亡或者轴突的退行性变的重要时间节点。caspase3与DCX的免疫荧光结果也提示垂体柄损毁后3 d是细胞凋亡的高峰。由此可见,第二相时释放的AVP可能大多来源于坏死、凋亡的AVP神经元[26],经通透性增高的轴突和胞体直接释放,也有观点认为体液的低渗环境会促进AVP神经元胞体和树突对AVP的胞吐,同时促进AVP神经元的死亡[32]。垂体柄损毁后第7天时,c-Jun和p-c-Jun的表达继续上调,同时DCX的表达上调至最高,可见DCX的变化与c-Jun密切相关[21-22]。有观点认为,c-Jun的表达对轴突的修复具有明显积极意义[34, 37],据此推测,垂体柄损毁后第7天c-Jun和DCX表达的升高,参与了细胞骨架的恢复,促进了神经元存活[19]。7 d后JNK下调可能使残存AVP神经元走向再生,恢复对AVP的分泌功能,这也与既往报道相符[35]。
Caspase3与DCX均可受JNK/c-Jun调控[38],基于caspase3与DCX免疫荧光结果的时间规律,我们分析,垂体柄损毁后,AVP神经元中JNK/c-Jun-DCX与JNK/ c-Jun-caspase3两条通路的表达可能存在平衡关系。随着时间推进,caspase3阳性细胞占DCX阳性细胞比例下降,提示凋亡细胞逐渐减少,并在损毁后第14天基本消失,绝大多数存活细胞为DCX+caspase3-的单阳性细胞。据此推断,在垂体体柄损毁急性期,由于神经轴突的完全离断,大量AVP神经元表达了caspase3,表明大部分caspase3+DCX+双阳性细胞发生了细胞凋亡。而急性期后,仅剩余少数caspase3-DCX+单阳性的细胞未发生细胞凋亡,提示这些细胞可能是受到了DCX的保护和修复作用得以长期存活。但哪些关键因子参与调控了DCX的保护作用,何种机制介导了垂体柄损毁后AVP神经元的不同转归,还有待进一步探讨。
另一方面,我们前期结果表明[24],垂体柄损毁后,轴突并不能突破鞍膈进入垂体后叶,而损毁端的赫令体可形成新的神经叶样结构,但此神经叶样结构并不能完全代偿损伤后下降的AVP释放能力,这可能受限于伸长细胞对正中隆起神经-血管的连接的屏障作用[28-30]。因此,如何让AVP神经元受损轴突实现更好的修复,建立更好的突触血管连接,可能是后续治疗垂体柄损伤的潜在方向。然而,本研究也存在不足,我们并没有直接证明DCX对轴突修复的作用,缺乏对调控DCX表达机制的深入探讨。
综上所述,我们的结果提示,在垂体柄损伤导致的中枢性尿崩中,JNK/c-Jun通路可能促进了急性期AVP神经元的死亡,同时在恢复期通过上调DCX促进了神经元骨架的重构和轴突的修复,最终维持AVP的合成分泌能力进入损伤后相对代偿状态,并部分重建神经内分泌稳态。
| [1] |
丁陈禹, 王守森. 鞍区病变与中枢性尿崩症[J]. 临床神经外科杂志, 2014(5): 398-400. DOI:10.3969/j.issn.1672-7770.2014.05.026 |
| [2] |
贺龙, 王莎, 柳红艳, 等. 鞍区肿瘤术后、重度颅脑损伤合并中枢性尿崩症的早期临床诊断意义及预后分析[J]. 国际神经病学神经外科学杂志, 2015, 42(6): 515-8. |
| [3] |
杨娜. 中枢性尿崩症病因构成及临床特点[J]. 现代仪器与医疗, 2018, 24(2): 101-3. |
| [4] |
漆松涛, 张晓峰, 潘军, 等. 脑外伤后尿崩症25例临床分析[J]. 广东医学, 2006, 27(10): 1487-9. DOI:10.3969/j.issn.1001-9448.2006.10.025 |
| [5] |
Bogusz A, Mueller HL. Childhood-onset craniopharyngioma: latest insights into pathology, diagnostics, treatment, and follow-up[J]. Expert Rev Neurother, 2018, 18(10): 793-806. DOI:10.1080/14737175.2018.1528874 |
| [6] |
Bernal A, Mahia J, Puerto A. Animal models of Central Diabetes Insipidus: Human relevance of acquired beyond hereditary syndromes and the role of oxytocin[J]. Neurosci Biobehav Rev, 2016, 66: 1-14. DOI:10.1016/j.neubiorev.2016.02.023 |
| [7] |
Feng ZP, Ou YC, Zhou MF, et al. A rat model for pituitary stalk electric lesion-induced central diabetes insipidus: application of 3D printing and further outcome assessments[J]. Exp Anim, 2018, 67(3): 383-92. |
| [8] |
Liu JS, Schubert CR, Fu XQ, et al. Molecular basis for specific regulation of neuronal kinesin-3 motors by doublecortin family proteins[J]. Mol Cell, 2012, 47(5): 707-21. DOI:10.1016/j.molcel.2012.06.025 |
| [9] |
Miura M, Kameda Y. Neuronal properties in cultured ultimobranchial C cells of chick embryos: process outgrowth and expression of TuJ1 and enkephalin[J]. Brain Res, 2001, 905(1/2): 1-11. |
| [10] |
Tischfield MA, Baris HN, Wu C, et al. Human TUBB3 mutations perturb microtubule dynamics, kinesin interactions, and Axon guidance[J]. Cell, 2010, 140(1): 74-87. DOI:10.1016/j.cell.2009.12.011 |
| [11] |
Bielas SL, Serneo FF, Chechlacz MA, et al. Spinophilin facilitates dephosphorylation of doublecortin by PP1 to mediate microtubule bundling at the axonal wrist[J]. Cell, 2007, 129(3): 579-91. DOI:10.1016/j.cell.2007.03.023 |
| [12] |
Tsukada M, Prokscha A, Ungewickell E, et al. Doublecortin association with actin filaments is regulated by neurabin Ⅱ[J]. J Biol Chem, 2005, 280(12): 11361-8. DOI:10.1074/jbc.M405525200 |
| [13] |
Feng Y, Walsh C. Protein-protein interactions, cytoskeletal regulation and neuronal migration[J]. Nat Rev Neurosci, 2001, 2(6): 408-16. DOI:10.1038/35077559 |
| [14] |
Tanaka T, Serneo FF, Tseng HC, et al. Cdk5 phosphorylation of doublecortin ser297 regulates its effect on neuronal migration[J]. Neuron, 2004, 41(2): 215-27. DOI:10.1016/S0896-6273(03)00852-3 |
| [15] |
Schaar BT, Kinoshita K, Mcconnell SK. Doublecortin microtubule affinity is regulated by a balance of kinase and phosphatase activity at the leading edge of migrating neurons[J]. Neuron, 2004, 41(2): 203-13. DOI:10.1016/S0896-6273(03)00843-2 |
| [16] |
Karl C, Couillard-Despres S, Prang P, et al. Neuronal precursorspecific activity of a human doublecortin regulatory sequence[J]. J Neurochem, 2005, 92(2): 264-82. DOI:10.1111/j.1471-4159.2004.02879.x |
| [17] |
Westermann S, Weber K. Post-translational modifications regulate microtubule function[J]. Nat Rev Mol Cell Biol, 2003, 4(12): 938-47. |
| [18] |
Villar MJ, Meister B, Hokfelt T. Reorganization of neural peptidergic systems in the median eminence after hypophysectomy[J]. J Neurosci, 1994, 14(10): 5996-6012. DOI:10.1523/JNEUROSCI.14-10-05996.1994 |
| [19] |
Nawabi H, Belin S, Cartoni R, et al. Doublecortin-Like kinases promote neuronal survival and induce growth cone reformation via distinct mechanisms[J]. Neuron, 2015, 88(4): 704-19. DOI:10.1016/j.neuron.2015.10.005 |
| [20] |
Lu Y, Belin S, He ZG. Signaling regulations of neuronal regenerative ability[J]. Curr Opin Neurobiol, 2014, 27: 135-42. DOI:10.1016/j.conb.2014.03.007 |
| [21] |
Zeke A, Misheva M, Remenyi A, et al. JNK signaling: regulation and functions based on complex Protein-Protein partnerships[J]. Microbiol Mol Biol Rev, 2016, 80(3): 793-835. DOI:10.1128/MMBR.00043-14 |
| [22] |
Gdalyahu A, Ghosh I, Levy T, et al. DCX, a new mediator of the JNK pathway[J]. EMBO J, 2004, 23(4): 823-32. DOI:10.1038/sj.emboj.7600079 |
| [23] |
Bjorkblom B, Vainio JC, Hongisto V, et al. All JNKs can kill, but nuclear localization is critical for neuronal death[J]. J Biol Chem, 2008, 283(28): 19704-13. DOI:10.1074/jbc.M707744200 |
| [24] |
Feng Z, Ou Y, Zhou M, et al. Functional ectopic neural lobe increases GAP-43 expression via PI3K/AKT pathways to alleviate central diabetes insipidus after pituitary stalk lesion in rats[J]. Neurosci Lett, 2018, 673: 1-6. DOI:10.1016/j.neulet.2018.02.038 |
| [25] |
Poulain DA, Wakerley JB. Electrophysiology of hypothalamic magnocellular neurones secreting oxytocin and vasopressin[J]. Neuroscience, 1982, 7(4): 773-808. DOI:10.1016/0306-4522(82)90044-6 |
| [26] |
Rizzoti K, Lovell-Badge R. Early development of the pituitary gland: Induction and shaping of Rathke's pouch[J]. Rev Endocr Metab Disord, 2005, 6(3): 161-72. DOI:10.1007/s11154-005-3047-7 |
| [27] |
Takuma N, Sheng HZ, Furuta Y, et al. Formation of rathke's pouch requires dual induction from the diencephalon[J]. Development, 1998, 125(23): 4835-40. |
| [28] |
Mullier A, Bouret SG, Prevot VA. Differential distribution of tight junction proteins suggests a role for tanycytes in BloodHypothalamus barrier regulation in the adult mouse brain[J]. J Comp Neurol, 2010, 518(7): 943-62. DOI:10.1002/cne.22273 |
| [29] |
Clasadonte J, Prevot V. The special relationship: glia-neuron interactions in the neuroendocrine hypothalamus[J]. Nat Rev Endocrinol, 2018, 14(1): 25-44. DOI:10.1038/nrendo.2017.124 |
| [30] |
Mueller-Fielitz H, Stahr M, Bernau MA, et al. Tanycytes control the hormonal output of the hypothalamic-pituitary-thyroid axis[J]. Nat Commun, 2017, 8(1): 484. DOI:10.1038/s41467-017-00604-6 |
| [31] |
Anbalagan S, Gordon L, Blechman J, et al. Pituicyte cues regulate the development of permeable neuro-vascular interfaces[J]. Dev Cell, 2018, 47(6): 711. DOI:10.1016/j.devcel.2018.10.017 |
| [32] |
Sato K, Numata T, Saito T, et al. V-2 receptor-mediated autocrine role of somatodendritic release of AVP in rat vasopressin neurons under hypo-osmotic conditions[J]. Sci Signal, 2011, 4(157): ra5. |
| [33] |
Rishal I, Fainzilber M. Axon-soma communication in neuronal injury[J]. Nat Rev Neurosci, 2014, 15(1): 32-42. DOI:10.1038/nrn3609 |
| [34] |
Shin JE, Cho Y, Beirowski B, et al. Dual leucine zipper kinase is required for retrograde injury signaling and axonal regeneration[J]. Neuron, 2012, 74(6): 1015-22. DOI:10.1016/j.neuron.2012.04.028 |
| [35] |
Liu C, Zhang CW, Zhou Y, et al. APP upregulation contributes to retinal ganglion cell degeneration via JNK3[J]. Cell Death Differ, 2018, 25(4): 661-76. |
| [36] |
Zhou MF, Feng ZP, Ou YC, et al. Endoplasmic reticulum stress induces apoptosis of arginine vasopressin neurons in central diabetes insipidus via PI3K/Akt pathway[J]. CNS Neurosci Ther, 2019, 25(5): 562-74. DOI:10.1111/cns.13089 |
| [37] |
Raivich G, Bohatschek M, Da Costa C, et al. The AP-1 transcription factor c-jun is required for efficient axonal regeneration[J]. Neuron, 2004, 43(1): 57-67. DOI:10.1016/j.neuron.2004.06.005 |
| [38] |
Wen XR, Tang M, Qi DS, et al. Butylphthalide suppresses neuronal cells apoptosis and inhibits JNK-caspase3 signaling pathway after brain ischemia/reperfusion in rats[J]. Cell Mol Neurobiol, 2016, 36(7): 1087-95. DOI:10.1007/s10571-015-0302-7 |
 2019, Vol. 39
2019, Vol. 39

