睾丸癌是20~34岁青壮年男性常见的恶性肿瘤[1]。睾丸肿瘤绝大多数(90%~95%)为生殖细胞肿瘤,在5~ 34岁的因恶性肿瘤死亡的人群中,生殖细胞肿瘤是导致死亡的主要原因[2]。金属铂类化合物在睾丸癌化疗中占有重要地位[3],但不良反应及耐药性的发生均严重限制了该类药物的临床应用。因此,寻找特异性相对较高,可影响抗肿瘤药物作用的因素对于增强其疗效、减少不良反应及耐药性具有重要的意义[4]。
缝隙连接是由连接蛋白(Cxs)组成的维持细胞间通讯的重要方式[5]。Cxs是由多基因家族编码的一类结构相似而分子质量不同的蛋白质。目前的研究证实Cx可以增强多种抗肿瘤药物的细胞毒性[6-8]。在睾丸癌组织中,表达11种缝隙连接蛋白,其中Cx43是表达量最多的缝隙连接蛋白[9-11]。
自噬指自身成分被溶酶体降解的一种细胞过程[12-13]。近年来,有大量文献报道,自噬可以清除错误折叠的蛋白质及破损的细胞器,支持肿瘤细胞的存活[9, 14-15]。Cx43可以抑制Atg蛋白达到抑制自噬[16],另外,其他Cxs亚型也对自噬流产生抑制作用,这表明许多Cxs家族成员可以充当自噬调节者。但到目前为止,在睾丸癌细胞中Cx43对自噬的影响尚未明确,为探究在睾丸癌细胞中Cx43与自噬这两者的关系,本研究拟通过在耐药株睾丸癌I-10/DDP细胞中过表达Cx43初步探究Cx43对自噬的影响。
1 材料和方法 1.1 细胞株和细胞培养小鼠睾丸癌细胞株I-10(ATCC)。课题组前期采用浓度递增法成功建立了耐顺铂睾丸癌细胞株I-10/DDP [17]。此外,我们在后期使用该耐药细胞株时都通过检测RI(RI > 3则认为耐药细胞系的耐药性符合耐药株的要求),来保证细胞株耐药性的稳定。采用F12高糖培养基,加入2.5%(V/V)胎牛血清,15%(V/V)马血清,100 U/mL青霉素,100 U/mL链霉素。细胞贴壁生长于25 cm2透气培养瓶中,置于37 ℃、含体积分数5% CO2以及饱和湿度的细胞培养箱中。0.25%胰酶细胞消化液(含0.02% EDTA)消化传代,每周传代2~3次。
1.2 试剂F12高糖培养基、马血清、opti-MEM(Gibco);预染蛋白Marker(Thermo Fisher),细胞裂解液、BCA蛋白浓度测定试剂盒(碧云天),胎牛血清(杭州四季青)。羊抗小鼠二抗、羊抗兔二抗、Tris-base、Glycine、SDS(SigmaAldrich),Cx43、p62、LC3一抗体(CST),GAPDH一抗(Proteintech)。
1.3 I-10/DDP细胞株转染细胞接种6孔板,待培养至60%~80%。将5 µL全基因质粒(full-length mouse Cx43 vector, mCx43)(吉玛)和5 µL Lipofectamine2000分别与250 µL opti-MEM混合(室温放置5min),然后将以上两种溶液充分混合(总体积为510 µL),室温放置20 min,然后将混合液加入6孔板,最后用opti-MEM补足到2 mL。12 h后更换正常培养液,提取蛋白。过表达实验分3组,mCx43组为转染全基因组,NC组为未转染质粒对照组,Mock组为只加入Lipofectamine2000转染组,免疫印迹法检测mCx43组蛋白表达,观察过表达转染效果。
1.4 免疫印迹法检测Cx43,LC3,p62蛋白表达分别收集Mock组,NC组,mCx43组I-10/DDP细胞,加适量细胞裂解液裂解细胞,收取蛋白,用BCA试剂盒进行蛋白定量处理。制备12% SDS-PAGE凝胶;将需检测蛋白标本上样,电泳,转膜,封闭,孵抗体,一抗(Cx43,LC3,p62)4 ℃孵育过夜,二抗室温孵育2 h,ECL发光试剂盒暗室发光、显影、定影。Bio-Rad凝胶成像系统采集图像,用Bio Imaging system(Gene Genius)对图像进行灰度扫描分析。
1.5 mCherry-GFP-LC3B转染法检测细胞自噬水平细胞分组为Mock组,NC组,mCx43组,取生长状态良好的细胞,细胞以5×104/mL的密度接种于共聚焦培养皿中。避光条件下,将5 µLLipofectamine2000和5 µL mCherry-GFP-LC3B质粒溶液分别与250 µLopti-MEM混合室温放置。5 min后将两种溶液充分混合(混合液体的总体积为510 µL),室温放置20 min。然后将混合液加入6孔板,最后用opti-MEM补足到2mL,6 h后更换新鲜的含血清培养基,使用400倍激光共聚焦显微镜观察并进行图片的采集。
1.6 透射电子显微镜观察细胞内自噬体的形成情况细胞分组为Mock组,NC组,mCx43组,取出生长状况良好的细胞,接种于100 mm的一次性细胞培养皿上(细胞密度为1×105 cells/mL),细胞培养24 h,消化收集细胞,低温离心机4 ℃,12 000 r/min离心5 min,弃去上层液体,PBS重悬细胞后再离心,最后收集细胞至一个1.5mL的离心管中。沿着离心管的管壁缓缓加入1mL的固定液(2.5%戊二醛),4 ℃冰箱保存。最后使用透射电子显微镜进行图片的采集。
1.7 统计学分析所有实验数据来自至少3次独立实验,以均数±标准差表示。统计分析使用SPSS 16.0软件,两组之间的数据比较采用两独立样本的t检验,多组之间的数据比较采用单因素方差分析,P < 0.05认为有统计学意义。
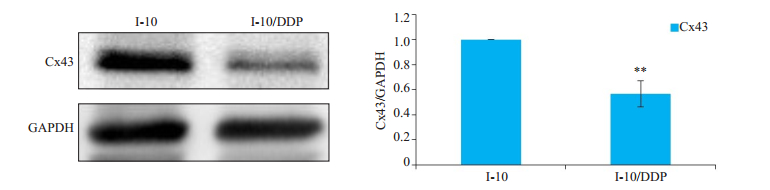
2 结果 2.1 Cx43蛋白在I-10和I-10/DDP细胞中的表达采用免疫印迹法检测Cx43蛋白,图 1A显示,与I-10细胞比较,I-10/DDP细胞中的Cx43的表达增加(P < 0.01)。
|
图 1 Cx43蛋白在I-10和I-10/DDP细胞中的表达 Fig.1 Expressions of connexin43 (Cx43) protein in I-10 Leydig tumor cells detected by Western blotting (n=3). **P < 0.01. |
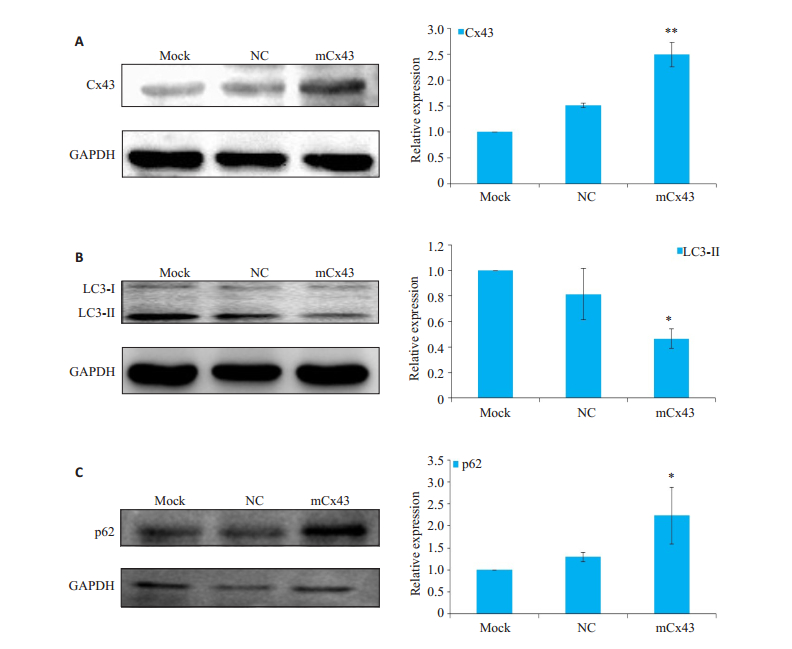
采用免疫印迹法检测Cx43,LC3和p62蛋白,图 2A显示,转染全基因质粒mCx43后,mCx43蛋白的表达量增加(P < 0.001)。图 2B显示,mCx43组与对照组相比LC3-Ⅱ蛋白表达量降低(P < 0.05)。图 2C显示,mCx43组与对照组相比p62蛋白表达量升高(P < 0.05)。以上结果表明过表达Cx43可抑制I-10/DDP细胞中的细胞自噬。
|
图 2 mCx43对I-10/DDP细胞中Cx43,LC3-Ⅱ和p62蛋白的影响 Fig.2 Effects of mCx43 transfection on expressions of Cx43, LC3-Ⅱ and p62 proteins in the I-10/DDP Leydig tumor cells (n=3). A: Cx43; B: LC3-Ⅱ; C: p62; NC: Negative control; **P < 0.01, *P < 0.05 vs NC group. |
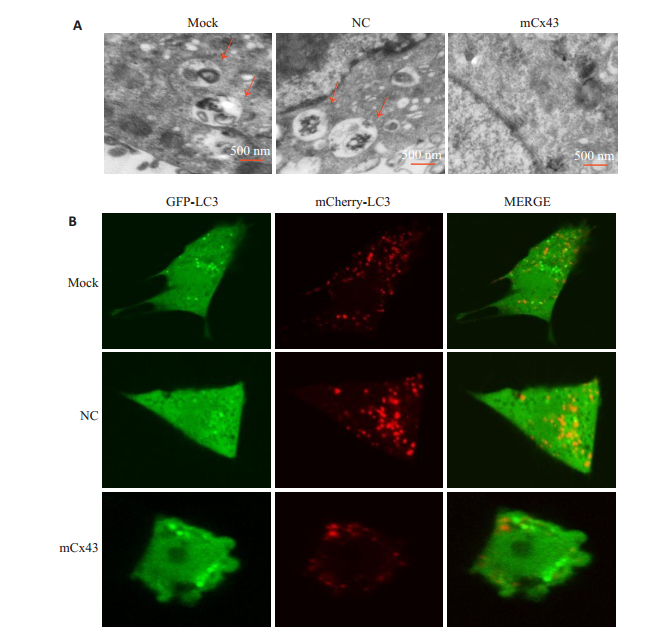
进一步使用透射电子显微镜法对细胞中的自噬进行定位,如图 3A所示,与阴性对照组相比,mCx43组细胞内自噬体减少。图 3B显示,经mCherry-GFP-LC3B瞬时转染的mCx43组细胞与阴性对照组相比较,在顺铂处理后可见mCx43组细胞内红色和绿色亮点减少,在红绿色合成图像中黄色亮点(自噬体)和红色亮点(自噬溶酶体)均减少。
|
图 3 过表达Cx43抑制I-10/DDP细胞内自噬流 Fig.3 Overexpression of Cx43 inhibits autophagy fluxs in I-10/DDP Leydig tumor cells (n=3). A: Autophagy analyzed by transmission electron microscopy (Original magnification: ×15 000); B: LC3 puncta observed with confocal fluorescent microscopy (×400). |
Cx是肿瘤抑制基因[5, 7, 18-19]。恢复或增强Cx的表达逆转肿瘤特性、增强化疗药的细胞毒性[5, 18]。例如,过表达Cx26可以增加非小细胞肺癌对吉西他滨的细胞毒性[20],Cx43可以增加大肠癌细胞对紫杉醇的敏感性[8],另外,增加Cx43的表达可以使肿瘤细胞对顺铂更加敏感[21]。在本研究中我们使用免疫印迹法测定Cx43表达量,发现耐顺铂睾丸癌I-10/DDP细胞与睾丸癌I-10细胞相比Cx43表达量明显降低,我们推测睾丸癌细胞耐药性的产生可能与Cx43表达降低有关。
细胞自噬在肿瘤发生和肿瘤抑制过程中都发挥着重要的作用,因此它是一把“双刃剑” [22]。近年来,越来越多研究发现自噬可以清除错误折叠的蛋白质及破损的细胞器,支持肿瘤细胞存活。有研究证实在人乳腺癌中,表阿霉素可以诱导自噬的发生,使MCF-7细胞逃避表阿霉素介导的凋亡[23]。在结肠癌中,奥沙利铂也可以诱导细胞发生自噬,增加SW480和SW620细胞对奥沙利铂的耐药性[24]。自噬作为一种促进生存的机制可使肿瘤细胞逃避化疗药物的毒性作用,而抑制自噬将有助于增强肿瘤细胞对化疗药物的敏感性。因此,我们猜测睾丸癌耐药性的产生与Cx43抑制细胞自噬水平有关。本研究使用免疫印迹法测定LC3和p62的表达量,我们首次发现过表达Cx43后,自噬的标志蛋白LC3-Ⅱ表达量降低,自噬的底物蛋白p62表达量升高。LC3主要定位于前自噬泡和自噬泡膜表面,是细胞自噬泡膜的通用标记物,存在LC3-Ⅰ和LC3-Ⅱ两种形式。自噬形成时,非脂化形式的LC3(即LC3-Ⅰ)会酶解掉一小段多肽,转变为脂化形式的LC3(即LC3-Ⅱ),而LC3-Ⅱ参与自噬体的生物合成[25]。p62是自噬底物蛋白,在自噬过程中,p62被降解。
自噬是动态的过程,包括自噬体形成、自噬性底物向溶酶体的运送以及降解过程。从形态上看,即将发生自噬的细胞的胞质中出现许多的膜性结构,游离的膜性结构不断扩张形成一个“隔离膜”的囊泡,能够在透射电子显微镜下观察到,称为吞噬泡,吞噬泡进一步延伸形成双层膜性结构并包裹变性坏死的细胞器、错误折叠的蛋白质和部分细胞浆等,形成自噬体。最后自噬体与溶酶体融合后形成自噬溶酶体。随后研究中我们使用透射电子显微镜观察自噬体,发现mCx43组细胞中自噬体的数量较NC组和Mock组细胞明显减少(图 3A)。激光共聚焦显微镜观察发现mCx43组细胞内红色和绿色荧光亮点减少,同时在红色荧光和绿色荧光合成的图像中黄色荧光亮点(自噬体)和红色荧光亮点(自噬溶酶体)数量减少。上述结果初步证实了过表达Cx43抑制耐顺铂睾丸癌I-10/DDP细胞自噬水平。
综上所述,我们的研究证实了Cx43参与睾丸癌细胞耐药性的产生,其机制可能与Cx43抑制自噬水平有关。Cx43组成的缝隙连接通道允许小分子物质,如离子(Na+和K+)、代谢分子及第二信使ATP通过。有文献报道,胞外ATP可引起Ca2+水平增加,进一步激活mTOR [26],mTOR是细胞自噬的主要调节分子。在后续的研究中我们将深入探究Cx43,mTOR和自噬这三者的关系。
| [1] |
谭于龙, 钱辉军. microRNA在睾丸肿瘤中的最新进展[J]. 实用癌症杂志, 2016, 31(4): 694-6. DOI:10.3969/j.issn.1001-5930.2016.04.056 |
| [2] |
Le CC, Lortet-Tieulent J, Forman D, et al. Testicular cancer incidence to rise by 25% by 2025 in Europe? Model-based predictions in 40 countries using population-based registry data[J]. Eur J Cancer, 2014, 50(4): 831-9. DOI:10.1016/j.ejca.2013.11.035 |
| [3] |
Mezencev R. Interactions of cisplatin with non-DNA targets and their influence on anticancer activity and drug toxicity: the complex world of the Platinum complex[J]. Curr Cancer Drug Targets, 2014, 14(9): 794-816. |
| [4] |
Liu G, Fan X, Tang M, et al. Osteopontin induces autophagy to promote chemo-resistance in human hepatocellular carcinoma cells[J]. Cancer Lett, 2016, 383(2): 171-82. DOI:10.1016/j.canlet.2016.09.033 |
| [5] |
Cronier L, Crespin S, Strale P, et al. Gap junctions and cancer: new functions for an old story[J]. Antioxid Redox Signal, 2009, 11(2): 323-38. DOI:10.1089/ars.2008.2153 |
| [6] |
Bian S, Sun X, Bai A, et al. P2X7 integrates PI3K/AKT and AMPKPRAS40-mTOR signaling pathways to mediate tumor cell death[J]. PLoS One, 2013, 8(4): e60184. DOI:10.1371/journal.pone.0060184 |
| [7] |
King TJ, Bertram JS. Connexins as targets for cancer chemoprevention and chemotherapy[J]. Bioch Biophys Acta, 2005, 1719(1/ 2): 146-60. |
| [8] |
Wang SQ, Zhang SW, Zhao ZY, et al. Connexin 43 enhances paclitaxel cytotoxicity in colorectal cancer cell lines[J]. Exp Ther Med, 2017, 14(2): 1212-8. DOI:10.3892/etm.2017.4589 |
| [9] |
Yu YC, He SJ, Chen S, et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly[J]. Nature, 2012, 486(741): 113-U139. |
| [10] |
Mercer A. Electrically coupled excitatory neurones in cortical regions[J]. Brain Res, 2012, 1487(SI): 192-7. |
| [11] |
Yang Y, Zhu J, Zhang N, et al. Impaired gap junctions in human hepatocellular carcinoma limit intrinsic oxaliplatin chemosensitivity: A key role of connexin 26[J]. Int J Oncol, 2016, 48(2): 703-13. DOI:10.3892/ijo.2015.3266 |
| [12] |
Harnett MM, Pineda MA, De Late PL, et al. From Christian de Duve to yoshinori ohsumi: more to autophagy than just dining at home[J]. Biomed J, 2017, 40(1): 9-22. DOI:10.1016/j.bj.2016.12.004 |
| [13] |
赖华毅, 陈强, 李红, 等. p38MAPK信号通路在鼠伤寒沙门菌spvB基因影响Henle-407细胞自噬中的作用[J]. 南方医科大学学报, 2018, 38(3): 268-73. |
| [14] |
Zhou Y, Liang X, Chang H, et al. Ampelopsin-induced autophagy protects breast cancer cells from apoptosis through Akt-mTOR pathway via endoplasmic reticulum stress[J]. Cancer Sci, 2014, 105(10): 1279-87. DOI:10.1111/cas.12494 |
| [15] |
Chi Y, Gao K, Li K, et al. Purinergic control of AMPK activation by ATP released through connexin 43 hemichannels-pivotal roles in hemichannel-mediated cell injury[J]. J Cell Sci, 2014, 127(Pt 7): 1487-99. |
| [16] |
Bejarano E, Yuste A, Patel B, et al. Connexins modulate autophagosome biogenesis[J]. Nat Cell Biol, 2014, 16(5): 401-14. DOI:10.1038/ncb2934 |
| [17] |
李贝贝, 董淑英, 樊宗兵, 等. 两种方法建立的睾丸癌顺铂耐药细胞株的比较[J]. 南方医科大学学报, 2015, 35(12): 1755-9. |
| [18] |
Kandouz M, Batist G. Gap junctions and connexins as therapeutic targets in cancer[J]. Expert Opin Ther Targets, 1994, 14(7): 51-2. |
| [19] |
Trosko J E, Ruch R J. Gap junctions as targets for cancer chemoprevention and chemotherapy[J]. Curr Drug Targets, 2002, 3(6): 465-82. DOI:10.2174/1389450023347371 |
| [20] |
Yang J, Qin G, Luo M, et al. Reciprocal positive regulation between Cx26 and PI3K/Akt pathway confers acquired gefitinib resistance in NSCLC cells via GJIC-independent induction of EMT[J]. Cell Death Dis, 2015, e1829. |
| [21] |
Chang WW, Lai CH, Chen MC, et al. Salmonella enhance chemosensitivity in tumor through connexin 43 upregulation[J]. Int J Cancer, 2013, 133(8): 1926-35. DOI:10.1002/ijc.28155 |
| [22] |
Wei HJ, Wei S, Gan BY, et al. Suppression of autophagy by FIP200 deletion inhibits mammary tumorigenesis[J]. Genes Dev, 2011, 25(14): 1510-27. DOI:10.1101/gad.2051011 |
| [23] |
Sun WL, Chen J, Wang YP, et al. Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicinresistance development[J]. Autophagy, 2011, 7(9): 1035-44. DOI:10.4161/auto.7.9.16521 |
| [24] |
Yang HZ, Ma Y, Zhou Y, et al. Autophagy contributes to the enrichment and survival of colorectal cancer stem cells under oxaliplatin treatment[J]. Cancer Lett, 2015, 361(1): 128-36. DOI:10.1016/j.canlet.2015.02.045 |
| [25] |
Nakatogawa H, Suzuki K, Kamada YA. Dynamics and diversity in autophagy mechanisms: lessons from yeast[J]. Nat Rev Mol Cell Biol, 2009, 10(7): 458-67. DOI:10.1038/nrm2708 |
| [26] |
Ito N, Ruegg UT, Takeda S. ATP-induced increase in intracellular calcium levels and subsequent activation of mTOR as regulators of skeletal muscle hypertrophy[J]. Int J Mol Sci, 2018, 19(9): pii: E2804. DOI:10.3390/ijms19092804 |
 2019, Vol. 39
2019, Vol. 39

