2. 烟台毓璜顶医院 中心实验室,山东 烟台 264000
2. Central Laboratory of Yantai Yuhuangding Hospital, Yantai 264000, China
睾丸是一个特殊的器官,其主要功能是产生精子和分泌雄性激素。精子的生成是一个复杂而细微的过程,在这个过程中同时伴随有多种基因的表达[1-4]。附睾是一个卷曲的管道结构,其附着于睾丸的背部,它既是精子运输与储存的部位,也在精子获得运动能力和受精能力上发挥重要作用。在睾丸曲细精管内同一时间可见到各个发育时期的生精细胞,它们有规律、有秩序地排列在曲细精管的不同部位。这些生精细胞按各自增殖和发育的规律逐步向前推进,形成曲细精管局部随时间变化出现不同的细胞组合[5-6]。生精细胞在进入附睾后,在附睾头部和体部的运行过程中会逐渐获得运动能力和受精能力,从而达到功能上的完全成熟,在以上这些过程中需要多种蛋白质的参与[7]。
热休克蛋白(HSPs)又称为热应激蛋白,是Ritossa在1962年研究果蝇时首次发现的[8-9]。热休克蛋白的表达,能够促使热休克因子保护细胞免受环境的刺激,更是细胞发生和发育不可缺少的调控因子[10, 11]。HSP110是热休克蛋白的一种,是一个由不同种类蛋白质构成的分子伴侣家族,在一系列细胞活动中发挥重要作用,在哺乳动物基因组中有四种基因,分别是:HSPA4l,HSPA4,HSPH1和ORP150 [12-13]。前期的研究表明HSPA4l在睾丸中特异性表达,在粗线期晚期精原细胞到减数分裂后的精子细胞中高度表达。HSPA4在小鼠的睾丸、卵巢和脾脏中表达最高[14]。Torsten等[15]将雄性小鼠HSPA4基因敲除后小鼠表现出不育。进一步研究表明,由于HSPA4的缺失,细胞周期被阻断,进而发生凋亡,睾丸的生精过程被抑制,提示HSPA4是维持睾丸正常生精功能所必需的。近年来对HSP110家族的研究主要集中在肿瘤治疗方面[16-18],前期本课题组研究了HSP110家族在输精管结扎后小鼠睾丸和附睾中的表达,探讨了HSP110家族在输精管结扎后睾丸细胞凋亡中的作用,为输精管结扎术安全性研究提供了新的理论依据[19-20]。为了进一步探究HSP110家族在雄性生殖中的意义,探讨HSP110家族在生精过程和睾丸、附睾成熟中的作用,本课题设计研究HSP110家族基因在不同发育阶段小鼠睾丸和附睾中的表达,以及去势后在附睾中表达的变化,有助于进一步阐明该家族蛋白在生精过程以及睾丸、附睾发育过程中的生物学功能。
1 材料和方法 1.1 去势小鼠模型制备将10周龄左右的昆明白小鼠(购至北京市维通利华实验动物技术有限公司)腹腔注射5%水合氯醛(7 mL/kg)进行麻醉,待麻醉后将四肢固定于手术台上,充分暴露手术视野,用剪刀紧贴腹腔下侧剪去被毛。用70%酒精消毒手术部位。剪开腹腔,轻轻夹出睾丸、附睾及周围组织,分离睾丸动脉与精索动脉并结扎,之后剪去睾丸并缝合腹腔。将青霉素粉末涂于缝合处,进行抗炎处理。假手术组仅开腹分离双侧睾丸动脉与精索动脉,不结扎动脉,不切除睾丸。
1.2 实验动物分组将48只10周龄左右的昆明小鼠随机分为3大组,分别为假手术组(8组,3只/组),双侧去势组(4组,3只/组)和双侧去势补充睾酮组(4组,3只/组)。双侧去势组分别在去势后的第1、3、5、7天处死小鼠,断头取血并取出两侧附睾。补充睾酮组从去势后的第7天开始补充激素,按3 mg/kg/2 day的剂量肌注丙酸睾酮。并于首次注射激素后的第1、3、5、7天处死小鼠,断头取血并取出两侧附睾。
1.3 血清睾酮浓度测定小鼠断头取血后,血液先于37 ℃静置1 h,然后4 ℃过夜。次日用低温高速离心机3000 r/min离心15 min,吸取上层血清。血清通过化学发光法进行睾酮浓度的测定。
1.4 不同周龄小鼠的准备成年昆明白雌性小鼠8只与雄性小鼠32只(购至北京市维通利华实验动物技术有限公司),体质量(35~42)g。保证良好的饲养条件,给予充足的饲料和清洁饮水。其中成年昆明白小鼠雌雄合笼饲养以便交配产仔,待小鼠产仔后准确出生天数,收集出生后第14、21、28、35、42、49、70、90天小鼠的睾丸、附睾组织,提取RNA进行实验。
1.5 主要试剂荧光TUNEL试剂盒,蛋白酶K,抗荧光淬灭封片液(碧云天);PI(东仁化学)。
1.6 RNA提取和半定量RT-PCR总RNA提取:从液氮中取出小鼠睾丸、附睾组织,在液氮中充分研磨,加适量Trizol,充分匀浆,室温静置5 min,10000×g离心15min,取上清。加氯仿(0.2 mL/mL Trizo1)剧烈震荡15 s。室温静置2~3 min。4 ℃离心,12 000×g,15 min。吸上层水相,加入异丙醇(0.5 mL/mL Trizol),混匀,室温静置5 min。离心,12 000×g,10 min。弃上清,沉淀中加75%乙醇(1 mL/mL Trizo1)。4 ℃离心,7500×g,5 min。弃上清,室温晾干(5~10 min)。加20~40 μL DEPC水(Rnase-free),充分溶解,在260 nm波长下用紫外分光光度法测A值(吸光度),并根据OD值计算出RNA的含量。进行逆转录和PCR扩增。
琼脂糖凝胶电泳鉴定PCR产物:配制1.5%琼脂糖凝胶,取8 μLPCR扩增产物上样。以75 V恒压进行电泳,电泳结束后,运用GBOX-EF2 Gene Company Limited型凝胶成像系统扫描并保存结果。
1.7 灰度分析以目的基因RT-PCR产物测定值与内参β-actin的RT-PCR产物测定值比值的百分数来表示目的基因mRNA相对表达水平,进行结果比较分析。
1.8 伦理学声明本实验所有的动物实验都是在伦理委员会的批准下进行的。本研究严格按照伦理委员会的指导方针进行。所有手术在麻醉条件下进行,所有努力都是为了尽量减少实验动物的痛苦。
1.9 统计学方法统计分析采用单向方差分析,数据采用均数±标准差表示,P < 0.05表示有显著差异。
2 结果 2.1 HSP110家族基因在不同发育阶段小鼠睾丸和附睾中的表达情况HSP110家族mRNA在各周龄小鼠睾丸中表达情况如图 1,由实验结果可知HSPA4 mRNA表达水平在出生后第14天较低,21~49 d表达较高,小鼠睾丸发育成熟后其表达量相对降低;HSPH1 mRNA在21 d之前表达较低,之后表达量趋于平稳;HSPA4l在出生前42 d前表达量较高,之后表达量降低;而ORP150在发育中的睾丸中的表达量没有显著变化。
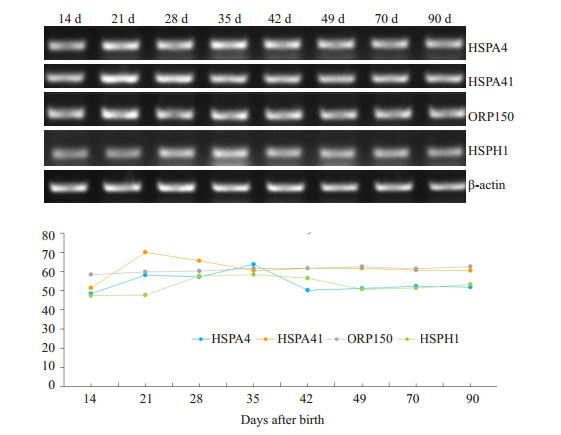
|
图 1 HSP110家族mRNA在发育中小鼠睾丸中的表达 Fig.1 Expression of HSP110 mRNAin the testis of mice during postnatal development. |
HSP110家族mRNA在各周龄小鼠附睾中的表达水平如图 2,由结果可见HSPA4 mRNA在小鼠14~21 d表达较低,28 d开始表达逐渐增强,之后表达水平平稳;HSPA4l在附睾中的表达量比在睾丸中低,在28~35 d表达相对高;ORP150 mRNA在21 d前表达低,之后增高;HSPH1 mRNA在14 d前表达较低,之后增高并保持稳定,70~90 d表达略微减少。
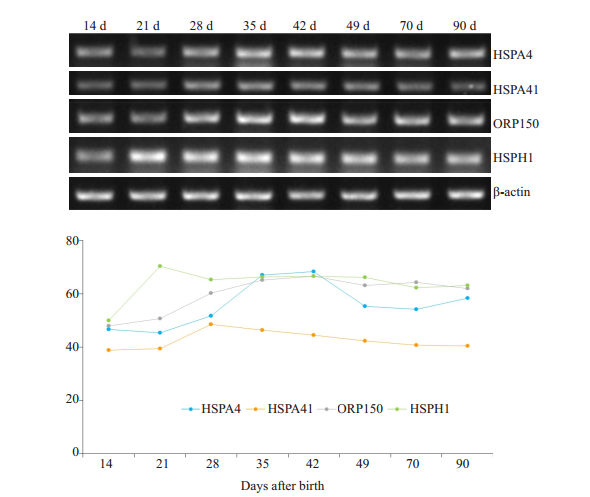
|
图 2 HSP110 mRNA在发育中小鼠附睾中的表达 Fig.2 Expression of HSP110 mRNAin mouse epididymis during postnatal development. |
为了证明小鼠去势模型的有效性,我们测试了去势组小鼠在手术后1、3、5、7 d及补充睾酮1、3、5、7 d血清中的睾酮浓度。各去势组小鼠血清睾酮浓度曲线见图 3,由曲线图可看出小鼠去势后血清中睾酮浓度急剧下降,去势后大概7天左右其值降到最低值;补充睾酮后血清中睾酮浓度急剧升高。该睾酮测定结果与已有的文献报道一致,说明小鼠的去势模型构建成功。
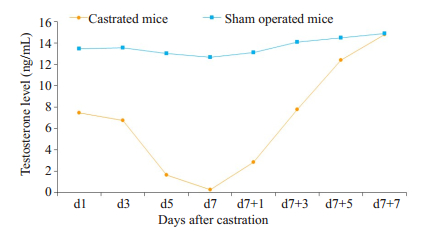
|
图 3 去势后血清睾酮的变化趋势 Fig.3 Variation curve of serum testosterone level after castration. |
去势会造成小鼠附睾中精子细胞的凋亡,同时附睾中其他细胞的凋亡也增加,补充睾酮后凋亡的精子细胞及附睾细胞数均减少。去势后3~7 d凋亡是逐渐增多的,此时凋亡的细胞主要集中在精子细胞、精原细胞和初级精母细胞。
2.2.3 HSP110家族基因在去势后小鼠附睾中的表达通过RT-PCR实验发现HSP110家族成员中HSPA4、HSPA4l mRNA的表达水平受激素水平的影响(图 4),HSPA4在去势第7天左右mRNA表达水平下调较为显著,补充睾酮后表达水平逐渐回升。HSPA4l mRNA在去势后第5~7天下调明显,补充睾酮后其表达量增高;ORP150和HSPH1的mRNA表达受激素影响不大。
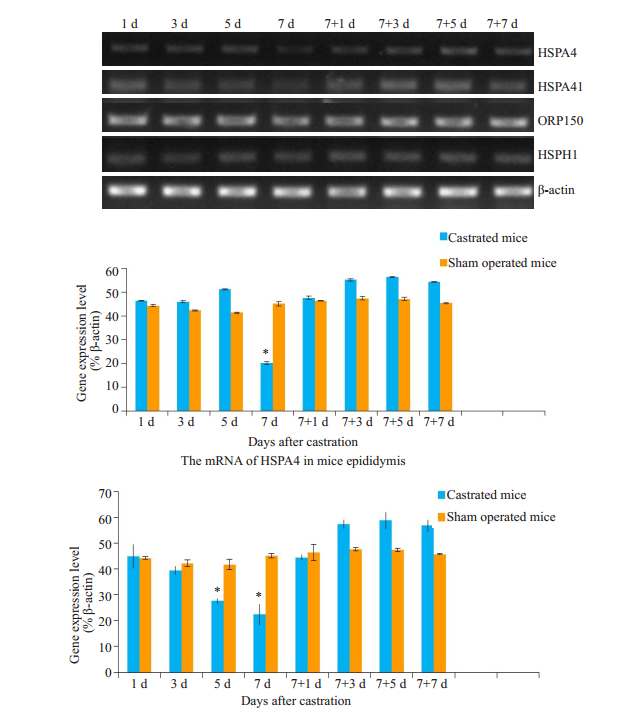
|
图 4 去势后HSP110家族成员mRNA的表达变化 Fig.4 Castration induces changes in mRNA levels of HSP110 family members. The mRNA levels of HSPA4 and HSPA41 in the epididymis of the mice were determined using RT-PCR. *P < 0.05. |
精子生成过程是一个复杂而细微的过程,睾丸中的各级生精细胞均起源于精原干细胞,是精原干细胞经过多次的增殖和更新产生的[21-23]。精子形成和成熟过程中所经历的一系列变化并非仅仅依靠精子自身完成的,而是需要睾丸、附睾中多种基因的程序性表达产物与精子自身协同完成。生精过程和睾丸、附睾发育过程涉及到一系列的细胞增殖、分化过程,在这个过程中涉及很多基因的表达变化。最近研究发现HSP110在小鼠胚胎期和出生后的机体和精子细胞中均有表达,而在雄性不育小鼠精子减少和运动力不足时,HSP110表达明显降低,精子的发生在减数分裂前期被抑制[24]。因此,HSP110是维持雄性正常生育能力重要的分子伴侣,但其具体机制尚不清楚。本课题设计研究HSP110家族在不同发育阶段小鼠睾丸和附睾中的表达情况。本研究显示HSPA4、HSPA4l、HSPH1基因在不同发育阶段的小鼠睾丸中的表达水平不同,而HSP110家族的4个成员在发育中的附睾中表达水平均发生变化,说明该家族在睾丸和附睾发育成熟的过程中可能发挥重要的作用,同时也说明该类成员的表达水平受发育过程调控的影响。系统地研究HSP110家族基因在不同发育阶段小鼠睾丸、附睾中的表达,有助于阐明该家族在生精过程及睾丸、附睾发育过程中的调控机制和生物学功能。HSP110家族在生精过程和睾丸、附睾的发育过程中的作用有待进一步的研究。
雄性激素在启动和维持精子形成,延长附睾中精子寿命中起到不可代替的作用。激素水平是影响睾丸及附睾组织中某些蛋白表达水平的重要因素,睾丸及附睾发育过程中同样伴随着激素水平的变化,附睾中很多基因的表达受雄性激素的调节[25-26],因为精子的形成与成熟本身就是一个激素依赖性的过程[27-29]。睾酮对维持附睾的结构和功能起着十分重要的作用,睾酮减少可导致附睾上皮退化、细胞凋亡以及大多数基因表达的下调,此时附睾中的精子也不能成熟,补充外源性雄性激素后,附睾的结构和功能基本能恢复到原始状态[30-32]。本实验发现去势后可导致附睾上皮细胞凋亡增加,附睾内精子大量凋亡,外源补充激素后凋亡细胞及精子均减少,与上述结论相符。激素水平是影响睾丸及附睾组织中某些基因表达水平的重要因素,睾丸及附睾发育过程中同样伴随着激素水平的变化,本研究通过小鼠去势实验证实HSPA4和HSPA4l基因表达水平受睾酮调节,该实验进一步证实了激素水平是影响发育进程中HSPA4和HSPA4l表达趋势的主要因素。而睾酮调节HSPA4和HSPA4l表达的作用机制有待于进一步深入的研究。研究HSP110在睾丸及附睾中的表达是否受激素调控,有助于进一步研究附睾基因表达及其雄激素调控的区域性从而阐明附睾精子成熟的分子机制。而HSP110家族基因在小鼠附睾中受激素的调节,说明其在精子的成熟中可能发挥重要作用,其受激素调节的机制,以及其在精子形成和成熟中的作用有待进一步研究。
通过系统的研究HSP110家族在各周龄小鼠睾丸、附睾组织中的表达,显示随着发育过程的进行该家族表达水平存在变化,这说明HSP110家族的表达水平受发育过程调控。去势实验结果说明HSPA4和HSPA4l基因的表达受激素调控。
| [1] |
Ma K, Inglis JD, Sharkey A, et al. A Y-chromosome gene family with rna-binding protein homology-candidates for the azoospermia factor azf controlling human spermatogenesis[J]. Cell, 1993, 75(7): 1287-95. DOI:10.1016/0092-8674(93)90616-X |
| [2] |
Amann RP. The cycle of the seminiferous epithelium in humans:a need torev is it[J]. Androl, 2008, 29(5): 469-87. |
| [3] |
Hermo L, Pelletier RM, Cyr DG, et al. Surfing the wave, cycle, Life history, and genes/proteins expressed by testicular germ cells. Part1: background to spermatogenesis, spermatogonia, and spermatocytes[J]. Microsc Res Tech, 2010, 73(4): 241-78. DOI:10.1002/jemt.20783 |
| [4] |
Yanagisawa M, Mukouyama Y, Watanabe T, et al. A novel serine/threonine kinase gene, Gek1, is expressed in meiotic testicular germ cells and primordial germ cells[J]. Mol Reprod Dev, 1996, 45(4): 411-20. DOI:10.1002/(SICI)1098-2795(199612)45:4<411::AID-MRD2>3.0.CO;2-U |
| [5] |
Hermo L, Pelletier RM, Cyr DG, et al. Surfing the wave, cycle, Life history, and genes/proteins expressed by testicular germcells. Part1: background to spermatogenesis, spermatogonia, and spermatocytes[J]. Microsc Res Tech, 2010, 73(4): 241-78. DOI:10.1002/jemt.20783 |
| [6] |
Hermo L, Pelletier RM, Cyr DG, et al. Surfing the wave, cycle, Life history, and genes/proteins expressed by testicular germ cells. part 2: changes in spermatid organelles associated with development of spermatozoa[J]. Microsc Res Tech, 2010, 73(4): 279-319. |
| [7] |
Zhou Y, Zheng M, Shi Q, et al. An epididymis-specific secretory protein Hongr ES1 critically regulates sperm capacitation and male fertility[J]. PLoS One, 2008, 3(12): e4106. DOI:10.1371/journal.pone.0004106 |
| [8] |
Ritossa F. A new puffing pattern induced by temperature shock and DNP in drosophila[J]. Experientia, 1962, 18(12): 571-3. DOI:10.1007/BF02172188 |
| [9] |
Tissières A, Mitchell HK, Tracy UM. Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs[J]. J Mol Biol, 1974, 84(3): 389-98. DOI:10.1016/0022-2836(74)90447-1 |
| [10] |
Mobaraki F, Seghatoleslam M, Fazel A. Effects of MDMA (ecstasy) on apoptosis and heat shock protein (HSP70) expression in adult rat testis[J]. Toxicol Mech Methods, 2018, 28(3): 219-29. DOI:10.1080/15376516.2017.1388461 |
| [11] |
Selim ME, Rashed EA, Aleisa NA, et al. The protection role of heat shock protein 70(HSP-70) in the testes of cadmium-exposed rats[J]. Bioinformation, 2012, 8(1): 58-64. |
| [12] |
徐煌, 韩冬, 程惠平. 热休克蛋白110的研究进展[J]. 嘉兴学院学报, 2008, 20(6): 15-7, 73. DOI:10.3969/j.issn.1008-6781.2008.06.003 |
| [13] |
Vos MJ, Hageman J, Carra S, et al. Structural and functional diversities between members of the human HSPB, HSPH, HSPA, and DNA chaperone families[J]. Biochemistry, 2008, 47(27): 7001-11. DOI:10.1021/bi800639z |
| [14] |
Kaneko Y, Kimura T, Kishishita M, et al. Cloning of apg-2 encoding a novel member of heat shock protein 110 family[J]. Gene, 1997, 189(1): 19-24. |
| [15] |
Held T, Barakat AZ, Mohamed B, et al. Heat-shock protein HSPA4 is required for progression of spermatogenesis[J]. Reproduction, 2011, 142(1): 133-44. DOI:10.1530/REP-11-0023 |
| [16] |
Berardinelli GN, Scapulatempo-Neto C, Durães R, et al. Advantage of HSP110(T17) marker inclusion for microsatellite instability (MSI) detection in colorectal cancer patients[J]. Oncotarget, 2018, 9(47): 28691-701. |
| [17] |
Gozzi GJ, Gonzalez D, Boudesco C, et al. Selecting the first chemical molecule inhibitor of HSP110 for colorectal cancer therapy[J]. Cell Death Differ. 2019 May 8. doi: 10.1038/s41418-019-0343-4.[Epubaheadofprint].
|
| [18] |
Causse SZ, Marcion G, Chanteloup GA, et al. HSP110 translocates to the nucleus upon genotoxic chemotherapy and promotes DNA repair in colorectal cancer cells[J]. Oncogene, 2019, 38(15): 2767-77. DOI:10.1038/s41388-018-0616-2 |
| [19] |
Du ZN, Rong CT, Hui S, et al. Expression and function of HSP110 family in mouse testis after vasectomy[J]. Asian J Androl, 2017, 19(3): 355-61. DOI:10.4103/1008-682X.164197 |
| [20] |
戎成婷, 韩俊岭, 杜振宁. HSP90β在小鼠生殖系统中的表达及调控[J]. 南方医科大学学报, 2013, 33(4): 491-5. |
| [21] |
Toshima J, Ohashi K, Okano I, et al. Identification and characterization of a novel protein kinase, TESK1, specifically expressed in testicular germ cells[J]. J Biol Chem, 1995, 270(52): 31331-7. DOI:10.1074/jbc.270.52.31331 |
| [22] |
Amann RP. The cycle of the seminiferous epithelium in humans:a need torev is it?[J]. J Androl, 2008, 29(5): 469-87. DOI:10.2164/jandrol.107.004655 |
| [23] |
Hermo L, Pelletier RM, Cyr DG, et al. Surfing the wave, cycle, Life history, and genes/proteins expressed by testicular germ cells. Part 5: Intercellular junctions and contacts between germs cells and Sertoli cells and their regulatory interactions, testicular cholesterol, and genes/proteins associated with more than one germ cell generation[J]. Microsc Res Tech, 2010, 73(4): 409-94. |
| [24] |
Ferlin A, Speltra E, Patassini C, et al. Heat shock protein and heat shock factor expression in sperm: relation to oligozoospermia and varicocele[J]. J Urol, 2010, 183(3): 1248-52. DOI:10.1016/j.juro.2009.11.009 |
| [25] |
Hu Y, Zhou Z, Xu C, et al. Androgen down-regulated and reginspecific expression of germ cell nuclear factor in mouse epididymis[J]. Endocrinology, 2003, 144(4): 1612-9. DOI:10.1210/en.2002-220915 |
| [26] |
Douglass J, Garrett SH, Garrett JE. Differential patterns of regulated gene expression in the adult rat epididymis[J]. Ann N Y Acad Sci, 2010, 637(1): 384-98. |
| [27] |
崔毓桂, 陈子庆, 沙家豪. 激素对精子发生的调控[J]. 中华男科学, 2004, 10(6): 465-7, 469. DOI:10.3969/j.issn.1009-3591.2004.06.020 |
| [28] |
Zhu CF, Liu Q, Zhang L, et al. RNase9, an androgen-dependent member of the RNase a family, is specifically expressed in the rat epididymis[J]. Biol Reprod, 2007, 76(1): 63-73. DOI:10.1095/biolreprod.106.054635 |
| [29] |
Rao MK, Wayne CM, Meistrich ML, et al. Pem homeobox gene promoter sequences that direct transcription in a Sertoli cell-specific, stage-specific, and androgen-dependent manner in the testis in vivo[J]. Mol Endocrinol, 2003, 17(2): 223-33. DOI:10.1210/me.2002-0232 |
| [30] |
Qiu Y, Yang DT, Wang SM, et al. Successful pregnancy and birth after intrauterine insemination using caput epididymal sperm by percutaneous aspiration[J]. Asian J Androl, 2003, 5(1): 73-5. |
| [31] |
Ezer N, Robaire B. Gene expression is differentially regulated in the epididymis after orchidectomy[J]. Endocrinology, 2003, 144(3): 975-88. DOI:10.1210/en.2002-220705 |
| [32] |
Rodringuez CM, Kirby JL, Hinton BT. Androgenic regulation of the structure and function of the epididymis[M]//Robaire H. The Epididymis: From Molecules to Clinical Practice. Kluwer Academic/Plenum Publishers, 2002, 297-315.
|
 2019, Vol. 39
2019, Vol. 39

