癌症是全球发病率和死亡率的主要原因之一,接受抗癌治疗55%的患者和晚期转移66%的患者出现疼痛[1]。骨是乳腺癌、肺癌、前列腺癌远处转移的最常见部位,这些转移产生的症状包括严重且无法治愈的疼痛,称为骨癌痛(CIBP)[2-3]。这些疼痛已成为严重影响患者的功能状态、生活质量和生存时间的重要疾患。目前CIBP的治疗策略主要集中在放射治疗和镇痛药物上,包括强效非甾体抗炎药和阿片类药物[1],但这些药物可引起严重的剂量限制性副作用,限制了其使用。随着CIBP患者的数量增加,越来越需要关注保持生活质量的干预措施。因此,研究CIBP的发病机制和新的治疗靶点至关重要。
背根神经节(DRG)为疼痛感觉的初级传入神经元,在疼痛发生机制中具有重要作用[4-5]。因此,DRG在疼痛机制中的作用和疼痛治疗始终是疼痛领域的研究重点。有报道称,DRG的致敏作用有助于肿瘤诱导痛觉过敏和持续的疼痛[6]。临床常以DRG为靶点的介入治疗和神经调节治疗缓解疼痛[7]。
长期以来,中医药已被证明可有效治疗癌症疼痛,提高疼痛阈值,降低身体对癌症的反应,改变患者的精神环境,它也会产生很长的有效时间,副作用较少[8]。华蟾素注射液是一种来自蟾蜍皮肤的水溶性提取物,对多种癌症疼痛有效[9]。特别是与化疗药物联合使用时,不仅可以在很大程度上减轻疼痛,还可以减少化疗药物的副作用,提高患者的整体生活质量[10]。我们前期研究发现,华蟾素对骨癌痛大鼠有较好的镇痛效应[11]。但对于“离子通道病理改变”的癌痛机制尚知之甚少。快速激活快速失活的A-型电压门控钾离子通道在调控神经元的兴奋性及基本电生理学特性中起着非常重要的作用[12]。越来越多的研究显示,A-型电压门控钾离子通道广泛参与痛觉信息传递与调制的可塑性[13-14]。有文献报道,在疼痛机制中,与疼痛机制密切相关IA电流是实现DRG靶向镇痛的关键[15],但其具体作用机制尚未阐明。本研究选用大鼠胫骨骨癌痛模型,采用全细胞膜片钳记录,首次研究了华蟾素对DRG神经元IA电流的调制作用,深入探讨华蟾素对骨癌痛大鼠痛觉过敏的作用及其机制,为临床治疗骨癌痛提供新的理论参考。
1 材料和方法 1.1 药品和试剂DMEM培养基,trypsin-EDTA(Gibco);神经生长因子(NGF)、青霉素-链霉素、山羊血清、Ⅰ/Ⅱ型胶原酶、多聚赖氨酸(Sigma)。华蟾素(安徽金蟾生化股份有限公司,国药准字Z34020274,规格为每支5 mL,货号150723-25。
1.2 骨癌痛大鼠模型的建立 1.2.1 实验动物与分组SPF级雌性SD大鼠48只,体质量(100±10)g,由三峡大学实验动物中心提供[实验动物许可证号:SCXK(鄂)2011-0012]。将大鼠按随机数字表法分为4组,正常对照组、华蟾素组、骨癌痛组和华蟾素干预组,每组12只。
1.2.2 骨癌痛大鼠模型的建立[11, 16]取体质量60~80 g雌性幼鼠2只,腹腔注射乳腺癌Walker 256细胞0.5 mL(细胞浓度为4×107/mL),第7天收集腹水,以无菌PBS漂洗细胞3次,细胞浓度调整至4×105/mL的浓度。骨癌痛组与华蟾素干预组大鼠麻醉后,向左侧胫骨骨髓腔内注射4 µL乳腺癌细胞,骨蜡封孔。华蟾素组和华蟾素干预组在造模第7天开始腹腔注射华蟾素注射液(5 mL/kg,1次/d,连续8 d),其余各组每天予以等体积生理盐水。8 d后急性分离SD大鼠DRG细胞,应用全细胞膜片钳记录华蟾素对骨癌痛大鼠DRG细胞IA电流的影响。
1.3 大鼠DRG神经元的急性分离各组大鼠称质量麻醉后,断头处死,迅速分离出左侧(骨癌细胞接种侧)L2~L5段DRG,将清除干净的DRG尽可能地剪碎。弃去DMEM后,加入1.5 mLⅠ型胶原酶(1.5 mg/mL),37 ℃,110 r/min的恒温摇床上消化45 min。然后弃去胶原酶,加入1.5 mL Ⅱ型胰酶(2 mg/mL),继续消化10 min。然后1000 r/min离心5 min,弃上清液,再加入适量的DMEM培养基稀释,吹打成细胞悬液。将上述细胞悬液用,接种至提前一天用多聚赖氨酸(0.1 mg/mL)包被过的直径35 mm×10 mm细胞培养皿上,轻轻晃动,使其均匀分布。静置于37 ℃,5% CO2培养箱培养2 h后进行电生理实验。
1.4 全细胞膜片钳记录[17] 1.4.1 溶液配制细胞外液(mmol/L):5 KCl,70 TEA-Cl,2 CaCl2,1 MgCl2·6H2O,1 CaCl2,70 Chol-Cl2,0.1 CdCl2,10 HEPES,10 glucose,氢氧化钠调pH至7.3~7.4,于4 ℃保存备用。
电极内液(mmol /L):118 K-l-aspartic acid potassium(L-ASP),20 KCl,2 MgCl2·6H2O,10 EGTA,10 HEPES,5 Na-ATP,氢氧化钾调pH至7.3,于-20 ℃保存备用。其中Chol-Cl2阻断钠离子通道,TEA-Cl阻断延迟整流性钾离子通道。
1.4.2 电生理记录室温控制在(25±2)℃左右。培养皿去掉培养基,细胞外液冲洗2~3次,加1 mL外液,利用倒置显微镜(Ⅸ-71, Olympus)寻找细胞形态饱满、膜干净、折光度强的细胞。玻璃电极用毛细玻管由P-97电极拉制仪(Sutter Instrument Co, San Rafael)两步拉制而成,入水电阻5~8 MΩ,接触细胞后抽负压,形成高阻抗封接(电阻≥GΩ)后,负压破膜,形成全细胞电压钳模式进行记录。本研究采用EPC 10双通道膜片钳(Heka Electronic, Lambrecht)放大系统。记录IA电流的Ⅰ~Ⅴ曲线设置:细胞钳制电压为-70 mV,去极化到+80 mV,每次跃迁10 mV,持续1000 ms,频率为0.2 Hz。失活曲线设置:采用阶梯波给予其刺激,细胞钳制电压为-70 mV,给予-120 mV~+50 mV的去极化脉冲,持续50 ms,步幅为10 mV,再给予50 mV×200 ms的测试脉冲刺激记录电流。
1.5 统计学处理利用软件Patchmaster直接获得膜电容,结合软件ABF Utility和Clampfit 11.0计算出电流密度(pA /pF)=电流强度/膜电容。电流强度:在激活过程中的电流与最大激活电流的比值。激活曲线与失活曲线通过Boltzmann方程:G/Gmax=1/{1+exp [(-V-V1/2)/k] }和I/Imax= 1/{1+exp [(V-V1/2)/k] }拟合得到。应用SPSS20软件统计分析,所有实验数据均用均数±标准误表示,采用单因素方差分析进行组间差异的统计学检验,两组间比较采用SNK-q检验进行统计学分析,以P < 0.05为差异有统计学意义。
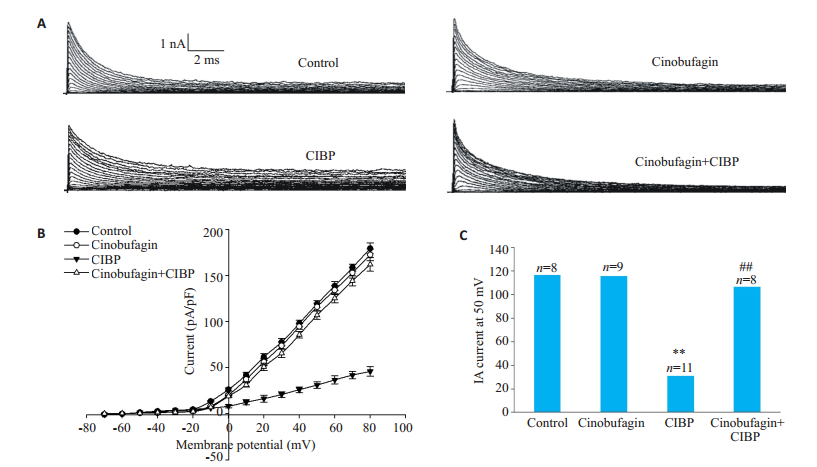
2 结果 2.1 华蟾素对骨癌痛大鼠DRG细胞IA电流密度的影响将细胞钳制电压为-70 mV,去极化到+80 mV,每次跃迁10 mV,持续1000 ms,频率为0.2 Hz。图 1A为IA电流原始图。骨癌痛组电流增大,华蟾素干预骨癌痛组明显抑制了IA电流。图 1B显示各组细胞IA电流密度的改变。与正常组相比,骨癌痛组IA电流明显减小(**P < 0.01),而华蟾素组无明显改变;与骨癌痛组比,华蟾素+骨癌痛组电流明显增大(##P < 0.01);图 1C显示电压为50 mV时各组平均电流强度直方图。
|
图 1 华蟾素对骨癌痛大鼠DRG细胞IA电流密度的影响 Fig.1 Effect of cinobufagin on IA current density in DRG cells acutely isolated from normal rats and rats with bone cancer pain. A: Original current map of IA currents in each group; B: IA current-voltage curves in each group; C: Average IA current intensity at 50 mV voltage (**P < 0.01 vs control group; ##P < 0.01 vs CIBP group). |
|
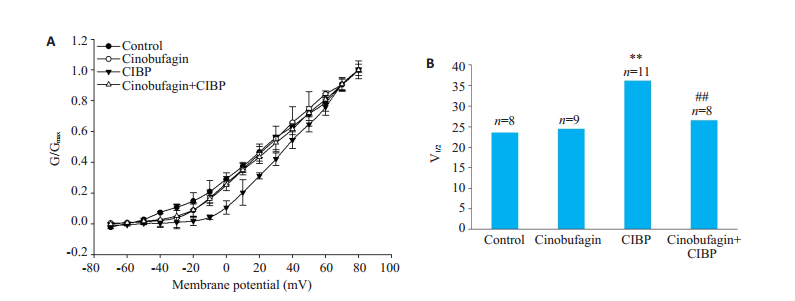
图 2 华蟾素对骨癌痛大鼠DRG细胞IA电流激活的影响 Fig.2 Effect of cinobufagin on IA current activation in DRG cells from rats with bone cancer pain. A: IA current activation curves; B: Half-activation voltage V1/2 (**P < 0.01 vs control group; ##P < 0.01 vs CIBP group). |
根据图 1记录到的Ⅰ~Ⅴ电流用G=I/(V-VRev)公式计算出每个点的电导G,用Boltzmann方程G/Gmax=1/{1+ exp [(-V-V1/2)/k] }对激活曲线进行拟合,得到IA电流的稳态激活曲线。结果显示,骨癌痛使DRG细胞IA电流激活曲线左移;而华蟾素使骨癌痛DRG细胞IA电流的激活曲线右移。求得各组半激活电压V1/2分别是:正常组(23.6±1.3 mV,n=8);华蟾素组(24.5±1.4 mV,n=9);骨癌痛组(36.3±2.0 mV,n=11)**P < 0.01;华蟾素干预组(26.6±1.2 mV,n=8)##P < 0.01。
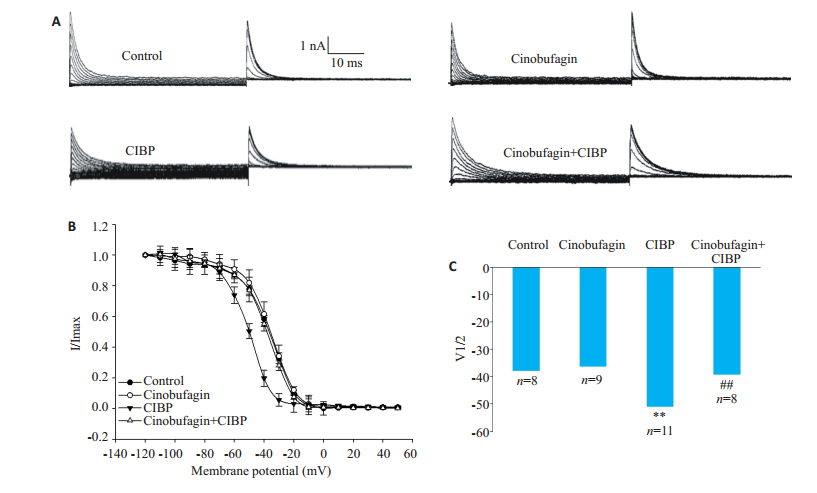
2.3 华蟾素对骨癌痛大鼠DRG细胞IA电流失活的影响采用阶梯波给予其刺激,钳制电压为-70 mV,给予-120 mV~+50 mV的去极化脉冲,持续500 ms,步幅为10 mV,再给予200 ms 50 mV的测试脉冲刺激记录电流。图 3A为IA电流失活原始电流图,根据记录到的失活电流测量脉冲数据用Boltzmann方程I/Imax=1/{1+ exp [(V-V1/2)/k] }对失活曲线进行拟合,得到失活曲线。结果显示,骨癌痛组失活曲线右移,而华蟾素使骨癌痛DRG细胞IA电流的失活曲线左移。各组半激活电压V1/2分别是:正常组([-38.0±2.4) mV,n=8];华蟾素组([-36.3±2.0) mV,n=9];骨癌痛组([-51.0±3.2) mV,n= 11]**P < 0.01;华蟾素干预组([-39.2±2.4) mV,n=8]##P < 0.01(图 3)。
|
图 3 华蟾素对骨癌痛大鼠DRG细胞IA电流失活的影响 Fig.3 Effect of cinobufagin on IA current inactivation of DRG cells from rats with bone cancer pain. A: Original maps of IA current inactivation; B: IA current inactivation curves; C: Half-inactivation voltage V1/2 (**P < 0.01 vs control group; ##P < 0.01 vs CIBP group). |
骨癌痛引起的神经病理性疼痛是临床常见的慢性疾病,发病机制十分复杂。本研究旨在探讨华蟾素作为骨癌痛镇痛可能机制的电生理效应。揭示了华蟾素可以通过调节大鼠DRG神经元中的IA电流特性发挥作用。
本实验研究发现,骨癌痛大鼠DRG细胞IA电流激活曲线右移,失活曲线向左移,半激活电压和半失活电压改变,这将导致钾离子通道异常,电流减小,电流密度减小。激活曲线的正向偏移这意味着IA电流从闭合构象转变为开放构象的难度增加。换句话说,通过改变IA电流的电生理特性,在骨癌痛的存在下DRG神经元的兴奋性增加。此外,随着IA电流的下调,DRG细胞内钾离子水平和神经递质的平衡可能随之改变,然后导致机体内信号异常传导,引起神经病理性疼痛[13]。华蟾素干预使骨癌痛大鼠DRG细胞IA电流激活曲线左移,失活曲线向右移,逆转了通道的异常,电流增大,电流密度增加。而单用华蟾素组,与正常组无显著性差异,华蟾素本身对大鼠DRG细胞IA电流密度、激活及失活等电流特性均不产生影响。这与其他神经病理痛模型中IA电流表达下降的结果相一致,随着神经病理痛和炎症痛的发展,IA在DRG上被广泛地报道为下调[13, 18-21]。A-型钾通道和IA在神经元上的下调增强了神经元对伤害性刺激的反应,参于机械痛敏和热痛敏的形成[22]。因此,我们认为华蟾素可能主要通过改变IA电流的激活和失活,使骨癌痛大鼠DRG细胞IA电流的增大,起到对骨癌痛病理性疼痛的控制作用。
DRG作为感觉传入的初级神经元,在传递和调节机体感觉中具有非常重要的作用。DRG细胞异常放电主要通过离子通道来调控,在此过程中钾离子通道起着重要作用[23]。DRG神经元表达调节膜兴奋性的各种A-型钾通道[13]。外周神经损伤引起的疼痛与DRG细胞IA电流异常有紧密关系[24]。
电压门控钾通道中存在一种激活和失活都非常迅速的钾离子通道,它产生的电流称为IA电流,这类钾离子通道称为瞬间外向钾通道或A-型钾通道,这种A-型钾通道广泛分布在许多不同类型的神经元上,这些通道在确定内在膜特性和伤害感受神经元的兴奋性方面发挥着关键作用[25]。并且它们已广泛涉及疼痛可塑性[26-27]。例如,周围神经损伤显示诱导IA电流的下调,导致感觉神经元的兴奋性增加,这可能增加对伤害性刺激的反应性[28]。此外,遗传和功能分析已经确定了A-型通道在放大外周伤害性信号和促进脊髓背角中枢致敏方面的重要作用[29]。IA电流是动作电位复极化早期外向电流的主要成分,可影响初级传入神经元动作电位阈值及其脉冲间隔,在生理情况下,IA电流主要发挥其抑制神经元兴奋性的功能,当神经损伤或使用药理学方法抑制IA电流时可使神经元兴奋性增高,导致痛觉过敏[30-31]。因此,预期A-型通道的操纵将调节内在神经元兴奋性和随后的伤害感受传递,这被认为对疼痛治疗有用。
本研究利用大鼠骨癌痛模型,研究了DRG初级感觉神经元IA电流参与骨癌痛的神经电生理变化,这些结果显示IA电流在骨癌痛介导的DRG神经元痛觉过敏中的重要作用,并进一步揭示了骨癌痛发生的基本机制。并且首次证明华蟾素可以通过调制IA电流电学特性而有效地缓解骨癌痛。本研究为临床使用华蟾素治疗骨癌痛方面提供了新的理论依据。
| [1] |
WHO Guidelines for the Pharmacological and radiotherapeutic management of cancer pain in adults and adolescents[M]. Geneva: World Health Organization, 2018.
|
| [2] |
Ungard R G, Linher-Melville K, Nashed M, et al. xCT knockdown in human breast cancer cells delays onset of cancer-induced bone pain[J]. Mol Pain, 2019, 15: 2070341335. |
| [3] |
Wang W, Jiang QL, Wu JX, et al. Upregulation of bone morphogenetic protein 2 (Bmp2) in dorsal root ganglion in a rat model of bone cancer pain[J]. Mol Pain, 2019, 15: 2070339270. |
| [4] |
吴越, 周祖华, 闻庆平, 等. 葛根素对大鼠背根神经节神经病理性疼痛的镇痛作用[J]. 中国医科大学学报, 2018, 47(9): 803-6. |
| [5] |
Dib-Hajj SD, Cummins TR, Black JA, et al. Sodium channels in normal and pathological pain[J]. Annu Rev Neurosci, 2010, 33: 325-347. DOI:10.1146/annurev-neuro-060909-153234 |
| [6] |
Zheng Q, Fang D, Cai J, et al. Enhanced excitability of small dorsal root ganglion neurons in rats with bone cancer pain[J]. Mol Pain, 2012, 8(24): 1-24. |
| [7] |
Deer T, Pope J, Hunter C, et al. Safety analysis of dorsal root ganglion stimulation in the treatment of chronic pain[J]. Neuromodulation, 2019. |
| [8] |
Guo YM, Huang YX, Shen HH, et al. Efficacy of compound kushen injection in relieving cancer-related pain: a systematic review and meta-analysis[J]. Evid Based Complement Alternat Med, 2015, 840742. |
| [9] |
Chen T, Yuan S, Wan XN, et al. Chinese herb cinobufagin-reduced cancer pain is associated with increased peripheral opioids by invaded CD3/4/8 lymphocytes[J]. Oncotarget, 2017, 8(7): 11425-41. |
| [10] |
Wu T, Sun RM, Wang ZX, et al. A meta-analysis of cinobufacini combined with transcatheterarterial chemoembolization in the treatment of advanced hepatocellular carcinoma[J]. J Cancer Res Ther, 2014, 10(5, 1): 60-4. |
| [11] |
刘丹, 张文, 王心怡, 等. 华蟾素对骨癌痛大鼠的镇痛效应及对脊髓胶质细胞活化的影响[J]. 癌变·畸变·突变, 2018, 30(4): 302-6. DOI:10.3969/j.issn.1004-616x.2018.04.011 |
| [12] |
Humphries ES, Dart C. Neuronal and cardiovascular potassium channels as therapeutic drug targets: promise and pitfalls[J]. J Biomol Screen, 2015, 20(9): 1055-73. DOI:10.1177/1087057115601677 |
| [13] |
Zemel BM, Ritter DM, Covarrubias MA. A-type K-V channels in dorsal root ganglion neurons: diversity, function, and dysfunction[J]. Front Mol Neurosci, 2018, 11: 253. DOI:10.3389/fnmol.2018.00253 |
| [14] |
Qu LT, Caterina MJ. Enhanced excitability and suppression of A-type K + currents in joint sensory neurons in a murine model of antigen-induced arthritis[J]. Sci Rep, 2016, 6: 28899. DOI:10.1038/srep28899 |
| [15] |
Schmitt LI, Leo M, Kleinschnitz CA. Oxaliplatin modulates the characteristics of voltage-gated calcium channels and action potentials in small dorsal root ganglion neurons of rats[J]. Mol Neurobiol, 2018, 55(12): 8842-55. DOI:10.1007/s12035-018-1029-5 |
| [16] |
Huang YQ. Expression of BDNF in dorsal root ganglion of rats with bone cancer pain and its effect on pain[J]. J Musculoskelet Neuronal Interact, 2018, 18(1): 42-6. |
| [17] |
Zou Z, Lu Y, Zha Y, et al. Endocannabinoid 2-Arachidonoylglycerol suppresses LPS-induced inhibition of A-Type potassium channel currents in caudate nucleus neurons through CB1 receptor[J]. J Mol Neurosci, 2016, 59(4): 493-503. DOI:10.1007/s12031-016-0761-4 |
| [18] |
Zhang YL, Cai GJ, Ni X, et al. The role of ERK activation in the neuronal excitability in the chronically compressed dorsal root ganglia[J]. Neurosci Lett, 2007, 419(2): 153-7. DOI:10.1016/j.neulet.2007.04.040 |
| [19] |
Takahashi R, Yoshizawa T, Yunoki TA, et al. Hyperexcitability of bladder afferent neurons associated with reduction of Kv1.4 alphaSubunit in rats with spinal cord injury[J]. J Urol, 2013, 190(6): 2296-304. DOI:10.1016/j.juro.2013.07.058 |
| [20] |
Calvo M, Richards N, Schmid AB, et al. Altered potassium channel distribution and composition in myelinated axons suppresses hyperexcitability following injury[J]. Elife, 2016, 5: e12661. DOI:10.7554/eLife.12661 |
| [21] |
Shinoda M, Fukuoka T, Takeda M, et al. Spinal glial cell line-derived neurotrophic factor infusion reverses reduction of Kv4.1-mediated A-type Potassium currents of injured myelinated primary afferent neurons in a neuropathic pain model[J]. Mol Pain, 2019, 15: 1-35. |
| [22] |
Kuo YL, Cheng JK, Hou WH, et al. K+ Channel modulatory subunits KChIP and DPP participate in Kv4-Mediated mechanical pain control[J]. J Neurosci, 2017, 37(16): 4391-404. DOI:10.1523/JNEUROSCI.1619-16.2017 |
| [23] |
Sheng A, Hong J, Zhang L, et al. The distributions of voltage-gated K (+) current subtypes in different cell sizes from adult mouse dorsal root ganglia[J]. J Membr Biol, 2018, 251(4): 573-9. DOI:10.1007/s00232-018-0033-z |
| [24] |
Viatchenko-Karpinski V, Gu JG. Mechanical sensitivity and electrophysiological properties of acutely dissociated dorsal root ganglion neurons of rats[J]. Neurosci Lett, 2016, 634: 70-5. DOI:10.1016/j.neulet.2016.10.011 |
| [25] |
Zhang Y, Jiang DS, Li H, et al. Melanocortin type 4 receptormediated inhibition of A-type K+ current enhances sensory neuronal excitability and mechanical pain sensitivity in rats[J]. J Biol Chem, 2019, 294(14): 5496-507. DOI:10.1074/jbc.RA118.006894 |
| [26] |
Duan KZ, Xu Q, Zhang XM, et al. Targeting a-type K+ channels in primary sensory neurons for bone cancer pain in a rat model[J]. Pain, 2012, 153(3): 562-74. DOI:10.1016/j.pain.2011.11.020 |
| [27] |
Cheng CF, Wang WC, Huang CY, et al. Coexpression of auxiliary subunits KChIP and DPPL in Potassium Channel Kv4-positive nociceptors and pain-modulating spinal interneurons[J]. J Comp Neurol, 2016, 524(4): 846-73. DOI:10.1002/cne.23876 |
| [28] |
Takeda M, Tsuboi Y, Kitagawa J, et al. Potassium channels as a potential therapeutic target for trigeminal neuropathic and inflammatory pain[J]. Mol Pain, 2011, 7(5): 1-8. |
| [29] |
Chien LY, Cheng JK, Chu DC, et al. Reduced expression of A-type Potassium channels in primary sensory neurons induces mechanical hypersensitivity[J]. J Neurosci, 2007, 27(37): 9855-65. DOI:10.1523/JNEUROSCI.0604-07.2007 |
| [30] |
Zemel BM, Muqeem T, Brown EV, et al. Calcineurin dysregulation underlies spinal cord injury-induced K(+) Channel dysfunction in DRG neurons[J]. J Neurosci, 2017, 37(34): 8256-72. DOI:10.1523/JNEUROSCI.0434-17.2017 |
| [31] |
Rasband MN, Park EW, Vanderah TW, et al. Distinct potassium channels on pain-sensing neurons[J]. Proc Natl Acad Sci USA, 2001, 98(23): 13373-8. DOI:10.1073/pnas.231376298 |
 2019, Vol. 39
2019, Vol. 39

