2. 石家庄市妇幼保健院妇产科, 河北 石家庄 050050;
3. 石家庄市妇产医院, 河北 石家庄 050082
2. Department of Obstetrics and Gynecology, Maternal and Child Health Hospital, Shijiazhuang 050050, China;
3. Department of Obstetrics and Gynecology, Shijiazhuang Obstetrics and Gynecology Hospital, Shijiazhuang 050082, China
卵巢恶性肿瘤以卵巢癌最为多见,占卵巢恶性肿瘤的90%,严重威胁着妇女生命与健康[1-2]。卵巢癌是易于转移及广泛播散的肿瘤,就诊时70%的患者已属晚期[3-4]。尽管临床上对于该病给予理想的肿瘤细胞减灭术并辅以铂类和紫杉醇的联合化疗能够使患者预后得到改善,但目前卵巢癌总的复发率仍在40%~60%,且存在较高的铂耐药情况,因此治疗卵巢癌复发及耐药仍是妇产科肿瘤工作者的严峻挑战[5]。探讨卵巢癌复发及耐药原因及机制对于卵巢癌的治疗至关重要。TSCs是肿瘤组织中具有干细胞特征的细胞群,具有自我更新、无限增殖、多潜能分化等特征[6]。其已在多种恶性肿瘤如恶性黑色素瘤[7]、前列腺癌[8]、结肠癌[9]、胃癌[10]等被发现。有研究提出数量较少的CSCs是导致肿瘤耐药、复发及转移的根源[11]。有研究认为CSCs具有高度的横向分化的能力,其存在有可能在肿瘤血管形成的过程中发挥作用,从而为肿瘤的生长、侵袭及转移提供营养[12]。但上皮性卵巢癌肿瘤干细胞至今尚未分离鉴定[13],其在卵巢癌复发及耐药中起到的作用及其机制仍待进一步研究。
血管生成拟态(VM)为除血管外供应肿瘤营养的另一种有效方式[14],是在研究高度恶性黑色素瘤时首次发现[15],其与恶性肿瘤的侵袭、转移关系密切[16-17]。研究发现,TSCs不仅与内皮依赖性肿瘤血管新生有关[18-19],而且在VM形成中也起至关重要的作用[20]。肿瘤干细胞可能通过横向分化等机制参与VM的形成[21]。但卵巢癌TSCs是否参与VM形成并造成卵巢癌的复发及耐药仍有待进一步研究。本研究采用无血清悬浮培养法传代培养人卵巢癌SKOV3细胞,分离获得具有TCSs生物学特性的细胞球,初步探讨其在VM形成机制中的作用,为卵巢癌的诊治提供新思路。
1 材料和方法 1.1 主要试剂重组人表皮生长因子、人重组碱性成纤维生长因子(Peprotech);人重组胰岛素(中杉金桥);DMEM/F12培养基、B-27(Gibco);Matrigel胶(BD),DMEM培养液(Gibco);小鼠抗人CD133-PE、CD117-APC抗体(Abcam);HiFiScript快速去基因组cDNA第一链合成试剂盒和荧光实时定量PCR试剂盒(世纪康为);兔抗人基质金属蛋白酶2(MMP-2)单克隆抗体和兔抗人MMP-9单克隆抗体(Abcam);辣根酶标记的山羊抗兔IgG(H+L)(中杉金桥)。
1.2 方法 1.2.1 细胞培养人卵巢浆液性癌细胞株SKOV3(中国科学院上海生命科学研究院细胞资源中心)。将SKOV3细胞接种于含10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2的细胞培养箱中进行培养,2~3 d传代1次。
1.2.2 无血清悬浮培养法对SKOV3进行传代培养取生长状态良好的SKOV3细胞,制成细胞悬液,0.01 mol PBS洗涤两次后重悬于无血清培养基(含有EGF、bFGF、B27、人重组胰岛素、DMEF/F12)中,细胞密度调整至2×105/mL,置于细胞培养孵育箱中培养。为防止细胞贴壁,每隔2 h摇晃1次。隔天更换无血清培养基。拍照记录。每隔7~10 d收集悬浮的克隆球细胞,经离心、轻柔吹打分散、洗涤后,将细胞重悬于无血清培养基中,连续培养扩增。观察悬浮细胞球的生长情况并拍照记录。
1.2.3 流式细胞仪检测分选细胞中CD133、CD117阳性细胞的表达量取对数生长期的亲代SKOV3细胞及在无血清培养基中培养的第1、3、5、7代细胞,后者经胰酶消化后加入含血清培养基。分别离心,0.01 mol PBS洗涤后计数,调整细胞浓度至1×106/mL,分别加入1 μg小鼠抗人CD133-PE、CD117-APC单克隆抗体,混匀,BD FACS Aria流式细胞仪上分别进行检测。流式检测均重复3次。
1.2.4 平板克隆形成实验取对数生长期的SKOV3细胞和分选细胞,0.25%胰蛋白酶消化并吹打成单细胞,悬浮于完全培养基中备用。以100细胞/皿的密度接种于培养皿,37 ℃、5%CO2培养,培养1~2周,出现肉眼可见的克隆球时终止培养,4%福尔马林液固定,姬姆萨染色。显微镜下计数超过50个细胞的克隆数,并计算克隆形成率,克隆形成率=(克隆数/接种细胞数)×100%,实验重复3次。
1.2.5 小鼠成瘤实验将SKOV3细胞和第7代分选细胞重悬于0.5 mLPBS溶液中,密度分别配制为1×105/mL和1×103/mL细胞,各取0.2 mL接种于裸鼠的右(第7代分选细胞)、左(亲代SKOV3细胞)侧大腿皮下,两种接种浓度均较低。隔1 d观察裸鼠的一般情况及其移植瘤生长情况。接种6周后,戊巴比妥麻醉后将裸鼠固定于手术台上,暴露接种部位,剖视测量瘤体直径,比较两种细胞的成瘤率。本实验将移植瘤体积大于100 mm3视为肿瘤形成[22]。
1.2.6 三维立体培养将SKOV3细胞和分选细胞制备成单细胞悬液,细胞计数调至1×105/mL备用。24孔板做预冷处理,吸取289 μL的Matrigel基质胶均匀的铺于其上。放入37 ℃,5%CO2细胞培养箱中,使胶凝固15~30 min。将SKOV3细胞及分选细胞各1 mL分别加入孔板,置于细胞培养箱中培养。每隔30 min观察VM的形成情况,利用倒置相差显微镜随机取上、下、左、右、中心5个视野拍照记录,实验重复3次。
1.2.7 采用RT-PCR法检测MMP-2、MMP-9的基因表达由上海生工生物工程有限公司合成MMP-2、MMP-9、GAPDH基因的引物。MMP-2上游序列为5'ACCTGGATGCCGTCGGGAC3',下游序列为5'TGTGGCAGCACCAGGGCAGC3';MMP-9上游序列为5'CGCTGGGCTTAGATCATTCC3',下游序列为5'GTGCCGGATGCCATTCAC3';用Trizol提取处于对数生长期的亲代HO8910和悬浮细胞球的mRNA,并按康为世纪公司提供的HiFiScript快速去基因组cDNA第一链合成试剂盒说明书操作,逆转录得到cDNA。各取1 μL的cDNA为样本,按照SYBR Green1 25 μL的反应体系配比各试剂进行PCR扩增。每个样品设置3个副孔,利用QIAGEN Rotor-Gene Q Real Time RT-PCR System得出各待测样本的Ct值并绘制扩增动力曲线及融解曲线,并用2-ΔΔCT来表示目的RNA的相对表达量并进行统计分析。此实验重复3次。
1.2.8 采用Western blot检测分选细胞与亲代SKOV3细胞MMP-2、MMP-9蛋白表达收集两种细胞1×106/mL,提取细胞总蛋白后,采用BCA法进行蛋白定量。取蛋白各30 μg上样,10% SDS-PAGE分离蛋白后在20 V恒压、130 mA条件下将分离蛋白移至二氟乙烯膜上,封闭液封闭蛋白1 h(室温);分别加入兔抗人MMP-2单克隆抗体、兔抗人MMP-9抗体(体积稀释比例为1:500)。4 ℃过夜。次日用TTBS洗膜后,加入辣根过氧化物酶标记的二抗(体积稀释比例为1:3000),室温反应60 min。DAB显色,X胶片曝光。用Image-J软件进行条带灰度分析。内参为beta-actin antibody(兔多抗sc1616-R,1:200),目的蛋白/β-actin灰度的值做为蛋白的相对表达水平,进行半定量检测,实验重复3次,取均值。
1.3 统计学处理数据经SPSS 17.0统计软件进行处理,数值以均数±标准差表示,两独立样本的比较采用非配对的t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 采用无血清悬浮培养人卵巢癌SKOV3细胞的形态学观察将SKOV3细胞接种于无血清培养基中,大部分沉积于培养板底,并有部分呈贴壁生长,24 h左右死亡,仅小部分细胞存活呈悬浮生长。2~4 d后可见少量的悬浮细胞球形成,由3~8个细胞组成,大小一致,具有一定的折光性。5~7 d后,悬浮球细胞数量增多达数十个,体积增大,细胞间连接紧密,界限不清,折光性增强。随着细胞传代,悬浮细胞球数量不断增加,且体积不断增大(图 1)。
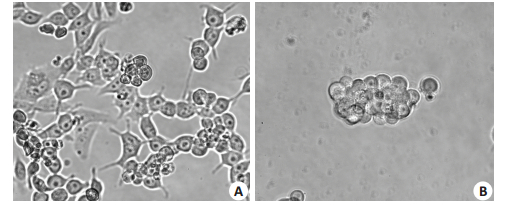
|
图 1 第1代,第7代人SKOV3细胞 Fig.1 The 1st (A) and 7th (B) generations of SKOV3 cells in serum- free medium (Serum free medium, original magnification: ×400) |
CD133阳性细胞比例在各代细胞变化很大,亲代SKOV3细胞CD133阳性细胞比例为0.25%,第1、3、5、7代分选细胞CD133阳性细胞比例分别为0.25%、40.41%、70.00%、84.69%和91.58%。亲代SKOV3细胞CD1117阳性细胞比例为0.01 %,第1、3、5、7代分选细胞CD117阳性细胞率分别为14.96%、25.14%、37.73%和49.58%,均呈显著上升趋势(图 2)。
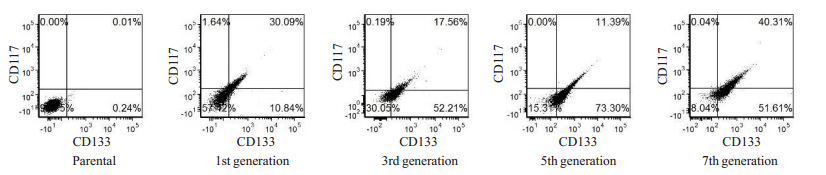
|
图 2 流式细胞仪检测每代中CD133、CD117阳性细胞的比例 Fig.2 Percentage ofCD133- andCD117-positive cells in each generation analyzed by flow cytometry |
悬浮细胞球的克隆形成率(50.33%)高于SKOV3的克隆形成率(5.33%),差异有统计学意义(P < 0.001),分选细胞与亲代SKOV3相比增殖能力更强(图 3)。
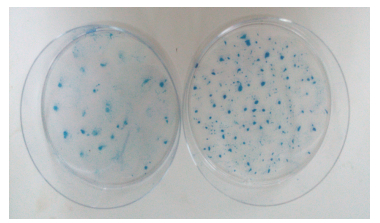
|
图 3 平板克隆形成实验 Fig.3 Plate clone formation assay |
接种分选细胞的裸鼠右侧大腿在3周左右即可观察到肿瘤生长,而接种亲代SKOV3细胞的裸鼠左侧大腿在同一时期未观察到肿瘤生长。至6周时,接种分选细胞的裸鼠右侧大腿均能见到肿瘤形成(6/6),成瘤率为100%,而接种亲代SKOV3细胞的裸鼠左侧大腿始终未见成瘤(0/6),成瘤率为0,分选细胞比亲代细胞更具成瘤能力(图 4)。
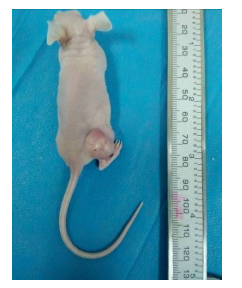
|
图 4 小鼠体内成瘤实验 Fig.4 Tumorigenesis of the sorted cells in a nude mouse |
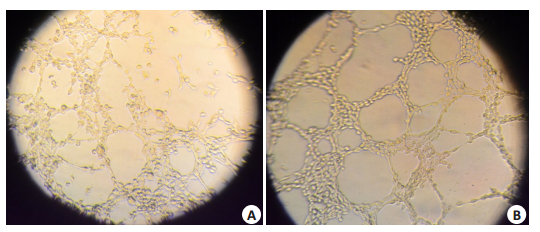
Matrigel基质胶中,分选细胞在1.5 h开始形成VM管状结构,部分细胞伸长呈长梭形,形成突起,细胞间突起彼此连接,构成网格状。此后细胞间连接逐渐增多,管道纵横交错,连接紧密,4 h后形成较为规则的网格状结构,持续时间较长,至30 h结构方开始松散凋落;而SKOV3细胞于接种后3 h才开始出现VM管状结构,部分细胞亦产生突起,但与分选细胞相比,突起数量不多。细胞间连接形成缓慢,至6 h后管状样结构达最多,但规则的网格形成不多,细胞间连接不规则(图 5)。
|
图 5 分选细胞与亲代SKOV3细胞的VM形成 Fig.5 Vasculogenic mimicry formation of the sorted cells (A) and the parental SKOV3 cells (B) |
采用RT-PCR方法检测细胞MMP-2、MMP-9的基因表达,根据熔解曲线,在基因扩增过程中没有明显的引物二聚体形成,证明引物的特异性较好;根据扩增曲线,随着循环数的增加荧光信号具有明显的对数期,且扩增曲线平滑,检测到的各目的基因RNA的Ct值为20~30,属于正常检测值范围,其值可信。经统计学分析第7代分选细胞MMP-2、MMP-9基因表达较SKOV3细胞分别增高了2倍、7.6倍。
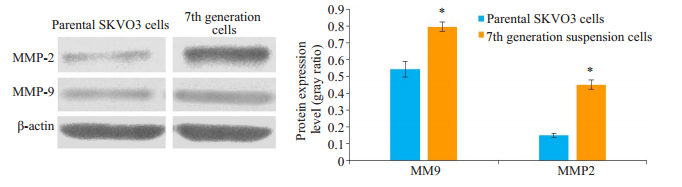
2.7 分选细胞与亲代SKOV3细胞MMP-2、MMP-9蛋白表达采用Western blot检测分选细胞与亲代SKOV3细胞MMP-2、MMP-9蛋白表达,结果显示第7代分选细胞MMP-2、MMP-9明显高于亲代SKOV3细胞,差异具有统计学意义(P < 0.05,图 6)。
|
图 6 亲代SKOV3细胞和第7代分选细胞MMP-2、MMP-9的蛋白表达 Fig.6 Expression of MMP-2 and MMP-9 in the parental SKOV3 cells and the 7th generation sorted cells. *P < 0.05 |
VM是除血管外的维持肿瘤生长的另一重要血供结构,由经塑形的肿瘤细胞及过碘酸雪夫染色阳性的细胞外基质成分共同构成,与血管结构相似,该结构的存在是抗血管生成治疗肿瘤失败的原因之一[23]。迄今为止,VM已在上皮性卵巢癌[24]、头颈部鳞状细胞癌[25]、结肠癌[26]、炎性乳腺癌[14]、肝癌[16]等多种恶性肿瘤中被发现,与肿瘤的侵袭、转移密切相关,为肿瘤的持续生长及转移提供营养支持。但关于VM形成的机制研究较少,未见在卵巢癌的相关研究中报道。CD133是最为经典的肿瘤干细胞标记分子之一[27]。本文采用无血清悬浮培养法对人卵巢癌SKOV3细胞进行分选,鉴定分选细胞生物学特性,分选出具有CSCs生物学特性的卵巢癌细胞,将其称为肿瘤干细胞样细胞。通过三维立体培养探讨CSCs与VM形成的关系,并探讨可能的机制。
无血清悬浮培养法是常用的肿瘤干细胞分选方式之一[28]。本实验通过该方法发现小部分悬浮生长的细胞随着传代培养,生长状态良好,具有自我更新、不断增殖的能力。本研究采用流式细胞术检测亲代SKOV3细胞及第1、3、5、7代细胞CD133、CD117阳性细胞比例,至第7代CD133阳性细胞比例高达91.58%,CD117阳性细胞比例为49.58%,而此两种TSCs标记物标记的阳性细胞比例在亲代SKOV3细胞中的含量极低(分别为0.25%,0.01),这表明采用无血清悬浮培养方法能够分离纯化卵巢癌SKOV3细胞中具有TSCs特征的细胞。本研究进一步对第7代分选细胞进行了生物学鉴定,克隆形成实验结果显示分选细胞与亲代SKOV3相比增殖能力更强(50.33% vs 5.33%)。小鼠体内成瘤实验显示分别采用较低的不同细胞浓度进行接种,即使分选细胞的接种浓度远低于亲代SKOV3细胞,分选细胞仍然比亲代SKOV3细胞具有更强的成瘤能力(100% vs 0)。实验结果显示分选细胞高表达肿瘤干细胞标记分子CD133及CD117,且具备肿瘤干细胞的生物学特性,即自我更新、增殖能力强。
研究表明,VM形成能力与上皮性卵巢癌的恶性度相关,生存分析发现有VM的患者生存时间较无VM的患者短[29]。三维立体培养是目前体外研究VM的重要方法[17],该培养模型能更好地模拟细胞在体内的生长环境。本实验采用三维立体培养技术比较分选细胞及亲代SKOV3细胞VM形成的能力。结果显示,分选细胞出现VM管状结构的时间较早,且达高峰时VM结构更为典型,呈规则的网格状,具备更强的可塑性。说明肿瘤干细胞样细胞可能在上皮性卵巢癌VM的形成过程中发挥作用。MMP-2和MMP-9是促进VM形成的重要介质,可诱导细胞外基质重塑,在VM形成中起至关重要的作用[30]。有研究在小鼠黑色素移植瘤血管生成拟态的研究中推测MMP2可能参与VM形成,MMP9亦与VM形成相关[31]。本研究发现,第7代分选细胞的MMP-2、MMP-9基因和蛋白表达水平显著高于亲代SKOV3细胞,推测MMP-2、MMP-9表达上调,可能使上皮性卵巢癌细胞基质发生重塑,促进VM形成,进而导致细胞间黏附力下降,细胞间连接变得疏松,从而增强肿瘤侵袭转移的能力。
综上所述,采用无血清悬浮培养的分选细胞具有TSCs的生物学特性,是一种具有较高VM形成能力的细胞亚群,MMP-2、MMP-9可能通过诱导细胞外基质重塑参与上皮性卵巢癌肿瘤干细胞样细胞VM形成。通过对上皮性卵巢癌干细胞样细胞在VM形成机制的作用进行深入研究,可能会为上皮性卵巢癌的靶向治疗提供新的研究方向,同时为上皮性卵巢癌化疗耐药的机制的研究提供新思路。
| [1] |
Siesto G, Cavina R, Romano FA. Primary debulking surgery versus neoadjuvant chemotherapy in advanced epithelial ovarian cancer: a propensity-matched analysis[J]. AmJ Clin Oncol, 2018, 41(3): 280-5. |
| [2] |
Verdoodt F, Kjaer SK, Dehlendorff CA. Aspirin use and ovarian cancer mortality in a danish nationwide cohort study[J]. Br J Cancer, 2018, 118(4): 611-5. DOI:10.1038/bjc.2017.449 |
| [3] |
Hu H, Huang GH, Wang HB, et al. Inhibition effect of triptolide on human epithelial ovarian cancer via adjusting cellular immunity and angiogenesis[J]. Oncol Rep, 2018, 39(3): 1191-6. |
| [4] |
Rice Ms, Prist PM, Winter AC, et al. Migraine and invasive epithelial ovarian cancer risk in the nurses' health study Ⅱ and the women's health study[J]. Intern J Cancer, 2018, 142(3): 534-9. DOI:10.1002/ijc.31062 |
| [5] |
Manousakidi S, Guillaume A, Pirou CA, et al. FGF1 induces resistance to chemotherapy in ovarian granulosa tumor cells through regulation of p53 mitochondrial localization[J]. Oncogenesis, 2018, 7(2): 13-8. DOI:10.1038/s41389-017-0012-8 |
| [6] |
Li SS, Ma J, Wong A. Chemoresistance in ovarian cancer: exploiting cancerstem cell metabolism[J]. J Gynecol Oncol, 2018, 29(2): e32-43. DOI:10.3802/jgo.2018.29.e32 |
| [7] |
Al DR, Sartelet H, Powell J, et al. Expression of CD133 + cancer stemcells in childhood malignant melanoma and its correlation with metastasis[J]. Mod Pathol, 2010, 23(3): 376-80. DOI:10.1038/modpathol.2009.163 |
| [8] |
Song XL, Huang B, Zhou BW. miR-1301-3p promotes prostate cancer stem cellexpansion by targeting SFRP1 and GSK3β[J]. Biomed Pharmacoth, 2018, 99(4): 369-74. |
| [9] |
Nagata H, Ishihara S, Kishikawa J, et al. CD133 expression predicts post-operative recurrence in patients with colon cancer with peritoneal metastasis[J]. Int J Oncol, 2018, 52(3): 721-32. |
| [10] |
Yang W, Zhang H, Xin L. A novel design of HA-coated nanoparticlesco- encapsulating plasmid METase and 5-Fu shows enhanced application intargeting gastric cancer stem cells[J]. Biol Chem, 2018, 399(3): 293-303. DOI:10.1515/hsz-2017-0208 |
| [11] |
Marx J. Cancer research: mutant stem cells may seed cancer[J]. Clin Oncol, 2003, 301(5638): 1308-10. |
| [12] |
Monzani E, La Porta CA. Targeting cancer stem cells to modulate alternative vascularization mechanisms[J]. Stem Cell Rev, 2008, 4(1): 51-6. DOI:10.1007/s12015-008-9009-1 |
| [13] |
Flesken-Nikitin A, Hwang CI, Cheng C, et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche[J]. Nature, 2013, 495(7440): 241-5. DOI:10.1038/nature11979 |
| [14] |
Camorani S, Crescenzi E, Gramanzini MA, et al. Aptamer-mediated impairment of EGFR-integrin alpha v beta 3 complex inhibits vasculogenic mimicry and growth of triple-negative breast cancers[J]. Sci Rep, 2017, 7(32): 44659-6654. |
| [15] |
Maniotis AJ, Folberg R, Hess A, et al. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry[J]. AmJ Pathol, 1999, 155(3): 739-52. DOI:10.1016/S0002-9440(10)65173-5 |
| [16] |
Qu B, Sheng GA, Guo L, et al. MIG7 is involved in vasculogenic mimicry formation rendering invasion and metastasis in hepatocellular carcinoma[J]. Oncol Rep, 2018, 39(2): 679-86. |
| [17] |
Han GS, Li YA, Cao YQ, et al. Overexpression of leptin receptor in human glioblastoma: correlation with vasculogenic mimicry and poor prognosis[J]. Oncotarget, 2017, 8(35): 58163-71. |
| [18] |
Sun HM, Jia J, Wang XL, et al. CD44(+)/CD24(-) breast cancer cells isolated from MCF-7 cultures exhibit enhanced angiogenic properties[J]. Clin Transl Oncol, 2013, 15(1): 46-54. DOI:10.1007/s12094-012-0891-2 |
| [19] |
Brossa A, Grange C, Mancuso L, et al. Sunitinib but not VEGF blockade inhibits cancer stem cell endothelial differentiation[J]. Oncotarget, 2015, 6(13): 11295-309. |
| [20] |
Wang SS, Gao XL, Liu X, et al. CD133(+) cancer stem- like cells promote migration and invasion of salivary adenoid cystic carcinoma by inducing vasculogenic mimicry formation[J]. Oncotarget, 2016, 7(20): 29051-62. |
| [21] |
Fan YL, Zheng M, Tang YL, et al. Anew perspective of vasculogenic mimicry: EMTand cancer stem cells (review)[J]. Oncol Lett, 2013, 6(5): 1174-80. DOI:10.3892/ol.2013.1555 |
| [22] |
吴小华, 张彩虹, 曹琴英, 等. 顺铂低剂量节拍化疗对荷人卵巢癌裸鼠及其移植瘤生长的影响[J]. 肿瘤, 2015, 35(1): 31-7. |
| [23] |
Song Y, Mu L, Han X, et al. siRNA targeting stathmin inhibits invasion and enhances chemotherapy sensitibity of stem cells derived from glioma cell lines[J]. Acta Biochim Biophys Sin, 2014, 46(12): 1034-40. DOI:10.1093/abbs/gmu099 |
| [24] |
Yu L, Zhu B, Wu SW, et al. Evaluation of the correlation of vasculogenic mimicry, ALDH1, KiSS-1, and MACC1 in the prediction of metastasis and prognosis in ovarian carcinoma[J]. Diagn Pathol, 2017, 12(1): 23-32. DOI:10.1186/s13000-017-0612-9 |
| [25] |
Hu A, Huang JJ, Jin XJ, et al. Curcumin suppresses invasiveness and vasculogenic mimicry of squamous cell carcinoma of the larynx through the inhibition of JAK-2/STAT-3 signaling pathway[J]. Am J Cancer Res, 2015, 5(1): 278-88. |
| [26] |
Zhu B, Zhou L, Yu L, et al. Evaluation of the correlation of vasculogenic mimicry, ALDH1, KAI1 and microvessel density in the prediction of metastasis and prognosis in colorectal carcinoma[J]. BMCSurg, 2017, 17(1): 47-59. |
| [27] |
Qiu ZX, Zhao S, Mo XM, et al. Overexpression of PROM1 (CD133) confers poor prognosis in non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2015, 8(6): 6589-95. |
| [28] |
Gedye C, Ailles L. Isolation and characterization of cancer stem cells in vitro[J]. Methods Mol Biol, 2013, 946(3): 181-204. |
| [29] |
高燕, 赵秀兰, 古强, 等. 卵巢癌组织中血管生成拟态观测及其与临床病理特征和预后的关系[J]. 中华病理学杂志, 2009, 38(9): 585-9. DOI:10.3760/cma.j.issn.0529-5807.2009.09.003 |
| [30] |
Guo JQ, Zheng QH, Chen H, et al. Ginsenoside Rg3 inhibition of vasculogenic mimicry in pancreatic cancer through downregulation of VE cadherin/EphA2/MMP9/MMP2 expression[J]. Int J Oncol, 2014, 45(3): 1065-72. DOI:10.3892/ijo.2014.2500 |
| [31] |
张凡, 赵秀兰, 刘易欣, 等. 小鼠黑色素移植瘤血管生成拟态CD31、MMP2、MMP9、Cathepsin D的表达[J]. 临床与实验病理学杂志, 2006, 22(5): 595-600. DOI:10.3969/j.issn.1001-7399.2006.05.021 |
 2019, Vol. 39
2019, Vol. 39
