现代辅助生殖技术的广泛开展,能使99%的男性不育患者成为生物学父亲[1]。但对于成熟阻滞型的非梗阻性无精子症的不育男性患者,由于难以获得成熟精子,一般釆用供精授精[2-3]。近些年研究发现众多基因参与精子的发生过程[4-5],这些基因表达的异常都有可能导致精子成熟阻滞,针对成熟阻滞的发生机制和治疗策略进行研究引起了人们的关注[6-7]。目前对精子发生及其分子机制尚不清楚,研究尚处在起始阶段,还不能针对其特殊靶位或信号通路进行针对性治疗。因此,寻找精子成熟阻滞潜在的治疗靶点引起了各位研究人员的极大兴趣。
蛋白质组学技术可以发现疾病特异性的靶点和标记物,可以提供广泛的诊断及预后信息。近年来,相对和绝对定量的等量异位标签(iTRAQ)多重标记-串联质谱技术发展迅速。本研究在前期运用iTRAQ技术筛选发现CEP55蛋白为成熟阻滞组及生精正常组患者的睾丸组织表达差异蛋白质,并且对CEP55蛋白进行验证。目前尚未有研究进行相关报道,现报道如下。
1 资料和方法 1.1 研究对象选取2017年1月1日~12月31日在南方医科大学南方医院妇产科生殖中心就诊的无精子症男性不育症患者,其精液常规依据WHO《人类精液检查与处理实验室手册》(第5版)提供的方法和标准,均经过3次检查未发现任何精子。根据其睾丸病理切片诊断分为:成熟阻滞组,患者睾丸病理切片诊断为精子成熟阻滞;生精正常组,患者睾丸病理切片诊断为生精功能大致正常。两组各纳入3名,研究对象均为无精子症患者,需要常规进行睾丸活体组织检查,研究的睾丸组织为活检后废弃的睾丸组织标本。本研究通过南方医科大学南方医院伦理委员会审查,审批编号:NFEC-2017-102,收集样本对象均已签署知情同意书。
1.2 获取睾丸组织患者取仰卧位,常规消毒铺无菌巾,麻醉成功后,固定睾丸及附睾,12号粗针头穿刺一侧睾丸,负压抽吸,取出曲细精管,大小如绿豆,检查后无明显出血加压包扎。睾丸组织放入冻存管后置于液氮中保存备用。
1.3 蛋白提取、定量收集睾丸组织,加入Disolution buffer,吸取裂解液,根据M-PER®Mammalian蛋白抽提试剂说明书抽提细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。
1.4 iTRAQ标记及检测按照iTRAQ试剂盒说明书方法,取细胞蛋白各100 μg,加入变性试剂1μL和还原试剂2 μL,60 ℃反应1 h;再加入半胱氨酸封闭试剂1 μL室温封闭10 min,之后按样品:蛋白酶质量比5:1比例加入蛋白酶,37 ℃恒温摇匀过夜,收集酶解肽段。iTRAQ试剂100 μL中加入乙醇70μL,将将前面收集的酶解肽段加到里面用振荡器振荡1 min,将内容物离心至管底部,收集管底沉淀。两组睾丸组织分别加入对应的iTRAQ标签分子,成熟阻滞组对应稳定碘同位素114标签,生精正常组对应稳定碘同位素115标签,混合iTRAQ试剂标记的蛋白,加入同一试管后室温反应1 h;每管加入超纯水10 μL,室温反应10 min,终止反应。将混合后样品加入iTRAQ试剂盒中的脱盐柱,用脱盐柱对样品进行脱盐处理,真空浓缩仪浓缩成冻干样品,置于-20 ℃冰箱中保存备用。本检测由上海康成生物工程有限公司进行。
1.5 LC/MS/MS分析 1.5.1 强阳离子交换Buffer A液含10 mmol/L KH2PO4和25%ACN,pH3.0;Buffer B液含10 mmol/L KH2PO4、350 mmol/L KCl和25%CAN,pH3.0。将冻干样品溶解于80μLBufferA液并全部上样,紫外检测波长为214 nm/ 280 nm,流速为200μL/min,进行线性梯度洗脱。根据峰形和时间共收取20个梯度,真空离心浓缩后,每馏分用50μL反相液相色谱的A相溶解,进样量20μL。
1.5.2 反相液相色谱分离Solvent A液为0.1%TFA和25% ACN,Solvent B液为0.1% TFA和95% ACN。RPLC柱线性梯度洗脱。
1.5.3 质谱鉴定采用4800 Plus MALDI TOF/TOF蛋白质分析仪(Applied Biosystems,美国)进行多肽的串联质谱鉴定和相对定量分析。MS扫描范围400~1800 u,一个谱图选择4个最强的母离子进行串级扫描,MS/MS扫描范围100~2000 u。检测模式为正离子模式,离子喷雾电压保持在2.0 kV,信息为基础的获取模式下得到iTRAQ标记样品的质谱。本分析由上海康成生物工程有限公司进行。
1.6 生物信息学分析将得到的质谱图通过ProteinPilot3.0软件检索SwissProt数据库,种属选择为人,根据软件对鉴定到的蛋白质打分,软件依据同位素报告基团的相对含量进行蛋白质定量。当蛋白在成熟阻滞组中的表达水平与在生精正常组中的表达水平有差异,且P < 0.05时为差异显著,选择差异显著的结果报告。使用Cluster3.0软件进行分层聚类分析蛋白的表达模式。所得串级质谱数据通过DAVID Bioinformatics Resources 6.7软件对上调和下调的蛋白进行生物信息学分析,分别从生物学进程、细胞成分和分子功能3方面进行基因显著性分析。通过数据库PANTHER(www.pantherdb.org)进行检索、分类,初步探究鉴定到的差异表达蛋白的亚细胞定位情况、发挥的生物学功能和参与的细胞进程。本分析由上海康成生物工程有限公司进行。
1.7 Western blot将两组睾丸组织蛋白分别上样,20 μg/孔,进行配胶8% SDS-PAGE,将电泳分离后的蛋白电转移至硝酸纤维素膜上。以5%脱脂牛奶室温封闭2 h,加入1:200稀释的鼠抗人CEP55单克隆抗体,于4 ℃反应过夜。PBST洗膜3次,加入1:4000稀释的羊抗兔IgG二抗,置于摇床室温反应2 h,PBST洗膜3次;采用Super SignalWestern blot Kit化学发光底物发光,胶片曝光、显影和定影。
1.8 实时定量基因扩增荧光检测系统TRIzol试剂提取细胞总RNA,根据Prime Script RT Reagent Kit和SYBR Premix ExTaqTM II试剂盒说明书,反转录成cDNA,并以此cDNA为模板在7500 Real- Time PCR仪进行PCR扩增,以GAPDH作为内参照,CEP55的引物序列
F:5-TTGGAACAACAGATGCAGGC-3
R:5-GAGTGCAGCAGTGGGACTTT-3。
1.9 精原细胞培养小鼠GC-1 spg细胞,置于37 ℃、饱和湿度、5% CO2培养箱中培养,培养液为DMEM/高糖+10%FBS+1.0 mmol丙酮酸钠+1×双抗(100 U/mL青霉素+0.1 mg/ mL链霉素)。
1.10 CEP55 siRNA的合成及转染根据CEP55基因字GenBank中的序列设计相对应的2对siRNA,同时合成阴性对照siRNA。
干扰片段1:5-CACCUAAGGUCAAGAUAUATT-3
干扰片段2:5-UAUAUCUUGACCUUAGGUGT T-3
阴性对照:5-UUUUCCGAACGUGUCACGUTT-3
转染操作按LipofectamineTM 2000试剂说明书进行,分为空白对照组、阴性对照组及siRNA转染组。
1.11 体外细胞增殖能力(CCK8实验)收集空白对照组、阴性对照组及siRNA转染组细胞分别消化,计数,取2000细胞加入96孔板内,培养箱培养。培养后加入10 μL CCK-8试剂,然后继续培养4 h。最后上机酶标仪检测吸光值A450nm。
1.12 统计学方法应用SPSS13.0进行数据处理,各组数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 临床情况比较成熟阻滞组3例,年龄26.4±3.3岁,双睾丸大小约13.0±1.7 mL,FSH水平为6.0±0.3 mU/L,LH水平5.0± 1.0 mU/L,T水平为3.5±1.5 ng/L,INHB水平为145.8± 50.1 pg/mL,染色体均正常。
生精正常组3例,年龄25.8±2.9岁,双睾丸大小约11.3±1.2 mL,FSH水平为4.8±2.8 mU/L,LH水平6.0± 3.1 mU/L,T水平为5.1±2.1 ng/L,INHB水平为143.8± 16.9 pg/mL,染色体均正常。
两组在年龄、睾丸体积等方面差异无统计学意义,成熟阻滞组较生精正常组,FSH水平高,但是差异无统计学意义(P > 0.05,表 1)。
| 表 1 两组之间临床情况比较 Tab.1 Comparison of clinical data between the two groups of patients (n=3) |
通过iTRAQ核素标记结合LC/MS/MS分析,共鉴定出差异蛋白共四百余个,其中差异显著的蛋白有27个,其中CEP55蛋白在基因表达水平差异最显著(表 2)。
| 表 2 两组之间差异蛋白的iTRAQ分析 Tab.2 iTRAQ analysis of differentially expressed proteins between the two groups of patients |
这些以结合蛋白、催化活性、生长发育和氧化还原酶蛋白为主,利用PANTHER软件将这些蛋白分类,分类结果见图 1。
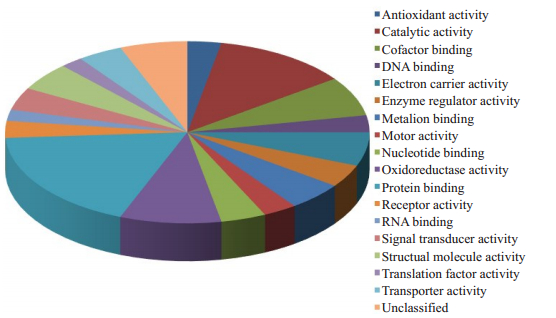
|
图 1 差异蛋白分析 Fig.1 Analysis of differentially expressed proteins |
采用Western blot、qPCR分别对两组睾丸组织进行CEP55含量鉴定,结果显示CEP55的蛋白含量和mRNA表达量在生精正常组高于成熟阻滞组(图 2)。
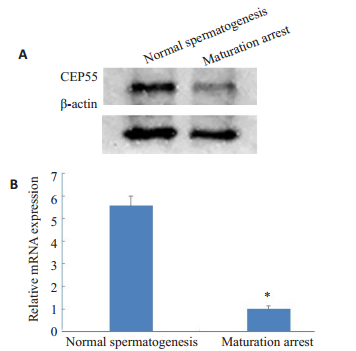
|
图 2 蛋白质印迹法(A)和实时荧光定量PCR法(B)检测CEP55的表达 Fig.2 Expressions of CEP55 in the testicular tissues of the patients detected by Western blotting (A) and real-time fluorescent quantitative PCR(B). *P < 0.05 vs maturation arrest |
Western blot结果显示,siRNA转染组CEP55蛋白的相对表达水平明显低于空白对照组和阴性对照组(图 3A)。qPCR结果显示,siRNA转染组CEP55的mRNA表达量低于空白对照组和阴性对照组(P < 0.05,图 3B)。
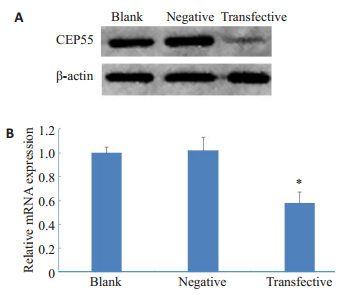
|
图 3 蛋白质印迹法(A)和实时荧光定量PCR法(B)检测转染后CEP55的表达 Fig.3 Expressions of CEP55 in the transfected mouse spermatogonia detected by Western blotting (A) and real-time fluorescent quantitative PCR (B). *P < 0.05 vs blank and negative controls |
CCK8实验结果显示,在相同的初始条件下,各组细胞增殖速度相近,但48 h后siRNA转染组细胞增殖速度减慢,空白对照组与阴性对照组细胞增殖速度相近(图 4)。
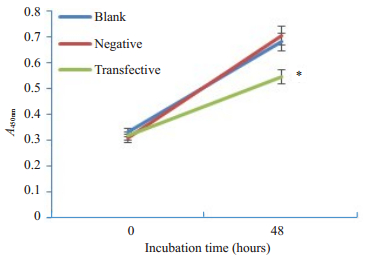
|
图 4 CCK-8法检测CEP55 siRNA对小鼠精原细胞体外增殖的影响 Fig.4 Effect of CEP55 siRNA on the proliferation of mouse spermatogonia in vitro assessed using CCK8 method. *P < 0.05 vs blank and negative controls |
不孕不育症约50%是由于男方因素造成的,其中非梗阻性无精子症是其中严重的生精障碍性疾病[8-10]。成熟阻滞是非梗阻性无精子症的一种病理类型,由于成熟阻滞患者的睾丸组织中获取成熟精子,则只能借助供精等方式来生育下一代[11-13]。因此,促进生精功能,提高取精率是治疗成熟阻滞的关键[14]。从蛋白质组水平进行研究是目前研究的重要趋势[15]。基于高度敏感性和精确性的串联质谱分析进行蛋白质定量的相关标记技术发展迅速,iTRAQ多重标记-串联质谱技术正是这些新进展中的一大主力,与其他蛋白质组学研究技术或同位素标记技术相比,iTRAQ技术具有众多优点[16-18]。
运用iTRAQ技术发现CEP55蛋白为成熟阻滞组及生精正常组患者的睾丸组织表达差异的蛋白质。本实验设计合成2对针对CEP55基因不同位点的siRNA序列,脂质体介导转染入小鼠精原细胞中,PCR和Western blot检测结果显示,两对siRNA在小鼠精原细胞对CEP55 mRNA和蛋白的表达均有不同程度的抑制作用。CCK8实验结果显示,转染siRNA组的增殖能力明显下降,说明在小鼠精原细胞中抑制CEP55基因的表达可抑制细胞的增殖能力。由此我们推测CEP55可能在精子发生过程中起到关键作用,CEP55可能成为治疗成熟阻滞型非梗阻无精子症的分子靶标。CEP55蛋白,又被称为FLJ10540、C10orf3、URCC6等[19],细胞间桥是生殖细胞生精功能中的特点,可以使细胞停滞在胞质分裂的最后一步[20]。CEP55可与微管聚集相关蛋白CG-NAP和Kendrin相互作用而参与纺锤体的装配,在纺锤体装配、极化、分离及胞质分裂中有重要调控作用,对于完成胞质分裂的过程和中间体的完整性都是至关重要[21]。断裂是细胞分裂的最后一步,由ESCRT机制调节,而CEP55则是ESCRT机制一部分[22],是胞质分裂所必需[23]。CEP55表达水平的降低可导致多核细胞中期纺锤体异常,并且许多细胞停滞于中间体阶段,胞质分裂失败[24-25]。本研究推测,通过使CEP55表达升高有可能使细胞不出现阻滞过程,从而使成熟阻滞的过程恢复,促进成熟精子生成。研究人员也相继在动物模型中验证并发现CEP55可能发挥的作用机制。通过检测牛的SNP单核苷酸序列发现CEP55影响雌性减数分裂重组率[26]。CEP55通过促进Akt稳定调节斑马鱼胚胎的生长发育[27]。FAK-Src信号通路能减慢PLK1降解和CEP55积累[28]。
本研究的差异蛋白质谱共鉴定出27个显著差异表达蛋白,CEP55是最高差异表达,因此首先选择CEP55做进一步分析,但是在功能和细胞信号通路方面尚且未知。目前有研究认为,CEP55表达增加,能够通过激活PI3K/Akt信号通路抑制Foxo1核保留使小鼠出现不育[29]。还有相关的信号通路如PI3K/AKT/mTOR通路[25],JAK2-STAT3-MMPs通路[30],PI3K/Akt/p21通路[31]等等。因此,CEP55在功能和细胞信号通路方面的机制研究是未来的研究方向,本实验下一步将对CEP55如何作用于精子发生过程进行深入探讨。
本研究也存在不足之处,精子发生过程的4个阶段有众多基因的参与,这些基因表达的异常都有可能导致精子生成障碍,成熟阻滞。但是目前尚未有理想的细胞能完成4个阶段的变化,因此本研究选择精原细胞进行CEP55的基因表达。与人类睾丸精原细胞相比较,采用小鼠精原细胞之间可能存在同源基因差异,由于人类睾丸精原细胞研究受到伦理方面的制约,本研究选择小鼠细胞进行研究。
综上所述,CEP55可能在精子发生过程中起到关键作用,CEP55可能是治疗成熟阻滞型非梗阻无精子症的分子靶标。
| [1] |
禇庆军. 男性不育症的ART治疗策略及展望[J]. 广东医学, 2010, 31(19): 2483-5. DOI:10.3969/j.issn.1001-9448.2010.19.005 |
| [2] |
Meyer JM, Maetz JL, RumplerY. Cellular relationship impairment in maturation arrest of human spermatogenesis: an ultrastructural study[J]. Histopathology, 1992, 21(1): 25-33. |
| [3] |
Hung AJ, King P, Schlegel PN. Uniform testicular maturation arrest: a unique subset of men with nonobstructive azoospermia[J]. J Urol, 2007, 178(2): 608-12. DOI:10.1016/j.juro.2007.03.125 |
| [4] |
Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges[J]. Nat Med, 2008, 14(11, S): 1197-213. DOI:10.1038/nm.f.1895 |
| [5] |
Minai-Tehrani A, Jafarzadeh N, Gilany K. Metabolomics: a state-ofthe- art technology for better understanding of male infertility[J]. Andrologia, 2016, 48(6): 609-16. DOI:10.1111/and.12496 |
| [6] |
Li LJ, Zhang FB, Liu SY, et al. Decreased expression of SAM68 in human testes with spermatogenic defects[J]. Fertil Steril, 2014, 102(1): 61-73. DOI:10.1016/j.fertnstert.2014.03.036 |
| [7] |
Malcher A, Rozwadowska N, Stokowy TA, et al. Potential biomarkers of nonobstructive azoospermia identified in microarray gene expression analysis[J]. Fertil Steril, 2013, 100(6): 1686-99. DOI:10.1016/j.fertnstert.2013.07.1999 |
| [8] |
Zhu YT, Hua R, Zhou Y, et al. Chronic exposure to mono-(2- ethylhexyl)- phthalate causes endocrine disruption and reproductive dysfunction in zebrafish[J]. Environ Toxicol Chem, 2016, 35(8): 2117-24. DOI:10.1002/etc.3369 |
| [9] |
Hua R, Zhou Y, Wu B, et al. Urinary triclosan concentrations and early outcomes of in vitro fertilization-embryo transfer[J]. Reproduction, 2017, 153(3): 319-25. DOI:10.1530/REP-16-0501 |
| [10] |
Zhu YT, Luo C, Li Y, et al. Differences and similarities between extremely severe oligozoospermia and cryptozoospermia in intracytoplasmic sperm injection[J]. Asian J Androl, 2016, 18(6): 904-7. |
| [11] |
Lei B, Xing R, Zhou X, et al. Neutral alpha- 1, 4- glucosidase and fructose levels contribute to discriminating obstructive and nonobstructive azoospermia in Chinese men with azoospermia[J]. Andrologia, 2016, 48(6): 670-5. DOI:10.1111/and.12498 |
| [12] |
Jaiswal D, Trivedi S, Agrawal NK, et al. Dysregulation of apoptotic pathway candidate genes and proteins in infertile azoospermia patients[J]. Fertil Steril, 2015, 104(3): 736-43. DOI:10.1016/j.fertnstert.2015.05.029 |
| [13] |
Hussein A. Evaluation of diagnostic testis biopsy and the repetition of testicular sperm extraction surgeries in infertility patients[J]. Fertil Steril, 2013, 100(1): 88-93. DOI:10.1016/j.fertnstert.2013.03.022 |
| [14] |
Bernie AM, Shah K, Halpern JA, et al. Outcomes of microdissection testicular sperm extraction in men with nonobstructive azoospermia due to maturation arrest[J]. Fertil Steril, 2015, 104(3): 569-82. DOI:10.1016/j.fertnstert.2015.05.037 |
| [15] |
Li F, Chen DN, He CW, et al. Identification of urinary Gc-globulin as a novel biomarker for bladder cancer by two-dimensional fluorescent differential gel electrophoresis (2D-DIGE)[J]. J Proteomics, 2012, 77(3): 225-36. |
| [16] |
Evans C, Noirel J, Ow SY, et al. An insight into iTRAQ: where do we stand now[J]. Anal Bioanal Chem, 2012, 404(4): 1011-27. DOI:10.1007/s00216-012-5918-6 |
| [17] |
王春燕, 聂庆文, 周璇, 等. S100A4:潜在抑制膀胱癌干细胞的靶分子[J]. 南方医科大学学报, 2017, 37(7): 869-74. DOI:10.3969/j.issn.1673-4254.2017.07.03 |
| [18] |
王春燕, 周璇, 聂庆文, 等. RIPK1是抑制膀胱肿瘤干细胞的潜在分子靶标[J]. 肿瘤, 2017, 37(12): 1243-51. DOI:10.3781/j.issn.1000-7431.2017.11.569 |
| [19] |
Hauptman N, Skok DJ, Spasovska EA, et al. Genes CEP55, FOXD3, FOXF2, GNAO1, GRIA4, and KCNA5 as potential diagnostic biomarkers in colorectal cancer[J]. BMC Med Genomics, 2019, 12(1): 54-67. DOI:10.1186/s12920-019-0501-z |
| [20] |
Kim HJ, Yoon J, Matsuura A, et al. Structural and biochemical insights into the role of testis-expressed gene 14 (TEX14) in forming the stable intercellular bridges of germ cells[J]. Proc Natl Acad Sci USA, 2015, 112(40): 12372-7. DOI:10.1073/pnas.1418606112 |
| [21] |
Xu ZY, Ma XS, Qi ST, et al. Cep55 regulates spindle organization and cell cycle progression in meiotic oocyte[J]. Sci Rep, 2015, 5(10): 16978-90. |
| [22] |
Agromayor M, Martin-Serrano J. Knowing when to cut and run: mechanisms that control cytokinetic abscission[J]. Trends Cell Biol, 2013, 23(9): 433-41. DOI:10.1016/j.tcb.2013.04.006 |
| [23] |
Doxsey SJ. Molecular links between centrosome and midbody[J]. Mol Cell, 2005, 20(2): 170-2. DOI:10.1016/j.molcel.2005.10.010 |
| [24] |
Rawlins LE, Jones H, Wenger O, et al. An amish founder variant consolidates disruption of CEP55 as a cause of hydranencephaly and renal dysplasia[J]. Eur J Hum Genet, 2019, 27(4): 657-62. DOI:10.1038/s41431-018-0306-0 |
| [25] |
Chen H, Zhu D, Zheng Z, et al. CEP55 promotes epithelialmesenchymal transition in renal cell carcinoma through PI3K/AKT/ mTOR pathway[J]. Clin Transl Oncol, 2019, 21(7): 939-49. DOI:10.1007/s12094-018-02012-8 |
| [26] |
Ma L, O'connell JR, Vanraden PM, et al. Cattle Sex-specific recombination and genetic control from a large pedigree analysis[J]. PLoS Genet, 2015, 11(11): e1005387-98. DOI:10.1371/journal.pgen.1005387 |
| [27] |
Jeffery J, Neyt C, MooreW, et al. Cep55 regulates embryonic growth and development by promoting Akt stability in zebrafish[J]. FASEB J, 2015, 29(5): 1999-2009. DOI:10.1096/fj.14-265090 |
| [28] |
Kamranvar SA, Gupta DK, Huang Y, et al. Integrin signaling via FAK-Src controls cytokinetic abscission by decelerating PLK1 degradation and subsequent recruitment of CEP55 at the midbody[J]. Oncotarget, 2016, 7(21): 30820-30. |
| [29] |
Sinha D, Kalimutho M, Bowles J, et al. Cep55 overexpression causes male-specific sterility in mice by suppressing Foxo1 nuclear retention through sustained activation of PI3K/Akt signaling[J]. FASEB J, 2018, 32(9): 4984-99. DOI:10.1096/fj.201701096RR |
| [30] |
Li MJ, Gao J, Li DF, et al. CEP55 promotes cell motility via JAK2- STAT3-MMPs cascade in hepatocellular carcinoma[J]. Cells, 2018, 7(8): 1265-78. |
| [31] |
Li F, Jin D, Tang CX, et al. CEP55 promotes cell proliferation and inhibits apoptosis via the PI3K/Akt/p21 signaling pathway in human glioma U251 cells[J]. Oncol Lett, 2018, 15(4): 4789-96. |
 2019, Vol. 39
2019, Vol. 39

