2. 蚌埠医学院临床医学部, 安徽 蚌埠 233030
2. Department of Clinical Medicine, Bengbu Medical College, Bengbu 233030, China
胃癌是消化系统最为常见的恶性肿瘤之一,以中国和日本尤为高发[1]。2018年《全球癌症报告》显示世界范围内胃癌的发病率约为百万分之5.7,但却构成癌性致死比例的百分之8.2,紧随肺癌位列第二[2]。在我国,胃癌长期以来是居民恶性肿瘤的高发类型[3-4]。近年来以手术为主的综合治疗使得实体瘤的治疗水平得到了显著提升,但胃癌的高死亡率问题仍然未得到显著改善[5]。主要原因包括[6-8]:胃癌早期缺乏典型的临床症状,部分临床表现与同样高发的胃炎、胃溃疡高度重合;胃器官血管及淋巴组织丰度,易发生早期转移;胃组织解剖毗邻复杂,使得其局部侵犯形式多样也增加了其R0切除的难度。此外,发病机制及病理生理过程不完全明确是限制胃癌临床治疗水平提高的根本因素[9-10]。分子病理学水平的研究有望为胃癌的发病机制和临床诊疗提供参考[11]。腺苷酸环化酶相关蛋白(CAP)最早于酵母的研究中被发现,在腺苷酸环化酶协同调节细胞信号转导中发挥关键作用[12]。CAP1在人体中有广泛的分布,而CAP2的表达则主要限于骨骼肌和心肌等[13]。但新近的研究却显示CAP2在恶性黑色素瘤[14],乳腺癌[15]和肝细胞性肝癌[16-17]中呈现高表达,且其表达量与患者预后不良密切相关。CAP2在肿瘤组织中的异常分布提示其可能参与恶性肿瘤的发生或发展。
目前胃癌的发病机制并不清楚,可能涉及到复杂的病理生理及分子信号调控过程,这是阻碍胃癌治疗水平根本性提高的重要因素;此外,临床上缺乏较为实用、便捷的预后评估客观指标。因此,本研究分析CAP2在胃癌组织中的表达情况,并进一步分析其对手术远期预后的评估价值,有望为探索胃癌的病理生理提供线索,为胃癌的手术预后判断提供备选指标。
1 资料和方法 1.1 一般资料纳入2010年1月~2013年11月在我院接受胃癌根治术的患者。纳入标准:所有患者均经临床及病理检查明确诊断为原发性胃癌;成功施行胃癌根治术,并依据手术探查及术后病理证实为R0切除;术前均未接受过放疗或化疗。排除标准:患者合并其他组织起源的恶性肿瘤;患者资料缺失或不完整;患者死于胃癌以外的其他因素。依据纳入及排除标准入选并采集患者如下3种疾病相关资料:(1)住院期间临床资料:通过永久保存的电子病历系统采集性别、年龄、肿瘤临床分期、手术病理诊断、术前肿瘤标志物指标[癌胚抗原(CEA)及糖抗原19-9(CA19-9)]等;(2)生存资料:通过电话随访采集患者术后生存情况,确定术后5年肿瘤相关性死亡是否发生及时间;(3)手术病理蜡块:调取癌组织及癌旁组织蜡块,并进行CAP2免疫组织化学染色。最终纳入分析患者数量为105例。该研究通过伦理委员会批准。
1.2 诊断及标准胃癌的最终诊断依据手术标本病理检查结果,临床诊断及病理学诊断标准参照美国肿瘤联合会及国际抗癌联盟制定的第7版胃癌诊断及分期系统[18]。
1.3 检测及评估CA19-9及CEA的检测由我院检验科采用化学发光法完成,CA19-9的阳性阈值为≥37 000 U/L,CEA的阳性阈值为≥5 μg/L[11]。CAP2及Ki67在胃癌组织中的表达及细胞定位采用免疫组织化学法评估:手术标本采用10%的中性甲醛固定,经脱水后石蜡包埋,制作4 μm厚度连续切片,60 ℃烘干及脱蜡后标记CAP2(兔抗人多克隆抗体;1:200;Abcam;ab236590)或Ki67(兔抗人多克隆抗体;1:400;Abcam;ab15580),复染苏木精后脱水、封片[12]。CAP2的半定量评估基于免疫组化染色结果的积分光密度(IOD)分析:由两位研究者独立对切片进行分析,于200倍光镜下取每张切片的5个不重复视野,采用Image-Pro Plus6.0软件计算目标蛋白CAP2的IOD值,取平均值作为单张切片的最终结果,并以癌旁组织CAP2的IOD值为基线,分别计算癌组织和癌旁组织的相对IOD值用于统计分析[19]。
1.4 随访采用电话回访的方式对患者进行随访,采集患者是否因胃癌死亡及死亡时间。随访时间截止到2018年11月。
1.5 观察指标采用免疫组化法分析CAP2在癌组织及癌旁组织中的表达差异,以及与Ki67表达量的相关性;分析CAP2的表达量与患者术前CEA及CA199间的相关性;以患者癌组织中CAP2相对表达量的中位数(3.50)为界将患者分为CAP2低表达组(n=52)和高表达组(n= 53)。并比较两组术后5年生存率;纳入患者性别、年龄、CAP2表达量等因素,采用单因素及多因素回归模型分析CAP2表达量是否为影响胃癌患者术后5年生存率的独立危险因素以及预测癌性致死的价值。
1.6 统计分析数据分析采用SPSS 23.0软件,计量资料采用均数±标准差表示,采用t检验进行组间比较;计数资料的组间比较采用χ2检验,样本量小于5时采用Fisher精确检验法;相关性分析采用Spearman检验。术后生存率采用Kaplan-Meier(K-M)曲线表示,组间比较采用Log-rank χ2检验;影响胃癌术后5年生存率的多因素分析采用Cox比例风险回归模型(Enter法)。CAP2预测胃癌术后5年癌性致死的诊断价值采用受试者工作曲线分析。所有统计检验均为双侧,统计效能设定为0.80,P < 0.05为差异具有统计学意义。
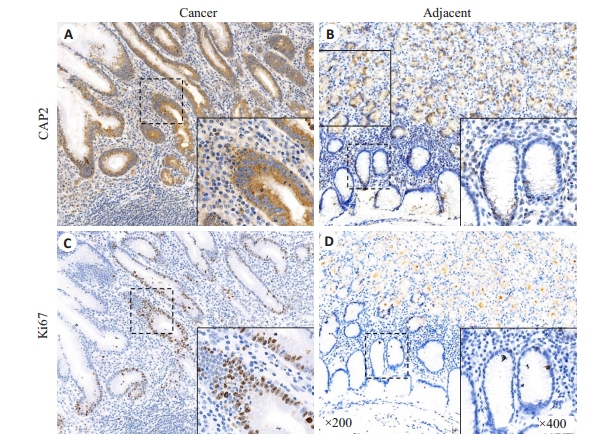
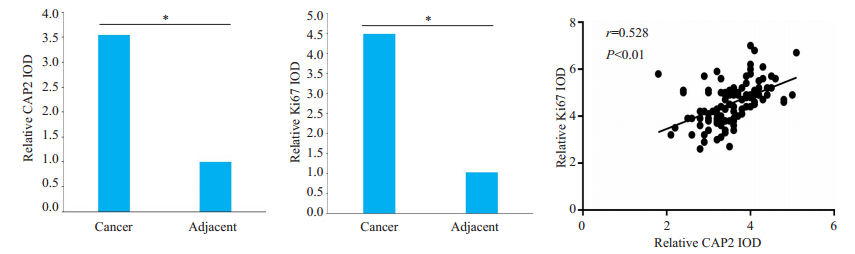
2 结果 2.1 CAP2在胃癌组织中的表达在胃癌组织中CAP2主要表达于癌细胞胞质,而Ki67主要表达于癌细胞胞核;在癌旁组织中有少量CAP2表达于细胞质及少量Ki67表达于细胞核(图 1)。免疫组化目标蛋白相对IOD值分析显示胃癌组织内CAP2及Ki67表达量均高于癌旁组织(P < 0.01);相关性分析显示,胃癌组织CAP2表达量与Ki67表达量呈正相关关系(r=0.528,P < 0.01,图 2)。
|
图 1 CAP2及Ki67在胃癌组织及癌旁组织中的细胞定位及表达 Fig.1 Cellular localization and expression of CAP2 and Ki67 in gastric cancer tissues and adjacent tissues. A: In gastric cancer tissues, CAP2 is mainly localized in the cytoplasm of the cancer cells, but can be also found in some non-cancerous cells; B: In the adjacent tissues, CAP2 is expressed at a low level in the non-cancerous cell cytoplasm; C: In gastric cancer tissues, Ki67 is mainly localized in the cancer cells nuclei with low expressions in non-cancerous cell nuclei; D: In the adjacent tissues, Ki67 is expressed at a low level in the non-cancerous cell nuclei |
|
图 2 胃癌组织中CAP2和Ki67的表达量及相关性分析 Fig.2 Analysis of the expressions of CAP2 and Ki67 and their correlation in gastric cancer tissues. *P < 0.05 |
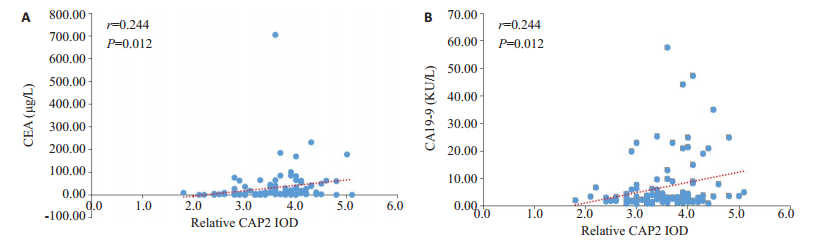
胃癌组织中CAP2表达量与外周血CEA(r=0.244,P < 0.01)及CA19-9间均存在正相关关系(r=0.399,P < 0.01,图 3)。
|
图 3 胃癌组织中CAP2与外周血CEA及CA19-9间的相关性分析 Fig.3 Correlation of CAP2 expression levels with peripheral blood CEA (A) and CA19-9 (B) in gastric cancer tissues |
CAP2低表达组和高表达组在性别、年龄、肿瘤大小及癌细胞类型上比较差异均无统计学意义(P > 0.05,表 1)。CAP2高表达组患者CEA≥5 μg/L、CA19-9≥37 kU/L、病理分级为G3~G4、T分期为3~4期及N分期为2~3期的比例高于CAP2低表达组(P < 0.05)。
| 表 1 胃癌组织中CAP2的表达量与临床及病理参数间的关系 Tab.1 Association of CAP2 expression level with the clinicopathological parameters of the patients with gastric cancer |
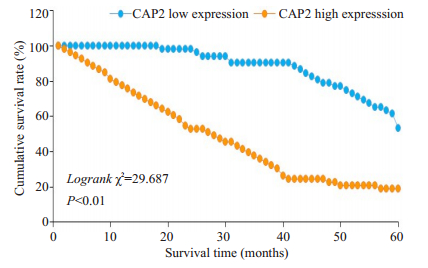
K-M生存分析显示,CAP2高表达组患者术后5年生存率低于低表达组(P < 0.01,图 4)。
|
图 4 胃癌组织中CAP2的表达量对根治术后5年生存率的影响 Fig.4 Effect of CAP2 expression level in gastric cancer on the 5-year survival rate after radical surgery |
单因素分析分析显示CAP2高表达、CEA≥5 μg/L、CA19-9≥37 kU/L、肿瘤≥5 cm、病理分级为G3~G4及N分期为2~3期可能为影响胃癌根治术后5年生存期的危险因素(P < 0.01)。将单因素分析所得阳性结果纳入Cox回归模型,最终得出CAP2高表达、CEA≥5 μg/L、CA19-9≥37 kU/L及病理分级为G3~G4为影响胃癌根治术后5年生存期的独立危险因素(表 2)。
| 表 2 影响胃癌根治术后5年生存期的单因素及多因素分析 Tab.2 Univariate and multivariate analyses of 5-year survival of the gastric cancer patients after radical gastrectomy |
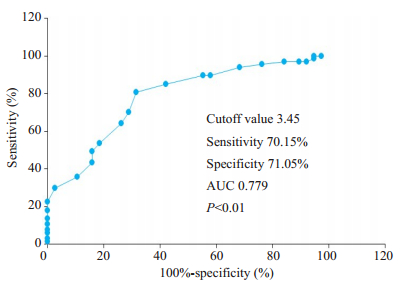
价值以CAP2相对表达量3.45为截点值,预判术后5年死亡的敏感性为70.15%,特异性为71.05%,曲线下面积为0.779(P < 0.01,图 5)。
|
图 5 CAP2表达量对胃癌根治术后5年生存情况的预判价值 Fig.5 Predictive value of CAP2 expression for 5-year survival of the gastric cancer patients after radical gastrectomy |
在基因缺陷、感染、理化刺激及机械性损伤等多种因素共同作用下,胃组织恶变呈现一个渐进的过程,伴有复杂的细胞因子表达异常和信号转导过程[20-22]。CAP2在实体肿瘤中高表达且发挥促进肿瘤恶性行为的一系列研究给我们以很大启发,其是否影响胃癌的进展以及该指标是否具有潜在的临床应用价值有待于探索。本研究显示胃癌组织内高表达CAP2,且CAP2的表达水平与恶性肿瘤增值标志物Ki67蛋白呈现显著正相关,同时与外周血肿瘤标志物CEA及CA19-9亦呈现正相关。CAP2在组织表达和功能上高度保守,其主要存在于肌肉组织(心肌、骨骼肌)中,是肌细胞的结构蛋白且参与调节肌动蛋白的功能[23-25]。CAP2在胃癌组织中高表达提示其可能参与了胃癌的发生或发展。本研究进一步数据分析显示,CAP2在胃癌组织中的表达水平与癌细胞恶性程度(病理G分期)、淋巴结转移(N分期)和浸润程度(T分期)均具有程度上的正关联。这组数据进一步提示CAP2和胃癌的侵袭力和进展状态间存在内在联系,但具体机制需要进一步基础研究以明确。为探寻CAP2在胃癌疾病诊疗中的临床价值,本研究采用K-M生存分析及Cox比例风险回归模型最终证实,CAP2高表达连同CEA≥5 μg/L、CA19-9≥37 kU/L及病理分级为G3~G4均为影响胃癌根治术后5年生存期的独立危险因素。CEA、CA19-9及病理分级对胃癌手术预后的影响已有多项研究证实[26-28]。本研究进一步采用ROC曲线分析显示,CAP2高表达预测术后5年死亡的敏感性及特异性均超过70%,具有一定预后判断价值。
既往研究显示,CAP2在肝细胞性肝癌中高表达,且其水平升高提示5年生存期显著降低[17];在恶性黑色素瘤的研究中,CAP2被证实与肿瘤进展和预后不良密切相关[14];此外,CAP2在乳腺癌中亦呈现高表达,且同样和肿瘤恶性程度、临床进展和预后不良密切相关[15]。在胃癌的研究领域,新近一项研究提示CAP2在胃癌组织内高表达,且其表达水平与肿瘤淋巴结转移有关[29]。本研究结果进一步证实其结论之余另有新的发现:CAP2在癌组织内的表达水平与癌细胞增殖指标Ki67呈现正相关,这提示CAP2可能参与胃癌细胞的增殖过程,这为理解CAP2促进肿瘤的病理生理过程提供了线索;另外,CAP2与胃癌患者外周血CEA和CA199呈现正相关,提示该项指标与临床常用肿瘤诊断指标具有良好的关联性,为血液学评估手段结合分子病理学检查综合评估胃癌疾病发展阶段提供了参考;此外,CAP2在癌组织学的表达水平可预期患者术后5年的生存率,这直接为胃癌的临床预后评估提供了参考指标。本研究结果提示CAP2在恶性肿瘤的发生和发展中扮演重要角色,有望成为临床预后评估的新指标,对深入认识肿瘤病理生理过程具有启发意义。
本研究中的不足:在病例回顾中,因远处转移患者难以做到R0切除而未纳入研究,所以没有将TNM分期纳入到生存分析之中,以单独T、N分期的形式进行了相关评估;由于随访时间跨度较大,因胃癌致死的患者家属多无法准确提供复发时间,因此仅对生存期进行了分析而未分析无复发生存期;本研究中符合条件的病例中未见胃鳞癌,因此无法评估CAP2在胃鳞癌中的表达情况;由于样本量有限,本研究中所得的具体数值尚需要进一步扩大样本量,特别是基于前瞻性研究所得数据分析进一步证实。
综上所述,本研究显示CAP2在胃癌组织中高表达并与肿瘤进展密切相关,是胃癌根治术后5年生存率的独立危险因素,对预后评估具有一定临床价值。
| [1] |
Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer, 2019, 144(8): 1941-53. DOI:10.1002/ijc.31937 |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CACancer J Clin, 2018, 8(3): 293-301. |
| [3] |
蔡成喜, 赵文琦. 青海省西宁市2009~2014年居民胃癌流行趋势分析[J]. 中华肿瘤防治杂志, 2018, 25(6): 381-3. |
| [4] |
白慧霞. 中国胃癌发病率及死亡率研究进展[J]. 临床医药文献电子杂志, 2019, 6(7): 192-203. DOI:10.3877/j.issn.2095-8242.2019.07.168 |
| [5] |
Kweon SS. Updates on cancer epidemiology in Korea, 2018[J]. Chonnam Med J, 2018, 54(2): 90-100. DOI:10.4068/cmj.2018.54.2.90 |
| [6] |
Harada K, Lopez A, Shanbhag N, et al. Recent advances in the management of gastric adenocarcinoma patients[J]. F1000 Res, 2018, 12(7): 815-28. |
| [7] |
Feng F, Zheng GZ, Wang Q, et al. Low lymphocyte count and high monocyte count predicts poor prognosis of gastric cancer[J]. BMC Gastroenterol, 2018, 18(1): 148-59. DOI:10.1186/s12876-018-0877-9 |
| [8] |
Mawalla B, Yuan X, Luo X, et al. Treatment outcome of antiangiogenesis through VEGF-pathway in the management of gastric cancer: a systematic review of phase Ⅱ and Ⅲ clinical trials[J]. BMCRes Notes, 2018, 11(1): 21-33. DOI:10.1186/s13104-018-3137-8 |
| [9] |
Santos E. Current approaches to gastric cancer in Peru and Mexico[J]. Transl Gastroenterol Hepatol, 2017, 39(2): 55-68. |
| [10] |
Chon SH, Berlth F, Plum PS, et al. Gastric cancer treatment in the world: germany[J]. Transl Gastroenterol Hepatol, 2017(2): 53-61. |
| [11] |
Lazar DC, Avram MF, Romoan IA, et al. Prognostic significance of tumor immune microenvironment and immunotherapy: Novel insights and future perspectives in gastric cancer[J]. World J Gastroenterol, 2018, 24(32): 3583-616. DOI:10.3748/wjg.v24.i32.3583 |
| [12] |
Kumar A, Paeger L, Kosmas K, et al. Neuronal actin dynamics, spine density and neuronal dendritic complexity are regulated by CAP2[J]. Front Cell Neurosci, 2016, 10(3): 180-9. |
| [13] |
Srivastav MK, Agarwal N, Natarajan K. Multiple evolutionarily conserved domains of cap2 are required for promoter recruitment and Iron homeostasis gene regulation[J]. mSphere, 2018, 3(4): 718-30. |
| [14] |
Masugi Y, Tanese K, Emoto K, et al. Overexpression of adenylate cyclase-associated protein 2 is a novel prognostic marker in malignant melanoma[J]. Pathol Int, 2015, 65(12): 627-34. DOI:10.1111/pin.12351 |
| [15] |
Xu LH, Peng SD, Huang QA, et al. Expression status of cyclaseassociated protein 2 as a prognostic marker for human breast cancer[J]. Oncol Rep, 2016, 36(4): 1981-8. DOI:10.3892/or.2016.5051 |
| [16] |
Chen M, Zheng TH, Han SY, et al. A preliminary study of plasma cyclase-associated protein 2 as a novel biomarker for early stage and alpha-fetoprotein negative hepatocellular carcinoma patients[J]. Clin Res Hepatol Gastroenterol, 2015, 39(2): 215-21. DOI:10.1016/j.clinre.2014.08.006 |
| [17] |
Fu J, Li M, Wu DC, et al. Increased expression of CAP2 indicates poor prognosis in hepatocellular carcinoma[J]. Transl Oncol, 2015, 8(5): 400-6. DOI:10.1016/j.tranon.2015.08.003 |
| [18] |
Washington K. 7th edition of the AJCC cancer staging manual: stomach[J]. Ann Surg Oncol, 2010, 17(12): 3077-9. DOI:10.1245/s10434-010-1362-z |
| [19] |
Ge YY, Li Y, Chen Q, et al. Adipokine apelin ameliorates chronic colitis in Il-10(-/-) mice by promoting intestinal lymphatic functions[J]. Biochem Pharmacol, 2018, 148(3): 202-12. |
| [20] |
Gu HF, Huang TH, Shen YC, et al. Reactive oxygen speciesmediated tumor microenvironment transformation: the mechanism of radioresistant gastric cancer[J]. Oxid Med Cell Longev, 2018, 20(7): 5801209-21. |
| [21] |
Gigek CO, Calcagno DQ, Rasmussen LT, et al. Genetic variants in gastric cancer: risks and clinical implications[J]. Exp Mol Pathol, 2017, 103(1): 101-11. |
| [22] |
Zhou YJ, Xia LZ, Liu Q, et al. Induction of pro-inflammatory response via activated macrophage-mediated NF-kappa B and STAT3 pathways in gastric cancer cells[J]. Cell Physiol Biochem, 2018, 47(4): 1399-410. DOI:10.1159/000490829 |
| [23] |
Field J, Ye D, Shinde M, et al. CAP2 in cardiac conduction, sudden cardiac death and eye development[J]. Sci Rep, 2014, 25(5): 17256-69. |
| [24] |
Kosmas K, Eskandarnaz A, Khorsandi AB, et al. CAP2 is a regulator of the actin cytoskeleton and its absence changes infiltration of inflammatory cells and contraction of wounds[J]. Eur J Cell Biol, 2015, 94(1): 32-45. DOI:10.1016/j.ejcb.2014.10.004 |
| [25] |
Peche VS, Holak TA, Burgute BD, et al. Ablation of cyclaseassociated protein 2 (CAP2) leads to cardiomyopathy[J]. Cell Mol Life Sci, 2013, 70(3): 527-43. DOI:10.1007/s00018-012-1142-y |
| [26] |
Miyata H, Sugimura K, Yamasaki M, et al. Clinical impact of the location of lymph node metastases after neoadjuvant chemotherapy for middle and lower thoracic esophageal cancer[J]. Ann Surg Oncol, 2019, 26(1): 200-8. DOI:10.1245/s10434-018-6946-z |
| [27] |
Feng F, Tian Y, Xu G, et al. Diagnostic and prognostic value of CEA, CA19-9, AFP and CA125 for early gastric cancer[J]. BMC Cancer, 2017, 17(1): 737-49. DOI:10.1186/s12885-017-3738-y |
| [28] |
Xu MX, Cui HJ, Yao TL, et al. Clinical value of combined tests for tumor markers for gastric cancer[J]. J Biol Regul Homeost Agents, 2018, 32(2): 263-8. |
| [29] |
Li L, Fu LQ, Wang HJ, et al. CAP2 is a valuable biomarker for diagnosis and prognostic in patients with gastric cancer[J]. Pathol Oncol Res, 2018, 25(7): 450-8. |
 2019, Vol. 39
2019, Vol. 39

