高强度聚焦超声(HIFU)已广泛应用于治疗实体肿瘤[1-3]。但在HIFU消融过程中,随着治疗深度的增加,到达靶区的超声能量越低,疗效越差[4-5]。增强超声辐照功率和延长消融时间可增强超声能量沉积,但会增加并发症的风险[4, 6-7]。目前,就如何提高HIFU治疗效率做了大量工作,其中改变组织声学特性是增加靶区能量沉积,减低能量投放、减少并发症,提高HIFU治疗效率的重要方向。组织声学特性包括靶组织的结构、密度和血液供应等[8-9]。目前,改变组织声学特性的方式主要有两个方面:一是引入介质,使得介质与靶区组织之间存在较大的声阻抗差,如微气泡等;二是直接改变靶区组织的结构,如羟基磷灰石等[8, 10-12];但这些方式通过静脉给予,易全身分布,仅部分能到达肿瘤,滞留时间短,靶向性不强。因此,本文欲找到可主动靶向肿瘤组织并改变组织声学特性的材料,达到增强HIFU消融的效果。
双歧杆菌(Bifidobacteria)由于其对肿瘤组织的特异性靶向和较好的生物安全性,已用于载基因和载药物治疗肿瘤的相关研究[13-15],本课题组利用双歧杆菌联合纳米粒增效HIFU消融的的论文,已在国内、外杂志刊出[16-18]。据文献报道,双歧杆菌约注射后第7天肿瘤内菌量达到峰值[19-21],还可以诱导肿瘤细胞凋亡、抑制肿瘤生长[19, 22-23]。但是,这些改变需要深入研究加以验证,它能否诱导靶组织声学特性改变,用于HIFU治疗增效尚不清楚。因此,本文选用长双歧杆菌(B. longum),为保证定植于肿瘤组织双歧杆菌足够多,经裸鼠尾静脉连续注射3 d;通过检测肿瘤组织声学特性的变化及进行HIFU消融实验,探究双歧杆菌对肿瘤组织声学特性的影响,并明确该影响是否能增强HIFU消融效果,为寻找一种新的可用于HIFU治疗增效的方法提供新思路。
1 材料和方法 1.1 建立荷瘤鼠模型选取4周龄的雌性BALB/c裸鼠40只(北京华阜康生物科技有限公司,许可证号:SCXK(京)2014-0004,动物实验取得重庆医科大学生物医学伦理委员会批准),体质量18~22 g。将200 μL培养至对数期的人乳腺癌细胞(MDA-MB-231,重庆医科大学超声影像学研究所惠赠)(浓度5×106/mL)接种于每只荷瘤鼠的右侧大腿根部皮下,之后常规饲养。约20 d后,待肿瘤长到直径约0.8~1 cm用于后续研究。
1.2 双歧杆菌培养将长双歧杆菌(ATCC-15707)(重庆医科大学基础医学院生物化学与分子生物学系惠赠)复苏后在37 ℃、厌氧条件下培养24 h。4 ℃条件下以1000 r/min离心10 min,收集菌体,磷酸盐缓冲液(PBS)洗涤2次,再重悬于PBS,调整细菌浓度至4×108 cfu/mL备用。
1.3 实验分组和注射选取40只荷瘤鼠随机分为2组,实验组和对照组,20只/组。实验组裸鼠连续3 d尾静脉注射上述双歧杆菌悬液,1次/d,200 μL/次;对照组连续3 d注射PBS,1次/d,200 μL/次。相同条件下饲养。
1.4 双歧杆菌对肿瘤组织声学特性的影响 1.4.1 肿瘤组织硬度检测双歧杆菌/PBS注射前、第1次注射后第3天和第7天采用Aixploxer超声诊断系统,SL15-4线阵探头(频率4~15 MHz)采集肿瘤组织B超图和弹性成像图,定量评估裸鼠皮下肿瘤硬度(杨氏模量)。将裸鼠平放且充分暴露肿瘤位置,在 < 40 kPa为弹性阈值条件下进行图像采集,并获得每次测量区的杨氏模量平均值,每只裸鼠由同一医师采集5次,取平均值。
1.4.2 声速和声衰减检测利用RAM-500非线性高能超声测试系统,2个1 MHz水浸式探头(V314-SU),采用插入式脉冲取代法测算肿瘤组织内声速和声衰减,声学特性检测装置见图 1。第1次注射后第7天,实验组和对照组各处死10只荷瘤鼠。完整剥离肿瘤组织,测量肿瘤厚度3次,取平均值(D)。将肿瘤组织样本置于两个探头中间,一个作为发射换能器,一个作为接收换能器,同轴相向,浸于作为耦合媒质的37 ℃恒温脱气水中。测量超声波从发射探头到接收探头所经历的时间间隔(Δtransittime)、超声波信号零时刻的幅值(A0)和第1回波的幅值(A1)3次,取平均值。根据以下公式计算肿瘤组织样本中的声速和声衰减:
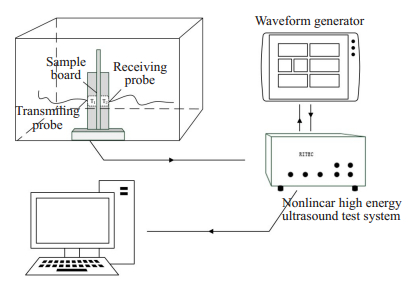
|
图 1 声速和声衰减检测装置 Fig.1 Apparatus for detecting sound velocity and sound attenuation. |
声速:
声衰减:Attenuation=
各肿瘤组织样本和摘取的心、肝、脾、肺、肾,置于4%多聚甲醛中,固定好后进行革兰染色,于OLYMPUS BX51光学显微镜下观察双歧杆菌在各组织内的定植情况。
1.4.4 肿瘤组织病理改变实验组、对照组肿瘤组织均做了HE染色、Masson染色、免疫组化CD31标记。HE染色于光学显微镜下观察肿瘤细胞形态学改变。Masson染色观察瘤内胶原纤维改变:使用显微镜以10×20放大倍率选择肿瘤内部4个胶原纤维高度密集区进行拍照;所获取的图片采用Image Pro Plus6.0软件分析每张照片上胶原纤维占整个照片的面积百分比,最后计算肿瘤内部4张照片的胶原纤维含量百分比的平均值。免疫组化,血小板-内皮细胞粘附分子(PECAM-1/CD31)标记观察瘤内新生血管,即微血管密度(MVD):根据Weidner判断标准[24],使用光学显微镜选择病灶内部4个新生血管高度密集区域进行计算,取其平均值。
1.5 HIFU辐照方法及其评价指标利用JC200型聚焦超声肿瘤治疗系统(重庆海扶医疗科技股份有限公司),工作频率1 MHz,进行HIFU辐照。两组各剩余的10只裸鼠在超声引导下选择治疗区域,治疗功率和辐照时间分别为120 W、3 s,采用点辐照的方式,每只裸鼠辐照1次。超声显示辐照前和辐照后即刻的灰度变化。HIFU辐照后24 h,处死荷瘤鼠,剥离肿瘤。沿HIFU辐照方向切开肿瘤,在37 ℃条件下,2%氯化三苯基四氮唑(TTC)染色40 min,测算各组荷瘤裸鼠肿瘤组织凝固性坏死体积和能效因子(EEF)。凝固性坏死体积V(mm3)=(π/6)×长度×宽度×深度,EEF(J/mm3)=ηPt/V[25],式中,η=0.7,为换能器聚焦系数;P为辐照功率(W);t为辐照时间(s);V为坏死体积(mm3)。经HIFU辐照后的肿瘤组织均做了病理学检查。
1.6 统计学分析采用SPSS 25.0软件处理,数据以均数±标准差表示;使用Shapiro-Wilk法检验数据正态性,满足方差齐性和正态性,采用t检验;不满足方差齐性,采用非参数Mann-Whitney U检验。检验水准α=0.05。
2 结果 2.1 双歧杆菌对肿瘤组织声学特性的影响 2.1.1 双歧杆菌在重要脏器及瘤内的定植情况实验组心、肝、脾、肺、肾内未见双歧杆菌,肿瘤组织可见大量散在、蓝染的双歧杆菌定植;对照组中肿瘤组织和各脏器革兰染色均未见蓝染的双歧杆菌(图 2)。
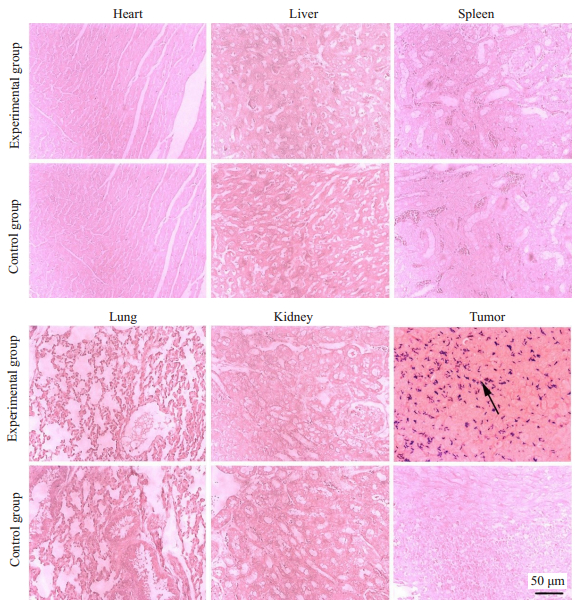
|
图 2 双歧杆菌在组织内的定植情况 Fig.2 Colonization of B. longum in different tissues (Gram staining, original magnification: ×200). The black arrow indicates B. longum. |
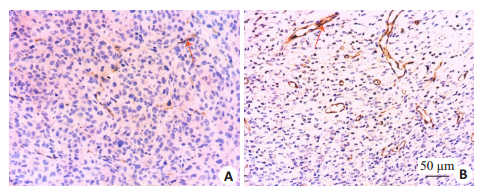
肿瘤细胞形态学改变:实验组肿瘤细胞排列紊乱,部分细胞核固缩,核浆比例下降,肿瘤细胞胞浆内出现空泡;对照组肿瘤细胞排列紧密(图 3)。胶原纤维:实验组肿瘤内可见大量呈蓝色束状的胶原纤维,形态粗大、排列紧密;对照组肿瘤中的胶原纤维形态细小。实验组肿瘤内胶原纤维含量百分比显著高于对照组,差异有统计学意义(P=0.000,表 1,图 4)。微血管密度:CD31阳性染色主要是定位血管内皮细胞的细胞质和细胞膜,新生的微血管被染成棕黄色。实验组肿瘤内新生血管较少,血管排列稀疏、结构不完整,呈条索状或点状;对照组肿瘤组织血管结构基本完整,呈长条形、类圆形。注射双歧杆菌后的实验组微血管密度显著低于对照组,差异有统计学意义(P=0.000,表 1,图 5)。
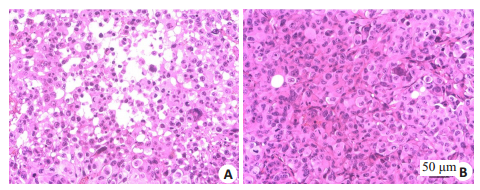
|
图 3 肿瘤细胞形态学改变 Fig.3 Histological changes of the tumor in the two groups of mice (HE staining, × 200).A: Experimental group; B: Control group. |
| 表 1 双歧杆菌对肿瘤组织内胶原纤维和新生血管的影响 Tab.1 Effect of B. longum on collagen fibers and neovascularization in tumor tissues (Mean±SD, n=10) |
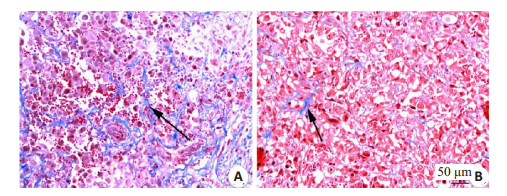
|
图 4 肿瘤组织内胶原纤维 Fig.4 Masson staining of the collagen fibers, shown as the blue bands (black arrows), in the tumor tissues (×200).A: Experimental group; B: Control group. |
|
图 5 肿瘤组织内新生血管 Fig.5 Neovascularization in the tumor tissues (red arrows) in the two groups (× 200).A: Experimental group; B: Control group. |
声速:实验组、对照组肿瘤内超声传播速度分别为1759.43 ± 71.65 m/s、1605.10 ± 101.60 m/s;实验组中超声在肿瘤组织内的传播速度大于对照组,差异具有统计学意义(P=0.001,表 2)。
| 表 2 双歧杆菌对肿瘤组织声速和声衰减的影响 Tab.2 Effects of B. longum injection on sound velocity and sound attenuation of the tumor tissue (Mean±SD, n=10) |
声衰减:实验组和对照组超声波穿过肿瘤组织,其衰减值分别为1.89±0.20 dB/cm、1.54±0.11 dB/cm,实验组肿瘤组织的声衰减大于对照组,差异有统计学意义(P=0.000,表 2)。
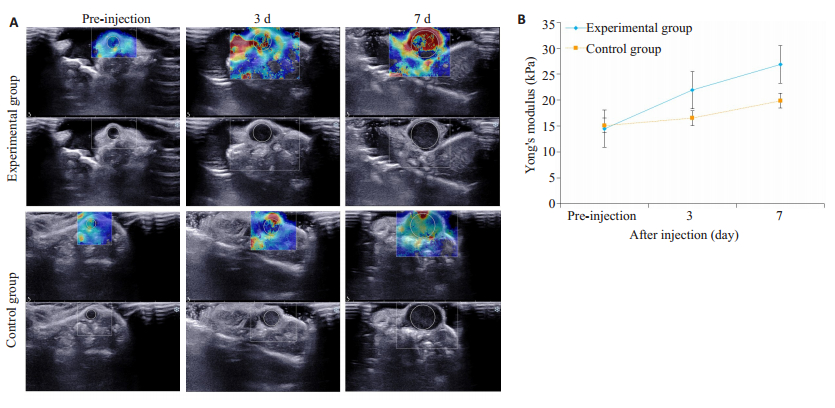
2.1.4 肿瘤组织硬度改变超声弹性图中,蓝色、黄色、红色表示组织软硬程度,其中红色最硬。双歧杆菌注射前、第1次注射后第3、7天,随着时间的推移,肿瘤内红色占比增多,实验组变化更加明显(图 6A)。两组荷瘤鼠的肿瘤杨氏模量随时间增加而增大;注射前、第1次注射后第3天,实验组和对照组杨氏模量差异不显著;第1次注射第7天,实验组杨氏模量值26.89±3.64 kPa高于对照组19.90±2.11 kPa,差异具有统计学意义(P=0.01,表 3,图 6B)。
|
图 6 双歧杆菌/PBS注射前及注射后(3、7 d)肿瘤组织硬度随时间的改变情况 Fig.6 Changes in tumor hardness at 3 and 7 days after injection of bifidobacteria or PBS. A: The first row for each group shows the shear wave elasticity images, and the second row shows the corresponding b-hypergraph; B: Polyline graph of tumor tissue hardness changes with time. |
| 表 3 双歧杆菌对肿瘤组织杨氏模量的影响 Tab.3 Effect of B. longum on Young's modulus of the tumor (Mean±SD, n=10) |
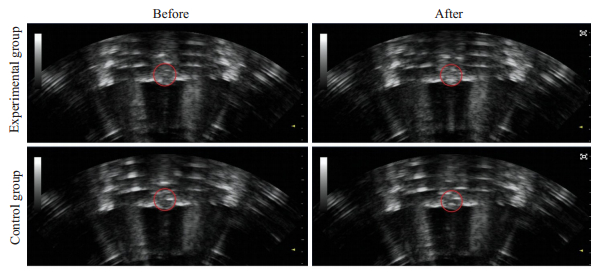
HIFU辐照前,B超图像下监控裸鼠的肿瘤组织为均匀等回声,HIFU辐照后即刻,可见肿瘤内出现团状强回声(图 7)。实验组辐照前/后灰度变化平均值为55.80±11.51,对照组辐照前/后灰度变化平均值为32.30±13.41;实验组辐照前后灰度变化大于对照组,差异具有统计学意义(P=0.0006,表 4)。
|
图 7 超声监控下HIFU辐照前/后(即刻)声像图表现 Fig.7 Sonogram before and immediately after HIFU irradiation under ultrasound monitoring. |
| 表 4 灰度变化、消融体积和EEF值比较 Tab.4 Comparison of gray scales, ablation volume and EEF value (Mean±SD, n=10) |
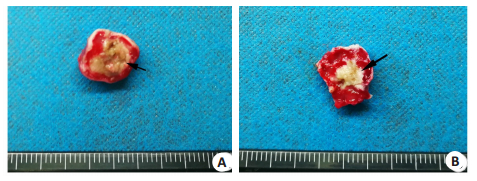
通过TTC染色观察到,凝固性坏死区为灰白色,未坏死区呈红色,凝固性坏死区与未坏死区分界明显(图 8)。实验组凝固性坏死体积为266.5±62.67 mm3,对照组凝固性坏死体积为174.8±63.47 mm3,实验组凝固性坏死体积大于对照组,差异具有统计学意义(P=0.0045,表 4)。在TTC染色的基础上,采用公式可计算出EEF,实验组EEF为1.00± 0.28 J/mm3,对照组EEF为1.64±0.64 J/mm3,差异有统计学意义(P=0.0134,表 4)。
|
图 8 HIFU辐照后肿瘤组织的凝固性坏死 Fig.8 Coagulative necrosis of tumor tissue after HIFU irradiation. The grayish white area (black arrow) shows the coagulative necrotic area. A: Experimental group; B: Control group. |
实验组在光学显微镜下可观察到消融区与非消融区分界明显,消融区细胞形态消失(核固缩,破碎和裂解),并可见大量物质被均匀地染成红色。对照组消融区与非消融区的分界处具有较多散在细胞碎片,因此对照组肿瘤组织损伤比实验组更轻,更弱(图 9)。
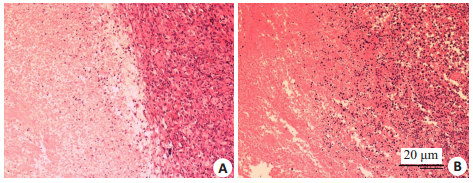
|
图 9 HIFU辐照后肿瘤组织HE染色 Fig.9 HE staining of the tumor after HIFU irradiation (×100). A: Experimental group; B: Control group. |
本研究利用双歧杆菌对肿瘤组织的特异性靶向和对肿瘤的抑制作用,将其作为改变组织声学特性,增效HIFU的生物材料,克服了传统HIFU增效剂靶向性不强,滞留时间短的问题,期望找到少用或不用增效物质就可增效HIFU的方式。HIFU是较新的非侵入性治疗实体肿瘤的技术[26],但由于超声波在传播过程中能量衰减较大,当肿瘤体积较大或其位置较深时,HIFU疗效会受到一定影响。延长消融时间或增强辐照功率又可能会损伤治疗区皮肤以及靶区周围正常组织。因此,从方法学的角度出发,改变靶组织声环境是提高HIFU治疗效率、减少并发症的重要方向。现有的HIFU增效剂,如微泡、羟基磷灰石等,存在靶向性不强、滞留时间短等问题,对HIFU增效具有一定局限性;目前仍在不断探索,以提升HIFU消融效率。
双歧杆菌对组织声学特性的影响:双歧杆菌定植于肿瘤组织一段时间后,瘤内声速、声衰减增大,其原因可能有以下几个方面:(1)胶原纤维改变导致:双歧杆菌定植于肿瘤组织致使瘤内胶原纤维增多、增粗。但双歧杆菌是如何导致肿瘤组织内胶原纤维发生改变的具体机制尚不清楚,需进一步探讨。①胶原纤维因其特殊的三股螺旋结构和其较高的粘弹性,具有较好的微孔吸声和共振吸声作用,能够更好的将声能转变成热能而被吸收[27],使得组织超声穿透肿瘤组织时,声衰减增大。②胶原纤维与周围组织的声阻抗差异较大。组织声阻抗与声速呈正比,因此组织内声速较大;同时声阻抗差异较大,则散射衰减增多,多重散射其实际上是一种附加吸收声能的现象,因此声能转化为热能的能力增强。与王智彪等[28-29]提出的胶原纤维含量丰富的组织表现出较高的声衰减和声速的观点相符。③胶原纤维增多、增粗使得肿瘤整体硬度增加,声能沉积增加;(2)新生血管减少导致:双歧杆菌注射后,使肿瘤内血管减少,可能使得肿瘤组织内结构发生改变,可能促进超声能量沉积[30-31],组织内总的声衰减增大。考虑双歧杆菌能够下调肿瘤中的缺氧诱导因子-α和血管内皮生长因子[22],致使肿瘤组织血管减少。同时,瘤内血管是与肿瘤组织的生长和转移密切相关,致使肿瘤内出现片状坏死,可能有利于减低肿瘤的侵袭性,更有利于肿瘤的后续治疗。因此双歧杆菌作用于肿瘤组织,可增加胶原纤维和减少新生血管,使得肿瘤组织内声速和超声衰减增加。
双歧杆菌改变组织学特性后对HIFU增效的影响:实验组HIFU辐照后肿瘤组织即刻灰度变化平均值增强,组织凝固性坏死体积增大,能效因子减低。分析原因可能是(1)增加超声能量的吸收:①注射双歧杆菌改变组织声学特性后,总的超声衰减增加。组织的超声衰减由扩散衰减、吸收衰减和散射衰减3部分组成,组织超声衰减越大,相应的肿瘤组织内声吸收也越大[25, 28]。②双歧杆菌改变组织声环境后,肿瘤组织内出现大量片状坏死和一部分的空泡样改变,可能增加组织的空化效应,从而提高肿瘤组织的损伤效率;(2)减少超声能量的“流失”:双歧杆菌改变组织声学特性后,其组织内新生血管较少,可使得在HIFU辐照时,血液带走的热能减少,更加有利于超声能量的沉积[30-32]。因此双歧杆菌改变组织组织声学特性,可增加超声能量的沉积,提高肿瘤组织的损伤效率,达到HIFU增效的目的。
综述所述,本研究证实双歧杆菌可增加肿瘤内胶原纤维含量和减少新生血管生成,增大组织内超声传播速度和超声衰减,从而增加HIFU辐照期间的超声能量沉积和减低超声能量“流失”,增强HIFU消融效果。为采用生物体作为靶向材料改变组织声环境并增效HIFU提供了新的思路。
| [1] |
Maloney E, Hwang JH. Emerging HIFU applications in cancer therapy[J]. Int J Hyperthermia, 2015, 31(3): 302-9. DOI:10.3109/02656736.2014.969789 |
| [2] |
Hsiao YH, Kuo SJ, Tsai HD, et al. Clinical application of highintensity focused ultrasound in cancer therapy[J]. J Cancer, 2016, 7(3): 225-31. DOI:10.7150/jca.13906 |
| [3] |
Wu F. High intensity focused ultrasound: a noninvasive therapy for locally advanced pancreatic cancer[J]. World J Gastroenterol, 2014, 20(44): 16480-8. DOI:10.3748/wjg.v20.i44.16480 |
| [4] |
Zhou P, Zhou P, He W, et al. The influence of blood supply on high intensity focused ultrasound a preliminary study on rabbit hepatic VX2 tumors of different ages[J]. Acad Radiol, 2012, 19(1): 40-7. |
| [5] |
Haar GT. HIFU tissue ablation:concept and devices[J]. Advances in Experimental Med Biol, 2016, 25(6): 3-20. |
| [6] |
陈飞. HIFU "帽式"消融及载血卟啉单甲醚纳米微球的相关实验研究[D].重庆, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10631-1016783538.htm
|
| [7] |
Li JJ, Xu GL, Gu MF, et al. Complications of high intensity focused ultrasound in patients with recurrent and metastatic abdominal tumors[J]. World J Gastroenterol, 2007, 13(19): 2747-51. DOI:10.3748/wjg.v13.i19.2747 |
| [8] |
唐瑞遥, 陈锦云. 改变组织声环境增效高强度聚焦超声方法研究进展[J]. 现代医药卫生, 2015, 31(11): 1635-7. DOI:10.3969/j.issn.1009-5519.2015.11.013 |
| [9] |
张奕, 邹建中. 改变组织声环境增强HIFU能量沉积的研究现状[J]. 中国医学影像学杂志, 2010, 18(2): 191-2. DOI:10.3969/j.issn.1005-5185.2010.02.032 |
| [10] |
计晓娟.微泡改变组织声环境提高HIFU治疗效率的初步研究[D].重庆, 2006. http://cdmd.cnki.com.cn/article/cdmd-10631-2006176271.htm
|
| [11] |
张奕, 陈菲, 邹建中, 等. 高强度聚焦超声二次辐照兔肝VX2移植瘤的实验研究[J]. 中国超声医学杂志, 2010, 26(5): 400-3. DOI:10.3969/j.issn.1002-0101.2010.05.005 |
| [12] |
Huang LH, Zhou K, Zhang J, et al. Efficacy and safety of highintensity focused ultrasound ablation for hepatocellular carcinoma by changing the acoustic environment: microbubble contrast agent (SonoVue) and transcatheter arterial chemoembolization[J]. Int J Hyperthermia, 2019, 36(1): 244-52. DOI:10.1080/02656736.2018.1558290 |
| [13] |
张定国, 罗素, 熊锋, 等. 携带IL-10基因的双歧杆菌对感染后肠易激综合征的治疗作用[J]. 中国微生态学杂志, 2019, 31(2): 138-9. |
| [14] |
Fujimori M. Genetically engineered bifidobacterium as a drug delivery system for systemic therapy of metastatic breast cancer patients[J]. Breast Cancer, 2006, 13(1): 27-31. DOI:10.2325/jbcs.13.27 |
| [15] |
Yu ZJ, Zeng ZM, Huang Z, et al. Increased mRNA expression of interferon-induced Mx1 and immunomodulation following oral administration of IFN-alpha 2b-transformed B. longum to mice[J]. Arch Microbiol, 2010, 192(8): 633-8. DOI:10.1007/s00203-010-0589-1 |
| [16] |
Luo Y, Xu D, Gao X, et al. Nanoparticles conjugated with bacteria targeting tumors for precision imaging and therapy[J]. Biochem Biophys Res Commun, 2019, 514(4): 1147-53. DOI:10.1016/j.bbrc.2019.05.074 |
| [17] |
高悬, 邹建中, 蒋冰蕾, 等. 双歧杆菌联合包裹液态氟碳阳离子脂质纳米粒增加HIFU消融效果:实验研究[J]. 中国介入影像与治疗学, 2019, 16(5): 309-14. |
| [18] |
Gao X, Zou WJ, Jiang BL, et al. Experimental study of retention on the combination of bifidobacterium with High-Intensity focused ultrasound (HIFU) synergistic substance in tumor tissues[J]. Sci Rep, 2019, 9(1): 6423. DOI:10.1038/s41598-019-42832-4 |
| [19] |
马永平, 刘革力, 钟贞, 等. 双歧杆菌在家兔实验性肝坏死模型中的靶向增殖研究[J]. 中国微生态学杂志, 2005, 31(6): 408-10. DOI:10.3969/j.issn.1005-376X.2005.06.004 |
| [20] |
Yazawa K, Fujimori M, Amano J, et al. Bifidobacterium longum as a delivery system for cancer gene therapy: Selective localization and growth in hypoxic tumors[J]. Cancer Gene Ther, 2000, 7(2): 269-74. DOI:10.1038/sj.cgt.7700122 |
| [21] |
Cronin M, Morrissey D, Rajendran S, et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors[J]. Mol Ther, 2010, 18(7): 1397-407. DOI:10.1038/mt.2010.59 |
| [22] |
蔡晓珊, 任瑞美, 张式暖, 等. 双歧杆菌对兔VX2瘤HIF-1α和VEGF表达的影响[J]. 中国肿瘤生物治疗杂志, 2008, 15(6): 548-51. DOI:10.3872/j.issn.1007-385X.2008.06.009 |
| [23] |
蔡晓珊, 朱洪光, 张式暖, 等. 双歧杆菌对兔VX2瘤组织的靶向性及其对肝癌细胞抑制作用的研究[J]. 中国现代医学杂志, 2009, 19(21): 3243-6. DOI:10.3969/j.issn.1005-8982.2009.21.012 |
| [24] |
Weidner N. Intratumor microvessel density as a prognostic factor in cancer[J]. Am J Pathol, 1995, 147(1): 9-19. |
| [25] |
李发琪, 白晋, 王智彪, 等. HIFU在牛肝组织中的传播衰减研究[J]. 生物医学工程学杂志, 2003, 25(4): 675-8. DOI:10.3321/j.issn:1001-5515.2003.04.029 |
| [26] |
熊六林. 高强度聚焦超声(HIFU)治疗肿瘤原理及临床应用现状[J]. 中国医疗器械信息, 2009, 15(3): 17-21. DOI:10.3969/j.issn.1006-6586.2009.03.005 |
| [27] |
张美云, 刘正伟. 胶原纤维吸音机理的研究[J]. 中国皮革, 2008, 37(5): 22-5. |
| [28] |
王智彪, 李发琪, 冯若, 等. 治疗超声原理与应用[M]. 南京: 南京大学出版社, 2008: 102-3.
|
| [29] |
Fleury EF, Rinaldi JF, Piato SA, et al. Appearence of breast masses on sonoelastography with special focus on the diagnosis of fibroadenomas[J]. Eur Radiol, 2009, 19(6): 1337-46. DOI:10.1007/s00330-008-1285-2 |
| [30] |
吴玉, 邹建中. 影响高强度聚焦超声能量沉积的血管因素分析[J]. 临床超声医学杂志, 2014, 27(5): 325-6. |
| [31] |
唐爱琼, 罗军, 唐敏. 高强度聚焦超声联合腹腔镜治疗肌壁间子宫肌瘤[J]. 分子影像学杂志, 2017, 40(4): 420-1. DOI:10.3969/j.issn.1674-4500.2017.04.10 |
| [32] |
薛凡凡.血管对HIFU焦域影响的实验研究[D].天津, 2014.
|
 2019, Vol. 39
2019, Vol. 39

