2. 南方医科大学第三附属医院脊柱骨科,广东 广州 510000
2. Department of Spine Surgery, Third Affiliated Hospital, Southern Medical University, Guangzhou 510000, China
骨质疏松症是一种以骨量减少、骨微结构破坏为特征,并导致骨脆性增加及易引起骨折的全身代谢性骨病[1]。骨质疏松症已成为中国的第4种常见慢性病,引起了社会和医学领域高度重视,骨质疏松的药物研发也成为当前的研究热点[2]。双膦酸盐是近年发展起来的最常用的一线抗骨质疏松药物,双膦酸盐类药物作为典型的骨吸收抑制剂,其抑制骨吸收的初步机制主要被认为是:直接作用于破骨细胞,抑制破骨细胞的活化和形成;干扰破骨细胞内代谢, 并诱导破骨细胞凋亡[3-4];作用于成骨细胞及巨噬细胞,抑制其产生的IL-1、IL-6、TNF-α等各类炎性因子,起到间接抑制骨吸收的作用[5-6]。
目前针对双膦酸盐抑制骨吸收的机制研究多局限于破骨细胞及成骨细胞,而骨髓腔内含量最为丰富的脂肪细胞往往被忽视了。而且,脂肪细胞与成骨细胞都来源于骨髓间充质干细胞,可以互相转换,并存在着“此消彼长”的特殊关系,这种特殊关系在临床病例中已得到证实[7],并且脂肪细胞可能作为抗骨质疏松的重要调控点已逐渐被认可[8]。同时,有研究发现β-石竹烯能显著抑制脂肪细胞生成,并刺激成骨细胞矿化,从而发挥抗骨质疏松的作用[9]。因此,我们提出假设:双膦酸盐的抗骨质疏松作用也可能通过调控骨髓内脂肪细胞分化及分泌功能来实现。
本研究立足于上述假设,以骨髓内脂肪细胞为研究对象,通过体外实验研究利塞膦酸钠(RIS)对骨髓间充质干细胞成脂分化及其对脂肪细胞来源核因子κB受体活化因子配体(RANKL)蛋白合成的影响,同时通过体内实验观察RIS对骨质疏松模型大鼠骨髓内脂肪含量及骨密度的影响。初步探讨RIS通过抑制脂肪细胞分化及其相关破骨细胞因子的表达,达到抑制骨吸收的作用,为双膦酸盐抗骨质疏松机制的研究提供新的理论依据。
1 材料和方法 1.1 材料细胞培养液、胎牛血清、0.25%胰蛋白酶(含0.02EDTA)消化液、青霉素、链霉素、1,25-二羟维生素D3、地塞米松、维生素C、胰岛素、β甘油磷酸钠、3-异丁基-1-甲基黄嘌呤、过硫酸铵(GIBCO)。β-actin抗体、辣根过氧化物酶标记的二抗和化学发光试剂盒(Abcam)。四甲基乙二胺、硝酸纤维素膜。Tris碱、甘氨酸、十二烷基磺酸钠(SDS)(广州威佳科技有限公司)。细胞培养板、培养皿和移液管(Corning)。RT-PCR试剂盒、DNA Marker、TRIzol试剂(TaKaRa)。DEPC、琼脂糖、EDTA(BBI)。RIS(Toronto Research Chemicals. Toronto, Canada)。RANKL抗体(北京博奥森生物科技公司)。
1.2 实验方法 1.2.1 原代骨髓间充质干细胞分离和培养采用全骨髓差速贴壁培养法(Fridenstein法),SD大鼠(4~6周)经颈椎脱臼法处死后,用75%乙醇全身浸泡消毒10 min。无菌条件下取股骨和胫骨,剔除骨表面软组织,PBS清洗3次。去除股骨及胫骨两侧骨骺端,露出骨髓腔。用1 mL注射器、25号针头和DMEM完全培养液冲洗髓腔,收集细胞移入细胞培养皿中,置于5% CO2、37 ℃培养箱中培养,48 h后换液1次,去除未贴壁细胞。以后2~3 d换液。细胞长至融合状态时,以消化传代(1: 2)。在消化传代时,将培养液吸出,用D-Hanks液清洗2次,加入0.05% EDTA-胰蛋白酶2 mL,显微镜下观察,消化至少量细胞脱落,其他细胞轮廓轻度皱缩时,吸弃消化液及消化掉的细胞(多数为混杂的其他细胞),加入含10%胎牛血清的DMEM,反复吹打,并注意及时观察细胞脱落情况,待细胞基本全部脱落时,收集消化下来的细胞,以合适密度传至新培养皿中,置5% CO2、37 ℃培养箱中培养。每2~3 d更换培养液。如此培养及传代2次,取第3代人骨髓间充质干细胞作为本实验的最终使用细胞。
1.2.2 RIS对大鼠骨髓间充质干细胞成脂分化的影响(1)骨髓间充质干细胞成脂诱导及加药干预:将大鼠骨髓间充质干细胞接种至12孔板,密度为2×103/mL。细胞贴壁后,以成脂诱导液进行培养,成脂诱导液配方:含地塞米松0.1 μmol/L,维生素C 50 μmol/L,β-甘油磷酸钠10 mmol/L的培养基。以浓度梯度为0、1、5、10、25 μmol/L的RIS进行药物干预。连续培养14 d,每隔3 d更换1次药物和培养基。(2)细胞计数、计算成脂率:培养及药物干预14 d后,于倒置显微镜下观察,各个浓度组分别照片。摄像系统为Nikon ECLIPSE E600 stereomicroscope(Nikon, Japan)。在各浓度组的照片中,随机选取3个视野,并随机计数100个细胞,然后在这100个细胞中再次计数成脂细胞数,以成脂率衡量骨髓基质干细胞成脂肪分化效果。成脂率=成脂细胞数/ 100×100%。
1.2.3 RIS对骨髓间充质干细胞来源的脂肪细胞RANKL蛋白表达的影响(1)骨髓间充质干细胞的成脂诱导及药物干预:方法同上。(2)脂肪细胞裂解及蛋白提取:培养及药物干预14 d后,将12孔板置于冰面上操作。吸净培养液。向培养板每孔均加入80 μL的2× SDS-PAGE蛋白上样缓冲液后尽快以刮棒刮下细胞,收集于1.5 mL EP管中,置于100 ℃金属浴恒温加热5 min,12 000 r/min离心3 min。吸出上清20 μL,加样品入上样孔底,行SDS-PAGE凝胶电泳。若不立即进行蛋白检测,可将样品置于-80 ℃保存。(3)Western blot检测RANKL蛋白表达:按照Western blot法操作常规进行。
1.2.4 RIS对骨髓间充质干细胞(未成脂诱导)RANKL蛋白表达的影响骨髓基质干细胞维持培养及药物干预,将骨髓间充质干细胞以密度为2×103/mL细胞接种至12孔板中。细胞贴壁后,更换新鲜完全培养基,并以浓度梯度为0、1、5、10、25 μmol/L的RIS进行干预96 h。细胞裂解、蛋白提取及Western blot方法同上。
1.2.5 OVX大鼠模型的建立及维持选用24周雌性SD大鼠,30只,体质量350~400 g,随机分为假手术组10只,OVX手术组20只。OVX大鼠模型的建立:1%的戊巴比妥钠(40 mg/kg),腹腔注射麻醉生效后,选用背侧入路。背部中线两侧各旁开1 cm、髂棘上1 cm处为手术切口,纵行切开约1 cm,切开皮肤和皮下组织,分离肌层,先后显露腹腔内双侧卵巢,于子宫与卵巢交界处丝线结扎并切除双侧卵巢,逐层关闭切口。假手术组:不切除卵巢,仅切除卵巢周围小块脂肪组织,余操作与模型组相同。严格无菌手术操作。术后保持呼吸通畅,自然清醒。饲养于室温、通风良好、自然光照的环境中12周。
1.2.6 OVX大鼠的药物干预术后将手术组随机分为两组,每组10只,RIS干预组(皮下注射RIS,2.4 μg/kg,3次/周)及对照组(皮下注射无菌生理盐水,0.3 mL/次,3次/周)[10],维持12周。
1.2.7 各组大鼠的骨密度测定给药12周后各组行骨密度测定,将大鼠俯卧位固定于扫描床上,采用小动物Total Body Bone Density模式,采用美国Lunar公司的Prodigy型DEXA骨密度仪。测量大鼠腰椎及股骨骨质的骨密度,单位mg/cm2。各组大鼠在骨密度测量完成后处死。
1.2.8 各组大鼠骨髓内脂肪含量的评测大鼠处死后迅速取出大鼠的左侧股骨远端,脱钙、固定、石蜡包埋、连续5 μm切片,HE染色。最后在显微镜下观察切片脂肪含量。
1.3 统计学分析所有实验数据采用SPSS 20.0统计软件进行分析,结果用均数±标准差表示,组间比较采用单因素方差分析,与对照组比较用LSD法,所有实验至少重复3次,P < 0.05为差异有统计学意义。
2 结果 2.1 RIS浓度依赖性抑制大鼠骨髓间充质干细胞成脂分化光镜下观察采像,各浓度组分别计算骨髓间充质干细胞的成脂率(图 1)。单因素方差分析显示不同组间差异有统计学意义(P < 0.05),经LSD方法对各浓度组间进行多重比较,结果显示,与对照组相比,随着RIS浓度的增大,骨髓间充质干细胞的成脂率呈浓度依赖性减少,差异具有统计学意义(P < 0.05,图 1G)。

|
图 1 RIS浓度依赖性抑制骨髓间充质干细胞成脂分化 Fig.1 Risedronate (RIS) dose-dependently inhibits adipogenesis of primary cultured rat BMSCs. (Original magnification: ×100). A: Blank control group; B-F: 0, 1, 5, 10 and 25 μ mol/L risedronate groups, respectively; G: Quantitative analysis of the adipocytes. **P < 0.01, ***P < 0.001 vs 0 μmol/L group. |
Western blot结果显示,1~25 μmol/L的浓度区间内,随着RIS浓度的逐渐增加,骨髓间充质干细胞来源的脂肪细胞RANKL蛋白的表达水平逐渐降低(图 2)。RANKL蛋白数据检测经单因素分析,结果显示RANKL蛋白表达在不同组间的差异有统计学意义(P < 0.001)。
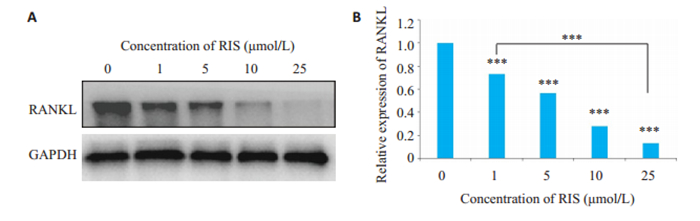
|
图 2 RIS抑制大鼠骨髓间充质干细胞成脂分化时RANKL蛋白表达 Fig.2 RIS suppresses RANKL expression in adipocytes derived from BMSCs. A: Western blotting of RANKL expression; B: Quantitative analysis of the gray value for RANKL. **P < 0.01, ***P < 0.001 vs 0 μ mol/L group. |
Western blot结果显示,1~25 μmol/L的浓度区间内,随着RIS浓度的逐渐增加,未进行成脂诱导的骨髓间充质干细胞RANKL蛋白的表达水平无显著变化(图 3),不同组间差异均无统计学意义(P>0.05)。
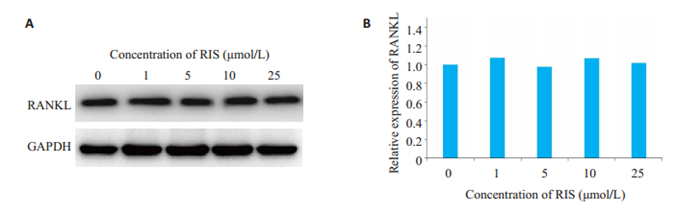
|
图 3 RIS干预未成脂诱导大鼠骨髓间充质干细胞RANKL蛋白表达 Fig.3 RIS suppresses RANKL expression in BMSCs without adipogenic induction. A: Western blotting of RANKL expression; B: Quantitative analysis of the gray value for RANKL. |
OVX组大鼠的腰椎、左股骨、右股骨骨密度值均低于Sham组,差异有统计学意义(P < 0.01,表 1)。应用RIS药物对OVX大鼠进行干预后,腰椎、左股骨、右股骨的骨密度值均升高(P < 0.05)。
| 表 1 RIS药物干预提升OVX大鼠骨密度 Tab.1 RIS increases bone mineral density of ovariectomized (OVX) rats (n=10, g/cm2) |
OVX组的骨质疏松模型大鼠骨髓内的脂肪细胞明显多于正常大鼠(图 4)。通过RIS药物干预后,大鼠骨髓内的脂肪细胞数目明显减少。
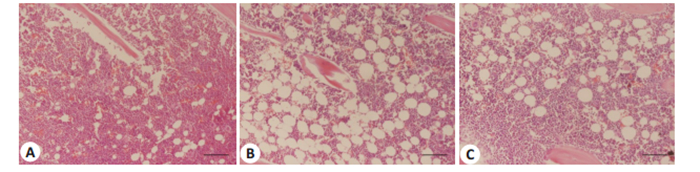
|
图 4 RIS药物干预抑制OVX大鼠骨髓内脂肪堆积(HE染色) Fig.4 RIS inhibits accumulation of bone marrow fat in OVX rats (HE, ×40). A: Sham group; B: OVX group without RIS treatment; C: OVX group with RIS treatment. |
骨髓间充质干细胞可以在不同的情况下竞争性地向成骨细胞、脂肪细胞分化,即间充质干细胞向脂肪细胞分化增强,即会减弱向成骨细胞分化;反之,如果向成骨细胞分化增强,同样也会减弱向脂肪细胞的分化[11]。有研究认为骨髓脂肪细胞的生成与骨生成、破骨细胞生成之间存在复杂的关系,抗骨髓脂肪过剩可能成为骨质疏松防治的重要分子靶点[12]。脂肪细胞的功能得到了更新的认识,已不仅是单纯的骨髓腔内空间的填充、脂代谢的参与及能量的供给,更作为一种内分泌及旁分泌器官,参与和调节骨代谢[13]。骨髓内大量堆积的脂肪,可能通过旁分泌作用分泌脂肪酸、脂肪因子等,干扰了骨髓间充质干细胞的正常分化,并抑制成骨细胞的功能、存活,促进破骨细胞的分化及活性,影响骨重建[14]。RANKL/核因子κB受体活化因子(RANK)系统是近年来发现的在破骨细胞分化过程中的一个重要的经典信号通路,对破骨细胞分化起关键作用[15-16]。RANKL被认为是破骨细胞增殖分化和活化主要且必需的关键调控因子[17-18]。RANK影响破骨细胞(及其前体细胞)的分化与成熟,是破骨细胞维持结构、发挥功能及存活所必需的可溶性蛋白[19-20]。RANKL与其受体RANK相结合后,通过促进破骨细胞分化与成熟来发挥作用,调节体内成骨细胞与破骨细胞的动态平衡[21]。
成骨细胞、软骨细胞、骨髓基质细胞通常被认为是表达RANKL的主要细胞,上述细胞表达的RANKL是破骨细胞的生成和活化所必需的。有研究发现脂肪细胞同样可以表达RANKL,并可通过表达RANKL促进破骨细胞分化[22-23]。骨髓内脂肪细胞的大量形成,不仅是成骨细胞生成减少的原因和结果,还可以通过影响RANKL/RANK系统,导致破骨细胞的大量生成和功能活化,从而引起骨形成和骨溶解的失衡,最终导致骨丢失。
双膦酸盐是抗骨质疏松的一线药物,被普遍应用于临床,疗效好,安全性高[24-25]。本研究体内实验部分也发现了RIS干预的骨质疏松大鼠与对照组相比,骨密度明显升高,证实了RIS抗骨质疏松的良好作用。然而,双膦酸盐类药物防治骨质疏松的具体机制目前尚未阐释清楚。有研究发现经RIS治疗3年的绝经后骨质疏松妇女,髂骨骨髓穿刺的脂肪含量结果对比安慰剂组明显降低[26]。本研究的体外实验发现RIS可以有效抑制脂肪细胞分化,同时体内实验对骨质疏松大鼠股骨远端进行的HE染色也发现RIS药物干预可显著抑制OVX大鼠骨髓内脂肪堆积,这进一步佐证了体内实验结果。另外,本研究还发现RIS在浓度依赖性抑制脂肪分化的同时,可以呈浓度依赖性抑制骨髓间充质干细胞来源的脂肪细胞RANKL蛋白的表达,为抑制破骨细胞的生成、分化及功能提供了必要的有利条件。值得注意的是,RIS可明显抑制骨髓间充质干细胞来源的脂肪细胞RANKL蛋白的表达,但RIS对骨髓基质干细胞本身表达的RANKL并没有产生影响。由此可见,RIS针对脂肪细胞、以脂肪细胞为靶点调控其RANKL蛋白的表达。
综上所述,我们推测RIS抑制骨吸收的主要机制,已不再是传统观点认为的其对破骨细胞的直接抑制作用及通过成骨细胞参与的间接抑制作用,尚存在着通过脂肪细胞参与的另一间接抑制作用,RIS通过高亲和力与骨组织中的羟基磷灰石紧密结合后,对与骨组织相邻的、骨髓腔内含量最为丰富的脂肪细胞的分化起到抑制作用,同时抑制脂肪细胞RANKL蛋白的表达,并通过RANKL/RANK系统,抑制破骨细胞的分化及功能的发挥,抑制骨吸收,最终达到抗骨质疏松的功效。以上发现进一步完善了RIS抗骨质疏松的机制研究,为RIS以及其他抗骨质疏松药物的研发拓展了新的方向。
| [1] |
Liu Y, Wu J, Zhu Y, et al. Therapeutic application of mesenchymal stem cells in bone and joint diseases[J]. Clin Exp Med, 2014, 14(1): 13-24. DOI:10.1007/s10238-012-0218-1 |
| [2] |
Tabatabaei-Malazy O, Salari P, Khashayar PA. New horizons in treatment of osteoporosis[J]. Daru, 2017, 25(1): 2-13. DOI:10.1186/s40199-017-0167-z |
| [3] |
Tai TW, Chen CY, Su FC, et al. Reactive Oxygen species are required for zoledronic acid-induced apoptosis in osteoclast precursors and mature osteoclast-like cells[J]. Sci Rep, 2017, 7(12): 44245-57. |
| [4] |
Russell R. Bisphosphonates: the first 40 years[J]. Bone, 2011, 49(1, SI): 2-19. DOI:10.1016/j.bone.2011.04.022 |
| [5] |
Kim HJ, Kim HJ, Choi Y, et al. Zoledronate enhances OsteocyteMediated osteoclast differentiation by IL-6/RANKL axis[J]. Int J Mol Sci, 2019, 20(6): 1467-78. DOI:10.3390/ijms20061467 |
| [6] |
Funayama H, Tashima I, Okada S, et al. Effects of zoledronate on local and systemic production of IL-1 beta, IL-18, and TNF-alpha in mice and augmentation by lipopolysaccharide[J]. Biol Pharm Bull, 2019, 42(6): 929-36. DOI:10.1248/bpb.b18-00923 |
| [7] |
Wren TA, Chung SA, Dorey FJ, et al. Bone marrow fat is inversely related to cortical bone in young and old subjects[J]. J Clin Endocrinol Metab, 2011, 96(3): 782-6. DOI:10.1210/jc.2010-1922 |
| [8] |
张冰雨, 曾瑞翔, 雷涛. 脂代谢与骨代谢相关机制的研究进展[J]. 中国骨质疏松杂志, 2015, 21(10): 1263-6. DOI:10.3969/j.issn.1006-7108.2015.10.023 |
| [9] |
Yamaguchi M, Levy RM. beta-Caryophyllene promotes osteoblastic mineralization, and suppresses osteoclastogenesis and adipogenesis in mouse bone marrow cultures in vitro[J]. Exp Ther Med, 2016, 12(6, A): 3602-6. DOI:10.3892/etm.2016.3818 |
| [10] |
Fuchs RK, Phipps RJ, Burr DB. Recovery of trabecular and cortical bone turnover after discontinuation of risedronate and alendronate therapy in ovariectomized rats[J]. J Bone Miner Res, 2008, 23(10): 1689-97. DOI:10.1359/jbmr.080501 |
| [11] |
Qi M, Zhang LQ, Ma Y, et al. Autophagy maintains the function of bone marrow mesenchymal stem cells to prevent estrogen deficiency-Induced osteoporosis[J]. Theranostics, 2017, 7(18): 4498-516. DOI:10.7150/thno.17949 |
| [12] |
徐铮. 骨髓脂肪在骨质疏松骨质量研究中的进展[J]. 同济大学学报:医学版, 2012, 33(3): 121-4. |
| [13] |
Turner RT, Kalra SP, Wong CP, et al. Peripheral leptin regulates bone formation[J]. J Bone Miner Res, 2013, 28(1): 22-34. DOI:10.1002/jbmr.1734 |
| [14] |
Cao Y, Gomes SA, Rangel EB, et al. S-nitrosoglutathione reductasedependent PPAR gamma denitrosylation participates in MSCderived adipogenesis and osteogenesis[J]. J Clin Invest, 2015, 125(4): 1679-91. DOI:10.1172/JCI73780 |
| [15] |
Fukumoto S, Matsumoto T. Recent advances in the management of osteoporosis[J]. F1000Res, 2017, 6(5): 625-38. |
| [16] |
Honma M, Ikebuchi Y, Kariya Y, et al. Regulatory mechanisms of RANKL presentation to osteoclast precursors[J]. Curr Osteoporos Rep, 2014, 12(1): 115-20. DOI:10.1007/s11914-014-0189-0 |
| [17] |
Lee KY, Kim JH, Kim EY, et al. Water extract of Cnidii Rhizoma suppresses RANKL-induced osteoclastogenesis in RAW 264.7 cell by inhibiting NFATc1/c-Fos signaling and prevents ovariectomized bone loss in SD-rat[J]. BMC Compl Altern Med, 2019, 19(1): 207-19. DOI:10.1186/s12906-019-2611-8 |
| [18] |
Chen X, Chen WX, Zhou Z, et al. Nirogacestat suppresses RANKLInduced osteoclast formation in vitro and attenuates LPS-Induced bone resorption in vivo[J]. Exp Cell Res, 2019, 382(1): 111470-83. DOI:10.1016/j.yexcr.2019.06.015 |
| [19] |
Lewiecki EM. New and emerging concepts in the use of denosumab for the treatment of osteoporosis[J]. Ther Adv Musculoskelet Dis, 2018, 10(11): 209-23. DOI:10.1177/1759720X18805759 |
| [20] |
Wu K, Lin TH, Liou HC, et al. Dextromethorphan inhibits osteoclast differentiation by suppressing RANKL-induced nuclear factor-kappa B activation[J]. Osteoporos Int, 2013, 24(8): 2201-14. DOI:10.1007/s00198-013-2279-8 |
| [21] |
Cao X. RANKL-RANK signaling regulates osteoblast differentiation and bone formation[J]. Bone Research, 2018, 3(6): 35-47. |
| [22] |
Goto H, Hozumi A, Osaki M, et al. Primary human bone marrow adipocytes support TNF-alpha-induced osteoclast differentiation and function through RANKL expression[J]. Cytokine, 2011, 56(3): 662-8. DOI:10.1016/j.cyto.2011.09.005 |
| [23] |
Ren L, Song ZJ, Cai QW, et al. Adipose mesenchymal stem cellderived exosomes ameliorate hypoxia/serum deprivation-induced osteocyte apoptosis and osteocyte-mediated osteoclastogenesis in vitro[J]. Biochem Biophys Res Commun, 2019, 508(1): 138-44. DOI:10.1016/j.bbrc.2018.11.109 |
| [24] |
Liang BC, Shi ZY, W[ang B, et al. Intravenous zoledronic acid 5 mg on bone turnover markers and bone mineral density in East China subjects with newly diagnosed osteoporosis: a 24-month clinical study[J]. Orthop Surg, 2017, 9(1): 103-9. DOI:10.1111/os.12307 |
| [25] |
Rogers MJ, Crockett JC, Coxon FP, et al. Biochemical and molecular mechanisms of action of bisphosphonates[J]. Bone, 2011, 49(1): 34-41. DOI:10.1016/j.bone.2010.11.008 |
| [26] |
Duque G, Li W, Adams M, et al. Effects of risedronate on bone marrow adipocytes in postmenopausal women[J]. Osteoporos Int, 2009, 44(1): S53-65. |
 2019, Vol. 39
2019, Vol. 39

