体外循环(CPB)是一种利用人工装置将回心静脉血引流至体外进行气体交换,调温并过滤后,再回输至体内的生命支持技术[1-4]。在心脏手术、大血管手术、心肺功能衰竭等患者的治疗中发挥着重要作用[5-6]。但作为一种非生理性的循环方式,CPB本身也会带来各种严重并发症,肺功能损伤是最常见的一类,关于其发生机制尚未达成完全共识[7-9]。右美托咪定是一类高效的α2受体激动剂,配伍禁忌少,同时具有独特的器官保护作用[10-11]。右美托咪定可通过下调Caspase-3蛋白表达,缓解肠缺血再灌注损伤,且这种保护作用呈剂量依赖性[12]。此外右美托咪定还能在大鼠脑部缺血再灌注损伤中发挥神经保护作用,改善其运动功能[13]。有研究发现右美托咪定能够减轻大鼠肺组织的缺血再灌注损伤,并推测可能与抑制炎症反应和氧化应激相关相关[14-15]。但目前关于右美托咪定对CPB肺损伤的保护作用停留在基础指标研究,相关信号通路未见报道。因此,本研究通过建立SD大鼠CPB模型,探讨右美托咪定对CPB大鼠肺组织可能的保护作用及相关信号通路,以期为临床建立更有效的干预方案提供依据。
1 材料和方法 1.1 实验动物40只SD健康成年大鼠(4~8月龄),购于军事医学科学院动物实验中心,且均符合以下纳入标准:心率介于250~600次/min;血压基本正常,排除≥180/120 mmHg或≤90/60 mmHg。
1.2 主要仪器与试剂主要仪器包括:HX-100E小动物呼吸机(泰盟公司,成都),大鼠专用膜式氧合器(科威医疗器械有限公司提供,广东),微量泵(WZS-50F2型),(浙江大学医学仪器有限公司,浙江),ACT监测仪(中国科学院仪器厂,北京),恒流蠕动泵(BT00-300M型,保定兰格恒流泵有限公司,河北),i-STAT血气分析仪(雅培),变温毯(美特器械有限公司,广东),BX53四色正置显微镜(olympus),微量移液器(Thermo)。主要试剂:Akt抗体、p-Akt抗体、Caspase-3抗体Caspase-9抗体均购于Abcam,渥曼青霉素购于Santa Cruz Biotechnology,盐酸右美托咪定购于江苏恩华公司。
1.3 大鼠模型构建及分组将40只SD大鼠随机分为5组,8只/组。根据处理方式的不同,将5组大鼠分别记为缺血再灌注组(A组)、右美托咪定组(B组)、空白对照(即假手术组,C组)、渥曼青霉素组(D组)、渥曼青霉素+右美托咪定组(E组)。采用戊巴比妥那腹腔注射麻醉,尾静脉置管后仰卧位固定,两侧股静脉穿刺置管,直视下气管插管,解剖右颈总动脉并穿刺置管,机械通气,将信号采集系统连接至右侧股动脉,实时监测。采用尾静脉入路进行全身肝素化,以股静脉作静脉端引流,右颈总动脉为动脉端灌注,C组不进行CPB。建立体外循环后10 min开胸,于阻断左肺门前10 min,A组、B组、D组、E组大鼠分别给予等容量生理盐水、右美托咪定3 μg/kg、渥曼青霉素1.5 μg/kg、渥曼青霉素1.5 μg/kg+右美托咪定3 μg/kg,均持续泵注至CPB停止时。阻断30 min后开放左肺门,循环持续45 min,停机90 min后结束实验。必要时,采用血管活性药物维持生命体征。C组仅注射等容量生理盐水。
1.4 血液及组织标本的收集与检测选取CPB前、开放左肺门时、实验结束时3个时间点,经股动脉抽取0.5 mL动脉血,在实验结束后剪取分离完整的左肺组织。采用动脉血气分析技术,自动获取氧合指数与呼吸指数。其中氧合指数(OI)为(PaO2×Mpaw)/FiO2,其中PaO2为动脉氧分压,Mpaw为平均气道压,FiO2为吸入氧浓度百分比;呼吸指数(RI)指肺泡动脉氧分压差与动脉氧分压之比P(A-a)O2/PaO2,是反映肺的通气、氧交换功能的实用指标。氧合指数单位为mmHg,呼吸指数单位为1。
将左肺组织分成3份,一份组织制备单细胞悬液,一份组织经甲醛固定后,进行病理学评分,一份用于Akt、p-AKT、Caspase-3、9等蛋白的表达。采用TUNEL法检测肺组织细胞凋亡情况,光镜下凋亡细胞的细胞核呈棕黄色,正常细胞核成蓝色,计算5个高倍镜(400倍下的凋亡细胞的平均数),即凋亡指数=5个高倍镜视野下凋亡细胞数/5个高倍镜视野下细胞总数×100%。肺组织病理学评分主要观察显微镜下以下4个指标:肺毛细血管充血;肺内出血;中性粒细胞在血管壁肺间隙集聚或浸润;肺泡壁增厚或透明膜形成。采用10分制进行评分,0分为正常,10分为91%~100%损伤,按照累及的组织比例计分。采用蛋白印迹技术检测Akt、p-AKT、Caspase-3、9等蛋白的表达。
1.5 统计学方法应用SPSS20.0软件进行统计分析。计量资料采用均数±标准差表示,同组不同时间点指标比较采用重复测量方差分析,不同组间相同时间点指标比较采用单因素方差分析,两两比较采用Dunnett's t检验,P < 0.05认为差异有统计学意义。
2 结果 2.1 5组大鼠在不同时间点心率、平均动脉压比较组内比较:随着实验时间的延长,A组、B组、D组与E组大鼠在CPB前、开放左肺门时、实验结束时3个时间点,心率、平均动脉压(MAP)均呈显著的下降趋势,C组大鼠在不同时间点心率与MAP不存在显著差异(P >0.05)。不同组别对比分析结果显示在CPB前5组大鼠的心率与MAP无明显差异(P >0.05);开放肺门时,C组心率与MAP高于其他组(P < 0.05);实验结束时,B组与C组心率与MAP高于其他组(P < 0.05),但C组心率高于B组(P < 0.05),两组MAP差异无统计学意义(P >0.05,表 1)。
| 表 1 5组大鼠不同时间点心率和平均动脉压比较 Tab.1 Comparison of heart rate (HR) and mean arterial pressure (MAP) at different time points in the 5 groups (n=8) |
组内比较:随着实验时间的延长,A组、B组、D组与E组大鼠在CPB前、开放左肺门时、实验结束时3个时间点,OI呈下降趋势、RI均呈上升趋势(P < 0.05),C组在不同时间点OI与RI不存在显著差异(P >0.05)。不同组别对比分析结果显示在CPB前5组大鼠的点OI与RI无明显差异(P >0.05);开放肺门时,C组OI、RI与其他组差异显著(P < 0.05);实验结束时,B组与C组OI、RI与其他组差异显著(P < 0.05),但C组OI高于B组,RI低于C组(P < 0.05,表 2)。
| 表 2 5组大鼠在不同时间点氧合指数、呼吸指数比较 Tab.2 Comparison of oxygenation index (OI) and respiratory index (RI) at different time points in the 5 groups (n=8) |
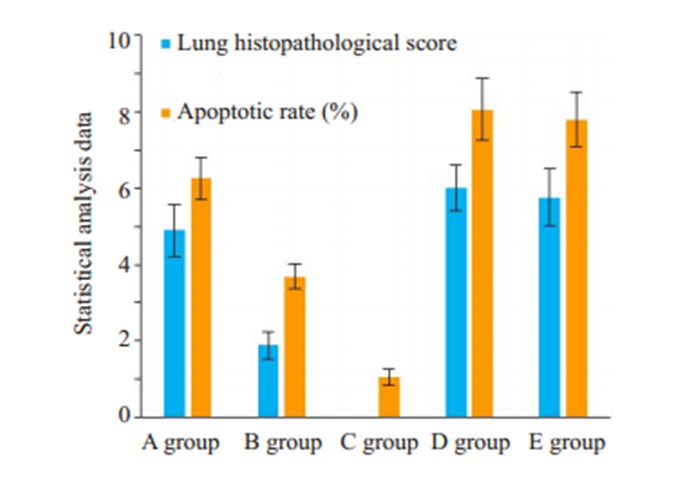
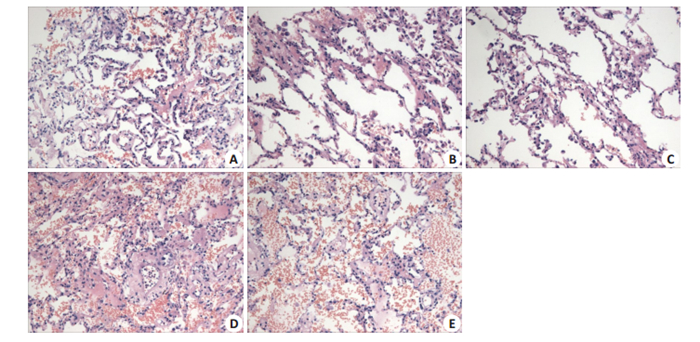
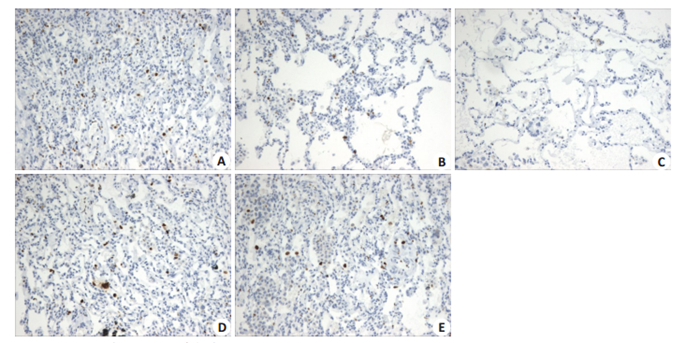
在实验结束时,A、B、C、D、E组大鼠肺组织病理评分平均值分别为4.89、1.89、0、6.01、5.76;肺组织细胞凋亡率平均值分别为6.25%、3.69%、1.06%、8.06%、7.79%,差异具有统计学意义(P < 0.001)。不同组大鼠肺组织评分与凋亡率见图 1,HE检测代表图形见图 2,Tunel染色代表图形见图 3。
|
图 1 不同组大鼠实验结束时肺组织病理评分、细胞凋亡率比较 Fig.1 Comparison of pathological score and apoptotic rate of the lung tissue among the groups at the end of the experiment. aP < 0.05 vs group A; bP < 0.05 vs group C. A: Ischemia reperfusion group; B: Dexmedetomidine group; C: Blank control group; D: Oman penicillin group; E: Oman penicillin + dexmedetomidine group |
|
图 2 5组大鼠左肺组织HE染色检查结果 Fig.2 HE staining of the left lung of the rats in the 5 groups (Original magnification: ×100). There were no abnormal morphological changes in group C. Alveolar structure disorder, epithelial cell degeneration, necrosis, a large number of fluid exudation and inflammatory cell infiltration were found in groups A, D and E. The most obvious pathological changes were observed in group D, followed by group E and group A; these pathological changes were milder in group B. Group A: Ischemia reperfusion group; Group B: Dexmedetomidine group; Group C: Blank control group; Group D: Oman penicillin group; Group E: Oman penicillin+dexmedetomidine group. |
|
图 3 5组大鼠左肺组织Tunel染色检查结果 Fig.3 TUNEL staining of the left lung tissue of the rats in the 5 groups (×100). A: Ischemia reperfusion group; B: Dexmedetomidine group; C: Blank control group; D: Oman penicillin group; E: Oman penicillin+dexmedetomidine group. |
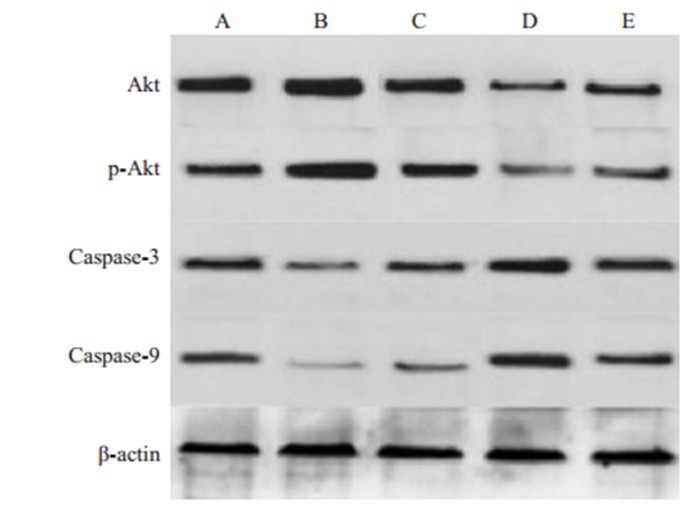
Western blot检测结果显示,与其他四组相比,B组的Akt、p-AKT蛋白表达量显著较高(P < 0.05),Caspase-3、Caspase-9蛋白相对表达量明显更低(P < 0.05,表 3、图 4)。
| 表 3 5组大鼠实验结束时Akt、p-AKT、Caspase-3、Caspase-9蛋白相对表达量 Tab.3 Relative expression of Akt, p-AKT, caspase-3 and caspase-9 at the end of the experiment in the 5 groups (Mean±SD, n=8) |
|
图 4 不同组大鼠实验结束时左肺组织Akt、p-AKT、caspase-3、caspase-9的蛋白印迹图 Fig.4 Western blotting of Akt, p-AKT, caspase-3 and caspase-9 in the left lung tissue in different groups at the end of the experiment. Group A: Ischemia reperfusion group; Group B: Dexmedetomidine group; Group C: Blank control group; Group D: Oman penicillin group; Group E: Oman penicillin+dexmedetomidine group |
约2%的CPB肺损伤会不可逆地进展为急性呼吸窘迫综合征,死亡率高达30%~50% [16]。寻求更高效的肺保护措施一直是临床研究的热点及难点。渥曼青霉素主要用于医药中间体,在动物学常用作PI3K/PKB通路的抑制剂用于对该通路性质的研究,在近年基础研究中被证实可诱发肿瘤细胞凋亡[17],本研究发现右美托咪啶能够减轻体外循环缺血再灌注损伤,进一步研究发现采用渥曼青霉素联合右美托咪啶组,用于评价右美托咪啶对减少渥曼青霉素诱导的凋亡及损伤,但从肺组织病理组织评分及凋亡率评价上均显示其对渥曼青霉素损伤引发的缓冲作用轻微。张小宁[18]采用渥曼青霉素诱导海马CA1区神经元凋亡,加用右美托咪定后可有效减少神经元细胞凋亡率,具有神经元保护作用。本次研究得出了右美托咪定对渥曼青霉素损伤没有显著的修复作用,可能原因为渥曼青霉素并非为本次研究中肺组织损伤凋亡的主要诱因,相对于缺血再灌注组,单用渥曼青霉素也并未明显加重组织损伤或凋亡,因此在对渥曼青霉素的诱发的组织损伤与细胞凋亡的缓冲作用也体现得并不明显。
在本研究中,尽管右美托咪啶在开放肺门及实验结束时心率、血压呈降低趋势,但显著高于除空白对照外的其他三组,且在实验结束时,右美托咪定组组大鼠氧合指数显著较高,呼吸指数显著较低。已有研究表明,右美托咪啶可辅助维持呼吸循环系统稳定,其应用于危重患者尽管可出现心率下降,但心输出量与血压可无明显波动[19-20]。研究显示,右美托咪定应用于脓毒症大鼠模型时,尽管大鼠心率下降,但呼吸指数、氧合指数及MAP不存在显著波动,提示右美托咪定对呼吸及循环系统就具有保护作用[21]。实际上,右美托咪定已广泛应用于全身麻醉辅助,可维持呼吸循环系统稳定性,并减少疼痛与术后躁动[22-23]。我们的研究结果显示显示右美托咪定有效降低了CPB大鼠肺组织损伤,提示右美托咪定对改善CPB大鼠肺功能有着确切效果。关于右美托咪定对损伤肺上皮保护作用的机制研究结论不一,Cui等[24]发现,右美托咪定可通过抑制肺泡上皮细胞氧自由基、细胞色素C等有害因子的产生与释放,提高细胞活性,减轻损伤。p38MAPK信号通路中的高迁移率族蛋白B1可能是右美托咪定发挥肺泡上皮细胞保护作用的靶点[25]。氧合指数与呼吸指数是一对负相关指标,二者的动态变化可反映肺功能的变化。右美托咪定是一类α2受体激动剂,作用于心血管系统时可抑制交感活性[26],但在实验中并未出现低血压或心动过缓,这可能是由于其对血流动力学的稳定作用超过了对交感抑制的副作用,但具体机制还有待进一步研究,也同时提示右美托咪定在心血管系统稳定性具备一定的安全性。
P13K是磷脂酶家族中的一种异源二聚体,是一种重要的胞内信号传导分子。Akt是P13K下游的信号分子,也是多条信号通路的交汇点[27]。Caspase家族共有14种caspase蛋白,是P13K/Akt信号通路更下游的效应分子,在生理情况下,以酶原形式存在,参与细胞凋亡[28]。其中,Caspase-9是细胞凋亡的主要启动者,Caspase-3是主要的执行者,整个过程一旦启动,将不可逆地进行。研究显示,P13K/Akt信号通路参与了右美托咪定减少大鼠脑与肾脏缺血再灌注损伤过程[29-30]。P13K/ Akt/HIF-1α(低氧诱导因子-1)介导了血管内皮细胞缺氧损伤,可促进凋亡因子表达,抑制抗凋亡因子的表达,进而诱导缺氧状态下细胞的凋亡[31]。Akt是P13K/Akt的核心环节,P13K可通过丙酮酸脱氢酶激酶实现Akt磷酸化激活,进而发挥其生物学效应。Markou等[32]最早发现,P13K/Akt信号系统可能参与了CPB肺损伤的发生发展。本研究中的Western blot检测结果显示,与其他四组相比,右美托咪定组大鼠的Akt、p-AKT蛋白表达量显著较高,Caspase-3、Caspase-9蛋白相对表达量明显更低。这表明,右美托咪定可通过激活P13K/ Akt信号通路,抑制下游Caspase蛋白表达,减轻肺损伤。这种保护机制也见于感染性休克的大鼠模型中,右美托咪定可显著降低感染性休克大鼠脾脏及胸腺中Caspase-3/9的表达水平,改善预后[18]。
综上所述,本研究发现,右美托咪定可有效减轻CPB大鼠的肺损伤,PI3K/Akt信号通路相关的Caspase- 3/9蛋白可能是其重要的作用靶点。
| [1] |
Shi SS, Yue XJ, Zhao DY, et al. Plasma gelsolin level predicts acute kidney injury after cardiopulmonary bypass in infants and young children[J]. World J of Pediatrics, 2018, 14(2): 143-50. DOI:10.1007/s12519-017-0116-4 |
| [2] |
王焰斌, 崔刚, 黄志勇, 等. 缺血后处理对体外循环心脏瓣膜置换患者心电图的影响[J]. 西安交通大学学报:医学版, 2018, 39(5): 703-8. |
| [3] |
Guay J, Kopp S. Epidural analgesia for adults undergoing cardiac surgery with or without cardiopulmonary bypass[J]. Cochrane Database Syst Rev, 2019, 1(3): 54-9. |
| [4] |
Michalski M, Pagowska-Klimek I, Thiel S, et al. Factors involved in initiation and regulation of complement lectin pathway influence postoperative outcome after pediatric cardiac surgery involving cardiopulmonary bypass[J]. Sci Rep, 2019, 9(1): 10. DOI:10.1038/s41598-018-36877-0 |
| [5] |
刘曦, 陈彧, 赵舟, 等. 非体外循环冠状动脉旁路移植术中转体外循环的预后、原因及危险因素分析[J]. 中国循环杂志, 2014, 29(11): 879-83. DOI:10.3969/j.issn.1000-3614.2014.11.006 |
| [6] |
Shi H, Lu RJ, Wang S, et al. Effects of SDF-1/CXCR4 on acute lung injury induced by cardiopulmonary bypass[J]. Inflammation, 2017, 40(3): 937-45. DOI:10.1007/s10753-017-0538-0 |
| [7] |
Feng JB, Liu HY, Chen JY, et al. Levosimendan reduces lung injury in a canine model of cardiopulmonary bypass[J]. Korean Circ J, 2016, 46(3): 402-7. DOI:10.4070/kcj.2016.46.3.402 |
| [8] |
Meng F, Han J, Wang J, et al. The gender-specific expression of neuropeptide Y and neuropeptide Y receptors in human atrial tissue during cardiopulmonary bypass surgery[J]. J Thorac DisDOI: 10.21037/jtd,2018,10(12):6563-8.
|
| [9] |
陈玲阳, 林仙菊, 王明仓, 等. 不同剂量右美托咪定对体外循环下心脏瓣膜手术患者肺损伤的保护作用[J]. 现代实用医学, 2018, 30(10): 0800-1671. |
| [10] |
Weerink MA, Struys MM, Hannivoort LN, et al. Clinical pharmacokinetics and pharmacodynamics of dexmedetomidine[J]. Clin Pharmacokinet, 2017, 56(8): 893-913. DOI:10.1007/s40262-017-0507-7 |
| [11] |
马波, 刘志恒, 王显春. 右美托咪定镇痛的临床应用进展[J]. 临床麻醉学杂志, 2018, 34(11): 1136-9. DOI:10.12089/jca.2018.11.023 |
| [12] |
岳芳, 吴涯雯, 汪海金, 等. 右美托咪定对大鼠肠缺血再灌注致胃粘膜损伤的影响[J]. 中华麻醉学杂志, 2016, 36(3): 0254-1416. |
| [13] |
Hashmi JA, Loggia ML, Khan S, et al. Dexmedetomidine disrupts the local and global efficiencies of large-scale brain networks[J]. Anesthesiology, 2017, 126(3): 419-30. DOI:10.1097/ALN.0000000000001509 |
| [14] |
Hanci V, Yurdakan G, Yurtlu S, et al. Protective effect of dexmedetomidine in a rat model of α-naphthylthiourea-induced acute lung injury[J]. J Surg Res, 2012, 178(1): 424-30. DOI:10.1016/j.jss.2012.02.027 |
| [15] |
Chen C, Zhang ZZ, Chen K, et al. Dexmedetomidine regulates inflammatory molecules contributing to ventilator-induced lung injury in dogs[J]. J Surgi Res, 2014, 187(1): 211-8. DOI:10.1016/j.jss.2013.09.018 |
| [16] |
Hu X, Shen HT, Wang Y, et al. Liver X receptor agonist TO901317 attenuates Paraquat-Induced acute lung injury through inhibition of NF-kappa B and JNK/p38 MAPK signal pathways[J]. Biomed Res Int, 2017(4): 1-13. |
| [17] |
郭云学, 莫德林, 陈瑶生, 等. PI3K/AKT抑制剂渥曼青霉素对猪前体脂肪细胞增殖和凋亡的影响[J]. 遗传, 2012, 34(10): 64-72. |
| [18] |
Luo CF, Yuan DD, Yao WF, et al. Dexmedetomidine protects against apoptosis induced by hypoxia/reoxygenation through the inhibition of gap junctions in NRK-52E cells[J]. Life Sci, 2015, 122(122): 72-7. |
| [19] |
Pandharipande PP, Sanders RD, Girard TD, et al. Effect of dexmedetomidine versus lorazepam on outcome in patients with sepsis: an a priori-designed analysis of the MENDS randomized controlled trial[J]. Crit Care, 2010, 14(2): R38. DOI:10.1186/cc8916 |
| [20] |
Tan JA, Ho KM. Use of dexmedetomidine as a sedative and analgesic agent in critically ill adult patients: a meta-analysis[J]. Intensive Care Med, 2010, 36(6): 926-39. DOI:10.1007/s00134-010-1877-6 |
| [21] |
马燕, 于湘友. 不同剂量右美托咪定对脓毒症大鼠早期免疫调节的影响[J]. 中华急诊医学杂志, 2016, 25(9): 1149-53. DOI:10.3760/cma.j.issn.1671-0282.2016.09.011 |
| [22] |
Bong CL, Lim E, Allen JC, et al. A comparison of single-dose dexmedetomidine or propofol on the incidence of emergence delirium in children undergoing general anaesthesia for magnetic resonance imaging[J]. Anaesthesia, 2015, 70(4): 393-9. DOI:10.1111/anae.12867 |
| [23] |
Hongo M, Fujisawa S, Adachi T, et al. Age-related effects of dexmedetomidine on myocardial contraction and coronary circulation in isolated Guinea pig hearts[J]. J Pharmacol Sci, 2016, 131(2): 118-25. DOI:10.1016/j.jphs.2016.05.002 |
| [24] |
Cui J, Zhao H, Wang C, et al. Dexmedetomidine attenuates oxidative stress induced lung alveolar epithelial cell apoptosis in vitro[J]. Oxidative Medicine & Cellular Longevity, 2015(6): 1-11. |
| [25] |
王晓光, 齐晓非, 李戈辉. 右美托咪啶对大鼠肺IRI中p38MAPK信号通路及肺组织HMGB1表达的影响[J]. 临床肺科杂志, 2016, 21(6): 1009-6663. |
| [26] |
Peng Y, Zhu HF, Chen HD, et al. Dexmedetomidine attenuates acute paroxysmal sympathetic hyperactivity[J]. Oncotarget, 2017, 8(40): 69012-9. |
| [27] |
Mathews ES, Appel B. Cholesterol biosynthesis supports myelin gene expression and Axon ensheathment through modulation of P13K/Akt/mTor signaling[J]. J Neurosci, 2016, 36(29): 0716-26. |
| [28] |
张伟, 张卫. PI3K-Akt-HIF-1α信号通路在右美托咪定减轻单肺通气大鼠非通气侧肺损伤中的作用[J]. 中华麻醉学杂志, 2016, 36(2): 242-5. DOI:10.3760/cma.j.issn.0254-1416.2016.02.031 |
| [29] |
Zhua YM, Wang CC, Chen L, et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J]. Brain Res, 2013, 1494(3): 1-8. |
| [30] |
孙经武, 王艳艳, 房灿. 藏红花酸预处理对大鼠心肌缺血再灌注损伤中炎症反应和细胞凋亡的影响及其机制[J]. 中国循环杂志, 2015(2): 172-5. DOI:10.3969/j.issn.1000-3614.2015.02.019 |
| [31] |
梁俊清, 徐海波, 陈小娟, 等. 通心络通过PI-3K/Akt/HIF信号通路改善血管内皮细胞缺氧损伤[J]. 中国病理生理杂志, 2012, 28(5): 846-51. DOI:10.3969/j.issn.1000-4718.2012.05.014 |
| [32] |
Martini M, De Santis MC, Braccini L, et al. PI3K/AKT signaling pathway and cancer: an updated review[J]. Ann Med, 2014, 46(6): 372-83. DOI:10.3109/07853890.2014.912836 |
 2019, Vol. 39
2019, Vol. 39

