2. 安徽中医药大学 药学院,安徽 合肥 230021;
3. 安徽中医药大学 医药信息工程学院,安徽 合肥 230021
2. College of Pharmacy, Anhui University of Chinese Medicine, Hefei 230021, China;
3. College of Information Engineering, Anhui University of Chinese Medicine, Hefei 230021, China
中风病是世界范围内主要的致残原因[1-2]。神经干细胞(NSCs)在神经发育和修复受损神经组织中发挥重要作用[3-6]。脑缺血病变后内源性NSCs的再生是机体实现自身修复的潜力。NSCs在脑缺血后增殖分化的速度与抑制其再生有关[7-9]。当NSCs向损伤灶局部迁移时,其量及有效分化程度却明显不足,甚至失去迁移能力[10-11]。因此,对于缺血性中风NSCs增殖分化及其干预研究有重要意义。中药复方治疗缺血性中风病有较好疗效,中医药在治疗缺血性中风凸显重要作用[12-13]。脑络欣通具有促进NSCs增殖的作用。脑络欣通可诱导NSCs分化成神经元、星形胶质细胞和少突胶质细胞,同时,脑络欣通能改善NSCs增殖的微环境[14-18]。既往研究主要集中在脑络欣通对NSCs增殖、分化作用,而对NSCs增殖分化的特征性标志物及分化程度研究较少,且缺乏脑络欣通对NSCs分化过程的动态观察研究。而缺血性中风在疾病不同时期NSCs的增殖分化程度不同,故本文着重以脑络欣通对NSCs的不同时间节点观察,并动态观察缺血后内源性NSCs分化为神经元细胞和胶质细胞的共同标记物β-微管蛋白Ⅲ(β-tubulinⅢ)/胶质纤维酸性蛋白(GFAP)的变化,以期更好了解脑络欣通的作用靶点。
1 材料和方法 1.1 材料 1.1.1 细胞和分组C17.2小鼠永生化NSCs细胞株(ATCC,zs100493)。将NSCs细胞株分为空白模型组(MC)、10%脑络欣通含药血清组(NLXT)、10%脑络欣通含药血清+Y27632组(以下简称Y-27632组)。
1.1.2 药物含药血清:取10只大鼠并标记为NLXT组,中药材由安徽广印堂中药股份有限公司提供。按NLXT原方比例分别称取黄芪30 g(批号:160902),川芎10 g(批号:160901),三七6 g(批号:160901),天麻10 g(批号:160801),当归10 g(批号:160803),红花10 g(批号:160801),蜈蚣2条(批号:160801)。将称取的药材(除去蜈蚣)加入砂罐中,常规煎煮得出煎煮液。将煎煮液低速离心取上清液过滤,再用旋转蒸发仪浓缩至1 mL含生药1 g。NLXT组按8.54g/(kg·d)灌胃共给药3 d,并于第3天最后一次灌胃后取血清备用。
1.1.3 主要试剂和仪器Transwell小室(Corning,Cat. No:3422,Lot.No:26117004),胎牛血清(MRC,Cat.No:CCS30009.02,Lot.No:S171204F),NSCs成神经元诱导分化培养基(Cyagen,Cat.No:MUXNX-90081,Lot.No:T171206G001),DMEM(Hyclone,Cat.No:SH30022.01,Lot.No:AC13298765),DMEM/F12(Hyclone,Cat.No:SH30023.01,Lot.No:AC11256314),DMSO(Solarbio,Cat.No:D8370,Lot.No:11773002),MTT(Solarbio,Cat. No:D8370,Lot.No:1172103),山羊抗兔-FITC二抗(Zsbio,Cat.No:ZF-0311,Lot.No:1345863),TRITC二抗(Zsbio,Cat.No:ZF-0313,Lot.No:133502),β-Actin(Zsbio,Cat.No:TA-09,Lot.No:18AV0403),甘氨酸(Solarbio,Cat.No:G8200,Lot.No:109J063),Tris(Solarbio,Cat.No:G8060,Lot.No:117W074),Tween-20(Solarbio,Cat.No:T8200,Lot.No:822I0424),预染蛋白Marker(Thermo,Cat.No:26616G8060,Lot.No:610351),PVDF膜(Millipore Cat.No:IPVH00010,Lot.No:R7JA4305G),ECL超敏反光试剂盒(Millipore Cat.No:34094,Lot.No:SF249607),GFAP小鼠抗小鼠(Bioss,Cat.No:bsm-33065M,Lot.No:AH03084346),β-tubulin Ⅲ兔抗小鼠(Bioss,Cat.No:bs-2670R,Lot.No:AG09273217),Brdu诱导剂(Sigma,Cat.No:B5002,Lot.No:11D037),Brdu小鼠抗小鼠(Bioss,Cat.No:bsm-0917M,Lot.No:AG08255316),双皮质素(DCX)兔抗小小鼠(Bioss,Cat.No:bsm-33065M,Lot.No:AG08255429),NeuN兔抗小鼠(Bioss,Cat.No:bs-10394R,Lot.No:AG07113117)。
1.2 实验方法 1.2.1 NSCs特征性标志蛋白巢蛋白(Nestin)鉴定将细胞悬液培养并予血清封闭。加一抗和相应种属二抗室温孵育50 min;细胞核复染并避光室温孵育。封片并镜检拍照。
1.2.2 NSCs细胞活性测定及细胞迁移观察采用MTT法检测NSCs细胞活性。Transwell小室观察NSCs迁移。光学显微镜下观察并随机拍照5个视野,计算每视野的侵袭细胞数,计算平均值。视野中显示的细胞即为穿过transwell小室底膜的细胞。
1.2.3 免疫印迹法观察β-TubulinⅢ、GFAP、MAP-2蛋白表达收集细胞并提取细胞蛋白;蛋白上样与电泳(电泳浓缩胶和分离胶的配方见表 1);转膜并封闭液封闭。4 ℃一抗孵育和二抗孵育;凝胶成像系统扫描并计算条带灰度值,以β-TubulinⅢ、GFAP、MAP-2与β-actin灰度值比值为相对表达量。
| 表 1 电泳浓缩胶与分离胶的比例 Tab.1 Electrophoretic concentrated gel and separation gel ratio |
显色剂DAPI染核,呈蓝色;显色剂FITC标记DCX、NEUN、β-TubulinⅢ,呈绿色;显色剂TRITC标记Brdu、GFAP,呈红色。
1.2.5 统计学分析采用SPSS 22.0软件分析,数据用均数±标准差表示。组间比较用单因素方差分析。P < 0.05具有统计学差异。
2 结果 2.1 NSCs特征性标志蛋白Nestin鉴定荧光显微镜下观察发现,当细胞出现明显的绿色荧光和染细胞核的蓝色荧光,说明C17.2细胞株复苏、传代成功(图 1)。
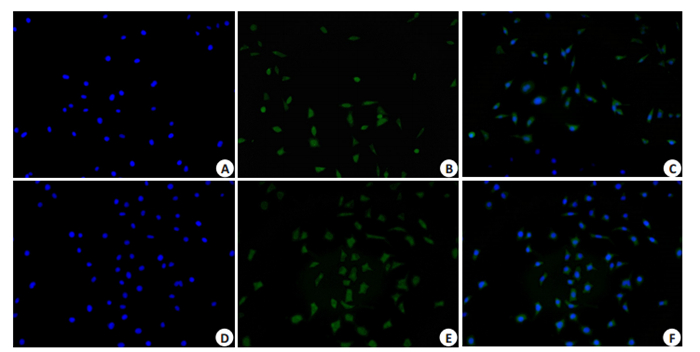
|
图 1 C17.2细胞株复苏传代后nestin染色 Fig.1 Nestin staining of resuscitated of C17.2 cell line (Original magnificatio: ×100). A, B, C: Fluorescent staining of the cells before induction; D, E, F: Fluorescent staining of the cells at 1 day of induction. |
MTT检测结果显示,与MC组比较,第7天NLXT组和Y-27632组细胞存活率明显升高(P < 0.05,图 2)。transwell法观察NSCs迁移结果显示,与MC组比较,第1天和第3天NLXT组、Y-27632组迁移细胞数增多(P < 0.05);第7天NLXT组、Y-27632组迁移细胞数显著增多(P < 0.01,图 3)。

|
图 2 脑络欣通对NSCs活性的影响 Fig.2 Effect of NLXT on the activity of NSCs. △P < 0.05 vs MC group. |
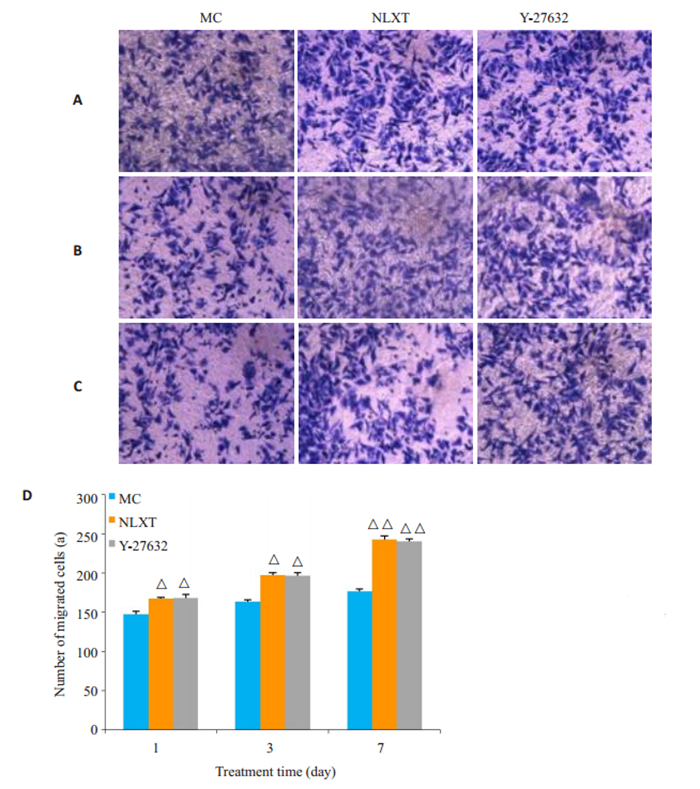
|
图 3 脑络欣通对NSCs迁移的影响 Fig.3 Effect of Naoluo Xintong on the migration of NSCs. A, B, C: Number of migrated cells on day 1, 3, and 7, respectively (× 100); D: Comparison of the number of migrated cells. △P < 0.05, △△P < 0.01 vs MC group. |
第1天β-tubulinⅢ、MAP-2和GFAP在各组间比较差异无统计学意义(P>0.05)。与MC组比较,第3天、第7天NLXT组和Y-27632组β-tubulinⅢ、MAP2、GFAP蛋白表达显著升高(P < 0.01或P < 0.05,图 4~6)。

|
图 4 β-tubulinⅢ的表达 Fig.4 Expression of β-tubulin Ⅲ protein in the cells detected by Western blotting on day 1 (A), 3(B), and 7(C) with quantitative analysis (D). △P < 0.05, △△P < 0.01 vs MC. |

|
图 5 MAP-2的表达 Fig.5 Expression of MAP-2 protein in the cells detected by Western blotting on day 1(A), 3 (B), and 7(C) with quantitative analysis (D). △△P < 0.01 vs MC. |
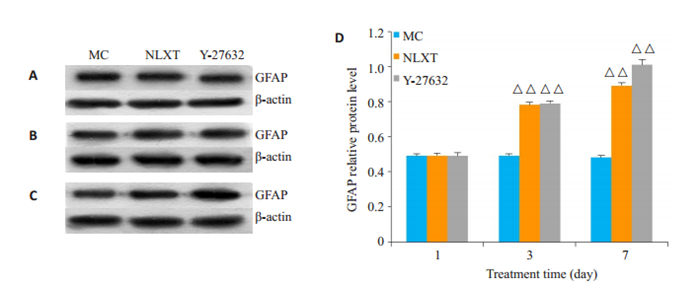
|
图 6 GFAP的表达 Fig.6 Expression of GFAP protein in the cells detected by Western blotting on day 1 (A), 3(B), and 7(C) with quantitative analysis (D). △△P < 0.01 vs MC. |
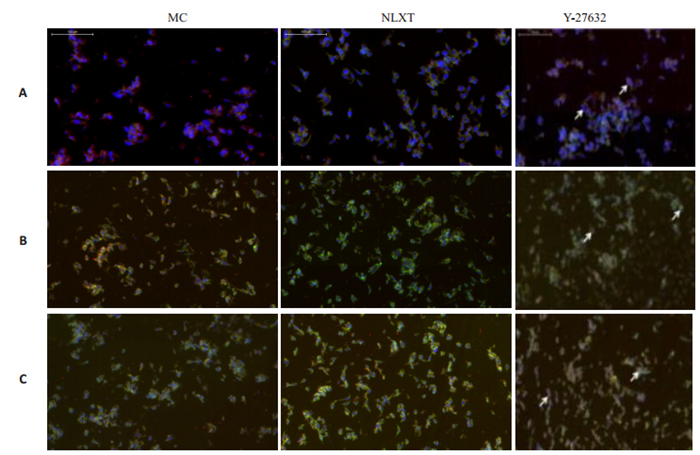
免疫荧光标记β-tubulinⅢ/GFAP表达观察发现,β- tubulinⅢ阳性反应呈绿色,GFAP呈红色,MC组中星形胶质细胞少量表达。NLXT组在第1天, 第3天和第7天β-tubulinⅢ阳性细胞明显增多,Y-27632组β-tubulinⅢ和GFAP阳性细胞明显增多,第7天达到最高峰且分布均匀(图 7)。神经元新生特异性标记BrdU/DCX免疫荧光显示:MC组见极少量BrdU/DCX标记阳性细胞;NLXT组有少量标记阳性细胞,双染散在细胞数目有限,第1天, 第3天与第7天比较未出现增多;Y-27632组BrdU/DCX标记阳性细胞增多,且第7天阳性细胞数比第1天,第3天明显增多(图 8)。

|
图 7 β-tubulinⅢ/GFAP阳性细胞表达 Fig.7 Expression of β-tubulinIII/GFAP in the NSCs detected by immunofluorescence assay on day 1 (A), 3 (B), and 7 (C) (× 200). |
|
图 8 BrdU/DCX阳性细胞表达 Fig.8 Expression of BrdU/DCX in the NSCs detected by immunofluorescence assay on day 1 (A), 3 (B), and 7 (C) (×200). |
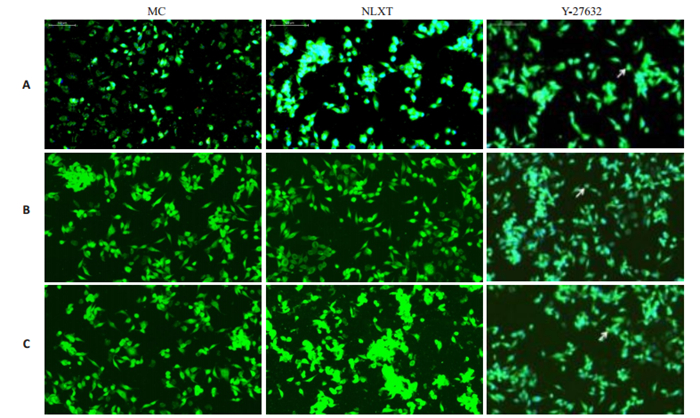
BrdU/NEUN免疫荧光标记为分化成熟神经元特异性标记,MC组BrdU/NEUN标记阳性细胞呈富集性,分布均匀;NLXT组标记细胞数目较空白组明显增多,且逐渐分布规律;Y-27632组与空白组、NLXT组比较,BrdU/NEUN标记阳性细胞数目呈进一步增多,分化明显,分布均匀,细胞形态完好(图 9)。
|
图 9 BrdU/NEUN阳性细胞表达 Fig.9 Expression of BrdU/NEUN in the NSCs detected by immunofluorescence assay on day 1 (A), 3 (B), and 7(C) (×200). |
脑缺血中风发生后脑组织可自发诱导NSCs增殖和分化,NSCs对损伤脑组织进行修复,脑组织缺血缺氧早期NSCs标志蛋白Nestin蛋白表达升高预示NSCs的激活,修复脑损伤[19-20]。因此,Nestin蛋白表达水平可作为判断中枢神经系统修复能力的指标,Nestin可反映脑组织中NSCs变化。并且,NSCs在脑缺血早期可有效进行神经功能维持和恢复,显著降低脑组织损伤程度[21-23]。本实验结果显示,空白模型组中在第1天,第3天可见少量表达Nestin标记阳性细胞,细胞体形态及排列不规整;第7天时Nestin阳性细胞数目进一步增多,反应更加强烈。脑络欣通组和阻滞剂组,脑缺血第1天时Nestin表达开始明显增加,第3天时Nestin表达显著增强,第7天时Nestin表达进一步增强。说明脑缺血中风发生后会重塑NSCs再生,而脑络欣通能和抑制剂作用类似,可迅速促进NSCs的增殖,并进一步修复损伤细胞。
β微管蛋白在NSCs由圆形分化为有极性的神经元过程中发生变化。β微管蛋白具有七个同源体, 其中β-微管蛋白-Ⅲ具有神经元特异性, 它是原始神经上皮中所表达的最早的神经元标志物之一。GFAP是神经胶质细胞标记物。本实验采用β-tubulinⅢ/GFAP共同标记来观察脑缺血后内源性NSCs分化为神经元细胞和胶质细胞的变化,从而进一步观察脑络欣通对NSCs增殖、分化的影响。实验结果显示,第1天时β- tubulinⅢ和GFAP阳性细胞明显增多,第3天,第7天呈现逐渐减少趋势;脑络欣通组β-tubulinⅢ阳性细胞都明显增多,GFAP阳性细胞变化不明显。阻滞剂组GFAP阳性细胞从第1天到第7天逐渐减少,β-tubulinⅢ阳性细胞增多且分布较为规律,与时间呈现正相关性。DCX与神经元迁移和分化相关,采用免疫荧光标记DCX/BrdU反应神经再生过程中迁移的NSCs。BrdU/DCX免疫荧光标记为神经元新生特异性标记,通过观察BrdU/DCX免疫荧光标记阳性细胞变化,可反映脑缺血损伤后NSCs分化情况。实验结果显示空白模型组见极少量BrdU/ DCX标记阳性细胞,空白模型组有少量标记阳性细胞。脑络欣通组和阻滞剂组BrdU/DCX标记阳性细胞增多,且第7天比第1天和第3天明显增多,且分布规律,呈集中分布。BrdU标记具有增殖迁移和分化能力的神经细胞。采用免疫荧光标记NeuN/BrdU反应神经再生过程中由NSCs新分化而来的神经元细胞。BrdU/ NEUN免疫荧光标记为分化成熟神经元特异性标记,空白模型组标记阳性细胞数目明显减少,第3天减少最为明显;脑络欣通组和阻滞剂组标记阳性细胞数目较空白组明显增多,第7天增多明显且逐渐分布规律。以上研究结果均提示脑络欣通具有类Y-27632样作用,能推动轴突再生促进神经干细胞的增殖,诱导分化。
前期研究发现[24-26]脑络欣通临床上治疗脑血管疾病疗效显著[27-30]。元气充足,则气能摄血,血液贯通于脉络,使血液循环畅通,而血循脉道则血液上于脑窍,保证大脑组织血液和氧气供应充足。气旺以生新血使化生有源。因此,在治疗缺血性中风病气虚血瘀证时应予“益气活血通络”法[32]。遵从“益气活血通络”法拟定的中药复方“脑络欣通”,全方由黄芪、川芎、三七、蜈蚣等组成。黄芪具有补气之功效,补气主要是改善机体功能状态,补气则消除脉中之瘀;气旺以生血活血,从而改善脑部血液循环。川芎具有活血、通络止痛功效。川芎活血而顺畅,使得机体气血渗灌脉络。三七具有活血化瘀之功;三七佐以蜈蚣则血脉疏通。脑络欣通全方扶正祛邪、攻补兼施,活血中寓以补气,使气贯经脉以助血行,营血流畅经脉得养。本研究通过脑络欣通对NSCs增殖和分化观察发现,脑络欣通干预后,GFAP阳性细胞从第1天到第7天逐渐减少,β-tubulinⅢ阳性细胞增多且分布较为规律,与时间呈现正相关性。说明脑络欣通能够促进NSCs向神经元细胞和胶质细胞分化,修复损伤细胞。
| [1] |
Yu W, Jiang WJ. Stenting for intracranial stenosis: potential future for the prevention of disabling or fatal stroke[J]. Stroke Vasc Neurol, 2018, 3(3): 140-6. DOI:10.1136/svn-2018-000158 |
| [2] |
Yu X, Wang X, Zeng S, et al. Protective effects of primary neuralstem cell treatment in ischemic stroke models[J]. Exp Ther Med, 2018, 16(3): 2219-28. |
| [3] |
Zhang G, Chen L, Chen W, et al. Neural stem cells alleviate inflammation via neutralization of IFN-γ negative effect in ischemic stroke model[J]. J Biomed Nanotechnol, 2018, 14(6): 1178-88. DOI:10.1166/jbn.2018.2568 |
| [4] |
Andres-Mach M, Haratym-Maj A, Zagaja M, et al. ACEA (a highly selective cannabinoid CB1 receptor agonist) stimulates hippocampal neurogenesis in mice treated with antiepileptic drugs[J]. Brain Res, 2015, 1624(15): 86-94. |
| [5] |
Tahta A, Izgi N, Bagci-Onder T, et al. Assessment of the MRI and behavioral test results in a focal cerebral ischemia-reperfusion model in the rat after separate and combined use of mouse-derived neural progenitor cells, human-derived neural progenitor cells and atorvastatin[J]. Turk Neurosurg, 2018, 28(4): 571-81. |
| [6] |
Jiang XC, Xiang JJ, Wu HH, et al. Neural stem cells transfected with reactive oxygen species-responsive polyplexes for effective treatment of ischemic stroke[J]. Adv Mater, 2019, 31(10): e1807591. DOI:10.1002/adma.201807591 |
| [7] |
Huat TJ, Khan AA, Abdmllah JM, et al. Mirna expression profile of neural progenitor-like cells derived from rat bone marrow mesenchymal stem cells under the influence of IGF-1, bFGF and EGF[J]. Int J Mol Sci, 2015, 16(5): 9693-718. |
| [8] |
Machado VM, Morte MI, Carreira BP, et al. Involvement of calpains in adult neurogenesis: implications for stroke[J]. Front Cell Neurosci, 2015, 9: 22. |
| [9] |
Yu X, Wang X, Zeng S, et al. Protective effects of primary neural stem cell treatment in ischemic stroke models[J]. Exp Ther Med, 2018, 16(3): 2219-2228. |
| [10] |
Lee SH, Lumelsky N, Studer L, et al. Efficient generation of midbrain and hindbrain neurons from mouse embryonic stem cells[J]. Nat Biotechnol, 2000, 18(6): 675-9. DOI:10.1038/76536 |
| [11] |
Boese AC, Le QE, Pham D, et al. Neural stem cell therapy for subacute and chronic ischemic stroke[J]. Stem Cell Res Ther, 2018, 9(1): 154. DOI:10.1186/s13287-018-0913-2 |
| [12] |
张兰兰, 曹琼, 胡子有, 等. 槲皮素对成年大鼠局灶性脑缺血后侧脑室室管膜下区神经干细胞增殖的影响[J]. 南方医科大学学报, 2011, 31(7): 1200-3. |
| [13] |
唐巍, 王键, 王又闻, 等. 脑络欣通和左归丸药物血清对体外培养的大鼠神经干细胞增殖分化的作用[J]. 中国中西医结合杂志, 2010, 30(2): 182-7. |
| [14] |
韩义皇, 王键. 脑络欣通对大脑中动脉阻塞再灌注模型大鼠神经干细胞增殖分化的影响[J]. 安徽中医药大学学报, 2017, 36(6): 58-63. DOI:10.3969/j.issn.2095-7246.2017.06.017 |
| [15] |
陈立铭, 裴磊. 脑络欣通和左归丸药物血清体外培养神经干细胞的增殖与分化[J]. 中国组织工程研究, 2016, 20(32): 4845-51. DOI:10.3969/j.issn.2095-4344.2016.32.020 |
| [16] |
唐巍, 王键, 王又闻, 等. 脑络欣通和左归丸药物血清对体外培养的大鼠神经干细胞增殖分化的作用[J]. 中国中西医结合杂志, 2010, 30(2): 182-7. |
| [17] |
王键, 陈业农, 唐巍, 等. 脑络欣通对局灶脑缺血/再灌注大鼠神经干细胞及相关调节因子影响的实验研究[J]. 中国中医基础医学杂志, 2008(11): 837-9. DOI:10.3969/j.issn.1006-3250.2008.11.016 |
| [18] |
唐巍, 王键, 陈业农, 等. 脑络欣通药物血清对大鼠胚胎神经干细胞生长分化的影响[J]. 北京中医药大学学报, 2007, 30(1): 32-5. DOI:10.3321/j.issn:1006-2157.2007.01.009 |
| [19] |
Jimenez-Gonzalez A, García-Concejo A, León-Lobera F, et al. Morphine delays neural stem cells differentiation by facilitating nestin overexpression[J]. Biochim Biophys Acta Gen Subj, 2018, 1862(3): 474-84. DOI:10.1016/j.bbagen.2017.10.016 |
| [20] |
Yan S, Li P, Wang Y, et al. Nestin regulates neural stem cell migration via controlling the cell contractility[J]. Int J Biochem Cell Biol, 2016, 78: 349-60. DOI:10.1016/j.biocel.2016.07.034 |
| [21] |
Zhang T, Yang X, Liu T, et al. Adjudin-preconditioned neural stem cells enhance neuroprotection after ischemia reperfusion in mice[J]. Stem Cell Res Ther, 2017, 8(1): 248. DOI:10.1186/s13287-017-0677-0 |
| [22] |
Shen F, Walker EJ, Jiang L, et al. Coexpression of angiopoietin-1 with vegf increasest-he structural integrity of the blood-brain barrier and reduces atrophy volume[J]. J Cereb Blood Flow Metab, 2011, 31(12): 2343-51. DOI:10.1038/jcbfm.2011.97 |
| [23] |
Ye Q, Wu Y, Wu J, et al. Neural stem cells expressing bFGF reduce brain damage and restore sensorimotor function after neonatal hypoxia-ischemia[J]. Cell Physiol Biochem, 2018, 45(1): 108-18. DOI:10.1159/000486226 |
| [24] |
谭辉, 尹婷婷, 王键, 等. 气虚血瘀证脑缺血再灌注病证结合大鼠模型的建立与评价[J]. 中国中西医结合杂志, 2018, 38(7): 832-7. |
| [25] |
何玲, 王键. 新安医家验方脑络欣通改善缺血性中风作用机制研究的思路与方法[J]. 中华中医药杂志, 2017, 32(5): 1921-5. |
| [26] |
谭辉, 王键, 尹婷婷, 等. 益气活血方基于miR-124调控Wnt通路促进神经再生[J]. 南方医科大学学报, 2017, 37(8): 1047-53. DOI:10.3969/j.issn.1673-4254.2017.08.08 |
| [27] |
杨文明, 李祥, 王键, 等. 脑络欣通治疗脑梗死恢复期气虚血瘀证的临床研究[J]. 中西医结合心脑血管病杂志, 2013, 12(12): 1424-6. DOI:10.3969/j.issn.1672-1349.2013.12.007 |
| [28] |
陈城, 张桥, 杨文明. 脑络欣通颗粒对脑梗死急性期气虚血瘀证超氧化物歧化酶和丙二醛的影响[J]. 中医药临床杂志, 2018, 30(3): 501-4. |
| [29] |
杨文明, 李祥, 汪瀚, 等. 脑络欣通对缺血性中风(脑梗死)恢复期气虚血瘀证血液流变学、P-选择素的影响[J]. 中医药临床杂志, 2013, 25(11): 986-8. |
| [30] |
邓华. 脑络欣通颗粒治疗缺血性中风急性期气虚血瘀证临床研究[J]. 中外医学研究, 2017, 15(7): 133-5. |
 2019, Vol. 39
2019, Vol. 39

