2. 南方医科大学 南方医院中医科,广东 广州 510515;
3. 广东省传统医学与运动伤害康复研究所,广东 广州 510317
2. Department of Traditional Chinese Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Guangdong Institute of Traditional Medicine and Sports Injury Rehabilitation, Guangzhou 510317, China
重型再生障碍性贫血(SAA)是以全血细胞减少、骨髓增生重度减低为特征的骨髓衰竭综合征,其发病机制可比喻为种子学说、土壤学说和虫子学说,主要涉及造血干祖细胞破坏、造血微环境异常、免疫功能亢进等[1]。临床上60%~70%患者对免疫抑制治有效,但迄今为止仍未找到特异性自身抗原[2-3],SAA患者骨髓造血细胞数量严重减少,限制了对SAA发病机制的研究,故获得性骨髓衰竭动物模型有利于我们深入探讨SAA发病机制,国内外大量实验研究证实免疫介导骨髓衰竭小鼠模型是一个最接近SAA发病机制的动物模型[4-5]。
目前免疫介导的骨髓衰竭(BMF)模型受体小鼠主要为BALB/c和cByB6F1小鼠[2, 5-6, 7-9],而C57小鼠广泛应用于生物医学研究,尤其适用转基因或基因敲除动物体内研究相关基因和分子在疾病模型中的作用[10],故我们选用C57小鼠作为受体小鼠。在建立免疫介导的BMF模型过程中,辐照和淋巴细胞输注是两个必需条件,国外报道一般采用γ射线辐照,而γ射线源自放射性元素衰变,在国内γ射线主要用于特殊类型肿瘤治疗,如宫颈癌和颅内肿瘤放疗[11-12],而较少应用于医学实验研究;X射线由电子直线加速器产生,辐照剂量和时间容易控制,并且国内X射线辐照更为常见,更容易满足实验条件。目前尚未见文献报道应用X射线来建立BMF模型,由于X、γ射线来源、能量及穿透力不同,可能对小鼠骨髓影响不同,故我们先选取6.5、5.75、5.0 Gy三种亚致死剂量X射线来建立BMF模型,以探索合适剂量的X射线用于后续的实验研究。许多文献报道川芎嗪(TMP)能促进损伤后骨髓微环境和造血功能重建[13-14],并能减轻辐射诱导的DNA损伤、氧化应激反应及细胞凋亡[15],而川芎嗪是否能促进BMF模型小鼠骨髓损伤后修复还未见报道,故我们并将探索川芎嗪对BMF的影响。
1 材料和方法 1.1 实验材料和主要仪器C57BL/6雌性小鼠,SPF级,6周龄,体质量15~18 g,共88只,购自南方医科大学实验动物中心,合格证号:SYXK(粤)2016-0167,在SPF级动物房内饲养。DBA/2雌性小鼠14只,6周龄,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0006。试剂:川芎嗪单体购自成都曼思特生物科技有限公司, 批号:A0189(纯度≥98%)。辐照仪(MultiRad);轮转石蜡切片机(Leica);血细胞计数仪(迈瑞BC-5000全自动血细胞分析仪);光学显微照相系统(Olympus);Fas抗体(Abcam,ab82419);Goat Alexa Flour 594(Thermo Scientific,A11012)。
1.2 分组与处理按随机数字表法将受体C57小鼠分为空白对照组、X射线低剂量组、X射线中剂量组、X射线高剂量组,10只/组。颈椎脱位法处死供体DBA/2小鼠,于体积分数75%乙醇中浸泡5 min,无菌操作取其颈部、腋下、肠系膜淋巴结及胸腺,加PBS缓冲液,轻轻研磨后用200目筛网过滤,按胸腺细胞:淋巴结细胞=1: 2的比例制成淋巴细胞混悬液,浓度为2×107/mL。
1.3 免疫介导的BMF模型的建立受体C57小鼠经相应剂量X射线全身均匀照射后,4 h内经尾静脉输入DBA/2小鼠淋巴细胞混悬液0.2 mL,含4×106淋巴细胞。从淋巴细胞输入的当天计数存活时间。模型成功判定标准:血细胞计数:全血细胞减少;骨髓活检:骨髓多部位增生不良或低下,巨核细胞缺如,非造血细胞比例增多。
1.4 观察指标 1.4.1 一般情况监测每天观察各组小鼠的一般状况如精神、饮食、活动、毛发等,记录每只小鼠的存活天数,隔天称量存活小鼠体质量。
1.4.2 血细胞检测与骨髓有核细胞计数在小鼠濒死状态或存活14 d后,采用摘眼球取血法采血,置于EDTA抗凝管中,检测各组小鼠血细胞计数。取右侧股骨,用PBS缓冲液反复冲洗骨髓腔直至股骨发白,留取骨髓细胞悬液,裂解红细胞后计数骨髓有核细胞数量。
1.4.3 骨髓、肝、肾、小肠病理学检查取肝、肾、小肠置于10%中性甲醛固定72 h;取左侧股骨,浸泡于脱钙液中至股骨软化后,用自来水浸泡2 h,置于4%多聚甲醛固定72 h。以上组织经乙醇梯度脱水、石蜡包埋、半薄切片及苏木精-伊红染色后,显微镜下观察模型小鼠各组织病理情况,并进行病理分析。
1.4.4 免疫荧光法检测骨髓Fas表达将经脱钙和固定后的左侧股骨切1/2段,置于30%蔗糖溶液中脱水至,经OTC胶包埋后行冰冻切片。切片经山羊血清封闭1 h后加入一抗Fas(1: 200),4 ℃孵育过夜;再经Alexa Flour 594荧光标记山羊抗小鼠Ig G抗体(1: 500)于37 ℃孵育30 min后,荧光显微镜下观察。
1.5 川芎嗪给药干预经过对X射线剂量探索,选定5.0 Gy X射线作为C57小鼠建立BMF模型辐照剂量。按照上述方法造模,分模型对照组、川芎嗪高剂量组(20 mg/mL)、川芎嗪中剂量组(10 mg/mL)、川芎嗪低剂量组(5 mg/mL),12只/组。为避免川芎嗪影响淋巴细胞归巢至骨髓,川芎嗪干预组于造模24 h后经腹腔注射给与相应剂量川芎嗪溶液,模型对照组每天给与等量生理盐水,连续14 d,每天观察各组动物的一般状况,14 d后处理小鼠分析川芎嗪干预后模型小鼠BMF情况。
1.6 统计学处理使用SPSS 20.0分析数据, 计量资料用均数±标准差来表示,采用单向方差分析检验进行组间比较;用GraphPad Prism 5软件作图。P < 0.05为差异有统计学意义。
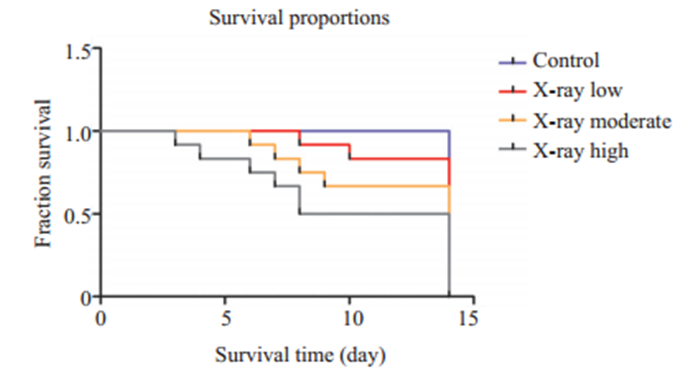
2 结果 2.1 造模后动物一般情况模型组小鼠自第2天起陆续出现倦怠、纳差、体质量下降,活动逐渐减少,弓背体形,竖毛;在造模14 d内5.0 Gy辐照组死亡2只(2/10),5.75 Gy辐照组死亡4只(4/10),6.5 Gy辐照组死亡5只(5/10),生存曲线见图 1。第14天解剖发现模型小鼠各脏器苍白,脾脏、胸腺明显萎缩。存活者自第10天体质量开始恢复,活动较前增加。
|
图 1 小鼠生存曲线 Fig.1 Survival curves of the mice with X-ray-induced immune-mediated bone marrow failure. |
模型小鼠在濒死状态或存活14 d后,外周血三系红细胞、白细胞、血小板和骨髓有核细胞数量都出现了明显下降(P < 0.05),尤其白细胞下降趋势最明显;随X射线剂量加大,外周血三系和骨髓有核细胞下降趋势越明显(图 2)。

|
图 2 造模后小鼠外周血细胞检测与骨髓有核细胞计数 Fig.2 Peripheral blood cell counts and counts of bone marrow nucleated cells after modeling. A: White blood cell count; B: Red blood cell count; C: Platelet count; D: Bone marrow nucleated cell count; *P < 0.05, ***P < 0.001 vs control. |
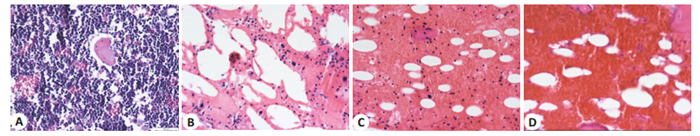
骨髓病理可见,空白对照组造血组织结构完整,造血细胞分布均匀,造血细胞增殖旺盛;而模型组小鼠骨髓充血明显,有核细胞明显减少,巨核细胞缺如,大量脂肪空泡代替造血细胞。随X射线辐照剂量增加,骨髓有核细胞越少,骨髓充血越明显;当X射线达到6.5 Gy时小鼠骨髓内几乎未见有核细胞(图 3)。
|
图 3 各组小鼠骨髓病理变化 Fig.3 Bone marrow pathology in each group (HE staining, original magnification: × 400) A: Control group; B: X-ray low dose group; C: X-ray moderate dose group; D: X-ray high dose group. |
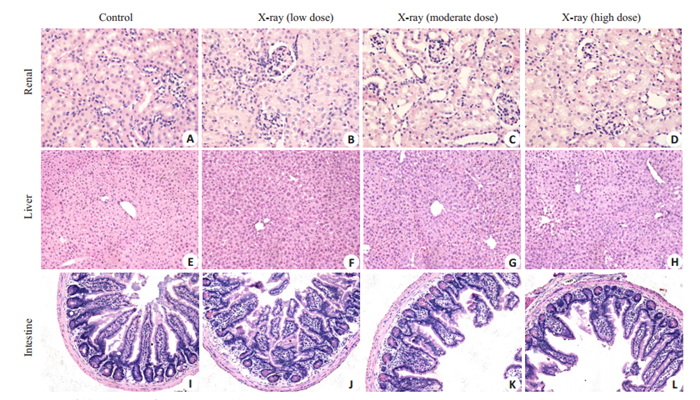
肾肝肠病理可见,三个辐照剂量模型小鼠的肾、肝、小肠没有明显的淋巴细胞浸润,但肠粘膜结构存在破坏,小肠绒毛变矮或脱落,表面纹状缘结构不完整(图 4)。
|
图 4 造模后各组小鼠肾、肝、小肠病理变化 Fig.4 Liver, kidney and intestinal pathologies in each group (HE staining; renal, ×400; liver, ×200; intestine, ×200). |
小鼠在接受5 Gy X射线造模后,经川芎嗪干预14 d外周血常规中RBC、WBC、PLT和骨髓有核细胞数量出现上升;随川芎嗪剂量的加大,WBC和PLT数量较川芎嗪低剂量组有所下降,而RBC呈现持续上升趋势(图 5)。

|
图 5 川芎嗪治疗后外周血细胞检测与骨髓有核细胞计数 Fig.5 Peripheral blood cell and bone marrow nucleated cell counts after tetramethylpyrazine (TMP) treatment. A: White blood cell count; B: Red blood cell count; C: Platelet count; D: Bone marrow nucleated cell count; *P < 0.05, **P < 0.01, ***P < 0.001 vs model. |
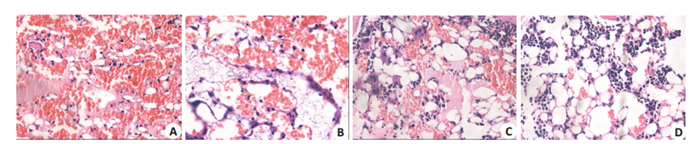
骨髓病理可见,川芎嗪治疗后小鼠骨髓充血减轻、有核细胞增加。随着川芎嗪给药浓度的增加,骨髓充血减轻和有核细胞增多趋势越明显(图 6)。
|
图 6 川芎嗪治疗后骨髓病理变化 Fig.6 Bone marrow pathology in the mice after tetramethylpyrazine (TMP) treatment at different doses (HE staining, ×400). A: Model group; B: TMP low dose group; C: TMP medium dose group; D: TMP high dose group. |
骨髓免疫荧光可见,与模型组相比,川芎嗪中、高剂量治疗组小鼠骨髓中Fas蛋白表达呈现减少趋势(图 7)。

|
图 7 川芎嗪治疗后骨髓Fas表达变化 Fig.7 Expression of Fas in the bone marrow of the mice after TMP treatment (IF staining, ×200). |
合适的动物模型对于SAA的发病机制及治疗方案的研究非常重要,免疫介导的BMF模型是最接近SAA患者发病机制的动物模型[5-6]。目前国内外大多采用辐照结合淋巴细胞输注的方法建立免疫介导的BMF动物模型。国外报道多采用γ射线辐照,具体细节没有统一的标准,在国内γ射线主要用于特殊类型肿瘤放疗,因辐照过程需要特殊设备和防护,较少应用于医学实验研究;在国内X射线更为常见和更易满足辐照条件,但是关于采用X射线辐照建立BMF模型尚未见文献报道,故我们通过对X射线剂量的探索,以期建立适合实验研究的免疫介导BMF模型。在14 d后不同剂量X射线照射的模型小鼠外周血三系和骨髓有核细胞均明显减少;骨髓病理可见脂肪空泡、骨髓细胞性明显降低、巨核细胞缺如;肾、肝、肠没有明显的淋巴细胞浸润;说明C57小鼠经亚致死剂量X射线照射后,输入MHC不相容的淋巴细胞可成功建立BMF模型,无移植物抗宿主病发生[8, 16]。由于小肠对射线高度敏感,在造模过程中出现肠粘膜损伤,可能与辐射后肠粘膜炎症和应激反应诱导的上皮干细胞和内皮细胞凋亡有关[17-19]。
在14 d后不同辐照剂量组的模型小鼠外周血三系和骨髓有核细胞明显下降,随X射线剂量的增加,外周血三系和骨髓有核细胞下降越明显,说明BMF程度与X射线剂量呈剂量依赖效应。6.5 Gy X射线组模型小鼠骨髓病理显示未见有核细胞,该亚致死剂量已达到清髓效果,死亡率达50%,不利于模型小鼠后续实验研究;然而低剂量组5.0 Gy X射线辐照模型小鼠,与6.5 Gy、5.75 Gy剂量组相比,BMF程度较轻,存活率提高,有利于免疫介导BMF模型的发病机制及治疗方案研究。
川芎嗪是从中药川芎中提取出来的活性生物碱,临床上广泛应用于心脑血管、呼吸系统及肾脏等疾病治疗,研究证实其具有扩张血管、改善微循环、抑制血小板聚集、抗氧化应激反应等作用[20],也有研究报道川芎嗪能促进损伤后骨髓微循环修复和造血功能重建[13-14, 21-22]。在我们实验中观察到小鼠经5.0 Gy X射线辐照及淋巴细胞输注造模后,给与川芎嗪治疗14 d,骨髓病理显示骨髓充血明显减轻、有核细胞增加,外周三系出现上升,随川芎嗪剂量的增加,骨髓改善越明显,表明川芎嗪对BMF小鼠骨髓造血微环境和造血功能修复有一定促进作用,也在一定程度上体现中药川芎的“活血祛瘀”的功效,并进一步拓展了“祛瘀生新”的理论[33-34]。Fas作为一种死亡受体,其与配体FasL结合后可诱导表达Fas的细胞凋亡,并且Fas介导的细胞凋亡是导致骨髓细胞破坏的主要途径[25],我们实验发现川芎嗪可降低骨髓衰竭小鼠Fas表达,表明川芎嗪可能通过调节细胞凋亡信号来参与骨髓修复[26],也可能与川芎嗪上调骨髓基质细胞bFGF、bFGFR表达[21, 27],及促进造模后骨髓氧自由基的清除、DNA损伤修复有关[15, 28-29]。
综上所述,采用亚致死剂量X射线照射联合同种异体淋巴细胞输注,可成功建立免疫介导的BMF模型,在该模型中亚致死剂量X射线辐照可导致受体小鼠骨髓损伤和免疫功能下降,同种异体淋巴细胞输注诱导的免疫反应进一步加重骨髓造血细胞破坏[30-32]。5.0 Gy X射线辐照组骨髓损伤程度相对较轻,存活率较高,有利于免疫介导的BMF模型实验研究。在该模型中BMF程度除了与辐照剂量及剂量率有关,也与受体小鼠的种类、年龄、性别、营养等一般情况有关[32-33]。川芎嗪治疗后模型小鼠骨髓造血功能改善,提示川芎嗪可用于SAA等骨髓衰竭疾病的治疗研究,也进一步拓展了“祛瘀生新”理论。
| [1] |
Young NS, Calado RT, Scheinberg P. Current concepts in the pathohysiology and treatment of aplastic anemia[J]. Blood, 2006, 108(8): 2509-19. DOI:10.1182/blood-2006-03-010777 |
| [2] |
Feng XM, Lin ZH, Sun WL, et al. Rapamycin is highly effective in murine models of immune-mediated bone marrow failure[J]. Haematologica, 2017, 102(10): 1691-703. DOI:10.3324/haematol.2017.163675 |
| [3] |
Roderick JE, Gonzalez-Perez G, Kuksin CA, et al. Therapeutic targeting of NOTCH signaling ameliorates immune-mediated bone marrow failure of aplastic anemia[J]. J Exp Med, 2013, 210(7): 1311-29. DOI:10.1084/jem.20112615 |
| [4] |
姚军, 李树浓. 淋巴细胞与再生障碍性贫血的实验研究[J]. 中华血液学杂志, 1991, 12(5): 229-31. |
| [5] |
Li J, Chen H, Lv YB, et al. Intraperitoneal injection of multiplacentas pooled cells treatment on a mouse model with aplastic anemia[J]. Stem Cells Int, 2016, 22(5): 3279793. |
| [6] |
Tang Y, Desierto MJ, Chen JC, et al. The role of the Th1 transcription factor T-bet in a mouse model of immune-mediated bone-marrow failure[J]. Blood, 2010, 115(3): 541-8. DOI:10.1182/blood-2009-03-211383 |
| [7] |
Gonzaga VF, Wenceslau CV, Lisboa GS, et al. Mesenchymal stem cell benefits observed in bone marrow failure and acquired aplastic anemia[J]. Stem Cells Int, 2017, 11(3): 1-12. |
| [8] |
Sato K, Feng X, Chen J, et al. PPARγ antagonist attenuates mouse immune-mediated bone marrow failure by inhibition of T cell function[J]. Haematol, 2016, 101(1): 57-67. DOI:10.3324/haematol.2014.121632 |
| [9] |
Erie AJ, Samsel L, Takaku T, et al. MHC class Ⅱ upregulation and colocalization with Fas in experimental models of immunemediated bone marrow failure[J]. Exp Hematol, 2011, 39(8): 837-49. DOI:10.1016/j.exphem.2011.05.005 |
| [10] |
Chen JC, Desierto MJ, Feng XM, et al. Immune-mediated bone marrow failure in C57BL/6 mice[J]. Exp Hematol, 2015, 43(4): 256-67. DOI:10.1016/j.exphem.2014.12.006 |
| [11] |
肖胜利, 单能飞, 郑好望. γ射线在核医学上的治疗作用[J]. 现代物理知识, 2008, 20(6): 40-1. |
| [12] |
贺选, 刘晓超, 杜建飞, 等. 体部伽马射线立体定向放疗治疗肺部原发及转移瘤的疗效及毒副反应[J]. 现代肿瘤医学, 2018, 26(14): 2206-8. DOI:10.3969/j.issn.1672-4992.2018.14.016 |
| [13] |
胡德蓉, 齐洁琳, 周登锋, 等. 川芎嗪对急性放射损伤小鼠骨髓中LFA- 1, ICAM-1表达影响的研究[J]. 中国病理生理杂志, 2008, 24(1): 128-31. DOI:10.3321/j.issn:1000-4718.2008.01.031 |
| [14] |
周银莉, 刘文励, 孙汉英, 等. 川芎嗪对骨髓移植小鼠早期造血重建作用的研究[J]. 中华血液学杂志, 2002, 23(4): 207-8. DOI:10.3760/j:issn:0253-2727.2002.04.011 |
| [15] |
Zheng H, Wang S, Zhou P, et al. Effects of tetramethylpyrazine on DNA damage and apoptosis induced by irradiation[J]. Environ Toxicol Pharmacol, 2013, 36(3): 1197-206. DOI:10.1016/j.etap.2013.09.023 |
| [16] |
Bloom ML, Wolk AG, Simon-Stoos KL, et al. A mouse model of lymphocyte infusion-induced bone marrow failure[J]. Exp Hematol, 2004, 32(12): 1163-72. DOI:10.1016/j.exphem.2004.08.006 |
| [17] |
夏小春, 陈秋, 武书, 等. X射线照射对小鼠小肠黏膜杯状细胞的影响[J]. 苏州大学学报:医学版, 2012, 32(4): 485-8, 493. |
| [18] |
Francois A, Milliat F, Guipaud OA. Inflammation and immunity in radiation damage to the gut mucosa[J]. Biomed Res Int, 2013, 19(3): 123241. |
| [19] |
Paris F, Fuks Z, Kang A, et al. Endothelial apoptosis as the primary lesion initiating intestinal radiation damage in mice[J]. Science, 2001, 293(5528): 293-7. DOI:10.1126/science.1060191 |
| [20] |
姜宇懋, 王丹巧. 川芎嗪药理作用研究进展[J]. 中国现代中药, 2016, 18(10): 1364-70. |
| [21] |
吴宁, 周登锋, 齐洁琳, 等. 川芎嗪对BMT后小鼠骨髓基质细胞bFGF表达水平的影响[J]. 中国实验血液学杂志, 2006, 14(5): 1004-7. DOI:10.3969/j.issn.1009-2137.2006.05.033 |
| [22] |
Li L, Chu LS, Fang Y, et al. Preconditioning of bone marrowderived mesenchymal stromal cells by tetramethylpyrazine enhances cell migration and improves functional recovery after focal cerebral ischemia in rats[J]. Stem Cell Res Ther, 2017, 8(3): 112. |
| [23] |
金玉青, 洪远林, 李建蕊, 等. 川芎的化学成分及药理作用研究进展[J]. 中药与临床, 2013, 4(3): 44-8. |
| [24] |
张金生. 活血化瘀与干细胞循环[J]. 中医杂志, 2012, 53(6): 451-4. DOI:10.3969/j.issn.0411-8421.2012.06.057 |
| [25] |
Omokaro SO, Desierto MJ, Eckhaus MA, et al. Lymphocytes with Aberrant Expression of Fas or Fas Ligand Attenuate Immune Bone Marrow Failure in a Mouse Model[J]. J Immunol, 2009, 182(6): 3414-22. DOI:10.4049/jimmunol.0801430 |
| [26] |
常保萍, 邓昊, 张海深, 等. Fas, Bcl2在放射损伤小鼠骨髓细胞的表达及意义和川芎嗪对其影响的研究[J]. 中国免疫学杂志, 2007, 23(5): 465-7. DOI:10.3321/j.issn:1000-484X.2007.05.020 |
| [27] |
Wu N, Sun H, Liu W, et al. The effects of Tetramethylpyrazine on the expression of bFGF and bFGFR in bone marrow in radiation injured mice[J]. J Huazhong Univ Sci Technolog Med Sci, 2003, 23(4): 348-51. DOI:10.1007/BF02829414 |
| [28] |
Zhang L, Deng MY, Zhou SW, et al. Tetramethylpyrazine inhibits hypoxia-induced pulmonary vascular leakage in rats via the ROS-HIF-VEGF pathway[J]. Pharmacol, 2011, 87(5/6): 265-73. |
| [29] |
Yu T, Qu J, Wang Y, et al. Tetramethylpyrazine protects chondrocyte against IL-1β induced injury by regulation of SOX9/NF-κB signaling pathway[J]. J Cell Biochem, 2018, 119(9): 7419-30. DOI:10.1002/jcb.27051 |
| [30] |
Chen J, Lipovsky K, Ellison FM, et al. Bystander destruction of hematopoietic progenitor and stem cells in a mouse model of infusion-induced bone marrow failure[J]. Blood, 2004, 104(6): 1671-8. DOI:10.1182/blood-2004-03-1115 |
| [31] |
Xu GS, Wu HY, Zhang JL, et al. Metformin ameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury in mice[J]. Free Radic Biol Med, 2015, 87(2): 15-25. |
| [32] |
孙谕, 顾军, 张宏, 等. 新型免疫介导骨髓造血功能衰竭小鼠模型的建立及特性分析[J]. 中国免疫学杂志, 2010, 26(11): 1024-8. DOI:10.3969/j.issn.1000-484X.2010.11.014 |
| [33] |
Williams JP, Brown SL, Georges GE, et al. Animal models for medical countermeasures to radiation exposure[J]. Radiat Res, 2010, 173(4, SI): 557-78. DOI:10.1667/RR1880.1 |
 2019, Vol. 39
2019, Vol. 39

