2. 暨南大学附属珠海医院体检中心,广东 珠海 519000
2. Health Management Center, Affiliated Zhuhai Hospital of Jinan University, Zhuhai 519000, China
肾缺血再灌注(I/R)损伤作为急性肾损伤的主要原因之一。涉及能量代谢、炎症和细胞凋亡等多个病理生理过程[1-2],发病机制尚未阐明。近年来,2型糖尿病发病率逐渐增高,糖尿病患者发生肾I/R损伤后导致的肾脏损害和功能障碍明显加重[3]。糖尿病加重肾脏I/R损伤的分子机制尚不明确。
盐酸右旋美托咪啶(Dex)是一种新型的、特异性、高选择性α2肾上腺素能受体激动剂,具有镇静、镇痛、利尿等肾保护作用[4-5]。有研究认为Dex能通过减少I/R诱导产生的ROS,减轻肾损伤后炎症反应、阻止肾小管上皮细胞凋亡加剧从而降低缺血再灌注后肾损伤的程度[6-8]。低氧诱导因子-1α(HIF-1α)在调节肾脏I/R细胞的代谢、血管生成、红细胞生成及抗凋亡等方面发挥其对细胞的保护作用[9-10]。有研究通过抑制HIF-1α羟基化降解、稳定HIF-1α水平,对肾脏IR有一定的保护作用[11]。HIF-1α是否参与Dex预先给药减轻糖尿病大鼠肾I/R损伤尚待探讨。地高辛能有效抑制HIF-1α的表达,在本研究中作为抑制剂使用。本实验拟通过建立2型糖尿病大鼠I/R模型,对肾功能、炎性因子及HIF-1α蛋白进行检测,探讨Dex预处理对糖尿病大鼠肾I/R损伤的保护作用的机制。
1 材料和方法 1.1 实验动物、主要试剂及仪器实验动物:健康雄性SD大鼠,体质量150~180 g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤)2017-0038。主要试剂:高脂高糖饲料(D12492)购自广东省医学动物实验中心;链脲佐菌素(STZ)购自Sigma-Aldrich;盐酸右旋美托咪定购自江苏恒瑞医药股份有限公司(批号:161208BP);地高辛片购自上海信谊药厂有限公司(批号:H31020678);BCA法蛋白含量检测试剂盒(中国南京KeyGEN);TUNEL试剂盒(Roche);HIF-1α、cleaved caspase-3、Bax抗体(CST);Bcl-2抗体(Abcam);β-actin抗体(中国Kang Chen Biotech);HRP标记二抗(中国上海碧云天公司);ELISA检测试剂盒(美国赛默飞世尔科技公司)。仪器:血糖仪(罗氏,卓越型);胰岛素放射免疫分析试剂盒(北京华英生物技术研究所);垂直电泳仪(Bio-Rad);血清肌酐(Scr)和尿素氮(BUN)的检测全自动生化分析仪(Olympus);M5多功能酶标仪(MD)。
1.2 方法 1.2.1 建立2型糖尿病大鼠模型适应性喂食SD大鼠1周后,给予高糖高脂饲料8周,糖尿病组大鼠单次腹腔注射STZ 30 mg/kg(柠檬酸和柠檬酸钠的缓冲液溶解STZ粉,配置浓度为10 mg/mL,pH4.2~4.5)。注射STZ后1周,大鼠断料不断水12 h,采集鼠尾动脉血1 mL,离心后,收集0.4 mL上层血清行血糖值和血清胰岛素值检测,随机血糖值≥16.7 mmol/L,同时表现为对胰岛素抵抗,符合2型糖尿病大鼠模型[12]。
1.2.2 建立肾缺血再灌注损伤大鼠模型采用双侧肾脏动脉夹闭60 min再灌注120 min的方法制作肾缺血再灌注损伤模型。盐酸戊巴比妥钠麻醉后大鼠被固定于操作台,腹部剃毛、消毒,剑突下1.5 cm处沿腹正中线切开,打开腹腔,使用玻璃分针分离肾动脉,用内径0.2 mm银夹夹闭,60 min后打开银夹,恢复血流使肾动脉再灌注120 min。多普勒扫描仪探查肾脏血流,确保双侧肾脏动脉充分夹闭,夹闭后肾脏颜色变创白[13]。
1.2.3 实验分组分为普通大鼠组(Con),假手术组(Sham)仅仅分离肾动脉,未夹闭,普通大鼠肾缺血再灌注损伤模型组(Con+I/R),普通大鼠肾缺血再灌注损伤模型Dex治疗组(Con+I/R+Dex),糖尿病大鼠组(DM),糖尿病大鼠Dex治疗组(DM+Dex),糖尿病大鼠地高辛(Digoxin)灌胃组(DM+Dig),糖尿病大鼠肾缺血再灌注损伤模型组(DM+I/R),糖尿病大鼠肾缺血再灌注损伤模型Dex治疗组(DM+I/R+Dex),糖尿病大鼠地高辛灌胃后肾缺血再灌注损伤模型Dex治疗组(DM+Dig+I/ R+Dex)。参考Gu等[8]对Dex的使用方法,生理盐水将Dex溶解,配置浓度为5 μg/mL,肾脏动脉结扎前2 h腹腔注射Dex(分为不同剂量10、20、25、30 μg/kg)。Dig组使用地高辛片0.05 mg/(kg·d)灌胃1周[14]。
1.2.4 缺血区肾脏细胞凋亡检测按照TUNEL试剂盒说明书检测肾脏TUNEL阳性细胞比例。组织切片二甲苯和梯度酒精中脱蜡,PBS冲洗。在组织切片上滴加蛋白酶K,孵育缓冲液(平衡缓冲液、核苷酸复合物、TdT酶),进行末端标记反应。PBS冲洗终止标记反应,滴加抗淬灭封片剂,荧光显微镜下观察并记录结果。
1.2.5 血清肌酐(Scr)和尿素氮(BUN)检测按照试剂盒说明书指示操作。
1.2.6 酶联免疫吸附试验(ELISA)检测用碳酸盐包被缓冲液稀释抗体,在包被过的反应孔中加入检测样品,37 ℃孵育1 h,在各个反应孔中加入目标抗体,37 ℃孵育0.5~1 h,洗涤后加入底物显色,37 ℃反应10~30 min,加入硫酸终止反应,M5多功能酶标仪检测A450 nm值。
1.2.7 Western blot试验将HIF-1α、cleaved caspase-3、Bax、Bcl-2、β-actin兔属一抗按照1:1000比例稀释待用,山羊属二抗按照1:500比例稀释待用。常规行SDSPAGE电泳,将蛋白转移至PVDF膜。加入一抗4 ℃孵育过夜,洗膜后加入相应二抗,37 ℃孵育1 h,用ECL法行化学发光。
1.3 统计学分析计量资料以均数±标准差表示,采用SPSS 20.0统计软件分析,多组间比较采用单因素方差分析,两两之间比较采用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究通过高糖高脂喂食结合小剂量STZ腹腔注射,SD大鼠的血糖值明显升高,平均值达21.9±3.6 mmol/L,血清胰岛素平均值达23.53±3.89 mU/L,符合2型糖尿病大鼠模型(表 1)。
| 表 1 大鼠的体质量、血糖值及血清胰岛素值 Tab.1 Body weight, blood glucose and plasma insulin levels of normal and diabetic rats (Mean±SD) |
对照组和糖尿病组大鼠在肾缺血再灌注后Scr、BUN值均明显升高,表现出显著的肾脏功能损伤。I/R之前预先腹腔注射20 μg/kg的Dex能有效减轻肾脏功能的损伤,而增加Dex注射剂量未能进一步减轻肾脏功能的损伤,故选择腹腔注射20 μg/kg的Dex进行下一步的研究。与Con+I/R相比,DM+I/R组Scr、BUN值明显升高(表 2)。
| 表 2 各组大鼠的Scr、BUN值 Tab.2 Levels of Scr and BUN in different groups (Mean±SD, n=8) |
普通大鼠和糖尿病大鼠在肾缺血再灌注后HIF-1α、p-eNOS、eNOS表达水平均显著升高(P < 0.05);与Con+ I/R相比,DM+I/R组p-eNOS、eNOS进一步升高;与DM+I/R组相比,DM+I/R+Dex组p-eNOS、eNOS及凋亡细胞比例明显降低,HIF-1α表达明显升高(P < 0.05);糖尿病组大鼠在肾缺血再灌注后凋亡细胞比例均明显升高。I/R之前预先腹腔注射20 μg/kg的Dex能有效减轻肾脏细胞的凋亡比例。使用地高辛作为HIF-1α蛋白表达的抑制剂,与DM+I/R+Dex组相比,DM+Dig+I/R+ Dex组肾脏细胞的凋亡比例明显增加(表 3、图 1)。
| 表 3 各组大鼠的HIF-1α、p-eNOS及eNOS值 Tab.3 Rena; expressions of HIF-1α, p-eNOS and eNOS in different groups (Mean±SD, n=8) |
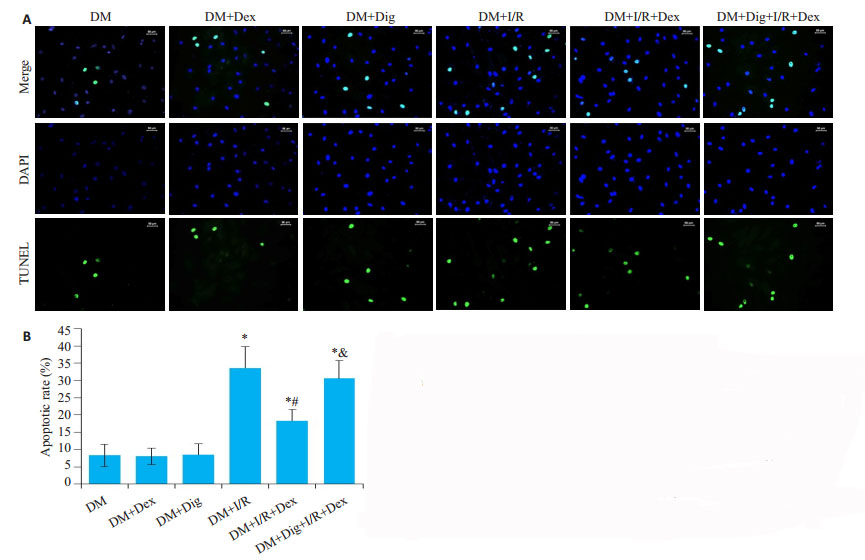
|
图 1 TUNEL法检测糖尿病大鼠肾脏细胞凋亡 Fig.1 Renal cell apoptosis in diabetic rats detected by TUNEL assay. A: Apoptosis of renal cells in the diabetic rats; B: Apoptotic rate of the renal cells in different groups. DM: Diabetes mellitus group; DM+Dex: Diabetes mellitus group treated with Dex; DM + Dig: Diabetes mellitus group with digoxin treatment; DM + I/R: Renal ischemia- reperfusion injury in diabetes mellitus group; DM+I/R+Dex: Renal ischemia-reperfusion injury in diabetes mellitus group treated with Dex; DM + Dig + I/R + Dex: Diabetes mellitus group after intragastric administration of digoxin and Dex trratment before renal ischemia-reperfusion injury. *P < 0.05 vs DM, DM+Dex and DM+Dig; #P < 0.05 vs DM+I/R; &P < 0.05 vs DM+I/R+Dex |
与DM组、DM+Dex组、DM+Dig组相比,DM+I/R组大鼠肾脏细胞中HIF-1α、cleaved caspase-3表达水平显著增加(P < 0.05);与DM+I/R组相比,DM+I/R+Dex组进一步促进HIF-1α的表达,而cleaved caspase-3表达明显降低(P < 0.05);与DM+I/R+Dex组相比,DM+Dig+ I/R +Dex组HIF-1α的表达下降,而cleaved caspase-3表达显著升高(P < 0.05)。与DM组、DM+Dex组、DM+ Dig组相比,DM+I/R组大鼠肾脏细胞中Bax蛋白表达水平明显升高,而Bcl-2表达明显降低(P < 0.05);与DM+I/R组相比,DM+I/R+Dex组Bax蛋白表达水平明显下降,而Bcl-2表达明显升高(P < 0.05);与DM+I/R+ Dex组相比,DM+Dig+I/R+Dex组Bax蛋白表达水平明显升高,而Bcl-2表达明显下降(P < 0.05,图 2、3)。
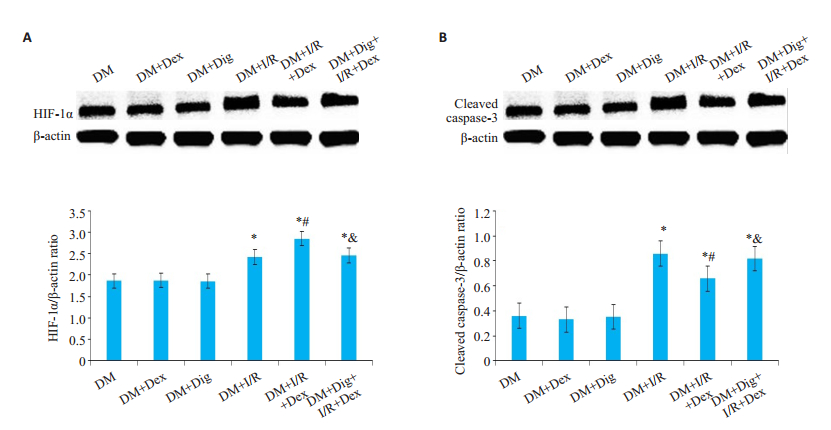
|
图 2 蛋白质印迹法检测糖尿病大鼠肾脏细胞HIF-1α、cleaved caspase-3蛋白表达 Fig.2 Western blotting for detecting renal expressions of HIF-1α (A) and cleaved caspase-3 (B) in diabetic rats. Data are shown as Mean±SD (n=8). *P < 0.05 vs DM, DM+Dex and DM+Dig; #P < 0.05 vs DM+I/R; &P < 0.05 vs DM+I/R+Dex |
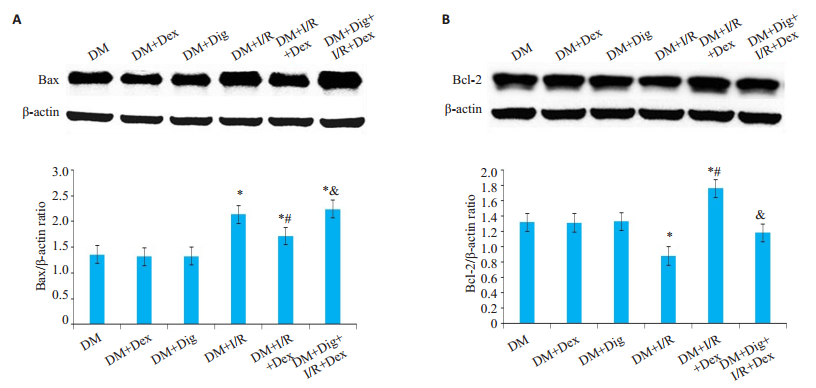
|
图 3 蛋白质印迹法检测糖尿病大鼠肾脏细胞Bax、Bcl-2蛋白表达 Fig.3 Western blotting for detecting renal expressions of Bax (A) and Bcl-2 (B) proteins in the rats. Data are shown as Mean± SD (n=8). *P < 0.05 vs DM, DM+Dex and DM+Dig; #P < 0.05 vs DM+I/R; &P < 0.05 vs DM+I/R+Dex |
肾脏是对I/R损伤最为敏感的器官之一,I/R损伤是一个复杂的过程,休克患者、肾脏外伤和肾移植中均可发生I/R损伤[1-2]。随着2型糖尿病发病率的不断增高,糖尿病患者发生肾脏细胞I/R的发病率明显增加[15],而且引起肾脏功能受损明显加重,严重者将导致急性肾功能衰竭。2型糖尿病产生的慢性微血管病变导致肾脏功能损害是糖尿病的严重并发症之一[3]。由于原先肾脏血流的受损,在I/R损伤后,对缺氧敏感的肾小管细胞内爆发性产生过量的ROS从而导致细胞DNA损伤引起小管上皮细胞凋亡和坏死[16]。由于肾脏I/R给患者带来严重的影响,对其防治研究具有重要的现实意义。本实验以高糖高脂饲料喂食结合小剂量STZ腹腔注射诱导的糖尿病大鼠模型,表现出血糖高,胰岛素水平不低等胰岛素抵抗的典型2型糖尿病大鼠特征。由于糖尿病大鼠模型造价昂贵,故选择普通大鼠作为假手术组,排除手术操作对实验结果的影响,同时在普通大鼠组别筛选Dex对肾I/R损伤保护的最优剂量。本研究中大鼠肾脏I/R后出现严重肾功能损伤,尤其是糖尿病大鼠反映肾功能的指标血清BUN和Scr显著升高[17-18],肾脏细胞凋亡比例增加,同时由于氧化应激损伤反应产生的炎症因子p-eNOS、eNOS和凋亡相关蛋白Bax、cleaved caspase-3表达显著增加,抗凋亡蛋白Bcl-2表达受抑制。
低氧诱导因子-1α(HIF-1α)是目前已知的唯一一个在缺氧状态下发挥活性的特异性转录因子[19]。低氧条件下,HIF-1α不被降解而在细胞内蓄积,通过HIF-1α蛋白的关键结构域核定位序列介导入细胞核发挥作用[20]。在细胞适应缺氧环境中发挥关键的调控作用,在低灌注缺氧条件下对细胞具有保护作用[21]。HIF-1α可以在缺氧状态下刺激肾脏组织细胞发生糖分解和新生血管的形成[22],可通过改善蛋白尿、抑制蛋白质在肾脏的沉积、抑制糖尿病肾脏中的炎症反应,有效减弱糖尿病引起的肾脏损伤[23-24]。有报道反复的缺氧预处理可以通过HIF-1α介导的Bcl-2抗凋亡通路减轻肾脏IR[25]。Bcl-2是重要的抗凋亡成员,受HIF-1α直接转录调控,是HIF-1α下游重要的凋亡调控分子[26]。本研究中普通大鼠和糖尿病大鼠在I/R后HIF-1α表达显著增加是分子水平的适应性反应,它能调控下游Bcl-2基因的表达,起到改善缺血缺氧抗凋亡的重要意义。
Dex作为一种高度选择性α2肾上腺素能受体激动剂,具有中枢性镇静、镇痛和稳定血流动力学等特性[27]。研究发现Dex可抑制促炎性细胞因子释放,抑制氧化应激反应,对神经组织、心肌组织、肾组织、肺组织、肝组织具有保护作用。对大鼠研究发现腹腔注射Dex可以缓解肾脏缺血再灌注损伤[4]。有研究表明Dex可上调体外损伤的肾脏HK-2细胞HIF-1α蛋白水平,升高Bcl-2/ Bax比例,从而改善细胞活力及减少细胞凋亡率[28]。本研究通过4种不同剂量的Dex进行剂量筛选实验,结果表明按照25 μg/kg腹腔注射Dex可减轻糖尿病大鼠肾缺血再灌注损伤,提示剂量选择的有效性。
本研究结果显示,普通组大鼠和糖尿病大鼠在I/R后肾脏组织ROS爆发性增加,肾功能明显受损,引起肾脏细胞凋亡。与I/R组相比较,Dex组BUN、Scr值和肾脏细胞凋亡比例明显降低,炎症因子p-eNOS、eNOS受到明显抑制,HIF-1α蛋白表达能力进一步升高。与普通组大鼠相比,糖尿病大鼠HIF-1α蛋白表达明显增加,提示了HIF-1α蛋白参与糖尿病肾脏微血管病变的发生发展。有研究发现,强心苷类药物如地高辛等,在低氧环境下可以有效地下调HIF-1α的表达[29]。在本研究中地高辛作为HIF-1α表达的抑制剂,进一步验证了Dex可上调糖尿病大鼠肾脏I/R损伤后细胞HIF-1α蛋白水平,激活抗凋亡蛋白Bcl-2,抑制凋亡相关蛋白Bax、cleaved caspase-3,从而改善细胞活力、减少细胞凋亡,抑制肾脏炎症反应,保护肾脏功能,其具体的作用机制还需进一步研究。
| [1] |
Xiaoyi Y, Gang T, Changjun H. Hydrogen sulfide protects cardiomyo cytes from myocardial Ischemia-Reperfusion injury by enhancing phosphorylation of apoptosis repressor with caspase recruitment do main[J]. Tohoku J Exp Med, 2012, 226(4): 275-85. DOI:10.1620/tjem.226.275 |
| [2] |
Moeini M, Nematbakhsh M, Fazilati M, et al. Protective role of recombinant human erythropoietin in kidney and lung injury following renal bilateral Ischemia-Reperfusion in rat model[J]. Int J Prev Med, 2013, 4(6): 648-55. |
| [3] |
Bakris GL. Recognition, pathogenesis, and treatment of different stages of nephropathy in patients with type 2 diabetes mellitus[J]. Mayo Clinic Proceedings, 2011, 86(5): 444-56. DOI:10.4065/mcp.2010.0713 |
| [4] |
Kocoglu H, Ozturk H, Ozturk H, et al. Effect of dexmedetomidine on ischemia-reperfusion injury in rat kidney: a histopathologic study[J]. Ren Fail, 2009, 31(1): 70-4. DOI:10.1080/08860220802546487 |
| [5] |
Carollo DS, Nossaman BD, Ramadhyani U. Dexmedetomidine: a review of clinical applications[J]. Curr Opin Anaesthesiol, 2008, 21(4): 457-61. DOI:10.1097/ACO.0b013e328305e3ef |
| [6] |
Sanders RD, Sun P, Patel S, et al. Dexmedetomidine provides cortical neuroprotection: impact on anaesthetic-induced neuroapoptosis in the rat developing brain[J]. Acta Anaesthesiol Scand, 2010, 54(6): 710-6. |
| [7] |
Zhang XY, Liu ZM, Wen SH, et al. Dexmedetomidine administration before, but not after, ischemia attenuates intestinal injury induced by intestinal Ischemia-Reperfusion in rats[J]. Anesthesiology, 2012, 116(5): 1035-46. DOI:10.1097/ALN.0b013e3182503964 |
| [8] |
Gu J, Sun P, Zhao H, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice[J]. Crit Care, 2011, 15(3): R153. DOI:10.1186/cc10283 |
| [9] |
Semenza GL. Oxygen sensing, hypoxia-inducible factors, and disease pathophysiology[J]. Annu Rev Pathol, 2014, 9(7): 47-71. |
| [10] |
Conde E, Alegre L, Blanco-Sanchez IA, et al. Hypoxia inducible factor 1-Alpha (HIF-1 alpha) is induced during reperfusion after renal ischemia and is critical for proximal tubule cell survival[J]. PLoS One, 2012, 7(3): e33258. DOI:10.1371/journal.pone.0033258 |
| [11] |
Eltzschig HK, Bratton DL, Colgan SP. Targeting hypoxia signalling for the treatment of ischaemic and inflammatory diseases[J]. Nat Rev Drug Discov, 2014, 13(11): 852-69. DOI:10.1038/nrd4422 |
| [12] |
吴晏, 韩静, 黄黎明, 等. 高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型[J]. 中国实验动物学报, 2012, 20(2): 11-5. DOI:10.3969/j.issn.1005-4847.2012.02.003 |
| [13] |
余晓东, 廖波, 邓显忠, 等. 一种新型实用的大鼠肾缺血再灌注损伤模型的建立[J]. 重庆医学, 2011, 40(13): 页码范围. DOI:10.3969/j.issn.1671-8348.2011.13.014 |
| [14] |
孙志强, 李超, 吴源鸿, 等. 南葶苈子提取液对心力衰竭大鼠心功能的影响[J]. 心脑血管病防治, 2016, 12(6): 427-30, 488. DOI:10.3969/j.issn.1009-816x.2016.06.06 |
| [15] |
Kantharidis P, Wang B, Carew RM, et al. Diabetes complications: the microRNA perspective[J]. Diabetes, 2011, 60(7): 1832-7. DOI:10.2337/db11-0082 |
| [16] |
Susztak K, Raff AC, Schiffer M, et al. Glucose-induced reactive Oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy[J]. Diabetes, 2006, 55(1): 225-33. DOI:10.2337/diabetes.55.01.06.db05-0894 |
| [17] |
Perco P, Oberbauer R. Kidney injury molecule-l as a biomarker of acute kidney injury in renal transplant recipients[J]. Nat Clin Pract Nephrol, 2008, 4(2): 362-3. |
| [18] |
Kramer AB, van Timmeren MM, Schuurs TA, et al. Reduction of proteinuria in adriamycin-induced nephropathy is associated with reduction of renal kidney injury molecule (Kim-1) over time[J]. Am J Physiol Renal Physiol, 2009, 296(5): F1136-45. DOI:10.1152/ajprenal.00541.2007 |
| [19] |
Stravodimos KG, Koritsiadis G, Lazaris AC, et al. Hydronephrosis promotes expression of Hypoxia-Inducible factor 1 alpha[J]. Urol Int, 2009, 82(1): 38-42. DOI:10.1159/000176023 |
| [20] |
Mahon PC, Hirota K, Semenza GL. FIH-1: a novel protein that interacts with HIF-1alpha and VHL to mediate repression of HIF-1 transcriptional activity[J]. Genes Dev, 2001, 15(20): 2675-86. DOI:10.1101/gad.924501 |
| [21] |
Sendoel A, Hengartner MO. Apoptotic cell death under hypoxia[J]. Physiology (Bethesda), 2014, 29(3): 168-76. |
| [22] |
Sumual S, Saad S, Tang OW, et al. Differential regulation of Snail by hypoxia and hyperglycemia in human proximal tubule cells[J]. Int J Biochem Cell Biol, 2010, 42(10): 1689-97. DOI:10.1016/j.biocel.2010.06.023 |
| [23] |
Miyata T, Dan T. Inhibition of advanced glycation end products (AGEs): an implicit goal inclinical medicine for the treatment of diabetic nephropathy[J]. Diabetes Res Clin Pract, 2008, 82(13): 25-9. |
| [24] |
Sagar SK, Zhang C, Guo Q, et al. Role of expression of endothelin- 1 and angiotensin· Ⅱ and hypoxia-inducible factor-l d in the kidney tissues of patients with diabetic nephropathy[J]. Saudi J Kidney Dis Transpl, 2013, 24(6): 959-64. |
| [25] |
Knudsen AR, Kannerup AS, Gronbaek H, et al. Effects of ischemic pre-and postconditioning on hif-1alpha, vegf and tgf-beta expression after warm ischemia and reperfusion in the rat liver[J]. Comp Hepatol, 2011, 10(1): 3. DOI:10.1186/1476-5926-10-3 |
| [26] |
Chen N, Chen XE, Huang R, et al. BCL-xL is a target gene regulated by hypoxia-inducible factor-1 alpha[J]. J Biol Chem, 2009, 284(15): 10004-12. DOI:10.1074/jbc.M805997200 |
| [27] |
吴志林, 褚淑娟, 姚尚龙, 等. 不同剂量右美托咪定预处理对大鼠心肌缺血再灌注损伤以及炎症反应的影响[J]. 华中科技大学学报:医学版, 2015, 44(4): 445-7. |
| [28] |
张建波, 王晓俏, 邱小弟, 等. 右美托咪定上调低氧诱导因子-1α对人肾小管上皮细胞H2O2损伤的保护作用[J]. 实用医学杂志, 2016, 32(7): 1084-7. DOI:10.3969/j.issn.1006-5725.2016.07.016 |
| [29] |
陈超, 潘媛, 王宇锋, 等. 地高辛下调缺氧诱导因子-1α的表达抑制结直肠癌HCT116细胞上皮间质化和迁移能力[J]. 宁夏医科大学学报, 2018, 40(3): 266-70. |
 2019, Vol. 39
2019, Vol. 39
