2. 南方医科大学珠江医院麻醉科,广东 广州 510282
2. Department of Anesthesiology, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
神经病理性疼痛(NP)是一种躯体感觉系统损伤或疾病所引起的顽固性疼痛,目前尚无针对NP治疗的有效方法和根治手段,严重影响患者生存质量[1-2]。神经损伤是NP产生的常见病因,近年来研究表明外周神经损伤引起神经元信号转导改变是NP发生和持续的主要基础,首先表现为疼痛传感器异常表达,特别是疼痛上传通路的背根神经节(DRG)内感觉神经元传感器表达量的改变[3-6]。例如,神经损伤导致DRG m阿片受体(m opioid receptor,MOR,由Oprm1基因编码)表达量减少,该改变降低了机体对伤害性刺激内源性阿片肽的抑制功能和效率,导致了神经元兴奋性增强,促进了感觉敏化的发生和NP的形成[7-8],同时也是吗啡耐受的发病基础[7, 9]。然而,上述研究尚未完全阐明外周神经损伤后DRG MOR下调的机制。
我们前期研究表明,锌指和同源框蛋白2(ZHX2)在外周神经损伤后DRG内高表达,抑制其表达可以有效缓解神经损伤引起的痛觉过敏行为[10]。然而,ZHX2调控疼痛行为产生的机制仍需进一步明确。既然ZHX2作为新型转录抑制因子发挥重要的生物学作用[11]。那么,ZHX2是否通过抑制外周神经损伤后DRG MOR的表达导致NP的产生和发展,目前尚未见报道。明确ZHX2调控MOR表达的新关系,以ZHX2作为治疗靶点,为临床治疗NP及吗啡耐受提供实验理论依据。基于此,本研究拟复制小鼠神经病理性疼痛模型,敲减DRG ZHX2表达,观察ZHX2与MOR的转录和翻译表达改变,进一步在DRG原代细胞水平上验证,探讨ZHX2对MOR的调控作用。
1 材料和方法 1.1 动物选择及分组实验动物由南方医科大学实验动物中心提供,合格证号:44002100016528。依据国际疼痛研究学会(IASP)准则和学校动物伦理委员会许可实施小鼠疼痛实验。实验一(在体实验),取48只8周龄SPF级健康成年雄性C57BL6J小鼠,体质量25~30 g小鼠,按随机数字表法分为4组,分别为注射无义阴性对照序列(siNC)、ZHX2 siRNA的CCI组和注射siNC、ZHX2 siRNA的假手术组(每组12只)。实验二(细胞实验),取6只21 d龄SPF级健康雄性C57BL6J小鼠,提取上述小鼠DRG组织行原代DRG细胞培养,根据转染处理的不同分为2组:siNC和ZHX2 siRNA组。
1.2 模型制备及Zhx2小干扰RNA显微注射神经病理性痛模型采用坐骨神经慢性缩窄损伤模型(CCI)[5, 10, 12],DRG显微注射方法同文献[13-15],具体方法为:1%异氟醚吸入麻醉后,取小鼠左侧大腿区消毒铺巾,大腿后侧纵向切开1 cm切口,显微镜下钝性显微镊分离肌肉组织,暴露并游离坐骨神经主干,4-0铬制肠线环绕神经干做疏松的4道单结扎环,结扎力度刚好能沿神经上下滑动,结扎环间距1 mm。假手术组小鼠则以显露左侧坐骨神经,不做任何处理。制备CCI或假手术模型处理后,随即正中切开背部约1.5 cm,钝性分离左侧L2~5椎体棘突椎旁肌肉群,显露上述椎体左侧缘和横突背侧缘,咬除L3和L4部分椎板后暴露DRG胞体,游丝镊子剥离其被膜。自制微电极注射针,接入一端连接有20 mL微量注射器的延长管,管内回路充灌矿物油,微量泵驱动该注射器抽吸和药液注射。为利于观察注射药物溶液在DRG胞体内扩散,按5:1注射液与亚甲蓝染料混合,每DRG注射1 mL(含20 mmol/L siRNA,Santa Cruz)药液,为促进siRNA胞内转运和预防体内降解,溶液中加入tuberfect in vivo转染试剂(Thermo Scientific)在以注射物质在DRG内均匀扩散、外观充实饱满且无外溢为佳。输注结束并停针5 min后,逐层缝合切口。于麻醉恢复期间,腹腔内注射5 mL无菌生理盐水维持血容量,术后单笼安置小鼠,观察术区有无感染或自噬等现象。
1.3 机械痛阈测定方法同既往研究[10, 16-18],使用0.4 g von Frey测定各组小鼠后肢机械痛阈。将小鼠放置于有机玻璃箱内适应30 min,安静后纤毛丝垂直刺激小鼠后爪足掌中部皮肤,小鼠产生缩爪/抬爪反应则记为有效反应,连续刺激10次,每次间隔5 s,记录10次刺激中出现有效反应的频数,计算缩爪反应频率(PWF)=(有效反应次数/10)× 100%,以此评定小鼠机械痛阈。
1.4 DRG原代神经元培养及ZHX2小干扰RNA转染6只21 d龄雄性小鼠深麻醉下处死后,劈开椎管去除脊髓组织后暴露椎间孔内DRG组织,尖镊逐个挑取DRG组织并放置于冰上预冷的DRG培养液。将收集到的DRG组织剪碎后转移1.5 mL EP管内,滴加1 mL含分散酶(3.5 mg/mL)和胶原酶IA(1.65 mg/mL)的HBSS消化液,37 ℃水浴消化20 min。消化结束,加入800 mL含10%胎牛血清和1%青-链霉素的DMEM/ F12 DRG培养液终止消化,反复抽吸吹打后收集上清至装有滤网的无菌50 mL离心管内。收集的的混悬液分别按1:2000和1:5000滴加神经营养因子(NGF)和阿糖胞苷,以促进神经元细胞生长和抑制胶质细胞再生。将上述混悬液平均分配到预先使用多聚赖氨酸(PolyD-lysine Hydrobromide,Sigma)包被处理2 h的6孔细胞培养板,共12孔2个板,37 ℃ 5% CO2培养箱过夜培养。次日,细胞贴壁后吸净培液,根据分组添加10 mL含100 mmol/mL的siNC或ZHX2小干扰RNA、200 mL无抗生素无血清的Opti-MEM培养基、3 mL Lipofectamine 2000和800 mL的无抗生素无血清的Neurobasal神经元培养液(Gibco)至6孔板内,37 ℃,5% CO2培养箱内转染4 h。转染结束,更换1 mL含10%胎牛血清和1%青-链霉素的DMEM/F12 DRG培养液继续培养48 h。
1.5 反转录实时定量PCR检测DRG Zhx2及Oprm1 mRNA表达的变化对在体实验,每组取6只小鼠,造模及Zhx2小干扰RNA显微注射后7 d,采用反转录实时定量PCR检测小鼠DRG Zhx2和Oprm1 mRNA表达。方法为:处死小鼠后快速收集L3、L4患侧和对侧DRG组织,将同处理组的2只小鼠的L3、L4 DRG(四个DRG)合成一样本- 80 ℃冻存备用。对细胞实验,转染48 h后选取两组3个重复细胞,吸净培养液,PBS清洗3次。根据miRNeasy试剂盒(QIAGEN)操作说明进行样本研磨(细胞不需要),采用滤柱式抽提总RNA,测定总RNA浓度,样本260/280 nm波长吸光度比值控制在1.97~2.08间。使用TaKaRa逆转录试剂盒(TaKaRa)进行总RNA逆转录合成cDNA,采用10 mL PCR反应体系,即:mRNA模板2 mL,Taq酶2 mL,ddH2O 6 mL。反应条件为:37 ℃ 15 min,85 ℃ 5 s去性。反应结束,采用荧光染料法行实时定量PCR,引物采用Primer 3.0软件设计,上海生工生物公司合成。采用10 mL反应体系:上下游引物各0.2 mL、cDNA模板1 mL、荧光染料合剂5 mL和ddH2O 3.6 mL。反应条件为:95 ℃ 3 min预变性后,随即95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,共40个循环,溶解曲线65~95℃。反应结束导出荧光信号数据,计算各反应管内Ct值,以Tubala为内参,采用2-△△Ct法计算各基因相对表达量。所需引物序列为:Tubala正义链5'-GTGCA TCTCCATCCATGTTG-3',反义链5'-GTGGGTTCCA GGTCTACGAA-3';Zhx2正义链5'-CAAGAAAGTGC CCAAGAAGC-3',反义链5'-GAG CTCCACGCTACC AAGTC-3';Oprm1正义链5'-TCTT CACCCTCTGCA CCATG-3',反义链5'-TCTATGGAC CCCTGCCTGTA-3'。
1.6 Western blot检测DRG ZHX2及MOR表达变化对于在体实验,每组取6只小鼠,造模及Zhx2小干扰RNA显微注射后7 d,同前述PCR法收集各处理组小鼠患侧和对侧L3、L4 DRG组织,并将将同处理组2只小鼠4个DRG组织混合成一个样品-80 ℃冻存备用。对于细胞实验,转染48 h后选取余下两组3个重复细胞,吸净培养液,PBS清洗3次。上述样品加入RIPA裂解液,冰上研磨并静置裂解10 min,12 000 r/min,4 ℃离心15 min(离心半径5 cm),取上清。BCA法测定上清蛋白质浓度,计算上样量后加入上样缓冲液,95 ℃ 5 min金属浴。凝胶电泳分离,PVDF膜湿转、50 g/L脱脂奶粉封闭1 h,加入ZHX2鼠单克隆抗体(1:500稀释,Santa Cruz)或兔抗MOR(1:500, Neuromics),以b-actin内参,4 ℃冰箱摇转孵育过夜。次日,经TBST漂洗3次后,加入辣根过氧化物酶标记的羊抗鼠或羊抗兔多克隆二抗(1:1000,美国Santa Cruz公司)室温孵育1 h,加ECL(美国Thermo公司)化学发光液,凝胶成像分析仪(美国Bio-Rad公司)成像,以目的蛋白条带光密度值与对照组条带光密度值的比值反映蛋白表达水平。
1.7 统计学分析SigmaPlot 12.0统计软件进行数据分析,计量资料以均数±标准差表示,多重比较采用单因素方差分析,组内比较采用Tukey法检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 敲减CCI引起的DRG ZHX2增加对Oprm1 mRNA表达的变化造模及ZHX2小干扰RNA处理后7 d,与注射siNC的假手术组比较,注射siNC的CCI组小鼠受损侧L3/L4 DRG Zhx2 mRNA的表达增加2.3倍,而Oprm1 mRNA表达降低77.1%,差异均有统计学意义(F= 17.218,P < 0.001和F=20.485,P < 0.001);而注射siRNA的CCI小鼠DRG Zhx2和Oprm1表达均无明显变化,差异均无统计学意义(F=17.218,P=0.648和F=20.485,P= 0.349);而注射Zhx2小干扰RNA的假手术组小鼠DRG Zhx2表达亦无明显变化(F=17.218,P=1和F= 20.485,P=0.997)。与注射siNC的CCI组比较,注射siRNA的CCI组能明显抑制CCI引起的Zhx2表达增加(F=17.218,P=0.005),提高CCI引起的Oprm1表达抑制(F=20.485,P=0.005,图 1)。

|
图 1 反转录实时定量PCR检测敲减CCI引起的DRG Zhx2增加对Oprm1 mRNA表达的变化 Fig.1 Effect of microinjection of ZHX2 siRNA (siRNA) or the negative control siRNA (siNC) into the ipsilateral L3/4 DRGs on Oprm1 expression in the DRGs on day 7 after CCI or sham operation (n=6). Unilateral L3/4 DRGs from two mice were pooled together. aP < 0.01 vs siNC+sham group; bP < 0.05 vs siNC+ CCI group |
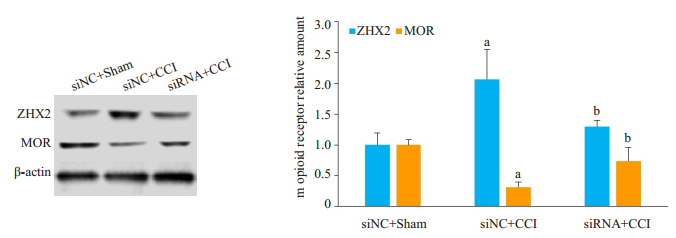
造模及ZHX2 siRNA处理后7 d,与注射siNC的假手术组比较,注射siNC的CCI组小鼠受损侧DRG(L3/ L4)ZHX2表达增加2.1倍,而MOR表达降低了68%,差异均有统计学意义(F=14.284,P=0.005和F=48.666,P < 0.001);而注射ZHX2 siRNA的CCI小鼠DRG ZHX2表达无明显变化,差异无统计学意义(F=14.284,P=0.382)。与注射siNC的CCI组比较,注射siRNA的CCI组能明显抑制ZHX2表达增加(F=14.284,P=0.023),提高CCI引起的MOR表达抑制(F=48.666,P=0.002,图 2)。上述结果表明,敲减CCI引起的DRG ZHX2增加,提高CCI引起的MOR转录和翻译表达抑制。
|
图 2 Western blotting检测敲减CCI引起的DRG ZHX2增加对MOR表达的变化 Fig.2 Effect of microinjection of ZHX2 siRNA or siNC into the ipsilateral L3/4 DRGs on m opioid receptor (MOR) expression on day 7 after CCI or sham operation (n=6). Unilateral L3/4 DRGs from two mice were pooled together. aP < 0.01 vs siNC+sham group. bP < 0.05 vs siNC+CCI group |
注射药物前1 d(-1 d),4组小鼠患侧后爪PWF比较,其差异无统计学意义(F=0.244,P=0.864)。注射药物后7 d,4组小鼠患侧PWF比较差异有统计学意义(F= 43.129,P < 0.001)。与siNC的假手术组比较,siNC的CCI组小鼠患侧PWF增加,差异有统计学意义(P < 0.05)。与注射siNC的CCI组比较,注射siRNA的CCI组小鼠患侧PWF降低,差异有统计学意义(P < 0.05,图 3)。

|
图 3 4组小鼠患侧后爪PWF的比较 Fig.3 Comparison of hind paw withdrawal frequency on the ipsilateral side in the 4 groups 7 days after CCI injury or sham operation with ZHX2 siRNA or siNC into the ipsilateral L3/4 DRGs (n=6). aP < 0.01 vs siNC+sham group. bP < 0.05 vs siNC+CCI group |
注射药物前1 d(-1 d)、注药后7 d,4组小鼠对侧PWF比较差异均无统计学意义(F=0.0725,P=0.996;F= 0.695,P=0.631,图 4)。

|
图 4 4组小鼠对侧后爪PWF的比较 Fig.4 Comparison of hind paw withdrawal frequency on the contralateral side of the mice on day 7 |
转染后28 h,与转染siNC的对照组比较,转染siRNA的实验组Zhx2 mRNA的表达降低50.2%,而Oprm1 mRNA表达增加73%,差异均有统计学意义(t= 4.254,P=0.013和t=-5.554,P=0.005);(图 5)。

|
图 5 敲减DRG神经元细胞ZHX2表达对Oprm1基因表达的影响 Fig.5 Effect of ZHX2 knockdown in the DRG on Oprm1 mRNA expression in DRG primary neurons (Mean±SD, n=3). aP < 0.01 vs siNC group |
转染后28 h,与转染siNC的对照组比较,转染siRNA的实验组ZHX2的表达降低59.7%,而MOR表达增加1.75倍,差异均有统计学意义(t=15.617,P= 0.001和t=-4.330,P=0.0123,图 6)。

|
图 6 敲减DRG神经元细胞ZHX2表达对MOR蛋白质表达的影响 Fig.6 Effect of ZHX2 knockdown on m opioid receptor (MOR) protein expression in DRG primary neurons (n=3). aP < 0.01 vs siNC group |
神经病理性疼痛(NP)常以自发性疼痛、痛觉过敏或超敏为显著特征,临床治疗效果不佳,阐明NP神经生物学致痛信号转导机制,借此研发新的治疗药物和制定有效的治疗方案具有重要的临床意义[19-21]。本研究首次明确了外周神经损伤引起NP时,敲减DRG ZHX2表达,可以很好地逆转外周神经损伤引起的MOR表达下调,在细胞水平上,敲减DRG ZHX2表达亦可促进MOR的转录和翻译表达,表明ZHX2可能是调控DRG MOR表达,从而导致NP发生和发展的关键因子,继而为NP治疗提供新的潜在靶点,为进一步探讨NP神经生物学机制提供基础。
目前认为,NP发生和发展的两个重要机制是外周和中枢神经系统敏化,而外周敏化通常发生于DRG内[20, 22-23]。当外周神经损伤时,DRG神经元异常兴奋,并不断向上一级中枢脊髓背角神经元发出冲动,从而诱导NP的发生和发展[20, 24-25]。DRG神经元在不同性质和不同类型的伤害刺激性痛觉信息传递和整合过程中发挥着重要作用[4, 26]。当外周神经损伤后引起DRG内MOR表达下调,该改变使原有伤害刺激性痛觉信息传导失去平衡,致使内源性阿片肽无法作用于该受体从而导致外周敏化[16, 26]。外周神经损伤后DRG MOR表达不仅受OCT1和C/EBPb等转录因子调控[13, 15],还受非转录因子蛋白(如DNMT3a、G9a和MBD1等)调控[5, 16, 27]。本研究发现神经损伤促进DRG转录因子ZHX2上调表达,抑制MOR表达,使用其特异性siRNA敲减DRG ZHX2表达,在整体水平上可以很好地逆转外周神经损伤引起的MOR表达下调;在细胞水平上,敲减DRG ZHX2表达,可以直接促进MOR的转录和翻译表达,表明ZHX2可能是抑制DRG MOR表达导致NP发生和发展的关键因子。然而,其确切调控机制我们将进一步使用特异性抑制剂和荧光素酶报告基因等方法和手段进一步明确。
本研究所使用的DRG显微注射小干扰RNA技术是一种有创操作,可能会对DRG胞体损伤从而影响实验对痛觉过敏测定[28]。然而,我们前期研究设计了等量溶剂和无义阴性对照序列注射组作为对照[10],发现等量溶剂和无义阴性对照序列DRG显微注射并不影响ZHX2在小鼠DRG上的基础表达以及痛觉过敏的产生,表明小心的操作对DRG损伤影响很小,我们之前的研究也证明了这一点[5, 16, 29]。考虑到小干扰RNA敲减特定基因表达方面存在脱靶效应,依据以往经验,我们在转染试剂中加入tuberfect in vivo辅助转染试剂,提高siRNA在DRG内转染效率和防止体内降解[13, 16, 30]。本研究发现,siRNA能敲减CCI引起的ZHX2 mRNA和蛋白质表达增加,缓解外周神经损伤后7 d机械痛敏行为。然而,siRNA并不能敲减在假手术组ZHX2基因和蛋白质基础表达水平,其具体原因仍不清楚,可能与ZHX2基础表达较低,siRNA干扰作用不显著。
综上所述,外周神经损伤引起DRG ZHX2表达上调,敲减其表达可有效逆转外周神经损伤引起的MOR表达下调,表明ZHX2可能是抑制DRG MOR表达,从而导致NP发生和发展的关键因子,为后续深入探讨ZHX2调控MOR表达介导外周神经损伤引起的NP神经生物学机制提供基础,为防治NP提供新的潜在靶点。
| [1] |
Finnerup NB, Haroutounian S, Kamerman P, et al. Neuropathic pain: an updated grading system for research and clinical practice[J]. Pain, 2016, 157(8): 1599-606. DOI:10.1097/j.pain.0000000000000492 |
| [2] |
Dieleman JP, Kerklaan J, Huygen FJ, et al. Incidence rates and treatment of neuropathic pain conditions in the general population[J]. Pain, 2008, 137(3): 681-8. |
| [3] |
宋学军. 疼痛信号外周神经转导的分子生物学机制[J]. 中国疼痛医学杂志, 2016, 22(1): 2-7. DOI:10.3969/j.issn.1006-9852.2016.01.002 |
| [4] |
Krames ES. The role of the dorsal root ganglion in the development of neuropathic pain[J]. Pain Med, 2014, 15(10): 1669-85. DOI:10.1111/pme.12413 |
| [5] |
Zhao JY, Liang LL, Gu XY, et al. DNA methyltransferase DNMT3a contributes to neuropathic pain by repressing Kcna2 in primary afferent neurons[J]. Nat Commun, 2017, 8: 14712. DOI:10.1038/ncomms14712 |
| [6] |
Guha D, Shamji MF. The Dorsal Root Ganglion in the Pathogenesis of Chronic Neuropathic Pain[J]. Neurosurgery, 2016, 63(Suppl 1): 118-126. |
| [7] |
Liang LL, Zhao JY, Gu XY, et al. G9a inhibits CREB-triggered expression of mu opioid receptor in primary sensory neurons following peripheral nerve injury[J]. Mol Pain, 2016, 12: 1744806916682242. |
| [8] |
Sun LL, Zhao JY, Gu XY, et al. Nerve injury-induced epigenetic silencing of opioid receptors controlled by DNMT3a in primary afferent neurons[J]. Pain, 2017, 158(6): 1153-65. DOI:10.1097/j.pain.0000000000000894 |
| [9] |
Zhou XL, Yu LN, Wang Y, et al. Increased methylation of the MOR gene proximal promoter in primary sensory neurons plays a crucial role in the decreased analgesic effect of opioids in neuropathic pain[J]. Mol Pain, 2014, 10: 51. |
| [10] |
龚华磊, 徐华丽, 磨凯. 背根神经节ZHX2在外周神经损伤痛觉过敏中的作用研究[J]. 中华神经医学杂志, 2018, 17(9): 918-24. DOI:10.3760/cma.j.issn.1671-8925.2018.09.009 |
| [11] |
Kawata H, Yamada K, Shou ZF, et al. Zinc-fingers and homeoboxes (ZHX) 2, a novel member of the ZHX family, functions as a transcriptional repressor[J]. Biochemi J, 2003, 373(3): 747-57. DOI:10.1042/bj20030171 |
| [12] |
Rigaud M, Gemes G, Barabas M, et al. Species and strain differences in rodent sciatic nerve anatomy: Implications for studies of neuropathic pain[J]. Pain, 2008, 136(1/2): 188-201. |
| [13] |
Li ZS, Mao YY, Liang LL, et al. The transcription factor C/EBP beta in the dorsal root ganglion contributes to peripheral nerve trauma-induced nociceptive hypersensitivity[J]. Sci Signal, 2017, 10(487). |
| [14] |
Zhang J, Liang L, Miao X, et al. Contribution of the suppressor of variegation 3-9 homolog 1 in dorsal root ganglia and spinal cord dorsal Horn to nerve injury-induced nociceptive hypersensitivity[J]. Anesthesiology, 2016, 125(4): 765-78. DOI:10.1097/ALN.0000000000001261 |
| [15] |
Yuan JJ, Wen J, Wu SG, et al. Contribution of dorsal root ganglion octamer transcription factor 1 to neuropathic pain after peripheral nerve injury[J]. Pain, 2019, 160(2): 375-94. |
| [16] |
Mo K, Wu SG, Gu XY, et al. MBD1 contributes to the Genesis of acute pain and neuropathic pain by epigenetic silencing of Oprm1 and Kcna2 genes in primary sensory neurons[J]. J Neurosci, 2018, 38(46): 9883-99. |
| [17] |
徐华丽, 徐世元, 磨凯. 蛋白精氨酸甲基化酶在小鼠外周神经损伤后背根神经节中的转录表达[J]. 南方医科大学学报, 2017, 37(12): 1620-5. |
| [18] |
磨凯, 郭雯静, 徐世元. 神经病理性痛小鼠背根神经节γ氨基丁酸受体亚型基因表达的变化[J]. 中华麻醉学杂志, 2018, 38(9): 1090-4. DOI:10.3760/cma.j.issn.0254-1416.2018.09.017 |
| [19] |
Costigan M, Scholz J, Woolf CJ. Neuropathic pain: a maladaptive response of the nervous system to damage[J]. Annu Rev Neurosci, 2009, 32: 1-32. DOI:10.1146/annurev.neuro.051508.135531 |
| [20] |
Basbaum AI, Bautista DM, Scherrer GA. Cellular and molecular mechanisms of pain[J]. Cell, 2009, 139(2): 267-84. DOI:10.1016/j.cell.2009.09.028 |
| [21] |
Scholz J, Woolf CJ. The neuropathic pain triad: neurons, immune cells and glia[J]. Nat Neurosci, 2007, 10(11): 1361-8. DOI:10.1038/nn1992 |
| [22] |
Meacham K and Shepherd A Neuropathic Pain: Central vs. Peripheral Mechanisms[J]. 2017, 21(6): 28.
|
| [23] |
Wu SG, Lutz BM, Miao X, et al. Dorsal root ganglion transcriptome analysis following peripheral nerve injury in mice[J]. Mol Pain, 2016, 12. |
| [24] |
Campbell JN, Meyer RA. Mechanisms of neuropathic pain[J]. Neuron, 2006, 52(1): 77-92. DOI:10.1016/j.neuron.2006.09.021 |
| [25] |
Liem L, Van Dongen E, Huygen FJ, et al. The dorsal root ganglion as a therapeutic target for chronic pain[J]. Reg Anesth Pain Med, 2016, 41(4): 511-9. DOI:10.1097/AAP.0000000000000408 |
| [26] |
Corder G, Tawfik VL, Wang D, et al. Loss of mu opioid receptor signaling in nociceptors, but not microglia, abrogates morphine tolerance without disrupting analgesia[J]. Nat Med, 2017, 23(2): 164-73. DOI:10.1038/nm.4262 |
| [27] |
Zhang YH, Chen SR, Laumet G, et al. Nerve injury diminishes opioid analgesia through lysine methyltransferase-mediated transcriptional repression of mu-Opioid receptors in primary sensory neurons[J]. J Biol Chem, 2016, 291(16): 8475-85. DOI:10.1074/jbc.M115.711812 |
| [28] |
Dorn G, Patel S, Wotherspoon G, et al. siRNA relieves chronic neuropathic pain[J]. Nucleic Acids Res, 2004, 32(5): e49. DOI:10.1093/nar/gnh044 |
| [29] |
Mo K, Xu HL, Gong HL, et al. Dorsal root ganglia coactivatorassociated arginine methyltransferase 1 contributes to peripheral nerve injury-induced pain hypersensitivities[J]. Neuroscience, 2018, 394: 232-42. DOI:10.1016/j.neuroscience.2018.10.038 |
| [30] |
Xu B, Cao J, Zhang J, et al. Role of microRNA-143 in nerve injuryinduced upregulation of dnmt3a expression in primary sensory neurons[J]. Front Mol Neurosci, 2017, 10: 350. DOI:10.3389/fnmol.2017.00350 |
 2019, Vol. 39
2019, Vol. 39

